需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
生物物理检测探头相间细胞核的力学性能:基材应变的应用和微针操纵
摘要
我们现在两个独立的显微镜为基础的工具来衡量,在应对全球性或局部应变的应用单一,生活贴壁细胞诱导核和细胞骨架变形。这些技术被用于确定核刚度(即变形)和探测细胞内的细胞核和细胞骨架的之间的传力。
摘要
在大多数真核细胞,细胞核是最大的细胞器,通常是2到10倍,比周围的细胞骨架的围追堵截,因此,原子核的物理性质,化学性质显着促进细胞生理和病理条件下的整体生物力学行为。例如,在中性粒细胞迁移和入侵的癌细胞,核刚度可以在外渗或通过狭窄的空间内组织的流逝带来的一大障碍。另一方面,机械活跃的组织,如肌肉细胞的细胞核,需要足够的结构支撑承受重复性的机械应力。重要的是,原子核是紧密集成到细胞结构,它是物理上连接到周围的骨架,这是关键的一个细胞核的细胞内运动和定位的要求,例如,在极化的细胞,在神经肌肉接头的突触核,或在细胞迁移。毫不奇怪,如lamins和nesprins,从而起到了关键作用,在确定核刚度和核苷酸骨架耦合的核衣壳蛋白的基因突变,已显示最近导致的人类疾病,包括金刚砂德赖富斯肌营养不良,肢带型肌营养不良症,和扩张型心肌病。探讨生物物理功能多样的核衣壳蛋白和特定的突变的影响,我们已开发的实验方法来研究原子核的物理性质,化学性质,在单,活细胞受到全球或局部的机械扰动。正是适用于基板应变的应用测量诱发核变形,细胞核变形产生重要的信息,并允许不同的突变或缺乏具体的核衣壳蛋白的细胞株之间的定量比较。用微针骨架应变本地化应用程序,是用来补充这个实验中,细胞内的细胞核和细胞骨架的之间的传力可以产生更多的信息。完整的活体细胞的核力学研究,保持正常的细胞内结构和避免潜在的孤立核工作时可能出现的文物。此外,基板应变的应用程序提供了一个很好的模式,在肌肉细胞或其他组织(例如,血管平滑肌细胞暴露血管应变)所经历的生理应激。最后,而这些工具已经被开发,主要研究核力学,他们也可以被应用于研究细胞骨架蛋白和mechanotransduction信号的功能。
研究方案
1。基板应变的应用
归核应变的测量包括应变菜的准备,透明,弹性硅膜细胞培养表面镀上的菜的细胞,获得细胞的图像(单轴或双轴)应变应用程序之前,期间和之后,。
制备硅膜的菜肴和细胞黏附
- 每一株菜由一个特制的直径为3的无底的塑料盘“和一个塑料O型圈举行的硅膜,细胞培养基材,准备应变菜,钳4”X 4“一块硅膜之间的O形圈和菜。小心切掉多余的膜,用去离子水冲洗,高压灭菌器的应变菜。
- 马克与细胞外基质分子(如纤维连接蛋白)的硅膜,在膜的底部中心(外)涂装前的参考点。这项具有里程碑意义,将有助于找出相同的细胞株实验期间。 (可选:申请单轴应变,两个平行条纹透明胶带适用于各地的参考点限制在一维膜变形。)
- 为了提供最佳的细胞附着,外套硅膜3微克/毫升稀释在10毫升PBS或任何合适的细胞外基质蛋白的纤维连接蛋白。盖应变倒10cm的聚苯乙烯盘菜,并在夜间孵化的菜在4 ° C
- 第二天,一次冲洗膜,用磷酸盐缓冲液(PBS),以除去多余的蛋白质。填写10毫升生长介质(贝科的改性老鹰培养基(高糖)含10%胎牛血清和1%青霉素/链霉素补充)的菜,并预留。
- 0.05%胰蛋白酶和生长培养基接种于涂硅膜的菜,并培育24到约30%汇合 - 48小时正常培养条件下小鼠胚胎成纤维细胞是胰酶消化。
基板应变实验
- 设置用于实验的显微镜。实验上执行一个倒置显微镜,荧光显微镜,相衬或DIC适合数码相机,使用60倍的目标和相应的图像采集软件(例如,IPLab或Metamorph)。一个堂堂正正的显微镜是不适合这种应用。应变装置由一个底座,适合在显微镜舞台上,并拥有中央圆柱滚筒服务申请应变的硅膜,一个可移动盘,拥有应变菜的中央部分,可以上下滑动四个指导引脚,以及一个5磅重板应用负载。
- 为了形象化的细胞核,细胞孵育1微克/毫升的Hoechst 33342 15分钟应变菜在37 ° C。吸中期和15毫升酚红的自由生长的培养基(酚红免费贝科的修改老鹰中等(高血糖),25毫米HEPES,辅以10%胎牛血清和1%青霉素/链霉素)取代。旋入菜架板的应变菜。小心油脂(Braycote 804真空润滑脂)硅膜的底部周长,以确保沿中央滚筒膜滑翔。请一定要保持膜的中央部分明确。
- 放置在显微镜舞台上的底座。山菜持有者板仔细的底板上。保证,在初始休息位置,硅膜的应变菜松散在于中央压板。
- 首先,着眼于底部的硅膜,并找到中央的黑色参考点。圆点将作为所有图像采集,并在相同的细胞定位,期间和之后舒展艾滋病的出发点。我们使用自定义编写的自动成像程序存储细胞的立场,并搬迁在实验过程中,这些细胞,但是这也可以实现手动。
- 从点开始,调整的重点,以可视化的细胞和硅膜的顶部。找到良好的传播与位于市中心核细胞,并获得一个相衬,荧光图像的核赫斯特染色。相衬图像,应着眼于细胞轮廓和硅膜,而应着眼于细胞核的中央平面的荧光图像。
- 获得5至15细胞的图像后,将回到中央点。慢慢地套用应变菜的重量,导致均匀应变应用中心的菜。最大的应用是有限的基板应变垂直对齐的引脚(指导引脚)上的尼龙垫片。
- 专注于硅膜的底部,并再次找到参考点。从开始点,相同的细胞迁移,并再次获得一个相衬,一个完整的应变下的细胞和细胞核的荧光图像,试图密切配合初始图像焦平面。这个过程不应超过10分钟,以避免紧张基板细胞活跃的重塑和适应。
- 所有相应的图像已被收购后,将在显微镜阶段回到起点。小心地从菜架板的重量和允许的硅膜放松。如果有必要,轻轻一推应变菜,直到它在初始位置。然后收购相衬的应变图像上面所述的应变后细胞的荧光图像。
分析
- 细胞图像和荧光标记的原子核之前,期间和之后,应变的应用进行了分析计算的归核应变。在我们的实验室中,我们使用自定义编写的MATLAB脚本的分析,但几个备选方案。分三步进行分析。
- 首先,要计算的应用基板应变,位于膜的3至6个控制点的位置是手动相应的预,全面,和应变后的图像之间的匹配。 MATLAB程序,然后计算应用膜应变比较匹配控制点之间的预应变和应变的图像和预应变和应变后的图像之间的残余应变的的位置。与此同时,控制点是用来注册的图像对,这将有助于发现损坏或分离的细胞(见图1)。
- 在第二个步骤,原子核是手动选择使用一个单独的MATLAB程序,计算匹配无论是核的大小或相应的预,全,以及应变后的荧光图像之间的核内标记为每一个人的原子核的核应变。要考虑小的变化应用于不同的实验之间的膜应变,我们表达定义为应用是计算每个细胞核膜应变诱导核应变的比例,归核应变的结果。 MATLAB脚本都可以从应要求Lammerding实验室。
- 最后,每个核验证,不含细胞的分离或成为应变的应用程序(图1)期间损坏的测量。
2。微针操纵试验
菜,贴壁细胞和微针的制备
- 孵育与低浓度的纤维连接蛋白(0.5ug/ml)(HBSS)汉克的缓冲盐生理盐水或任何合适的细胞外基质蛋白2小时35毫米的玻璃底部的细胞培养皿在37 ° C。的HBSS洗两次菜肴和添加2毫升培养液,然后再继续下一步的菜。
- 小鼠胚胎成纤维细胞,胰酶消化增长2毫升培养基接种7.5 × 10 4细胞/毫升到纤维连接蛋白涂层的玻璃底菜用0.05%胰蛋白酶和种子。位置细胞培养箱中培养过夜。位置细胞培养箱中培养过夜。一要优化细胞的数量,以获得单,贴壁,非为其他类型的细胞融合的细胞。
- 拉的微针,高硼硅毛细血管制成,尖端直径约1至3微米商业吸管拉马(例如,萨特仪器公司)。
微针操纵实验
- 第二天,孵化与MitoTracker细胞线粒体染色(600微米; Invitrogen公司)和赫斯特33342核染色(1微克/毫升)添加到增长为30分钟,在37℃孵化器的介质。
- 在室温下5分钟的HBSS清洗细胞一次,然后添加酚红的自由生长的培养基,细胞成像。
- 收购无微针插入相衬骨架的一种单细胞的形象,一个60X的目标(0.70 NA,计划色差)的线粒体的Hoechst 33342染色和荧光图像荧光图像染色,倒置显微镜用数码电荷耦合器件摄像机。
- 使用显微操作(例如,InjectMan NI 2,Eppendorf公司),小心地插入一个细胞一个固定的距离(一般为5微米),离核外围的细胞质中的微针,并采取一个相衬图像之一的Hoechst 33342荧光图像染色和线粒体染色的荧光图像。对于这种应用,它有助于控制通过计算机显微操纵器,例如,Windows超级终端,以实现一致的显微程序。
- 移动微针,对在1微米/秒的细胞外围的一个特定的距离(通常为10或20微米),同时收集荧光相衬图像,每10秒。由于微针是向特定的细胞外围的距离。所选择的参数,微针是向细胞外围的具体距离,这将对应到2-3帧在操作过程中。
- 微针是从骨架中删除后,最后获得额外的图像。
分析
- 使用自定义编写的MATLAB脚本的基础上跟踪荧光标记的细胞核和细胞质的功能,置换贴图计算。 (MATLAB脚本是从Lammerding实验室根据要求提供)。该程序使用了一个小图像区域,在随后的图像帧(约10微米× 10微米大小和间隔相距5微米)之间的归一化交叉相关算法。对于每个地区的中心,x和y方向位移计算之间原来的位置和新发现的位置转移,并显示为位移向量,并以数值存储。从位移的地图,在预定的区域内的平均位移可以计算。需要注意的是骨架的位移是基于荧光通道为骨架的标记(例如,MitoTracker线粒体染色),而核位移的荧光通道对应的Hoechst 33342信号计算。对于我们的应用程序中,我们经常检查以下区域:(一 )应变的应用程序的网站,即微针插入部位骨架应变;(ii)在区域内对应变的应用网站的核心核应变;(三)核应变核地区距离申请地点;及(iv)在整个细胞核的胞内区的骨架应变。此外,还可以直接从相衬或赫希斯特33342荧光图像序列测量核伸长。在这种情况下,应用核应变除以核伸长率(ΔL= L - L 0)计算,由最初的长度,L 0,其中L是原子核的最终长度应变的应用程序和 L 0年底原子核的初始长度。对于一个完整的核苷酸骨架耦合细胞,细胞核,将拉长对应变的应用网站。相反,在核苷酸骨架耦合被打乱,即细胞,力量是骨架和细胞核之间的传输效率较低,细胞核有望大大减少伸长应变申请地点的方向。因此,减少核变形骨架应变应用,意味着(部分)之间的细胞核和细胞骨架解偶联。
3。代表性的成果:
基板应变的应用
我们获得的图像之前,期间和应变应用从拉明杂合子和纯合子小鼠胚胎成纤维细胞后的A / C 缺陷(LMNA + / -和LMNA - / - )和野生型(LMNA + / +)小鼠,随后计算每个单元的归核应变。经过分析,细胞核验证和细胞损坏或收回的应用过程中的应变是从分析中排除。图1A描述了三个有效的细胞,细胞核,而图1B描述应该从分析中排除的细胞。归核应变数据汇集至少从三个独立的实验(每片含测量从〜5-10原子核)和统计分析与其他细胞或治疗组相比。归核应变增加,表明核刚度降低,细胞的核膜,核纤层蛋白A / C(图2)蛋白质的表达降低。
微针操纵试验
微针操纵实验,我们在本地化骨架应变应用核和细胞骨架的位移成像。损坏或分离的细胞是从分析中排除。我们进行了分析,措施,对单,贴壁细胞中的应用力网站的核和细胞骨架的运动幅度。例如,在图3中,我们跟踪线粒体(细胞骨架的标记)之前和之后细胞骨架应变位移,然后绘制为载体的位移。每个向量代表之间原来的位置和新发现的位置转移计算的位移。图像强度低或不足的质地(例如,在细胞外的地区)的区域是从分析中排除。细胞骨架和核位移,然后量化选择地增加应变申请地点距离(图4,地区相应的彩色博插图XES)。在小鼠胚胎成纤维细胞具有完整的核苷酸骨架耦合,传输势力在整个细胞,在诱导核和细胞骨架的变形,慢慢消散,远离应变的应用程序的网站(图4)。相比之下,成纤维细胞与不安核苷酸骨架的耦合(或改变细胞骨架组织)显示本地化位移申请地点附近,如图4所示,只有很少的诱导变形较远。骨架应变的应用比较微针插入网站(橙色框)是观察控制的成纤维细胞(mCherry单独)和成纤维细胞与中断的核苷酸骨架耦合(DN卡辛)。然而,扰乱核苷酸骨架耦合比对照组(mCherry单独)(图4)(DN卡辛)的成纤维细胞诱导核和细胞骨架的位移,在其他地区(蓝色,黄色和红色框)显著较小。因此,在细胞骨架和核位移应变申请地点远离减少,表明骨架和细胞核之间传递的力量感到不安。
更重要的是,我们也证实,线粒体是合适的细胞骨架的标记,通过转染绿色荧光蛋白或mCherry肌动蛋白和GFP -波形,并与Mitotracker绿色或红色荧光标记的小鼠胚胎成纤维细胞进行微针操纵。骨架的位移贴图是单独计算的线粒体和肌动蛋白或波形纤维蛋白细胞骨架的荧光信号。平均绝对位移计算为四个不同的骨架区域,远离应变申请地点在距离增加。从线粒体和肌动蛋白或波形,分别获得了测量之间的线性回归计算坡度和R平方值。肌动蛋白,坡度为0.99和R 2值是0.986;波形蛋白,坡度为1.04和R2的值是0.971,确认线粒体位移为骨架变形的可靠指标。
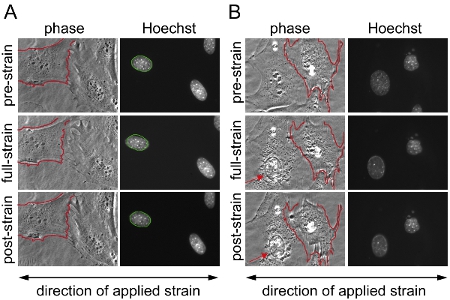
图1。底物对小鼠胚胎成纤维细胞(MEFs)应变的应用程序 。分布在两个不同领域上的硅膜的小鼠胚胎成纤维细胞成像与相衬,荧光显微镜前,期间和之后,20%的单轴应变的应用。 (一)从细胞中度过,没有任何损坏或支队及(B)例如收回/应变的应用程序在部分分离的细胞株应用程序的一个有效的核实验成功的例子,描绘细胞的结果(二)被排除在外从分析中。在(b),在左侧的细胞骨架破坏和核崩溃(箭头)的迹象,而在右侧的细胞分离部分缩回在应变的应用程序。这可以是一个过大的应力应用的指示。为了更好的比较,在(A)和(二)未拉伸细胞膜边界概述了红色和应变的应用程序,期间和之后的相同细胞上叠加。在(a)边界的未拉伸核概述了绿色和应变的应用程序,期间和之后在同一核叠加。
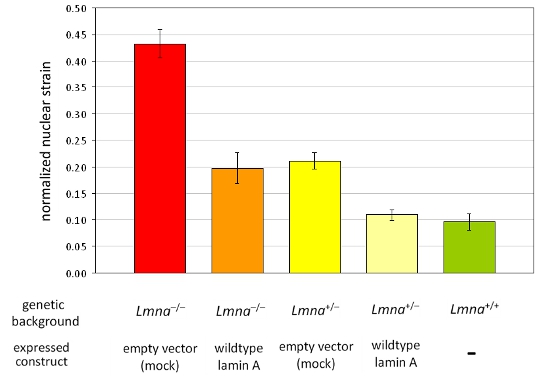
图2。分析归核菌株在不同的MEF细胞株小组MEFs LMNA - / -和LMNA + / -遗传背景异位表达空载体或野生型核纤层蛋白A的分析。从野生型窝(LMNA + / +),核纤层蛋白的损失比较MEFs的A / C核刚度下降的表达,可以完全放归野生型核纤层蛋白A。恢复的结果,值得注意的是,减少核刚度反映归核应变的增加值。误差线表示标准误差。

图3。 (C,D) 微针操纵实验来衡量细胞内传力 。相衬(A,B)和荧光图像与核染色(蓝色)标记的成纤维MitoTracker线粒体染色(绿色) 。一个微针插入细胞骨架在从细胞核(A和C)中定义的距离,并随后对细胞外围(B,D)提出。跟踪荧光标记的细胞核和使用自定义编写的互相关算法线粒体,细胞骨架和核位移进行了量化。 (五)最终骨架的位移图(绿色)荧光图像系列变形计算;箭头的长度是2倍的放大更好visibility。比例尺,10微米。
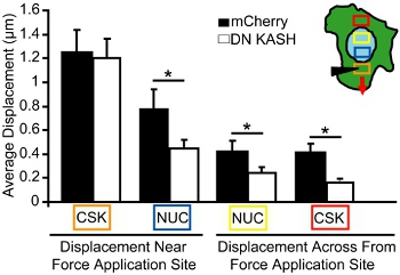
图4。在微针操纵诱导细胞内的传力分析过程中的微针操纵 。的细胞骨架和核位移,在相应领域的彩色框(在插图)测量。橙色框是应变的应用程序的网站。尽管类似的应变诱导细胞骨架(橙色框),应用核和细胞骨架的位移(蓝色,黄色和红色框)在胚胎成纤维细胞,中断的核苷酸骨架耦合(DN卡辛)与对照组比较(鼠标显著mCherry单独)细胞。
讨论
基板应变检测
应变的应用我们和其他团体已经成功地用于研究诱导核细胞受机械应力的变形,并探讨具体的核衣壳蛋白的核刚度的贡献。4-8这种技术的优点是,它探针的机械性能生活在正常的细胞和细胞骨架的环境和核基板应变程序类似于生理负荷的应用程序,如发现在许多组织,如承包肌肉或血管壁。9此外,它使许多细胞的应变应用程序并行,增加的数量在?...
披露声明
没有利益冲突的声明。
致谢
这项工作是支持的美国国立卫生(R01 HL082792和R01 NS059348)和布里格姆与妇女医院心血管领导小组奖研究院。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
| 纤维连接蛋白 | Millipore公司 | FC010 | |
| MitoTracker红FM和绿色调频 | Invitrogen公司 | M22425和M - 7514 | |
| 赫希斯特33342 | Invitrogen公司 | H3570 | |
| 汉克的缓冲盐生理盐水 | Invitrogen公司 | 14185 | |
| 苯酚自由,DMEM培养液 | Invitrogen公司 | 21063 | |
| 胎牛血清 | Aleken生物 | FBSS500 | |
| 青霉素/链霉素 | 西格玛 | P0781 - 100ML | |
| 高硼硅玻璃与长丝 | 萨特仪器 | BF100 - 78 - 10 | |
| 光泽度/光泽非增强硅薄膜,0.005“ | 专业制造公司 | ||
| 贝科的磷酸盐缓冲液 | Invitrogen公司 | 14200 | |
| 35毫米的玻璃底培养皿(FluoroDish) | 世界精密仪器公司 | FD35 - 100 | |
| Braycote 804真空润滑脂 | 灵宝用品 | 05133A - AB |
参考文献
- Friedl, P., Wolf, K., Lammerding, J. Nuclear mechanics during cell migration. Curr Opin Cell Biol. 23, 55-64 (2011).
- Mejat, A., Misteli, T. LINC complexes in health and disease. Nucleus. 1, 40-52 (2010).
- Worman, H. J., Fong, L. G., Muchir, A., Young, S. G. Laminopathies and the long strange trip from basic cell biology to therapy. J Clin Invest. 119, 1825-1836 (2009).
- Caille, N., Tardy, Y., Meister, J. J. Assessment of strain field in endothelial cells subjected to uniaxial deformation of their substrate. Ann Biomed Eng. 26, 409-416 (1998).
- Lammerding, J. Lamins A and C but not lamin B1 regulate nuclear mechanics. J Biol Chem. 281, 25768-25780 (2006).
- Lammerding, J. Abnormal nuclear shape and impaired mechanotransduction in emerin-deficient cells. J Cell Biol. 170, 781-791 (2005).
- Lammerding, J. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Verstraeten, V. L., Ji, J. Y., Cummings, K. S., Lee, R. T., Lammerding, J. Increased mechanosensitivity and nuclear stiffness in Hutchinson-Gilford progeria cells: effects of farnesyltransferase inhibitors. Aging Cell. 7, 383-393 (2008).
- Brooks, S. V., Zerba, E., Faulkner, J. A. Injury to muscle fibres after single stretches of passive and maximally stimulated muscles in mice. J Physiol. 488, 459-469 (1995).
- Maniotis, A. J., Chen, C. S., Ingber, D. E. Demonstration of mechanical connections between integrins, cytoskeletal filaments, and nucleoplasm that stabilize nuclear structure. Proc Natl Acad Sci. 94, 849-854 (1997).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。