Method Article
使用调频染料培养的小脑颗粒神经突触小泡池补充的定量分析
摘要
描述一个生活的荧光成像技术,量化的补给和动员特定的突触小泡(SV)池,在中央的神经末梢。两轮的SV回收进行监控,在相同的神经终端提供内部控制。
摘要
在中央神经末梢释放神经递质后,状态变量的内吞作用迅速检索。检索状态变量,然后重新填充的神经递质和归队回收池,作为状态变量定义的胞吐 1,2 。回收池,一般都可以分为两个不同的池 - 易释放池(RRP)和储备池(RP)。顾名思义,定价由是立即融合的状态变量,而RP的状态变量被释放在强烈的刺激 1,2只。重要的是有一个可靠的检测报告这些SV池差增资,以了解1)状态变量通车后不同模式的内吞作用(如网格蛋白依赖的内吞作用和活动依赖大量的内吞作用)和2)的机制如何调动双方的定价和RP控制在不同的刺激的反应。
定期聘请调频染料定量报告中央神经末梢的SV营业额3-8。他们有疏水性烃类尾气的,允许在脂双层的可逆分区,横跨膜和亲水性头组块通过。很少在水溶液中的荧光染料,但在膜 9分区时,其量子产率显着增加。因此,调频染料跟踪积极回收状态变量的理想荧光探针。调频染料使用标准的协议如下。首先,它们是适用于神经元和期间内吞作用(图1)。非内化后的染料从质膜,内回收池回收状态变量重新分配冲走。这些状态变量,然后使用卸载刺激(图1)耗尽。由于调频染料状态变量的标签是量子 10,由此产生的荧光下降释放囊泡数量成正比。因此,状态变量的回收和融合产生的PRevious轮内吞作用,可以可靠地量化。
在这里,我们提出了一个已被修改,以获得两个额外的信息内容的协议。首先,连续装卸刺激差异卸载定价和RP,让量化具体的SV池增资。其次,每一个神经末梢,两次经过协议。因此,在S1相同的神经末梢的反应可以比较一个阶段S2(图2)的测试物质的存在,提供了一个内部控制。这一点很重要,因为SV在不同的神经末梢循环再造的程度是高度可变的11。
可能对本协议中使用的任何附着的初级神经元文化,但电镀密度,解决方案和刺激的条件进行了优化小脑颗粒神经元(CGNS )12,13。
研究方案
1。小脑颗粒神经元的制备
- 高压灭菌约100直径25毫米的盖玻片(见表1)。
- 在50毫升无菌无菌聚D -赖氨酸溶液(见表2)管放置盖玻片。广场上为2小时到涂层的盖玻片的旋转平台。
- 干涂层盖玻片,在层流罩(见表1)消毒纸巾。
- 可以储存在4 ° C放置盖玻片进入无菌6孔板和温暖在二氧化碳培养箱(见表1)。 盖玻片在使用前1个月 。
- 安乐死7天的老只大鼠小狗根据当地的伦理委员会的指引。我们使用颈椎脱位安乐死幼仔。
- 剖析小脑和放置在无菌培养皿菜含有磷酸盐缓冲盐溶液(溶液B,表3)。
- 重复步骤4-6幼鼠1.5和1.6。
- 小脑,然后放在一个McIlwain组织赵无菌阶段PPER(见表1)。组织切碎通过90 °的旋转舞台,并重复这个过程之前,在375微米的间隔。
- 切碎的小脑被转移到一个胰蛋白酶溶液(溶液T,表4)以前被加热到37 ° C。
- 孵育小脑在37 ° C为20分钟,轻轻搅拌,大约每5分钟。
- 在胰蛋白酶消化,火焰波兰三个无菌玻璃滴管(见表1)使用本生灯火焰。使用火焰创建移液器各自的嘴巴一个罚款孔,一个中等口径和大口径。
- T溶液中20分钟孵化后,加入20毫升一个胰蛋白酶/ DNA酶抑制剂的解决方案(解决方案瓦,表5)小脑悬浮和沉淀细胞在台式离心机1分钟(见表1)1000 克 。
- 弃上清,重悬在1.5毫升集中胰蛋白酶/ DNA酶抑制剂(溶液C,表6)使用最广泛的孔吸管的细胞沉淀。
- 磨碎使用宽孔吸管的细胞,然后中型孔,最后直到细胞悬液窄孔是均匀的, 这是关键的一步,必须在这个阶段的同质暂停。
- 层的细胞悬液10毫升上一个预热(37℃)牛血清白蛋白补充Earles平衡盐溶液15毫升无菌管(表7)。
- 离心5分钟,暂停在1500 克和悬浮预热MLS 2细胞沉淀(37℃)培养基(表8)。
- 估计使用血球(见表1)细胞数量和细胞悬液稀释到最终密度3.3 × 10 6细胞每毫升。
- 细胞是镀加入75μL的细胞悬液,以D -聚赖氨酸包被盖玻片(最终密度为2.5 × 10 5)的中心。
- 二氧化碳培养箱含有盖玻片的培养皿放置60分钟,让一个在细胞dhere。
- 每口井照顾,不要打扰镀细胞,并返回到 CO 2培养箱培养板中加入培养基1.5毫升。
- 次日更换新鲜培养与有丝分裂抑制剂阿糖胞苷(表8)培养基中培养液中。 逮捕这种文化中的神经胶质细胞扩散。
2。实验装置
- 应包括以下基本实验装置(使用特定的设备和软件,见表1和表9):
- 倒外延荧光显微镜
- 冷却CCD相机
- 荧光光源(单色或滤光轮)
- 重力灌注设备
- 与平行的铂电极影像室
- 起搏器
- 计算机
- 图像采集软件
- 实验应在黑暗中或红色光COND下itions最小样品的荧光照明,以避免调频染料褪色。
- 实验是在室温下进行。如果是必需的生理温度,温度控制灌注系统也可使用。
3。样品制备
- 文化应采用体外后8-12天。
- 传输一个单一的盖玻片,在室温下10分钟的盐水(表10),以便在新的中期稳定。
- 取出盖玻片,干其底面和周边地区的小块用纸巾或吸水纸贴壁细胞。
- 使用硅脂(见表2),胶水盖玻片成像室的下部。细胞之间应该是两条平行线。应使用足够的硅脂完全密封腔,但没有任何油脂进入中心的洗浴室。
- 轻轻地填补了沐浴室〜260μLSA行的解决方案,然后填写相同的解决方案输入管。
- 清洁盖玻片室顶部与硅脂胶密封。输入和输出管道可用于被困在会议厅内,以消除任何空气气泡。 重要的是,气泡不中断电路 。
- Immobilise在不锈钢平台的成像室,轻轻灌注生理盐水溶液通过输入管泄漏检查。
- 山倒置显微镜阶段的组装室,和重力灌注系统连接室,先催芽与盐溶液的入口。
- 连接电刺激室的电线连接。
- 添加浸油下降的目标,如果使用油镜头。在使用亮场照明分中焦点细胞。
4。 S1期
- 灌注神经元与1.5毫升盐水稀释调频染料(见表2)。
- 使用的附加刺激,刺激神经元,以唤起染率。
- 刺激后,2分钟,用新鲜盐水灌注神经元,洗去多余的染料调频(流量为7毫升/分钟)。CGN文化系统中的胶质污染低于 5%14,因此这段时间内是足以消除染料。
- 保留神经元休息8分钟。
- 在此期间,找到个人FM染料加载神经末梢可见荧光波长(激发,480 nm处,发射,550 nm处)的轴突网络。避免细胞群的地区。保持照明至少在这一步,因为强烈的激励可以导致染料的光毒性。 这种明显的迹象是出泡轴突和缺乏的染料卸载(由于染料固色)。
- 立即重新聚焦图像,图像采集前,因为有轻微的漂移可能都发生在休息时间。
- 开始时间推移,每4秒1帧的速度图像采集
- 获取5 - 10个基准图像后,唤起人们提供2秒(60个动作电位)8 30赫兹刺激的胞吐的定价手动立即开始帧捕获后的刺激。
- 后获得另外10张图像,唤起对RP的SV胞吐为10秒(400个动作电位)40赫兹的刺激,每30 秒 ,除了8。
- 获得另外5 - 10图像,然后暂停图像采集。
5。恢复阶段(见图2)
- 允许的神经细胞恢复至少20分钟。
- 可选 -如果一种药物的内吞作用的影响进行测试,与药物溶液灌注神经元在此期间(图2b)3,8 。
6。 S2期
- 重复使用相同的视野,为控制实验S1阶段协议(第4)在S1。
- 可选 -如果一种药物的内吞作用的影响进行测试,灌注辅以FM染料(图2b)3,8的药物溶液中的神经元。
- 可选 -胞吐作用的药物的影响,或者,如果感兴趣的是,与药物溶液灌注神经元的定价和RP的装卸刺激(图2c)3之前和期间。
7。数据分析
- 使用ImageJ和Microsoft Excel或类似的软件进行数据分析。
- 在堆栈格式的图像序列进行分析,是必需的。一些图像处理软件可导出为单个图像序列。如果是这样的情况下,转换图像堆栈使用一个ImageJ内置函数图像>书库>图片堆叠。
- 堆栈调整亮度和对比度,以最大限度地提高动态范围图像>调整>亮度/对比度 (图3a) 。
- 如果发生在T显著横向漂移他的实验, 运行 StackReg ( http://bigwww.epfl.ch/thevenaz/stackreg/) 和 TurboReg ( http://bigwww.epfl.ch/thevenaz/turboreg/)ImageJ插件对齐图像堆栈(图3b ) 。
- 运行时间系列分析仪插件( http://rsbweb.nih.gov/ij/plugins/time-series.html )(图3c)。
- 定义了至少90神经末梢地区的利益(投资回报)。这些应该是相同的(直径为1.5微米的圆形的ROI)是有帮助的图像之间的切换前后染料装卸透露积极的神经末梢(或者一个预刺激的图像可以从刺激后的图像中减去)一个理想的投资回报率的大小是一个比一个典型的神经终端 (图3c) 大 。
- 获得每个ROI /综合荧光强度超过添E和导出到Microsoft Excel(图3d和4a)。
- Normalise的投资回报率的痕迹相同的任意值调整为先卸载在S1和S2两个阶段的刺激(图4B - C)在Y轴的平面的痕迹,这是为了控制背景荧光强度的微小变化。
- 测量荧光的绝对减少,在S1和S2如下(图4d)的任意荧光单位的每个装卸刺激诱发:
- 定价=荧光变化(ΔF)30赫兹2秒触发
- RP =ΔF萨姆3 × 40赫兹10秒触发
- 总回收池=定价+ RP
- 对于每个在7.9的相关参数,计算平均值,一次实验中所有的神经末梢。
- 进行统计分析,意味着可以从多个独立的实验中获得的值平均。而不是数量的神经末梢盖玻片应作为STATISTICA升北路
8。代表性的成果:
一个对照实验,其中CGNS经历了两轮相同的装卸步骤是在图5表示。当开始了一系列的实验,它是必不可少的,像这样的控制实验是每天执行确认S1和S2前不同实验条件下,在S2的相媲美。
在这个例子中,装有10微米使用80赫兹10秒刺激(图5a)FM1 - 43 CGNS。图5b显示FM1 - 43 -加载的神经,以荧光灯puncta为代表的终端。投资回报率超过90神经末梢定义在图5c所示。用于S1和S2的投资回报率相同。在这两种卸载,定价是先卸载30赫兹(2)反相卸载连续3 40Hz的刺激(10)(图5a)刺激。在每个刺激的荧光下降可以清楚地观察和量化(图5d - E)。检查时,相应的定价荧光滴,RP和总回收池S1和S2相媲美。此外,回收状态变量的20%居住在的定价,而80%的RP居住在S1和S2。
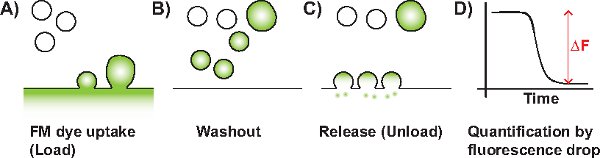
图1一个典型的FM实验示意图 。一)SV的内吞作用是触发FM染料(绿色表示)的存在。染料是内陷膜(单颗或批量内涵体)。乙)非内在质膜上的染料灌注冲走。 c)在应用程序卸载刺激标记SVS,已成为释放造成损失的荧光与血浆膜的导火索的。四)在荧光(ΔF)发布的标示为状态变量的数量成正比的变化,然后可以量化。
_upload/3143/3143fig2.jpg“/>
图2可能的实验方案的示意图。一)控制实验的细胞进行两个回合调频染料装卸(S1和S2)的流程图。细胞可以加载使用各种不同的刺激。卸载步骤是相同的,定价是2秒与30赫兹卸载的反相其次卸载使用第10号第3次40赫兹定价和储备库装卸刺激相隔40秒,所有其他的刺激,30秒。左细胞恢复为S1和S2之间的20分钟。流程图可能修改测试效果为B的一种物质)的内吞作用或C)胞吐也显示。相应的测试药物可以灌注在所示期间进入会议厅。
显示图像J的数据分析图3截图截图一)亮度和对比度调整,二)帧对齐,C)的投资回报的选择,和D)强度值的提取,使用图像研究
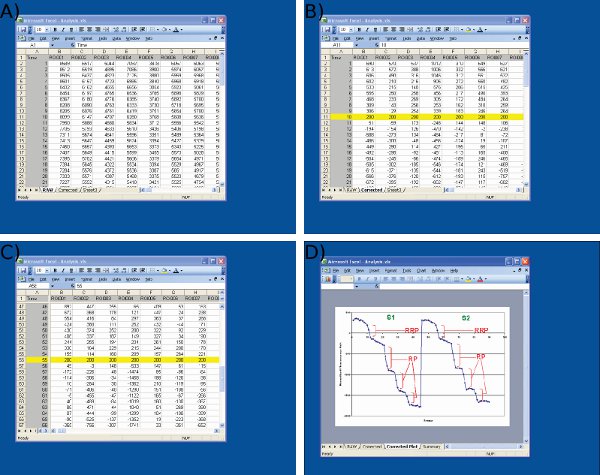
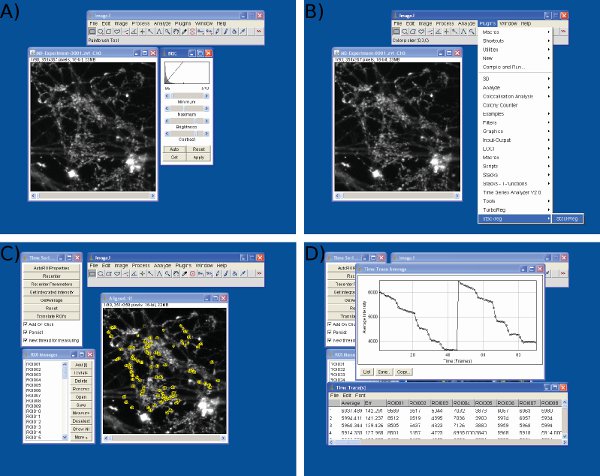
在Microsoft Excel中的数据分析图4截图 。截图一)导入图像J( 第一列的原始数据显示,车架号,其余各列数据,从个人的神经末梢B))S1的基准值(10帧)为任意值( 200)调整开始第一个刺激,三)调整S2基准值55帧,使用相同的协议,到S1,和D)测量使用Microsoft Excel的荧光滴。请注意,在D所示的平均跟踪是用来定义时间点前后每下降。每个ROI的荧光滴的大小应确定在C所示的电子表格上的值
图5。代表控制实验。一)CGNS被载入10μMFM1 - 43使用80赫兹(10秒)刺激的对照实验流程图。 S1和S2阶段是相同的。定价和储备库装卸刺激相隔40秒,所有其他的刺激,30秒。 b)在图像显示神经末梢加载FM1 - 43。三)与B相同的图像显示90编号的投资回报进行分析选择。 d)在选定的时间点在B红色框描绘一个地区的图片。前基底=刺激; 30赫兹= =后每40赫兹10秒刺激后,30赫兹2秒的刺激; 40赫兹1,2,3。这些图像中伪荧光的变化来说明(频谱显示在右边栏)。 E)平均± SEM跟踪从90 C.个人刺激神经描绘终端获得单杠代表。比例尺= 10微米。
讨论
调频染料被广泛用于研究在许多神经制剂的神经末梢功能。他们已受聘主要监察或SV的内吞作用,的SV营业额或胞吐 6动力学的程度。所描述的协议扩展了这些研究,探讨差卸载特定的SV池。这提供额外的信息有关的SV池的补水和他们的动员程度。
调频染料可用于多轮的SV回收范围内的标签相同的神经末梢。我们利用此属性和设计,其中SV在每一个终端的营业额可在同一神经末梢两次监测的协议。这提供了一个准确的内部控制,这是必不可少的,由于异质性的SV回收并行神经末梢11。通过使用作为内部控制的S1阶段,加气站的定价,RP和总SV药物池,可以比较可靠和直接。
除了提供回收的绝对大小的信息,定价和RP池不同的刺激条件下,该协议还可以提供下列资料 - 1)之间的定价和RP的状态变量作为一个回收池的功能分区S1和S2,2)总S1回收池和3)任何定义S2在S1相同的池功能的SV池的相对大小的功能(定价和RP)的S2池的相对大小。这种特殊的协议不会提供有关卸载动力学的信息不过,因为采集时间太慢(动能测量的采集时间应尽可能和卸载自动同步图像采集快速)。
我们30赫兹2秒的刺激唤起定价相同程度装卸高渗蔗糖8。由于定价的大小是由高渗蔗糖卸载15定义,我们可以这个协议卸载所有定价状态变量,在16个海马神经元的研究协议。储备库3 400刺激(40赫兹10秒),因为这刺激卸载相同的染料量范式(2 50毫米氯化钾刺激),耗尽所有染料标记的状态变量的95%的列车几乎完全耗尽8,17。准确的定量定价和储备库的大小还依赖于线性CCD相机的动态范围内获得的信息。
这个简单的协议,也可以进一步修改。装货刺激的强度,也可以是多种多样的,以确定神经元的活动和不同的内吞作用模式影响SV池补水。此外,也可以进行装卸大于两个周期,如果需要的话。此协议也可使用或者过度表达或转染细胞shRNA的载体。由于转染效率低的初级神经元文化,表达的蛋白质必须与荧光蛋白标记。它是必不可少的,这些荧光标记不与染料的调频信号干扰(例如,使用青色或红蛋白)。在这种情况下,在相同的视野转染和未转染细胞的神经末梢,也可以作为一个额外的控制8相比。在这种实验中的S1和S2之间的负载加载程度的比较是没有什么价值,因为目前在两个负载扰动。 SV池之间的染料分区仍然可以进行可视化不过 8 。
遗传记者称为pHluorins也可以监测初级神经元文化的SV胞吐和内吞作用。这些探头使用pH敏感的绿色荧光蛋白的管腔域的标签,如鞋面,突触和 VGLUT1 18的SV蛋白的pH值环境水泡ATP酶抑制剂一起使用时,pHluorins报告SV池动员19动力学和程度。调频染料为基础的方法这里描述在pHluorin技术的一些优点,首先,调频染料提供信息SV内吞作用模式的补充定价和储备池 8 。其次具体SV池可与具有不同的光谱特性的 20年,最后没有要求转FM染料标记。不能提供调频染料之间的休息,但是回收的SV池(对比pHluorins 19)的SV交通信息,自定义状态变量与染料期间加载的内吞作用是可见的。因此FM染料和pHluorins的长处和短处,并在独立实验中使用,以解决同样的问题时,是最强大的。
高品质的图像是必不可少的有效的分析和reproducib乐的结果。虽然可以很容易地纠正横向漂移,那里是一个在Z轴漂移的实验无法恢复。出于这个原因,重要的是重新集中开始前S1和S2卸载的图像。时发生的情况下,一个显著的荧光衰变,衰变更正可应用于(通常是由减去先前记录的跟踪,从FM加载细胞刺激的情况下)。然而,这是建议,图形表示和不被用于任何定量分析进行衰减校正。
披露声明
我们什么都没有透露。
致谢
这项工作是从威康信托基金(编号:084277)赠款支持。
材料
| Name | Company | Catalog Number | Comments |
| 名称 | 公司 | 目录没有。 | |
|---|---|---|---|
| AxioCam MRM牧师3数码相机 | 卡尔蔡司 | 4265099901000 | |
| Axio上Observer.A1显微镜 | 卡尔蔡司 | 43100.4亿 | |
| 细胞培养板(6井) | 格雷纳生物一 | 657160 | |
| 离心机(32R环球) | 海蒂诗Zentrifugen | 1610 | |
| 二氧化碳培养箱 | 贺利氏仪器 | 51014042 | |
| 猎鹰管(15/50毫升) | 格雷纳生物一 | 二十一万○二百六十一分之一十八万八千二百七十一 | |
| Fluar 20X / 0.75∞/ 0.17目标 | 卡尔蔡司 | 4401459901000 | |
| 盖玻片(Ø25mm) | VWR International的 | 631-1584 | |
| 玻璃巴氏吸管(230纳米) | 格雷纳生物一 | 612-1799 | |
| 血球 | VWR | 15170-170 | |
| 影像室 | 华纳 | RC - 21行为风险因素调查 | |
| 层流罩 | 百得 | VLF的行李处理系统1200 | |
| McIlwain组织砍刀 | 很多的实验室工程有限公司 | MTC / 2 | |
| 汞灯 | 卡尔蔡司 | HBO的103 | |
| MultiStim系统电刺激(100mV时,时脉宽度为1ms) | Digitimer有限公司 | D330 | |
| 灌注泵 | 沃森的马洛 | 313S | |
| 血清移液器(25年5月10日毫升) | 格雷纳生物一 | 606180/607180/760180 | |
| 快门控制器 | 卡尔蔡司 | MAC5000 | |
| 注射器(20毫升) | 屋宇署Plastipak | ST01 - B002 | |
| 注射式过滤器(Minisart - 0.20微米) | 赛多利斯Stedim | 16532 | |
| VC - 6六通道阀门控制器 | 华纳 | 64-0135 | |
| YFP的FilteR SET(设置46) | 卡尔蔡司 | 1196-681 |
表1。使用特殊设备和仪器
| 名称 | 公司 | 目录没有。 | 集中 |
|---|---|---|---|
| FM1 - 43 | 剑桥生物科学 | BT70021 | 10μM |
| FM2 - 10 | 剑桥生物科学 | BT70044 | 100μM |
| 聚D -赖氨酸 | 西格玛 | P7886 | 15微克/毫升 |
| 硅脂 | 西格玛 | 85403 | - |
表2。使用特定试剂
| 名称 | 公司 | 目录没有。 | 集中 |
|---|---|---|---|
| 牛血清白蛋白(BSA) | 西格玛 | A4503 | 0.3% |
| D -葡萄糖 | 西格玛 | G5767 | 0.25% |
| 镁以SO 4 · 7H 2 O | 西格玛 | M2773 | 1.5毫米 |
| D - PBS | Gibco公司 | 21300 | 960毫克毫升 |
- 使百毫升每个准备新鲜
使用前无菌过滤器
表3。溶液B中广核准备
| 名称 | 公司 | 目录没有。 | 集中 |
|---|---|---|---|
| 解决方案B | - | - | 19日毫升 |
| 胰蛋白酶(5毫克/毫升的股票,-20℃) | 西格玛 | T9201 | 1毫升 |
表4。解决方案T为中广核准备
| 名称 | 公司 | 目录没有。 | 集中 |
|---|---|---|---|
| 溶液C | - | - | 3.2毫升 |
| 解决方案B | - | - | 16.8毫升 |
表5。解决方案W为中广核准备
| 名称 | 公司 | 目录没有。 | 集中 |
|---|---|---|---|
| 脱氧核糖核酸(DNA酶,每0.5毫升股票500的U,-20℃) | 西格玛 | D5025 | 0.5毫升 |
| 硫酸镁4 · 7H 2 O | 西格玛 | M2773 | 1.5毫米 |
| 解决方案B | - | - | 10毫升 |
| 大豆胰蛋白酶抑制剂(SBTI,每0.5毫升股票,0.5毫克-20℃) | 西格玛 | T9003 | 0.5毫升 |
表6。溶液C中广核准备
| 名称 | 公司 | 目录没有。 | 集中 |
|---|---|---|---|
| 牛血清白蛋白(BSA) | 西格玛 | A4503 | 4% |
| 厄尔的平衡盐溶液(EBSS) | Gibco公司 | 24010 | 10毫升 |
| 硫酸镁4 · 7H 2 O | 西格玛 | M2773 | 3毫米 |
表7。中广核准备EBSS解决方案
| 名称 | 公司 | 目录没有。 | 集中 |
|---|---|---|---|
| 胞嘧啶β- D - arabinofuranoside(ARA - C)* | 西格玛 | C1768 | 10μM |
| 胎儿牛血清 | Gibco公司 | 10106 | 10% |
| D -葡萄糖 | 西格玛 | G5767 | 30毫米 |
| L -谷氨酰胺 | 西格玛 | G3126 | 2毫米 |
| 氯化钾 | 西格玛 | P5405 | 25毫米 |
| 最小的重要媒介(MEM) | Gibco公司 | 21090 | 500毫升 |
| (P)的青霉素/链霉素(S) | Gibco公司 | 15140 | 100 U /毫升(P)100微克/毫升(S) |
*的Ara - C应添加到中等,从1格起
表8。中广核准备的文化传媒
| 名称 | 版本 | 公司 |
|---|---|---|
| AxioVision REL。 | 4.8 | 卡尔蔡司 |
| ImageJ | 1.42q | 国家卫生研究院 |
| Microsoft Excel中 | 2003年 | 微软 |
表9。使用特定的计算机软件
| 名称 | 公司 | 目录没有。 | 集中 |
|---|---|---|---|
| 氯化钙2 · 2H 2 O | 西格玛 | C7902 | 1.3毫米 |
| 血糖 | 西格玛 | G5767 | 5毫米 |
| 氯化钾 | 西格玛 | P5405 | 3.5毫米 |
| KH 2 PO 4 | 西格玛 | P9791 | 0.4毫米 |
| 氯化镁2 · 6H 2 O | 西格玛 | M0250 | 1.2毫米 |
| 氯化钠 | Fluka公司 | 71378 | 170毫米 |
| 碳酸氢钠3 | Fluka公司 | 71627 | 5毫米 |
| NA 2 SO 4 | BDH实验室用品 | 10264 | 1.2毫米 |
| 工商业污水附加费 | 西格玛 | T1375 | 20毫米 |
表10。盐溶液(pH值7.4)
参考文献
- Rizzoli, S. O., Betz, W. J. Synaptic vesicle pools. Nat. Rev. Neurosci. 6, 57-69 (2005).
- Sudhof, T. C. The synaptic vesicle cycle revisited. Neuron. 28, 317-320 (2000).
- Evans, G. J., Cousin, M. A. Activity-dependent control of slow synaptic vesicle endocytosis by cyclin-dependent kinase 5. J. Neurosci. 27, 401-411 (2007).
- Clayton, E. L., Cousin, M. A. Differential labelling of bulk endocytosis in nerve terminals by FM dyes. Neurochem. Int. 53, 51-55 (2008).
- Clayton, E. L., Evans, G. J., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J. Neurosci. 28, 6627-6632 (2008).
- Cousin, M. A. Use of FM1-43 and other derivatives to investigate neuronal function. Curr. Protoc. Neurosci. Chapter 2, Unit 2-Unit 2 (2008).
- Clayton, E. L. The phospho-dependent dynamin-syndapin interaction triggers activity-dependent bulk endocytosis of synaptic vesicles. J. Neurosci. 29, 7706-7717 (2009).
- Cheung, G., Jupp, O. J., Cousin, M. A. Activity-dependent bulk endocytosis and clathrin-dependent endocytosis replenish specific synaptic vesicle pools in central nerve terminals. J. Neurosci. 30, 8151-8161 (2010).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Curr. Opin. Neurobiol. 6, 365-371 (1996).
- Ryan, T. A., Reuter, H., Smith, S. J. Optical detection of a quantal presynaptic membrane turnover. Nature. 388, 478-482 (1997).
- Murthy, V. N., Sejnowski, T. J., Stevens, C. F. Heterogeneous release properties of visualized individual hippocampal synapses. Neuron. 18, 599-612 (1997).
- Tan, T. C. Cdk5 is essential for synaptic vesicle endocytosis. Nat. Cell. Biol. 5, 701-710 (2003).
- Anggono, V., Cousin, M. A., Robinson, P. J. Styryl dye-based synaptic vesicle recycling assay in cultured cerebellar granule neurons. Methods. Mol. Biol. 457, 333-345 (2008).
- Gallo, V. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Stevens, C. F. Neurotransmitter release at central synapses. Neuron. 40, 381-388 (2003).
- Mozhayeva, M. G. Development of vesicle pools during maturation of hippocampal synapses. J. Neurosci. 22, 654-665 (2002).
- Cousin, M. A., Evans, G. J. O. Activation of silent and weak synapses by cAMP-dependent protein kinase in cultured cerebellar granule neurons. J. Physiol. 589, 1943-1955 (2011).
- Kim, S. H., Ryan, T. A. Synaptic vesicle recycling at CNS synapses without AP-2. J. Neurosci. 29, 3865-3874 (2009).
- Kim, S. H., Ryan, T. A. Cdk5 serves as a major control point in neurotransmitter release. Neuron. 67, 797-809 (2010).
- Groemer, T. W., Klingauf, J. Synaptic vesicles recycling spontaneously and during activity belong to the same pool. Nat. Neurosci. 10, 145-147 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。