需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
实验小鼠模型阴道接种和样品采集的协议念珠菌阴道炎
摘要
在评价中使用的关键技术念珠菌阴道炎在实验动物模型进行了描述。该方法将允许从阴道标本和淋巴细胞的快速收集,排水腰淋巴结。这些技术可能会引起女性下生殖道的其它疾病的小鼠模型。
摘要
由念珠菌引起的外阴阴道念珠菌病(VVC),是一个较低的女性生殖道,在他们 18,32-34的生育年龄影响其他健康妇女中约75%的真菌感染。诱发因素包括生殖激素水平的抗生素使用,未经控制的糖尿病和干扰因怀孕,口服避孕药或激素替代疗法 33,34 。复发性VVC(RVVC),定义为三个或三个以上,每年发作,影响一个单独的5至8%的妇女没有诱发因素33。
的VVC的实验小鼠模型已经建立,并用于研究的发病机制和 粘膜念珠菌3,4,11,16,17,19,21,25,37宿主反应。这种模式也得到了测试体内 13,24潜在的抗真菌治疗。该模型要求的动物保持在一个国家选择pseudoestrusimal 念珠菌定植/感染6,14,23。在这种情况下,将已接种过的动物身上检测到的几个星期到几个月的阴道霉菌负担。过去的研究表明一个非常高的动物模型和人类感染的相对免疫和生理特性3,16,21之间的平行。差异,但是,包括念珠菌作为阴道正常菌群的缺乏和中性在小鼠的阴道pH值。
在这里,我们展示了一系列的鼠标阴道炎模型的主要方法,包括阴道接种,迅速收集阴道标本,评估阴道的真菌负担,细胞提取/隔离的组织筹备工作。其次是阴道灌洗液真菌的负担,及引流淋巴结白细胞产量的选民代表结果。随着使用麻醉剂,灌洗样本可以在多个时间点收集纵向评价相同的小鼠感染/定植。此外,这种模式要求没有启动感染的免疫抑制剂,使定义的主机条件下的免疫学研究。最后,模型和每种技术的介绍,这里可能引起的方法来研究降低女性生殖道(细菌,寄生虫,病毒)和各自的局部或全身的宿主防御的其他传染病。
研究方案
1。阴道白色念珠菌接种
- 接种前三天,同时抑制动物暴露腹部,注入100μL芝麻油含有0.1-0.5毫克β-雌二醇皮下注射小腹。前进针约5至10毫米,外侧的皮肤,以尽量减少注射部位的泄漏。
在这个模型中,由于接近生殖道的最佳皮下注射雌激素在小腹。有效剂量可能会有所不同小鼠品系,年龄或雌激素衍生物。在以往的研究中使用CBA - J(H -κ),C3H/HeN(H -κ),C57BL / 6(H - B),BALB / C(H - D),DBA / 2( H 2 D),SJL 6-8周龄的小鼠(H - 2 S),0.1毫克μL发现有效证明阴道壁增厚,减少阴道粘液和增加上皮细胞脱落。以上,在此浓度的雌激素治疗的小鼠表现出一致的阴道念珠菌定植。接种其他菌株和年龄的小鼠,试验研究,建议,以确保修改后的条件下,雌激素的有效性,如果有必要增加雌激素的剂量。
雌激素的解决方案应准备新鲜,每次注射日。为了确保香油中的雌激素完整的溶解度,彻底的解决方案,使用一个旋涡混合器和热间歇混合,在37 ° C。在整个学习期间每周重复注射。 - 为了准备接种,添加一个C 的 loopful从最近的亚文化编制成10毫升与0.1%葡萄糖补充Phytone蛋白胨肉汤(SDA),沙氏葡萄糖琼脂念珠菌blastoconidia 。在25 ° C在一个惊天水浴孵育肉汤培养18小时的固定相。
- 孵化后,收集日发送到一个15毫升的锥形管和离心机在5分钟的800 XG的肉汤培养。用无菌PBS洗涤沉淀两次。
- 枚举通过台盼蓝染色排除血球可行blastoconidia。调整细胞浓度为2.5 × 10 6 / ml的无菌PBS(或所需的接种浓度) 。
- 为了稳定鼠标,用两个手指举行的尾巴基地,向上抬起臀部,使阴道口朝自己的方向(图1A)面临。它是理想的,如果鼠标被放置在平坦的磨碎的表面(如笼顶部),使鼠标可以提供对尾克制的阻力。
- 吸取20μL(或所需的量不超过20μL)接种悬挂插入深约5毫米到阴道腔(图1B)枪头。完成这一步,尽快和尽可能轻轻减少鼠标窘迫。
2。阴道灌洗
- 以下安乐死(或麻醉),H旧的鼠标用两个手指,使阴道口变得露出尾巴的基地向下。
- 通过引进与枪头反复抽吸和鼓动100μL无菌PBS灌洗阴道腔。枪头可能成为与细胞堵塞。如果发生这种情况,免除阻碍细胞,并在阴道内,继续与余下的PBS lavaging。收集到离心管灌洗液。
- 另外,阴道灌洗,可与异氟醚吸入麻醉麻醉小鼠。对于这一点,暴露小鼠蒸发异氟醚,直到它们完全镇静剂(〜30秒)。向下按住老鼠尾巴的基地,并使用无菌PBS 50μL,轻轻灌洗阴道管腔。确保一个枪头,以避免恶劣的鼓动,在此过程中,尽量减少创伤阴道。镇静小鼠从麻醉中恢复接触周围空气的30秒内。
异氟醚可以使用异氟醚蒸发器和O 2(首选)或一个标准的降系统关闭蒸发器系统(同时服用镇静剂,以避免呼吸窘迫,需要密切监测动物)麻醉室蒸发。
对麻醉小鼠阴道灌洗液应在同一小鼠的纵向灌洗样本的首选方法。连续lavaging不影响评估随着时间的推移41真菌负担。
- 湿安装的准备工作,转移到载玻片10μL灌洗液400 - 1000倍放大倍率光学显微镜观察。此外,灌洗液细胞成分可以染色研究细胞和核形态。涂抹的准备工作,转移到载玻片10μL灌洗液和使用一个枪头外壁轻轻蔓延。保持与CytoPrep固定液涂抹样品和标准的巴氏法染色(子宫颈抹片检查)。 400 ×放大倍率光学显微镜观察。
3。阴道霉菌负担的量化
- 在96圆底板,转移到一个顶行和该列分为以下5井(跌板)180μL无菌PBS灌洗液。
- 使阴道灌洗液1:10系列稀释液20μL转移到旁边的列以及。调匀反复每次转让前的愿望。连续稀释至12灌洗样本(一个完整的横向排)可以同时进行,使用了12道移液器。
- 从最低稀释,转移到沙氏葡萄糖琼脂(SDA),10μL的样品。可以进行多达36个样品的电镀1板使用方电网和可调间距多道移液器的Petri菜准备SDA。
- 枚举孵化后的菌落形成单位(CFUs)在34 ° C F或48小时
4。阴道组织提取
- 阴道灌洗过程,奠定了安乐死鼠标在它的后面,并用70%乙醇饱和腹股沟区。使用一对镊子,解除泌尿口向上,使阴道口变得暴露。
- 一双弯钳插入阴道腔和宫颈定位。同时保持与镊子牢牢把握,提取子宫颈通过阴道腔(图2A - C的)。
- 海关的阴道在阴道口的基地,然后取出宫颈从阴道手术剪。请记住,阴道组织繁难(阴道内的上皮端暴露向外)。组织可以是横向倒阴道保持原来的方向,或成片开使外侧切口。
切除阴道组织可用于1)淋巴细胞提取以下拼贴激酶消化(〜1 × 10 4 /鼠标)40,2)上皮细胞的分离以下dispase消化(〜5 × 10 4 /鼠标)28,3)冷冻或石蜡包埋的准备工作,为25个组织学分析。
5。腰淋巴结切除术
- 阴道灌洗过程,奠定了安乐死鼠标在它的后面,腹部用70%乙醇饱和。一个从小腹开始到胸部的外侧切口,暴露内部器官。使用双手一双镊子,向上移动肠子,使中央的血管变得可见。
- 找到下腔静脉和腹主动脉。通常情况下,可确定一对腰淋巴结腹主动脉旁,之间大约一半位于肾和髂动脉的起源39。这些淋巴结,可以直观地区别于脂肪组织,弹性质感更轻,颜色更不透明相比,脂肪组织(图3)。这些淋巴结明显较大,在受感染的动物,比未接种动物。
- 海关置于节点microforceps的淋巴结,然后轻轻地拉起周围组织分开。
6。在单细胞悬液中分离淋巴细胞
- 转移到无菌丝网屏幕置于无菌玻璃培养皿〜10毫升汉克斯'平衡盐溶液(HBSS)(图4)菜内(约3 × 3厘米大小2)淋巴结肿大。
- 倾向于轻微的培养皿中,按屏幕对用注射器柱塞头的淋巴结。确保打破所有淋巴结的节点,使细胞内容物通过屏幕传递节点的非细胞成分(即细胞膜,间质,脂肪),而留在屏幕上。
- 使用相同的柱塞和注射器,吸吨他HBSS中含有细胞。屏幕〜5毫升的HBSS洗净,并收集到一个15毫升的锥形管,其余的液体。
- 离心10分钟800 XG。在流体的顶部之前丢弃的液体用吸管吸任何脂肪沉积。与HBSS洗涤细胞沉淀三次。 1毫升的HBSS,并列举可行的细胞经台盼蓝染料排斥重悬沉淀。
7。代表性的成果:
> 4天接种小鼠阴道灌洗液细胞组分通常由念珠菌 ,上皮细胞和细胞浸润(图5)。 念珠菌湿装入镜, 可以直观地确定由菌丝的存在以及酵母(图5A) 。可染巴氏技术的研究,其中主要细胞是由三,形核确定中性粒细胞的上皮细胞和浸润的白细胞,阴道灌洗液涂片准备AR叶(图5B)。发现很少中性粒细胞,如果有的话,在未接种的小鼠(图5C)41 。
阴道霉菌负担的一个例子是如图6所示。在特定时间点收集的阴道灌洗液培养CFU枚举(图6a)。 念珠菌感染阴道定植/坚持周雌激素治疗的小鼠接种(图6B),而念珠菌不能建立在非雌激素治疗的小鼠接种(图6C)阴道定植。雌激素治疗的未接种的小鼠仍然念珠菌的负面整个时间(数据未显示)。此外,阴道灌洗,可以执行,也可以在不同的小鼠在各时间点或纵向相同的小鼠在麻醉状态下的一次。
腰淋巴结初级引流淋巴结,生殖道和阴道的挑战全身免疫反应,以评估最相关的网站。 ñOTE,这些淋巴结可能成为扩大接种小鼠,而他们通常出现在未接种的小鼠相当小。白血球细胞的回收率通常范围从8 × 10 5 /未接种的小鼠,以5 × 10 6 /接种鼠标。除了腰淋巴结,腹股沟,腘窝及肠系膜淋巴结也可使用。
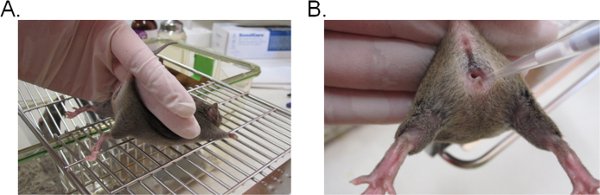
图1。阴道念珠菌接种。 A)鼠标克制接种。鼠标放在一个铁丝笼插入和尾巴的基地举行,稍微向上抬起双腿,露出阴道口。用同样的手,因为它试图抵制尾巴克制,臀部的鼠标可以稳定。 b)介绍的接种到阴道腔。一个枪头轻轻地插入到阴道腔深约5毫米。然后敷悬挂接种。
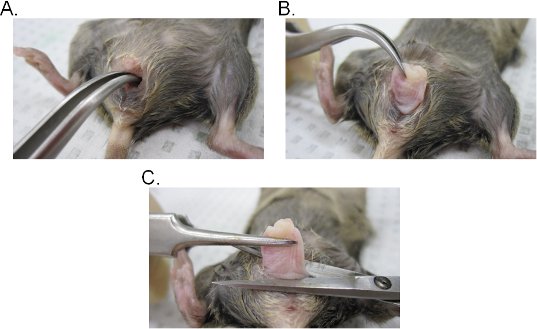
图2。阴道组织提取。 AB)提取的子宫颈。宫颈是位于弯钳和向外通过阴道腔暴露。一旦出了阴道内,子宫颈是进一步拉向外充分暴露阴道。三)提取的阴道。阴道切除外阴用剪刀。分离后,取出从阴道内的子宫颈。

图3。鉴定腰淋巴结。之间周围器官/血管在骨盆附近的腰淋巴结的位置表示。一,腹主动脉。 B,膀胱。 C,髂总动脉。我肠子。 L时,肝。 R,直肠。 S,脾。 U,子宫。

图4。腰淋巴结丝网屏幕上的节点。淋巴结汇集到放置在培养皿中与HBSS屏幕。对用注射器推杆,获得单细胞悬液淋巴细胞的屏幕上按下淋巴结。
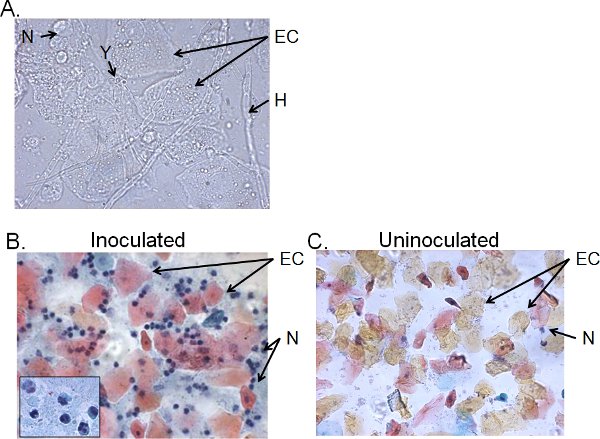
图5。接种小鼠阴道灌洗液的细胞组分。 a)湿安装和B)的巴氏涂片阴道灌洗样本的准备收集4天接种后和C)未接种小鼠。图像显示在1000 ×(A)或400 ×(B,C)的放大倍率。插入B中显示1000 ×阴道中性粒细胞的核形态。假丝酵母菌(Y)和菌丝(H)上皮细胞(EC)和neutrohils(N)表示。
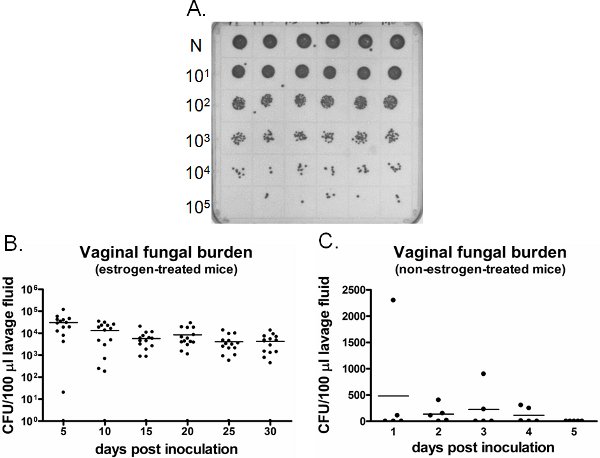
图6检测离子阴道霉菌负担。一)代表白念珠菌菌落生长在SDA板。整齐(N)的6个不同的接种小鼠(上排)灌洗样品连续稀释和培养CFU枚举。二)在雌激素阴道霉菌负担的量化处理和C)非雌激素治疗的老鼠。 CFU/100μL接种小鼠肺泡灌洗液评估在指定的时间点。
讨论
念珠菌性阴道炎的实验小鼠模型已经建立,在过去的几十年历史念珠菌的黏膜宿主反应,以及用于研究测试抗真菌疗法3,4,11,13,16,17,19,21,24 , 25,37。协议提出,这里纳入效率和劳动密集程度较低的方法,并出现念珠菌性阴道炎的最优化模型系统描述迄今为止。这些技术使真菌负担和收集阴道标本的快速定量分析。此外,以往的研究测试小鼠的几个haplotypic株(N =...
披露声明
没有利益冲突的声明。
致谢
这项工作是支持R01 AI32556(NIAID的国立卫生研究院)。这项工作也得到了支持路易斯安那疫苗中部和南部路易斯安那州路易斯安那州摄政理事会主办的传染病研究学会的部分。
材料
| 试剂名称 | 公司 | 目录编号 | 评论 |
| 雌性CBA / J小鼠 | 查尔斯河实验室 | 01C38 | 5-6周龄 |
| 白色念珠菌 (3153A) | 国家征收的致病真菌,英国 | NCPF3153 | |
| 芝麻油 | Sigma - Aldrich公司 | S3547 | 不需要使用前必须预消毒 |
| Β-雌二醇17戊酸 | Sigma - Aldrich公司 | E1631 | 0.1 - 0.5mg的香油 |
| Phytone蛋白胨 | 碧迪 | 211906 | 补充0.1%葡萄糖 |
| 台盼蓝溶液 | Sigma - Aldrich公司 | T8154 | |
| 沙氏葡萄糖琼脂 | 流式细胞迪克inson | 211584 | |
| 型胶原酶IV | Sigma - Aldrich公司 | C5138 | 0.25% |
| Dispase | Invitrogen公司 | 17105-041 | 1.7 U /毫升 |
| 丝网屏幕 | 雷公藤多甙 | 060X060S0065W36T | 第60号网,不锈钢 |
| 汉克斯“平衡盐溶液 | Invitrogen公司 | 24020-117 | |
| CytoPrep固定液 | Fisher Scientific则 | 12-570-10 | 保留涂抹幻灯片 |
| 巴氏染色EA - 65 | EMD化学品 | 7054X - 85 | |
| 巴氏染色OG - 6 | EMD化学品 | 7052X - 85 | |
| 哈里斯“明矾苏木 | EMD化学品 | 638A - 85 | |
| 异氟醚 | 百特医疗用品 | NDC 10019-773-60 | 异氟醚蒸发器,或在一个下拉系统中使用封闭麻醉室 |
参考文献
- Abraham, M. C. Inducible immunity to Trichomonas vaginalis in a mouse model of vaginal infection. Infect. Immun. 64, 3571-3571 (1996).
- Black, C. A. Major histocompatibility haplotype does not impact the course of experimentally induced murine vaginal candidiasis. Lab. Anim. Sci. 49 (6), 668-668 (1999).
- Black, C. A. Acute neutropenia decreases inflammation associated with murine vaginal candidiasis but has no effect on the course of infection. Inf. Immun. 66, 1273-1273 (1998).
- Black, C. A. Increased severity of Candida vaginitis in BALB/c nu/nu mice versus the parent strain is not abrogated by adoptive transfer of T cell enriched lymphocytes. J. Reprod. Immunol. 45, 1-1 (1999).
- Buchannan, D. L. Role of stromal and epithelial estrogen receptors in vaginal epithelial proliferation, stratification, and cornification. Endocrinology. 139 (10), 4345-4345 (1998).
- Clemons, K. V. Genetic susceptibility of mice to Candida albicans vaginitis correlates with host estrogen sensitivity. Infect. Immun. 72, 4878-4878 (2004).
- Conrady, C. D., Halford, W. P., Carr, D. J. Loss of the type I interferon pathway increases vulnerability of mice to genital Herpes simplex virus 2 infection. J. Virol. 85 (4), 1625-1625 (2011).
- Cunha, G. R., Cooke, P. S., Kurita, T. Role of estromal-epithelial interaction in hormonal responses. Arch Histol Cytol. 67 (5), 417-417 (2004).
- Enjalbert, B. A multifunctional, synthetic Caussia princeps luciferase reporter for live imaging of Candida albicans infections. 77 (11), 4847-4847 (2009).
- Feinen, B. Critical role of Th17 responses in a murine model of Neisseria gonorrhoeae genital infection. Mucosal Immunol. 3 (3), 312-312 (2010).
- Fidel, P. L. Distinct protective host defenses against oral and vaginal candidiasis. Med. Mycol. 40, 359-359 (2002).
- Fidel, P. L. An intravaginal live Candida challenge in humans leads to new hypotheses for the immunopathogenesis of vulvovaginal candidiasis. Infect. Immun. 72, 2939-2939 (2004).
- Fidel, P. L., Cutright, J. L., Sobel, J. D. Efficacy of D0870 treatment of experimental Candida vaginitis. Antimicrob. Agents. Chemother. 41, 1455-1455 (1997).
- Fidel, P. L., Cutright, J. L., Steele, C. Effects of Reproductive hormones on experimental vaginal candidiasis. Infect. Immun. 68, 651-651 (2000).
- Fidel, P. L. A murine model of Candida glabrata vaginitis. J. Inf. Dis. 173, 425-425 (1996).
- Fidel, P. L. Analysis of vaginal cell populations during experimental vaginal candidiasis. Inf. Immun. 67, 3135-3135 (1999).
- Fidel, P. L., Lynch, M. E., Sobel, J. D. Candida-specific cell-mediated immunity is demonstrable in mice with experimental vaginal candidiasis. Infect. Immun. 61, 1990-1990 (1993).
- Fidel, P. L., Sobel, J. D. Immunopathogenesis of recurrent vulvovaginal candidiasis. Clin. Microbiol. Rev. 9. 9, 335-335 (1996).
- Fidel, P. L., Sobel, J. D., Zak, O., Sande, M. . Murine Models of Candida Vaginal Infections, In Experimental models in antimicrobial chemotherapy. , 741-748 (1999).
- Fidel, P. L., Vazquez, J. A., Sobel, J. D. Candida glabrata: Review of epidemiology, pathogenesis, and clinical disease with comparison to C. albicans. Clin. Microbiol. Rev. 12, 80-80 (1999).
- Fulurija, A., Ashman, R. B., Papadimitriou, J. M. Neutrophil depletion increases susceptibility to systemic and vaginal candidiasis in mice, and reveals differences between brain and kidney in mechanisms of host resistance. Microbiology. 142, 3487-3487 (1996).
- Gill, N. NK cells require type I IFN receptor for antiviral responses during genital HSV-2 infection. Cell Immunol. 269 (1), 29-29 (2011).
- Hamad, M., Abu-Elteen, K. H., Ghaleb, M. Estrogen-dependent induction of persistent vaginal candidosis in naive mice. Cell. Immunol. 47 (7), 304-304 (2004).
- Hamad, M. Utility of the oestrogen-dependent vaginal candidosis murine model in evaluating the efficacy of various therapies against vaginal Candida albicans infection. Mycoses. 49 (2), 104-104 (2006).
- LeBlanc, D. M., Barousse, M. M., Fidel, P. L. A role for dendritic cells in immunoregulation during experimental vaginal candidiasis. Infect. Immun. 74, 3213-3213 (2006).
- McGrory, T., Garber, G. E. Mouse intravaginal infection with Trichomonas vaginalis and role of Lactobacillus acidophilus in sustaining infection. Infect. Immun. 60, 2375-2379 (1992).
- Naglik, J. R., Fidel, P. L., Odds, F. C. Animal models of mucosal Candida infection. FEMS. Microbiol. Lett. 283 (2), 129-129 (2008).
- Nomanbhoy, F. Vaginal and oral epithelial cell anti-Candida activity. Inf. Immun. 70, 7081-7081 (2002).
- Pietrella, D. A beta-glucan-conjugate vaccine and anti-beta-glucan antibodies are effective against murine vaginal candidiasis as assessed by a novel in vivo imaging technique. Vaccine. 28 (7), 1717-1717 (2010).
- Redondo-Lopez, V., Cook, R. N., Sobel, J. D. Emerging role of Lactobacilli in the control and maintenance of the vaginal bacterial microflora. Rev Infect Dis. 12 (5), 856-856 (1990).
- Saavedra, M. Local production of chemokines during experimental vaginal candidiasis. Inf. Immun. 67, 5820-5820 (1999).
- Sobel, J. D. Pathogenesis and epidemiology of vulvovaginal candidiasis. Ann. N. Y. Acad. Sci. 544, 547-547 (1988).
- Sobel, J. D. Pathogenesis and treatment of recurrent vulvovaginal candidiasis. Clin. Infect. Dis. 14, S148-S153 (1992).
- Sobel, J. D. Vulvovaginal candidiasis: Epidemiologic, diagnostic, and therapeutic considerations. Am. J. Obstet. Gynecol. 178 (2), 203-203 (1998).
- Song, W. Local and humoral immune responses against primary and repeat Neisseria gonorrhoeae genital tract infections of 17β-estradiol-treated mice. Vaccine. 26, 5741-5741 (2008).
- Taylor, B. N. In vivo virulence of Candida albicans isolates causing mucosal infections in people infected with the human immunodeficiency virus. J. Infect. Dis. 182, 955-955 (2000).
- Taylor, B. N., Saavedra, M., Fidel, P. L. Local Th1/Th2 cytokine production during experimental vaginal candidiasis. Med. Mycol. 38, 419-419 (2000).
- Tirabassi, R. S. A mucosal vaccination approach for herpes simplex virus type 2. Vaccine. 29 (5), 1090-1090 (2011).
- Broeck, W. V. a. n. d. e. n., Derore, A., Simoens, P. Anatomy and nomenclature of murine lymph nodes: descriptive and nomenclatory standardization in BALB/cAnNCrl mice. J. Immunol. Methods. 312 (1-2), 12-12 (2006).
- Wormley, F. L., Chaiban, J., Fidel, P. L. Cell adhesion molecule and lymphocyte activation marker expression during experimental vaginal candidiasis. J. Immunol. Methods. 69, 5072-5072 (2001).
- Yano, J. Epithelial cell-derived S100 calcium-binding proteins as key mediators in the hallmark acute neutrophil response during Candida vaginitis. Infect. Immun. 78 (12), 5126-5126 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。