需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
自动子宫组织移植手术诱发子宫内膜异位症小鼠模型
摘要
子宫内膜异位症手术诱导小鼠和大鼠子宫组织的自动移植到肠系膜动脉级联的描述。
摘要
子宫内膜异位症是一种慢性,痛苦的疾病,其病因尚不清楚。此外,子宫内膜异位症的治疗,可以要求腹腔镜切除病灶和/或慢性疼痛和不孕症状的药品管理。已与子宫内膜异位症相关的成本估计为每年220亿美元,在美国的1 。为了进一步了解我们这个谜一般的疾病的基本机制的,动物模型已被采用。灵长类动物的自发发展子宫内膜异位症,因此灵长类动物模型最接近妇女疾病。然而,啮齿动物模型更具成本效益和随时可用2。我们在这里描述的模型,涉及到肠系膜(图1)自体子宫组织转移,并首次在大鼠 3,后来转移到鼠标的4 。手术引起的子宫内膜异位症的自体啮齿动物模型的目标是模仿在女性的疾病。我们和其他人曾在小鼠或大鼠镜观察到,在妇女疾病5,6子宫内膜异位病灶观察表明,改变基因的表达模式。鼠标在执行手术的优点之一是,大量的转基因小鼠品系可以帮助研究人员确定的具体组成部分子宫内膜异位症的建立和发展中的重要作用。另一种模式,即切除子宫内膜碎片是免疫功能低下小鼠的腹膜也被广泛使用,但受限于缺乏正常的免疫系统被认为是在子宫内膜异位症2,7的重要。重要的是,手术引起的子宫内膜异位症的小鼠模型是一个通用的模型已被用于研究免疫系统8,9,10和 11,12激素环境因素如何影响子宫内膜异位症,以及子宫内膜异位症的影响,对fertility 13和痛苦14。
研究方案
1。规划活畜手术
- 确保相应的审批已收到与实验动物工作。
- 订购小鼠,并允许至少一个星期驯化新的环境。
- 雌性小鼠安置在接触到男性费洛蒙的情况下,可以停止循环,这种现象被称为惠滕效果15,16。为了保持骑自行车转移小鼠尿液浸泡过的男性床上用品的女性笼,每5天。另外,如果使用开顶式网箱,地方两个男性笼之间的女性笼保持经常骑自行车的女性。
- 确保通过阴道细胞学分析,老鼠是骑自行车,每天至少一个星期前手术(见表1)17。
- 使用蜡铅笔创建8个分区载玻片上,使阴道分泌物涂片检查可收集来自多个小鼠。
- 0.2-0.25 mL生理盐水或蒸馏水,用吸管冲洗阴道。是SURE的地方,只是在阴道口吸管,滴管宫颈的刺激,可能会导致假孕。将载玻片上的细胞类型分析的阴道灌洗。幻灯片可以读鲜(湿),或者固定的方法和研究使用标准光镜下17。
- 收集,清洗和消毒所有必要的手术设备,一个成功的无菌手术(见材料部分 ) 18。
- 准备在PBS镇痛使用无菌技术,提供0.2毫克/千克的最终剂量丁丙诺啡的解决方案。丁丙诺啡解决方案的浓度应为0.0333 mg / ml的假设,成人平均C57BL / 6小鼠重约0.025公斤皮下注射量的0.15%毫升鼠标。丁丙诺啡可提前准备的时间和存储作为等分。请注意,丁丙诺啡是一个附表第三类受控物质需要一个DEA许可证和详细的库存日志。
- 准备用青霉素(100 U /毫升)和链霉素(100微克/毫升)无菌PBS。
- 同步转移尿浸泡的男性床上用品的女性笼72小时前 15诱导发情周期。
2。活的动物手术准备手术区
- 准备手术区域,如前面所述的 18 。
- 准备通过设置电动快船,眼药膏,和手术磨砂准备区。
- 准备放置在手术区循环热水加热垫来维持整个手术体温手术区。放置一个以上的循环热水加热垫无菌防水垫。安排的手术器械,缝合,无菌玻璃培养皿中,活检冲床,无菌纱布,伤口剪辑和伤口无菌手术领域的剪辑撒施。
- 准备恢复区放置循环热水加热垫中途UNDER一个空笼子,让老鼠移动带走热量,如果需要的话。
3。准备手术的麻醉和鼠标
- 记录鼠标的重量和评估阴道细胞学检查,确定发情阶段。
- 麻醉诱导,放置在一个空的麻醉室(含固为异氟醚门户盖的空笼)鼠标。打开非再吸入异氟醚麻醉系统,蒸发器,并设置4%异氟醚(0.5至1 L / min的氧流量)。
- 当鼠标在麻醉状态下开关一个锥形的异氟醚流(30-60毫升注射器鞘)和地方鼠标的鼻子和嘴在编制表上的锥。低浓度的异氟醚可维持足够的麻醉,整个手术(〜2.5-3.5%异氟醚)的其余部分。足够的麻醉深度应由脚趾捏刺激了否定的答复。
- 应用眼药软膏吨o避免在手术过程中眼睛干燥。
- 使用小型电动指甲刀,刮手术的部位。
- 消毒和准备手术的部位与洗必泰擦洗和70%的乙醇的三个交替挥笔。
- 披风用无菌领域的动物。
4。子宫结扎
- 设为一个小正中切口(1厘米)或者使用小剪刀或手术刀刀片结束0.5 - 1.0厘米,喙阴道口。
- 插入刀片之间的体壁和腹壁开放封闭的剪刀。轻轻钝性解剖切口周围的区域,慢慢地打开和关闭腹壁充分从皮肤上脱落的剪刀。可仔细剪断剩余可见腹壁切口周围皮肤之间的粘连。未能充分钝性解剖切口部位将关闭腹壁更加困难。
- 使用小Forceps,轻轻地找到左侧子宫角。子宫是背肠,这是什么,你会看到在第一次进入切口部位。在某些情况下,最简单的方法是,首先找到卵巢和卵巢脂肪垫。轻轻拉出子宫角和幻灯片它下面的一个开放的镊子作为一个拉钩。如果需要的话,请注意此时的卵巢和子宫的诱导发情阶段(见表1)的更多信息的外观。
- 伸出子宫角下方,轻轻滑入两个6-8厘米5-0黑色编织丝线缝合件(不带针)。
- 安全结扎子宫tubual的交界处(只是尾椎输卵管)和子宫颈交界(喙宫颈)在每个位置使用一个平结的号角。离开的那一刻缝线的两端。
- 剪出两国结扎子宫角和地方组织在无菌玻璃培养皿conta状态寄存器〜100μL的PBS含青霉素(100 U /毫升)和链霉素(100微克/毫升)。切的丝线缝合两端。如果缝线松动或有出血,找到断端,并配合另一个结。
5。准备从切除子宫内膜异位植入
- 虽然切除子宫是被操纵的,用无菌纱布覆盖腹部,并用无菌PBS含青霉素和链霉素需要保持水化。
- 剥开的脂肪切除子宫角。
- 如果需要,权衡切除子宫角。
- 打开子宫角插入管腔小剪刀的刀片(14毫米刀片长度),并轻轻向下滑动角子宫剪刀按住钳的号角。
- 在玻璃培养皿中,用2毫米的活检冲床切出三个相同大小的植入。
6。缝合腹腔子宫内膜异位植入
- 广场灭菌发送立即以上的切口部位,彻底无菌PBS含青霉素和链霉素湿的纱布。
- 具有体积小,顺利钳轻轻地发现盲肠和小肠rostrally沿着。拉出的小肠小(4-5厘米)的部分,至少有两个动脉离盲肠,并安排它就像一个预湿纱布上的风扇,使肠系膜动脉级联清晰可见。一定要保持肠道湿润,在任何时候,用无菌生理盐水。注:不使用鼠齿钳,同时处理排便。
- 6-0黑ethilon缝合使用的P - 1,11毫米,3 / 8圈,反向切割针轻轻地缝合一个植入动脉约0.5厘米的肠管。
- 注:肠系膜是由薄薄的一层腹膜覆盖。周围动脉缝合时要小心,使通过这一层干净的传递。通过缓慢而仔细地拉出缝合撕裂腹膜或破裂动脉。
- 完成两节一抛出,小心不收紧缝合很难,因为这样做可能会导致血流量,随后坏死的小肠和死亡的损失。修剪内植入2毫米缝合。湿肠再继续保持移动到下一个植入前的水化。
- 在延髓的方向移动,未来3-4厘米的小肠拉出并轻轻地取代部分已经包含一个植入。从以前的植入部位跳过一个或两个动脉缝合植入未来。重复第三植入。
- 替换所有的肠管在腹腔。
7。深水手术
- 深水手术是无组织缝合肠系膜除外子宫内膜异位症手术中使用相同的步骤。
- 海关在左侧子宫角,在第4步。
- 子宫内膜异位植入物(步骤5)不准备在假手术。 “切除子宫角,可以丢弃或用于其他目的,如果需要的话。
- 三个动脉周围放置缝线,但没有组织,在第6步的肠系膜动脉级联。
8。关闭手术伤口
- 确保所有机关约回其解剖位置。
- 使用5-0薇乔缝线涂层在非环环相扣的连续缝合关闭腹壁。
- 使用9毫米伤口剪辑关闭皮肤。
9。恢复动物
- 0.15 ml/25克鼠标,通过剂量为0.2毫克/公斤皮下注射0.33毫克/毫升丁丙诺啡管理。丁丙诺啡是手术后管理,以防止进一步的心血管/呼吸抑制,可以延长恢复过程。
- 鼠标轻轻擦干kimwipes或如果它已经得到了手术过程中的湿纸巾。
- 广场动物腹侧面朝下笼partially之上循环加热水垫,直到动物恢复和恢复胸骨斜卧(在五分钟吸入麻醉很快消失之内)。
10。手术后的护理
- 老鼠应该遵守每15分钟,直到他们能够保持,直到他们恢复他们的正常行为,手术后的胸骨斜卧,然后每小时。
- 手术后24小时内应该会出现正常小鼠。应每天监测小鼠的复苏和健康良好的迹象七至10天。
- 迹象表明,在健康状况不佳,疼痛,或窘迫的动物包括活性下降,自残,ungroomed外观,或弯腰驼背的姿势。
- 如果动物没有出现健康良好,手术后24小时内,无论是管理丁丙诺啡(0.2毫克/千克)或安乐死的动物。如果动物补充丁丙诺啡管理动物shoul 8小时内不改善D是安乐死肠坏死可能。
- 删除伤口片段诱导后的7-10天。
- 继续监测发情的周期性阴道细胞学检查实验时间。同步发情周期,以收集前72小时尿浸泡的男性床上用品转让步骤1.3中所述的女性笼。
11。剖检和组织切除
- 剖检时机是依赖于特定的研究问题和代表性的结果,并讨论进一步讨论。
- 安乐死的二氧化碳窒息的鼠标。
- 收集心脏上1CC注射器使用的23号针头穿刺的“血液”(如果需要)。
- 收集阴道细胞学涂片,如上所述,以确定在发情阶段的时间收集17。
- 切子宫输卵管交界剩余的子宫角,子宫颈,去除脂肪,称重,和过程所需(见11.14和11.15)。
- 找到子宫内膜异位病灶周围的黑色缝线。照片不变,如果子宫内膜异位病灶所需。
- 仔细解剖用小剪刀和镊子的子宫内膜异位病灶周围的粘连,小心,不要枪的病变。快速,细致地工作,以防止RNA降解。
- 测量和记录使用卡钳的子宫内膜异位病灶的长度和宽度。
- 海关子宫内膜异位病灶和纸巾上沾用PBS。删除任何非子宫内膜异位症的病变组织。在解剖显微镜或放大镜站可用于援助在解剖。
- 权衡三个充满液体的子宫内膜异位病灶,以消除缝合前。
- 轻轻地取出缝合子宫内膜异位病灶。
- 对于组织学,福尔马林修复一个充满液体的子宫内膜异位症病灶我两个小时,三个30分钟的PBS洗涤和最终存储N 70%的乙醇。脱水和石蜡嵌入。
- 兰斯两个子宫内膜异位病灶。权衡这些了。自循环荷尔蒙的变化可以改变囊液量,这给衡量组织湿重,除了囊肿的重量加在11.10被测流体。
- RNA分离和基因表达研究,立即均质lanced子宫内膜异位症病灶裂解约束力的解决方案和存储(或子宫组织〜20微克),在-80 ° C RNAqueous试剂盒(Ambion公司)或其他方法为未来的RNA隔离理想。
- 对于未来的RNA,DNA或蛋白质隔离,立即抢购冻结第二lanced子宫内膜异位症病灶(或〜20微克子宫组织)在液氮和存储于-80 ° C。
代表性的成果
在手术引起的子宫内膜异位症小鼠模型的子宫内膜异位病灶形态和组织学与观察妇女。子宫内膜异位症的妇女和小鼠模型的组织学分析表明,子宫内膜异位病灶中含有子宫内膜腺体和间质(图2A)。在小鼠子宫内膜异位病灶中还含有含铁血黄素的巨噬细胞,这是一个妇女常见的子宫内膜异位症标志在(图2B)19。
子宫内膜异位病灶去除从小鼠诱导后3天出现红肿和出血(图3A)。经过两到四个星期在小鼠模型子宫内膜异位病灶增长囊肿样,充满液体和腹膜粘连包围(图3B及3C)。诱导病变的重量相比,充满液体的病灶分别为306%和862%在一两个月后上岗和lanced病变分别为51%和172%较大,分别(图4A和4B)。我们已取得一致的流体填补,并在一个月后上岗lanced子宫内膜异位症病灶重量超过五个不同的实验(图5)。在1个月后duction充满液体(7.44 ± 3.75毫克)和lanced(2.92 ± 1.23毫克)子宫内膜异位症病灶重量均显着相关(Pearson相关系数= 0.669,P <0.001)。
鼠标年龄不影响小鼠病灶大小为3到10之间个月的年龄。无论是充满lanced子宫内膜异位症病灶的重量,或在1个月的流体诱导后显着与动物的年龄(R = -0.136,P = 0.380和r = -0.063,P = 0.698 )。
小鼠子宫发生变化的大小,液体潴留,细胞增殖和外观由于类固醇激素的在发情周期的影响。我们从不同的发情阶段的动物,其余完好的子宫角的重量相比,子宫内膜异位症病灶重量。我们没有发现显著的相关性之间的子宫重量和填充液体或lanced子宫内膜异位症升esion体重在一个月后感应(R = -0.046,P = 0.765 和 r = 0.232,P = 0.155,分别)。
密切观察小鼠的子宫内膜异位症病变的基因表达模式的镜子,在妇女疾病的5报道。 3天诱导后基因调控的细胞外基质重塑,细胞粘附和血管生成高度上调,这些基因中的许多人仍然通过一个月增长上调。
图和表

图1。诱导自体组织移植在小鼠子宫内膜异位症手术。左侧子宫角结扎,切除,并打开纵向暴露子宫内膜。 3个2毫米2活检准备,每个缝合动脉动脉级联在肠道mesenteRY。一个月后上岗,子宫内膜异位病灶充满液体和周围粘连。
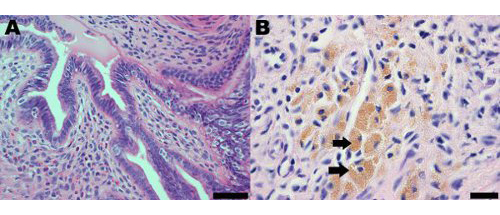
图2苏木精和曙红染色部分从子宫内膜异位症的小鼠模型,在1个月后上岗的子宫内膜病变展示(一)存在子宫内膜腺体和间质。比例尺= 50μm和(二)含铁血黄素巨噬细胞,其中有些是由箭头表示;比例尺= 20微米。

图3。子宫内膜异位病灶,在小鼠模型以下安乐死,要么诱导后3天(A)或1个月后感应(B和C) 。
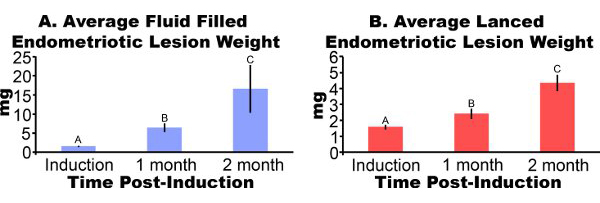
图4小鼠子宫内膜异位病变手术引起的有EN 的 。dometriosis切除重达一两个月后上岗。数据平均± SEM。数据日志转化和不同的字母表示单因素方差分析的意义在每个小组由片面费舍尔的最小显着差Mulitple比较。 (一)一样,充满液体的子宫内膜异位病灶囊肿(N = 10,或诱导,1个月,或2个月后上岗,分别为5)。 (二)Lanced子宫内膜异位病灶(N = 10,8,或诱导,1个月或2个月后上岗7)。
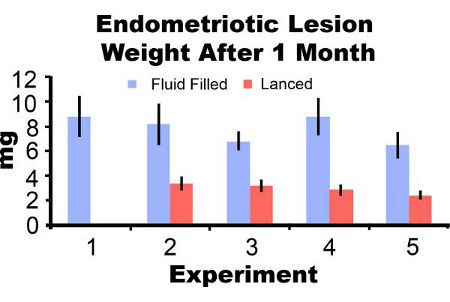
图5。子宫内膜异位病灶湿重流体,并在1个月5个独立的实验后诱导lanced。数据平均± SEM。小鼠N = 10,6,8,7日和7充满液体的病变和0,7,10,8,并在实验1,2,3,4和5,分别lanced病变8。
表1。发情期的观察阴道细胞学和卵巢和子宫和感应的视觉外观。
卵巢和子宫的外观将随时间变化的。以下是基于牺牲每个周期日上午上午8:00左右。此外,观察是主观的,比较卵巢和子宫角,将是一个更好的估计只比子宫角。这些意见是为了补充每天阴道细胞学检查读数获得的信息。

表2。手术在大鼠和小鼠的比较 。
讨论
有几个关键参数,应当指出,在执行子宫内膜异位症手术诱导小鼠。首先,子宫内膜异位症是一种雌激素依赖性疾病,应在完整的动物,或者在去卵巢动物辅以雌激素 20进行这种手术。二,缝合子宫内膜活检动脉级联必须格外小心。我们发现,只有两个有一个相对宽松的结抛出保持活检,同时防止结扎肠和随后的组织坏死和动物死亡的血液供应。我们强烈建议练上几个小鼠前实际实验,?...
披露声明
没有利益冲突的声明。
致谢
克里斯Kassotis这个手稿的严格审查和奥黛丽贝利和斯科特Korte博士,约瑟夫比曼,艾莉森Curfman,保罗甘,布里奇特Neibreggue,雅各Redel,艾米施罗德,迈亚斯坦伯格和Stacey Winkeler特别感谢他们在优化援助这种模式在我们的实验室。提供资助的临床Biodetectives培训资助(NIH T90的)(KEP),密苏里州的生命科学大学本科生研究机会计划研究理事会,穆,穆研究委员会的赠款和NIH R21HD056441(SCN)。
材料
| Name | Company | Catalog Number | Comments |
| 试剂/设备名称 | 公司 | 目录编号 | |
| 蜡笔 | 费舍尔 | NC9954135 | |
| 载玻片 | 费舍尔 | 12-550-433 | |
| 吸管 | 费舍尔 | S79383 | |
| 阴道细胞学涂片评估标准光镜下 | |||
| 丁丙诺啡盐酸C3(CARJET)10X1ml | 巴特勒动物保健供应 | 022891 | |
| 无菌磷酸盐缓冲液(PBS) | Gibco公司 | 14040-117 | |
| 万U / ml青霉素,10,000微克/毫升链霉素0.85%氯化钠 | Hyclone公司 | SV30010 | |
| 异氟醚 | 雅培动物健康 | 05260-05 | |
| 非再吸入异氟醚麻醉系统 | |||
| 循环热水加热垫 | |||
| 30毫升注射器鞘 | 费舍尔 | 14 - 823 - 16G | |
| 无粉无菌手套 | Fisherbrand | 19020558 | |
| 眼药膏 | 主要制药公司 | 10033691 | |
| 小电器快船 | 华尔 | 9861-600 | |
| 洗必泰擦洗 | 费舍尔 | NC9863042 | |
| 70%的乙醇 | |||
| Polylined无菌场 | Busse医院耗材 | 696 | |
| 大小3手术刀 | 费舍尔 | 22-079-657 | |
| 10号手术刀片 | 费舍尔 | 22-079-681 | |
| 小型手术剪 | Roboz | RS - 5850 | |
| 小锯齿半弯钳 | Roboz | RS - 5135 | |
| 5-0黑色编织丝线缝合 | 爱惜康 | K870H | |
| 消毒的耐热玻璃培养皿 | 康宁 | 70160-101 | |
| 2毫米活检冲床 | Miltex | 33-31 | |
| 无菌纱布 | 肯德尔 | 1806 | |
| 6-0黑色单丝ethilon尼龙缝线 | 爱惜康 | 697G | |
| 针驱动器(可选) | 世界精密仪器 | 500023 | |
| 5-0染色编织涂vicryl缝合 | 爱惜康 | J490G | |
| 9毫米Autoclip伤口剪辑 | 碧迪 | 427631 | |
| Autoclip应用方及卸妆 | 碧迪 | 427630 | |
| 23G针 | 碧迪 | 305193 | |
| 1CC注射器 | 流式细胞迪克森 | 301025 | |
| 5倍的放大镜支架(可选) | 费舍尔 | 14-648-23 | |
| 10%的福尔马林 | 费舍尔 | SF100 - 4 | |
| 游标卡尺 | Roboz | RS - 6466 | |
| 加工/嵌入录音带 | 费舍尔 | 15 - 197 - 700A | |
| 活检泡沫垫 | 费舍尔 | 22-038-222 | |
| RNAqueous的RNA提取试剂盒 | Ambion公司 | AM1912 | |
| 液氮 | |||
| 捕捉第离心平顶管 | 费舍尔 | 02-681-240 | |
| 氯胺酮(可选) | Simga | K4138 | |
| Domitor(medetomidine盐酸盐)(可选) | Tocris | 2023 | |
| Antisedan(atipamezole)(可选) | 西格玛 | A9611 |
参考文献
- Simoens, S., Hummelshoj, L., D'Hooghe, T. Endometriosis: cost estimates and methodological perspective. Hum. Reprod. Update. 13, 395-404 (2007).
- Grummer, R. Animal models in endometriosis research. Hum. Reprod. Update. 12, 641-649 (2006).
- Vernon, M. W., Wilson, E. A. Studies on the surgical induction of endometriosis in the rat. Fertil. Steril. 44, 684-694 (1985).
- Cummings, A. M., Metcalf, J. L. Induction of endometriosis in mice: a new model sensitive to estrogen. Reprod. Toxicol. 9, 233-238 (1995).
- Pelch, K. E. Aberrant gene expression profile in a mouse model of endometriosis mirrors that observed in women. Fertil. Steril. 93, 1615-1627 (2010).
- Flores, I. Molecular profiling of experimental endometriosis identified gene expression patterns in common with human disease. Fertil. Steril. 87, 1180-1199 (2007).
- Giudice, L. C., Kao, L. C. Endometriosis. Lancet. 364, 1789-1799 (2004).
- Lin, Y. J., Lai, L. e. i., Y, H., Wing, L. Y. Neutrophils and macrophages promote angiogenesis in the early stage of endometriosis in a mouse model. Endocrinology. 147, 1278-1286 (2006).
- Fang, Z. Intact progesterone receptors are essential to counteract the proliferative effect of estradiol in a genetically engineered mouse model of endometriosis. Fertil. Steril. 82, 673-678 (2004).
- Fang, Z. Genetic or enzymatic disruption of aromatase inhibits the growth of ectopic uterine tissue. J. Clin. Endocrinol. Metab. 87, 3460-3466 (2002).
- Cummings, A. M., Metcalf, J. L., Birnbaum, L. Promotion of endometriosis by 2,3,7,8-tetrachlorodibenzo-p-dioxin in rats and mice: time-dose dependence and species comparison. Toxicol. Appl. Pharmacol. 138, 131-139 (1996).
- Foster, W. G. Morphologic characteristics of endometriosis in the mouse model: application to toxicology. Can. J. Physiol. Pharmacol. 75, 1188-1196 (1997).
- Cummings, A. M., Metcalf, J. L. Effect of surgically induced endometriosis on pregnancy and effect of pregnancy and lactation on endometriosis in mice. Proc. Soc. Exp. Biol. Med. 212, 332-337 (1996).
- Lu, Y., Nie, J., Liu, X., Zheng, Y., Guo, S. W. Trichostatin A, a histone deacetylase inhibitor, reduces lesion growth and hyperalgesia in experimentally induced endometriosis in mice. Hum. Reprod. 25, 1014-1025 (2010).
- Whitten, W. K. Modification of the oestrous cycle of the mouse by external stimuli associated with the male. J. Endocrinol. 13, 399-404 (1956).
- Whitten, W. K., Bronson, F. H., Greenstein, J. A. Estrus-inducing pheromone of male mice: transport by movement of air. Science. 161, 584-585 (1968).
- Goldman, J. M., Murr, A. S., Cooper, R. L. The rodent estrous cycle: characterization of vaginal cytology and its utility in toxicological studies. Birth. Defects. Res. B. Dev. Reprod. Toxicol. 80, 84-97 (2007).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of Rodent Surgery for the New Surgeon. J. Vis. Exp. (47), e2586-e2586 (2011).
- Moen, M. H., Halvorsen, T. B. Histologic confirmation of endometriosis in different peritoneal lesions. Acta. Obstet. Gynecol. Scand. 71, 337-342 (1992).
- Cummings, A. M. Methoxychlor as a model for environmental estrogens. Crit. Rev. Toxicol. 27, 367-379 (1997).
- Fowler, R. E., Edwards, R. G. Induction of superovulation and pregnancy in mature mice by gonadotrophins. J. Endocrinol. 15, 374-384 (1957).
- Wilson, E. D., Zarrow, M. X. Comparison of superovulation in the immature mouse and rat. J. Reprod. Fertil. 3, 148-158 (1962).
- Lee, B., Du, H., Taylor, H. S. Experimental murine endometriosis induces DNA methylation and altered gene expression in eutopic endometrium. Biol. Reprod. 80, 79-85 (2009).
- Somigliana, E. Endometrial ability to implant in ectopic sites can be prevented by interleukin-12 in a murine model of endometriosis. Hum. Reprod. 14, 2944-2950 (1999).
- Hirata, T. Development of an experimental model of endometriosis using mice that ubiquitously express green fluorescent protein. Hum. Reprod. 20, 2092-2096 (2005).
- Story, L., Kennedy, S. Animal studies in endometriosis: a review. Ilar. J. 45, 132-138 (2004).
- Cummings, A. M., Hedge, J. M., Birnbaum, L. S. Effect of prenatal exposure to TCDD on the promotion of endometriotic lesion growth by TCDD in adult female rats and mice. Toxicol. Sci. 52, 45-49 (1999).
- Cummings, A. M., Metcalf, J. L. Effects of estrogen, progesterone, and methoxychlor on surgically induced endometriosis in rats. Fundam. Appl. Toxicol. 27, 287-290 (1995).
- Sharpe-Timms, K. L. Endometriotic lesions synthesize and secrete a haptoglobin-like protein. Biol. Reprod. 58, 988-994 (1998).
- Yavuz, E., Oktem, M., Esinler, I., Toru, S. A., Zeyneloglu, H. B. Genistein causes regression of endometriotic implants in the rat model. Fertil. Steril. 88, 1129-1134 (2007).
- Dmitrieva, N. Endocannabinoid involvement in endometriosis. Pain. 151, 703-710 (2010).
- Efstathiou, J. A. Nonsteroidal antiinflammatory drugs differentially suppress endometriosis in a murine model. Fertil. Steril. 83, 171-181 (2005).
- Becker, C. M. Endostatin inhibits the growth of endometriotic lesions but does not affect fertility. Fertil. Steril. 84, 1144-1155 (2005).
- Becker, C. M. Short synthetic endostatin peptides inhibit endothelial migration in vitro and endometriosis in a mouse model. Fertil. Steril. 85, 71-77 (2006).
- Sharpe-Timms, K. L. Using rats as a research model for the study of endometriosis. Ann. N.Y. Acad. Sci. 955, 318-327 (2002).
- Stilley, J. A., Woods-Marshall, R., Sutovsky, M., Sutovsky, P., Sharpe-Timms, K. L. Reduced Fecundity in Female Rats with Surgically Induced Endometriosis and in Their Daughters: A Potential Role for Tissue Inhibitors of Metalloproteinase 1. Biol. Reprod. 80, (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。