需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
重复性小鼠坐骨神经挤压和再生的后续评估整装肌肉分析
摘要
在这份报告中,我们描述了一种方法来粉碎小鼠坐骨神经。这种方法使用现成的止血钳和轻松,重现产生完整的坐骨神经。此外,我们描述了一种方法来准备适合分析坐骨神经后神经再生肌肉整个坐骑。
摘要
再生周围神经系统(PNS)被广泛研究人类疾病的相关了解PNS的神经元,从而有可能阐明中枢神经系统再生1失败安装强大的再生反应。坐骨神经(axonotmesis)的是在啮齿类动物2周围神经损伤的最常见的车型之一。粉碎中断所有轴突,但雪旺氏细胞基部叶片,使再生的最佳3,4保留。这使得研究者,研究正是越来越轴突的互动能力与雪旺氏细胞和基底椎板4。大鼠一般都首选的动物模型实验神经压榨。它们被广泛使用,其损毁坐骨神经提供了一个合理的近似人类神经病变5,4。虽然在规模小于大鼠神经,鼠神经有许多相似的特质。但最重要的,谅解备忘录E型是由于转基因株系的广泛的可用性日益成为宝贵的,现在允许一个关键的单个分子神经再生6,7的详细解剖。此前研究者已经使用了多种方法来产生神经挤压或损伤,包括简单的直角钳,冷藏镊子,止血钳,血管钳,研究者设计的夹8,9,10,11,12。研究者还利用各种方法标记的损伤部位,包括缝合,碳粒子和荧光珠13,14,1。我们描述的方法来获取准确和持久性标志的使用罚款的止血钳和随后的碳爱恋标志着网站的爱恋现场1再现完整的坐骨神经。作为我们描述的坐骨神经过程的一部分,我们还包括肌肉整体的一个比较简单的方法安装,我们使用到随后量化再生。
研究方案
1。动物主题
1.1。治疗
- 所有动物的程序应与本地机构的动物护理和伦理委员会的批准,并按照使用和卫生准则委员会和国家机构,采取措施以减少疼痛和不适。
- 我们的小鼠饲养温度控制在12小时的反向光明与黑暗周期条件下,而美联储鼠标议员和水随意。
- 对于成人再生的研究,老鼠应该是年龄至少6周时,坐骨神经进行。这个年龄段是超出修剪polyneural神经肌肉接头时发生的时间。
- 在这些实验中,我们用6-8周龄的C57BL / 6小鼠,从查尔斯河收购。当比较后坐骨神经再生(即:轴突生长率)应该是相同的小鼠品系,为轴突再生的差异已经不不同的近交系15,16之间。如果要使用小鼠基因操纵,窝控制是最合适的。
1.2。术前准备
- 动物深感麻醉手术通过腹腔注射氯胺酮(100毫克/千克)和甲苯噻嗪(10毫克/公斤)的鸡尾酒。每个动物也收到了美洛昔康皮下注射(10毫克/公斤),以减少手术后的疼痛。
- 都躯仔细剃光使用外科快船(Roboz,RC-5903)和脱毛奈尔脱毛膏(在当地的药店)完成的。
- 使用无菌棉头涂药器和手术优碘擦洗尔科技(19066452),皮肤洁净。
- 眼药膏(费希尔科学,19082795)被应用到眼睛,用无菌棉头涂药器。
- 鼠标被放置在一个干净的不锈钢板,根据已置于预先加热homeothermic毯系统(哈佛仪器,507222F)。动物的温度保持在37°C。
- 所有的四肢被录制下来,采取对称,使膝关节使身体(图1,A组)与直角定位后肢的照顾。
- 外科领域覆盖无菌的悬垂性。所有仪器消毒的高压灭菌器或热珠灭菌(精细的科学工具,18000-45)和医生戴着口罩,隔离衣,无菌手套。
2。重现坐骨神经神经压榨
- 准备后,横跨中线(图1)的半圆形切口皮肤。皮肤轻轻从底层肌肉解剖,折叠的出路在手术过程中保持。这是保持湿润,在手术过程中使用0.1毫升无菌生理盐水(Hospira公司,0409-4888-20)的应用。
- 开放筋膜平面之间的臀大肌和二头肌femori的前头部小号揭示了坐骨神经(图1,A组)。为控制外科手术,对侧坐骨神经应揭露和动员,但保持不变。臀部肌肉,然后再反对和缝合使用6-0编织丝,非吸收性缝合线(Roboz位SUT-1073-11)。
- 实验坐骨神经,然后以同样的方式,在地方可视化(图1,B组),以纾缓拉钩暴露。拉钩是消毒后才能使用。
注:虽然市售牵引系统,他们往往相当昂贵。我们能够做出一个满意的牵引系统,使用廉价的硬件供应和昆虫针(见材料部分)。 - 坐骨神经,然后轻轻地从周围的结缔组织组织使用虹膜切除术剪刀释放。
- 使用罚款5/45(精细的科学工具,11251-35)镊子,神经被放置在底部的超精细的止血钳颚(太精细科学LS 13020-12)。三个分册都是按顺序排列,而不是彼此的顶部(图1,插图乙)。止血钳已刻有商标,从他们的尖端在1.5毫米。坐骨神经的最外层部分被放置在此之前暗恋的标志线。这确保了统一宽度的挤压,神经不超过延长夷为平地,由于破碎力时的止血钳的钳口。如果超越钳尖端的神经延伸的神经将只能部分粉碎。
- 粉碎的神经垂直45毫米,第三脚趾,作为衡量一个线程,接近坐骨神经的路径。神经被压死15秒一次止血钳在3人次。护理是采取不舒展神经。当止血重开,整个神经应该是半透明的在暗恋网站。
- 已经预先浸的止血钳的第二对(第一)粉状碳(Fisher Scientific则,C272-500)是用来庆祝粉碎网站。神经被压死,15秒3次点击在同一暗恋网站。无碳标识应超出最初的暗恋的边界。如果需要精确的美眉网站的标志,这一点尤为重要。在使用之前,碳粉消毒紫外线照射两小时,并在其后使用无菌技术处理。
- 预先浸碳钳,但排除在手术部位广泛碳,钳开奶粉中碳,然后轻轻关闭(但不点击)关闭,并用无菌纱布擦去碳以外的止血。镊子进行检查核实,破碎表面均匀地涂上碳粉下至少3倍的放大倍率。如果有必要,他们正在重新浸泡和消灭。
- 臀部肌肉重新反对和缝合在对侧同样的方式。
- 最后,皮肤切口封闭使用9毫米反射剪辑(世界精密仪器,500346; APPLIER:500345)。如果发现9毫米的反射剪辑限制运动,规模较小的反射剪辑或6-0缝线(Roboz,被测-1073-11),可以用来代替。
3。手术后护理
- 程序之后,动物被放置在37°C,直到他们表现出的迹象,在加热垫。
- 然后,他们搬回到他们的家庭笼,易于凝胶和湿食品的形式在地板上的水和食物。
4。半薄膜的制备
- 过量的巴比妥(300毫克/千克)的腿部肌肉被删除暴露坐骨神经*。神经留在原地,后身是沉浸在2%多聚甲醛,2%和0.1米冰磷酸盐缓冲30分钟gluteraldehyde。
*如果完成整个安装肌肉准备,肌肉有收获前暴露坐骨神经。 - 小心取下的神经,只处理近端的照顾。然后神经是固定后,在另外三个小时固定液。
- 神经后固定在0.1 M磷酸缓冲冲洗三次。
- 正沉浸在2%四氧化锇在0.1 M磷酸缓冲一小时的神经。
- 神经,然后脱水顺序沉浸在越来越浓乙醇(50%,70%,80%,95%,100%,100%,100%)。每次浸泡15分钟。
- 脱水神经培养环氧丙烷两次,每次三分钟。
- 然后神经沉浸在1:1的环氧丙烷的混合物和嵌入至少6小时,812(通常是隔夜)。
- 然后神经沉浸在2:1的环氧丙烷的混合物和嵌入812过夜。
- 最后,神经沉浸在812纯嵌入了六个小时,然后在适当的模具和BA嵌入式在60°C KED为48小时。
- 从远端神经残端从粉碎用玻璃刀,并用甲苯胺蓝染色Ultracut开普敦超薄切片(徕卡)的网站设置距离1.0微米的部分被切断。薄片也可以制作电子显微镜超微结构检查。
5。整个山肌制备
- 第一小鼠牺牲与过量的巴比妥(300毫克/千克)和后肢的膝盖删除。
- 四个后肢肌肉被删除分析:胫骨前肌(TA),趾长伸肌(EDL)的比目鱼肌,腓骨长。
- 删除所有的肌肉都通过仔细解剖,并通过他们的结缔组织固定黑色sylgard(费希尔科学,NC9492579)涂层菜。他们在PBS冲洗,然后固定在4%多聚甲醛为30分钟。
- 电讯局长在PBS冲洗,嵌入在华侨城(Fisher Scientific则14-373-65),丙酮和干冰浴中迅速冻结。
- 它储存于-80°C薄切片的情况下,整个安装准备失败。在一般情况下,电讯局长是太充足的整个坐骑厚。
- 的EDL,比目鱼肌,腓骨长在PBS 3×10分钟放置在0.1 M甘氨酸*(尔科技,AC12007-0010;在PBS稀释),30分钟冲洗,并再次在PBS清洗3×10分钟。然后,他们在冰冷的100%的甲醇整整 5分钟,在-20°C间淬火,在PBS冲洗3×10分钟,沐浴在荧光标记的α-银环蛇(PBS稀释1:200),30分钟。肌肉冲洗3×10分钟,PBS在2%BSA的1小时块(嘉里建设,50-61-00)和0.2%的Triton X-100(点科学公司,9002-93-1),在PBS,在4°C过夜,而在相同的2%BSA/0.2%的Triton块稀释的初级抗体鸡尾酒摇摆。
* GLycine和阻塞的解决方案是肌肉收获的当天和前在室温下搅拌30-60分钟使用。- 为了纪念轴突和神经肌肉突触,我们使用相结合的鼠标单克隆神经丝标记(Covance公司,SMI-312R;稀释1:1000),鼠标单克隆突触囊泡标记(SV2 DSHB,稀释1:1000),和若丹明共轭阿尔法 - 银环蛇(Sigma-Aldrich公司,1:200稀释)。为了纪念反应的雪旺氏细胞,我们使用兔反GAP-43(Novus公司生物制品,NB300-143,稀释1/500)。 IgG1亚型特定的荧光标记的羊抗鼠二抗和DyLight 649标记的驴抗兔(的杰克逊ImmunoResearch,稀释1:200),可视化的主要抗体。
- 翌日,肌肉在PBS冲洗3×10分钟,孵育二抗稀释1:200(2%BSA/0.2%Triton的阻塞解决方案)。然后,他们在PBS冲洗,FO 2×10分钟llowed由5分钟的浸泡中的DAPI(Invitrogen公司,D3571;稀释在去离子水至300纳米),另外10分钟的PBS冲洗。
- 每一块肌肉,然后解剖上,黑色sylgard(尔科技,NC9492579)涂层培养皿。最初的肌腱被删除插入点到肌肉,然后肌肉变薄剥去室内肌纤维(图3,小组交流)。已采取审慎措施,以保持外表面的肌肉,包括终板带(图3,面板的DF)。所产生的肌肉安装在加幻灯片与vectashield(媒介实验室的H-1000)和22(Fisher Scientific则12-550-15)x 40毫米透明指甲油密封盖玻片(Fisher Scientific则12-548-5C)双方。当幻灯片上终板带触点的盖玻片上。
6。测量再生
- 可再生估计在所有三个肌肉(腓骨,EDL的,比目鱼)。我们经常前胺再生神经损伤后14天,在这一个相当大的比例NMJs重新支配的时间。较早和稍后的时间点也合适,取决于被要求的科学问题。在每一块肌肉,重新支配整个终板带进行检测。只有EN脸表面NMJs得分。在这种方式中,至少有200个肌肉NMJs可快速检测。
- 得分肌肉再次神经支配,我们确定了“再支配的比例”。分母是α-银环蛇毒素的结合和雪旺氏细胞GAP-43免疫标记的失神经支配神经肌肉接头的数量。分子标记neurofilament/SV2免疫重新支配NMJs的数量。如果需要,可能会被列为部分(SV2)α-银环蛇毒素的完整覆盖或完全(SV2α-银环蛇的全覆盖)重新支配NMJs。为重新支配与失神经NMJs的例子见图3,G和H板。
7。代表结果
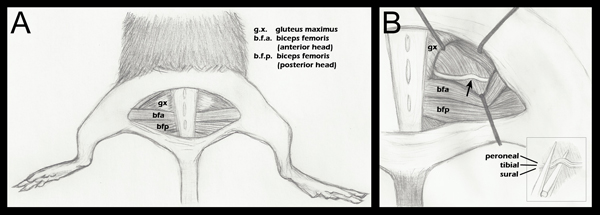
图1。 重要的神经损伤后肢的解剖示意图。A.一个半圆形的皮肤切口,已经露出底层肌肉,臀部肌肉已被分离,坐骨神经透露(步骤2.4以上)。箭头表示近似暗恋网站。拉钩安置作为一般指引,并在每个手术,以减轻对坐骨神经的可视化方法的止血钳挤压调整乙(插图):坐骨神经的位置上下颚之前暗恋的止血钳(步骤2.5以上)。单行本标记,以证明他们是相邻的水平,但不垂直,在粉碎。虽然3 FASCicles在此图中的标记,也可能会看到第四个分册,腓关节分支。为坐骨神经的分支模式的更详细的解剖图分册远端粉碎点,请参阅Greene的大鼠的解剖图188 17。
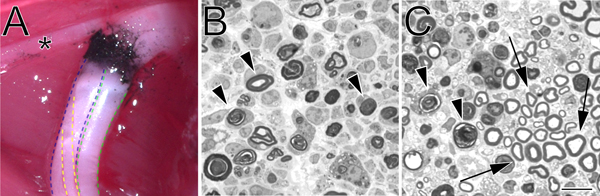
图2。一个在就地和甲苯胺蓝染色,半薄大鼠坐骨神经部分碳显着暗恋网站。在原位粉碎网站(左后肢)的一个例子。黑碳表示暗恋网站。星号标记的胫神经支配大腿肌肉和服务作为一个有用的标志性建筑在暗恋手术的一个分支。坐骨神经的胫骨分工中概述了腓蓝色,绿色,和黄色。B.半薄切片腓展示一个完整的挤压止血力量进行PS。C.半薄片,展示一个不完整的挤压与直角钳进行。在这两种图像退化髓鞘型材标记的箭头。在图 C箭头标记保存髓鞘型材的例子幸免轴突集群。比例尺为10μm。
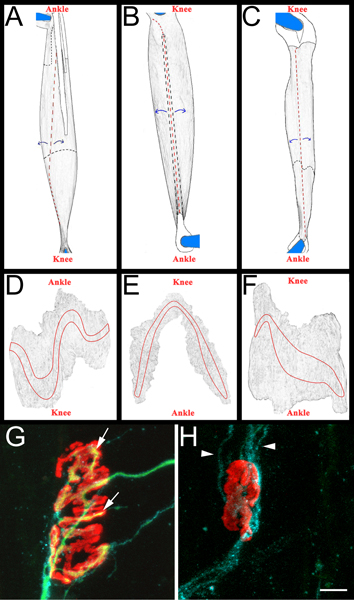
图3全安装肌肉示意图交流:和代表NMJs的。的EDL( 一 ),腓骨长肌(B)和比目鱼(c)在去除后肢肌肉渲染图像。 右后肢肌肉所示。膝盖和踝关节的解剖方向还包括以供参考。肌腱的各色白光和肌肉上的位置时,概述了坚实的黑线。他们概述了一个黑色的虚线下方的肌肉时,他们延长。裁员是在红色虚线所示。切割网站,如蓝色箭头所示的肌肉剥离,随后变薄。间伐后,肌肉分离从引脚切割固定肌腱周围什么DF:从整个安装肌肉渲染图像后,去除结缔组织和随后的变薄。每一块肌肉终板带概述GH:比目鱼整装肌肉坐骨神经展示(高)重新支配(G)和失神经肌肉路口粉碎后14天。在这些面板,NMJs,轴突,雪旺氏细胞可视化如上所述,在第5.5.1节。乙酰胆碱受体是红色的,绿色轴突,雪旺氏细胞处理蓝色。在面板Ğ,箭头指示的NMJ已经由一个轴突重新支配领域。在面板 H箭头表明,GAP-43阳性的雪旺氏细胞的过程。请注意没有轴突。比例尺为10μm。
讨论
我们已经提出了一个方法来获取可靠完整的坐骨神经与精确标记的美眉现场。如前所述,坐骨神经是一种常见的周围神经损伤的小鼠和大鼠模型。虽然每个美眉的方法都有其优点和缺点,我们发现,这种方法产生一个完整的挤压,很容易被一个特殊的设备(如特殊夹具等)的最低标记。
粉碎方法
仪器用于小鼠坐骨神经的最常见的是5号直角钳。虽然它有可能...
披露声明
我们什么都没有透露。
致谢
这项工作是由国家卫生研究院资助K08NS065157(TAF),此外支持,宾夕法尼亚肌肉劳损,关节炎研究所奖号码P30AR050950,肌肉骨骼及皮肤疾病(TAF和史蒂文与舍雷尔)支持这项工作。最后,施赖纳斯儿科研究中心种子资金(TAF),支持这项工作。我们要感谢年轻的博士,金的儿子,初步证明她的援助,在整个安装过程和Amy A.金生产的草图图1。
材料
| Name | Company | Catalog Number | Comments |
| 名称(描述/数量) | 供应商 | 目录编号 | |
| 迷你快船号0000刀片 | roboz | RC-5903 | |
| 奈尔头发卸妆(9盎司) | 教会和德怀特有限公司,公司 | N / A | |
| 优碘外科磨砂(1加仑) | Fisher Scientific则 | 19066452 | |
| 眼药膏(1盎司) | Fisher Scientific则 | 19082795 |
手术工具:
| 名称(描述/数量) | 供应商 | 目录编号 |
| 福斯特250热珠消毒 | 罚款科学工具 | 18000-45 |
| 虹膜剪刀(11厘米长) | 世界精密仪器 | 500216 |
| 帕兹 - 史密斯钳(直;18厘米的; 1X2牙) | 罚款科学工具 | 11024-18 |
| 麦克弗森Vannas剪刀(5毫米刀片) | 世界精密仪器 | 14124 - G |
| 杜蒙#5镊子 - Dumoxel标准提示 | 罚款科学工具 | 11252-30 |
| 杜蒙#5/45钳 - Dumoxel小费标准 | 罚款科学工具 | 11251-35 |
| 精细止血超(直光滑的内表面) | 罚款科学工具 | 13020-12 |
| 粉末活性炭(500克) | Fisher Scientific则 | C272-500 |
| 大小6-0缝线的C-1针(不育,丝绸,黑色,编织,非吸收性; 18“的长度;盒36) | roboz | 位SUT-1073-11 |
| 反射的剪辑APPLIER(9毫米剪辑) | 世界精密仪器 | 500345 |
| 9mm不锈钢的反射剪辑(100/box) | 世界精密仪器 | 500346 |
动物护理:
| 名称(描述/数量) | 供应商 | 目录编号 |
| 0.9%氯化钠注射液(不含防腐剂; 20毫升) | Hospira公司 | 0409-4888-20 |
| 完整的柔性探头Homeothermic毛毯系统(中等,115伏,60赫兹) | 哈佛仪器 | 507222F |
手术Platform和拉钩:
(在当地的五金商店购买)
| 名称(描述/) | 数量 |
| 不锈钢平台(铣削〜12“X12”X1 / 8“) | 1 |
| 按钮磁铁(例如:Eclipse的E825) | 3 |
| 不锈钢螺栓(长3“按钮磁铁决心直径) | 3 |
| 不锈钢螺母(大小以适合螺栓) | 9 |
| 橡皮筋(轻张力) | 3 |
| 昆虫销(两端弯曲,形成挂钩) | 3 |
半变薄:
| 名称(描述/数量) | 供应商</ STRONG> | 目录编号 |
| 多聚甲醛(1公斤) | Sigma-Aldrich公司 | P6148-1KG |
| 无水磷酸氢钠(500克;用于制备磷酸盐缓冲液) | Fisher Scientific则 | S375-500 |
| 无水磷酸二氢钠(1公斤;用于制备磷酸盐缓冲液) | Fisher Scientific则 | AC38987-0010 |
| 戊二醛(50%; 10×10毫升) | 特德·佩拉,公司 | 18431 |
| 四氧化锇(4%水溶液,10×10毫升) | 特德·佩拉,公司 | 18465 |
| 环氧丙烷(450毫升) | 特德·佩拉,公司 | 18601 |
| 嵌入812(包,硬质块/图像对比度高) | 电子显微镜科学 | 14120 |
| toluidiNE蓝(25克) | 特德·佩拉,公司 | 19451 |
整个山肌肉的制备及免疫组化:
| 名称(描述/数量) | 供应商 | 目录编号 |
| 多聚甲醛(1公斤) | Sigma-Aldrich公司 | P6148-1KG |
| 无水磷酸氢钠(500克;用于制备磷酸盐缓冲液) | Fisher Scientific则 | S375-500 |
| 无水磷酸二氢钠(1公斤;用于制备磷酸盐缓冲液) | Fisher Scientific则 | AC38987-0010 |
| 10%BSA稀释液/封闭液(200毫升) | kirkegaard佩里实验室,公司 | 50-61-00 |
| 的Triton X-100(100毫升) | 点科技有限公司的 | 9002-93-1 |
| 甘氨酸,98%(1公斤) | Fisher Scientific则 | AC12007-0010 |
| 组织TEK的Cryo-OCT复合(12个案例; 4盎司瓶) | Fisher Scientific则 | 14-373-65 |
| sylgard陶氏170(2磅包) | Fisher Scientific则 | NC9492579 |
| 不锈钢昆虫销,大小为1(100/pkg) | 罚款科学工具 | 26001-40 |
| 四甲-A银环蛇毒素(0.5毫克) | Sigma-Aldrich公司 | T0195-.5MG |
| 单克隆抗体对SMI-312(0.1毫升) | Covance公司 | SMI-312R |
| 单克隆抗体反对SV2(0.1毫升) | 发展研究杂交瘤细胞银行(DSHB) | SV2 |
| 兔聚GAP-43单克隆抗体对 | Novus公司生物制品 | NB300-143 |
| flourescein标记的羊抗鼠IgG,Fcγ小类1比 | 杰克逊ImmunoResearch | 11 5-095-205 |
| DyLight 649共轭的驴抗兔IgG | 杰克逊ImmunoResearch | 711-495-152 |
| 4',6-diamidino-2-苯基吲哚(DAPI,dilactate; 10毫克) | Invitrogen公司 | D3571 |
| vectashield安装介质(10毫升) | 媒介实验室 | 的H-1000 |
| superfrost加上载玻片(白尺寸:75×25毫米; 144包) | Fisher Scientific则 | 12-550-15 |
| 高级盖眼镜fisherfinest(尺寸:40×22毫米; 1盎司包。) | Fisher Scientific则 | 12-548-5C |
参考文献
- Pan, Y. A., Misgeld, T., Lichtman, J. W., Sanes, J. R. Effects of neurotoxic and neuroprotective agents on peripheral nerve regeneration assayed by time-lapse imaging in vivo. J. Neurosci. 23, 11479-11488 (2003).
- Magill, C., Tong, A., Kawamura, D., Hayashi, A., Hunter, D. Reinnervation of the tibialis anterior following sciatic nerve crush injury: A confocal microscopic study in transgenic mice. Exp. Neurol. 207, 64-74 (2007).
- Amado, S., Simñes, M. J., Armada-da-Silva, P. A. S., Luís, A. L., Shirosaki, Y. Use of hybrid chitosan membranes and N1E-115 cells for promoting nerve regeneration in an axonotmesis rat model. Biomaterials. 29, 4409-4419 (2008).
- Luís, A. L., Rodrigues, J. M., Geuna, S., Amado, S., Simðes, M. J. Neural cell transplantation effects on sciatic nerve regeneration after a standardized crush injury in the rat. Microsurgery. 28, 458-470 (2008).
- Luís, A. L., Amado, S., Geuna, S., Rodrigues, J. M., Simðes, M. J. Long-term functional and morphological assessment of a standardized rat sciatic nerve crush injury with a non-serrated clamp. J. Neurosci. Methods. 163, 92-104 (2007).
- Baptista, A. F., de Souza Gomes, J. R., Oliveira, J. T., Santos, S. M. G., Vannier-Santos, M. A. A new approach to assess function after sciatic nerve lesion in the mouse - adaptation of the sciatic static index. J. Neurosci. Methods. 161, 259-264 (2007).
- Ronchi, G., Raimondo, S., Varejão, A. S. P., Tos, P., Perroteau, I. Standardized crush injury of the mouse median nerve. J. Neurosci. Methods. 188, 71-75 (2010).
- Berg, A., Zelano, J., Cullheim, S. Netrin G-2 ligand mRNA is downregulated in spinal motoneurons after sciatic nerve lesion. Neuroreport. 21, 782-785 (2010).
- Girolami, E. I., Bouhy, D., Haber, M., Johnson, H., David, S. Differential expression and potential role of SOCS1 and SOCS3 in Wallerian degeneration in injured peripheral nerve. Exp. Neurol. 223, 173-182 (2010).
- Hossain-Ibrahim, M. K., Rezajooi, K., Stallcup, W. B., Lieberman, A. R., Anderson, P. N. Analysis of axonal regeneration in the central and peripheral nervous systems of the NG2-deficient mouse. BMC Neurosci. 8, 80-80 (2007).
- Thornton, M. R., Mantovani, C., Birchall, M. A., Terenghi, G. Quantification of N-CAM and N-cadherin expression in axotomized and crushed rat sciatic nerve. J. Anat. 206, 69-78 (2005).
- Beer, G. M., Steurer, J., Meyer, V. E. Standardizing nerve crushes with a non-serrated clamp. J. Reconstr. Microsurg. 17, 531-534 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。