Method Article
流感病毒的高通量检测方法
摘要
此方法介绍了染料的红外成像系统的使用H1N1病毒的检测,在细支气管肺泡灌洗(BAL)感染小鼠的高灵敏度流体。这种方法可以在96 - 或384孔板,要求<10μL测试材料的量,并有可能并发多种病原体筛查。
摘要
流感病毒是一种呼吸道病原体引起的发病率和死亡率每年在世界多个地区的高度。因此,感染的应变和广大临床标本的快速高通量筛选的准确诊断是至关重要的,以控制流感大流行感染的蔓延。目前流感感染的临床诊断是根据血清学检测,聚合酶链反应,直接试样免疫和细胞培养1,2。
在这里,我们报告了一种新的诊断技术,用于检测活流感病毒的发展。我们用鼠标适应人类A/PR/8/34(PR8,H1N1)病毒3测试使用MDCK细胞4技术的疗效。 (10 4或5×10%以及3)MDCK细胞培养在96 -或使用抗-M2的后面Pr8与病毒蛋白感染的384孔板,检测红外染料共轭秒次级抗体。 M2的5和1血凝素的两个主要标记的蛋白质,用于许多不同的诊断分析。采用红外染料标记的二抗,尽量减少与其他荧光染料相关的自体荧光。使用抗M2抗体,使我们能够使用的病毒数量的直接度量的抗原特异性的荧光强度。要列举的荧光强度,我们采用LI-COR的奥德赛基于红外扫描仪。该系统采用双通道基于激光红外检测到荧光识别和区分他们从背景噪音。第一个通道的激发在680 nm和700 nm的发射,以帮助量化的背景。第二通道检测到780纳米的荧光,激发和发射800纳米。 PR8感染MDCK细胞,在红外扫描仪的扫描表明病毒滴度依赖明亮的荧光。可以连接的荧光强度呈正相关病毒滴度从10 2 -10 5 PFUsistently观察。最小的,但检测阳性持续10 2 -10 3 PFU PR8病毒滴度表明,近红外染料的高灵敏度。通过比较模拟感染或同种抗体治疗MDCK细胞信号信噪比。
我们使用荧光强度 - 从96或384孔板格式,建造标准滴定曲线。在这些计算中,第一个变量是病毒滴度,而第二个变量是荧光强度。因此,我们用指数分布来生成曲线拟合,以确定病毒滴度和荧光强度之间的多项式关系。总的来说,我们得出这样的结论:红外染料为基础的蛋白质检测系统,可以帮助诊断感染病毒株,并精确地列举滴度的感染病原体。
研究方案
1。 MDCK细胞文化
- 文化5万元的T-75厘米的2瓶20毫升培养液完全培养基中10%胎牛血清,100 U / mL青霉素,100μg/ mL链霉素,1毫米丙酮酸钠,5%,7.5%碳酸氢钠过夜MDCK细胞注入5.2%的CO 2的解决方案和0.001%β-巯基乙醇在37℃培养箱。
2。 PR8感染和支气管肺泡灌洗液的收集
- 挑战的C57BL / 6小鼠滴鼻5000 PR8病毒通过一个鼻孔总量在30μL无菌PBS PFU。开展模拟使用未经病毒只无菌PBS感染。
- 安乐死小鼠0,2,4,感染后7天,并削减打开胸腔,并通过鼠标皮草揭露一个1厘米的切口平行气管。
- 做一个中线气管近端方面的切口。
- 气管内注入0.5毫升PBS-1%BSA和吸广管局大号流体。灌洗液体可以储存在-20°C冰箱,直到使用。
3。病毒感染和病毒基质蛋白(M2)的检测与LI-COR公司奥德赛
- 量化使用红外线染料标记的抗体的病毒滴度,收获的T-75厘米2瓶和光学平底黑色板MDCK细胞的96孔(每孔10000个细胞)或384(每口井5000细胞)板。文化过夜的MDCK细胞在37°C在RPMI 1640完全培养基,用无血清培养液含有BSA(0.2%,重量/体积),青霉素(100 U / ml的),链霉素(100微克/毫升),钠两次丙酮酸(1毫米),碳酸氢钠溶液,7.5%(5%)和β-巯基乙醇(0.001%)。
- BAL液(50μL384孔板96孔板或10微升)或PR8病毒滴度与等量,每口井(50 96孔板或10μL384μL孵育MDCK细胞 - 孔板DMEM培养基),含L-1-tosylamido-2-苯氯甲基酮(TPCK)都能处理的胰蛋白酶(0.2微克/毫升)。
- 感染1小时后,加入100μL(96孔板)或10%胎牛血清的RPMI 1640完全培养基,每孔20μL(384孔板)。
- 继续培养16小时的另一感染MDCK细胞洗两次MDCK细胞100μL(96孔板)或PBS-1%BSA溶液20μL(384孔板),并修复与100μL(96板)或20微升1%多聚甲醛5分钟(384孔板)。
- 固定之后,孵化MDCK细胞,进一步为100μL(96孔板)或PBS-1%BSA 20μL(384孔板)为阻断30分钟。
- 后阻断MDCK细胞孵育1小时,对M2蛋白与第一抗体(1:1000,在PBS-1%的BSA稀释)。使用50μL每井和20μL稀释后的抗体,每孔96孔或384孔板,分别。
- 洗3次,MDCK细胞100μL(96孔板)或20μLPBS包含1小时1%BSA孵育50μL(96孔板)或20微升(384孔板)羊抗鼠IRDye @ 800中学抗体((384孔板) 1:200稀释)。
- 洗三次与100μLPBS,含1%BSA的MDCK细胞。 LI-COR的的奥德赛红外扫描仪读玻璃平台上放置的彩色板,并设置读者,96 - 或384孔板阅读。
- 使用LI-COR的Odyssey软件,可以设置空白阴性对照井。量化范围内使用LI-COR的Odyssey软件的板整板或选定井。
- 使用自动形状工具,绘制一个目标区域(ROI)的边界,在测试中,96 - 或384孔板。创造的投资回报率,允许软件病毒滴定样品比较明确的背景井。
- 要设置为整个实验的基线值,使用背景的投资回报率。引进的两个对立的交叉奥德赛软件提供的毛发内的投资回报率measu重新在整个以及荧光强度。
- 扫描板采用780纳米检测通道和参考在LI-COR的的奥德赛红外扫描仪的波长为680纳米。
- 一旦被激活的“读”命令,将被均匀间隔的投资回报率的荧光强度测量和集成所收集的数据点。一个标准偏差的乘数将确定的信号电平超过基准的投资回报率的决心。
- 从单独控制的模拟感染或继发性抗体,将量化的背景荧光,将用于估算在综合强度试验井。
- 选择用于计算积分强度“,因为它代表了一个定义个人当场净像素量和特征尺寸无关。从已知的病毒滴度使用的标准曲线计算未知样品的病毒滴度。用很长的曲线插值方法精确地计算出病毒滴度。计算的V在测试样本iral滴度与标准曲线进行比较试验样品的强度。
4。代表结果
红外染料为基础的高通量病毒检测系统的标准化
PR8病毒可以感染MDCK细胞,因此,我们利用这些细胞来发展此法。我们测量了对流感病毒基质蛋白(M2)的主要抗体的病毒滴度。与其他方法相比,我们用二次抗体结合到近红外染料。这种方法提供了一个简单,自动化PR8病毒滴度测定荧光强度检测M2蛋白而产生的。流感病毒感染后,M2蛋白翻译,运输和在宿主细胞,包括细胞表面积累。因此,在M2蛋白的数量代表了衡量的参数,以确定该病毒的数量。从比较的强度测试样品与标准曲线提供的病毒滴度的精确测量。
基于荧光的方法来确定疗效,我们培养的MDCK细胞4 /室10片过夜。 PR8已知滴度的病毒库存分别加入不同的斑块形成单位(PFU)的重复井和允许吸附到细胞一小时。细胞培养16小时,以使病毒传播。在此之后,被固定在玻片MDCK细胞1%多聚甲醛,清洗和抗-M2抗体染色1小时,由AlexaFluor其次额外1小时的488-共轭的二次抗体。共聚焦显微镜分析表明感染MDCK细胞单层贴壁基本完好和PR8源性蛋白M2是大量内感染的MDCK细胞( 图1A)。荧光的细胞中可检测到感染病毒滴度低至10 2 。这些分析还显示,每口井的荧光MDCK细胞的数量成正比增加PR8病毒滴度。虽然,氩激光为基础的荧光激发光效提供了生动的细胞图像,其狭窄的信号信噪比和自体荧光的细胞呈现极其困难的病毒定量,尤其是在较低的滴定。
因此,建立一个准确的病毒估计方法,我们采用红外染料的检测和定量分析系统。感染Pr8与病毒蛋白的96孔板,培养MDCK细胞(10 4 /孔)使用反M2的红外染料标记的二抗检测。使用抗M2抗体,使我们能够使用的病毒数量的直接度量的抗原特异性的荧光强度。要列举的荧光强度,我们采用LI-COR的奥德赛基于红外扫描仪。该系统采用双通道激光BAS编辑红外检测,以确定荧光,从背景噪音中区分他们。第一个通道的激发在680 nm和700 nm的发射,以帮助量化的背景。第二通道检测到780纳米的荧光,激发和发射800纳米。扫描显示在LI-COR的奥德赛PR8感染的MDCK细胞的病毒滴度依赖明亮的荧光( 图1B)。 M2的积极荧光MDCK细胞内的水井( 图1B)清晰可见。的荧光强度呈正相关病毒滴度从10 2 -10 5 PFU开始可以持续观察。 PR8病毒滴定高于10 6 PFU导致细胞死亡,检测灵敏度设置一个上限。最小的,但检测阳性持续10 2 -10 3 PFU PR8病毒滴度表明,近红外染料的高灵敏度。商务部通过比较信号信噪比K-感染或同种抗体治疗MDCK细胞。这些控件都可以忽略不计或检测不到的水平,在荧光( 图1B)。
为了进一步提高灵敏度和降低测试的样本量的要求,我们感染了5×10 3 MDCK细胞/孔在384孔板。不同PR8个PFU进行串行一个日志稀释( 图1C)。从384孔板的检测灵敏度是可比的96孔板检测。双方10 1 10 2 PFU工作始终在384孔板,96孔板相比。我们使用荧光强度-从96或384孔板格式,建造标准滴定曲线( 图1D)。在这些计算中,第一个变量是病毒滴度,而第二个变量是荧光强度。因此,我们用指数分布来生成曲线拟合determ址错误发生的病毒滴度和荧光强度之间的多项式关系。我们也验证了我们的意见,使用另一种是对PR8病毒核蛋白(NP)(数据未显示)执导的抗体。 PR8株不同的来源也被用来测试与反NP或抗M2抗体(数据未显示)MDCK细胞感染。总的来说,我们得出这样的结论:红外染料为基础的蛋白质检测系统,可以帮助诊断感染病毒株,并精确地列举滴度的感染病原体。
数学计算病毒滴度的考虑
完成如下所述的荧光强度和滴度测定的数学计算。在染色过程中,整板或板内选定井量化使用LI-COR的Odyssey软件。使用自动形状工具,绘制目标区域(ROI)的边界,在中间试验井96 - 384我们LL板( 图2A和B)。创造的投资回报率,允许软件病毒滴定样品比较明确的背景井。一个背景的投资回报率是用来设置整个实验的基线值。介绍了两种对立的十字线(白)内的投资回报率来衡量整个井( 图2C)的荧光强度。右侧和下面的图2C代表井的曲线代表沿着这些十字线的像素强度。均匀间隔的投资回报率的荧光强度进行测量和收集到的数据点进行了整合。确定一个标准偏差乘数超过基准的投资回报率的决心的信号水平。背景荧光定量模拟感染或继发性抗体单独控制和用于估算在综合强度试验井。我们选择综合计算强度,因为它repres已废除的定义的个人现货和净像素量是独立的特征尺寸。此外,综合强度是实质上独立的决议。总强度/像素(一)对应所产生的信号强度以及选定在像素面积(IS)加上从像素面积(二)的背景下产生的信号。因此,对像素的“我”:
我我我的 i + B 我
像素量同时表示信号的幅度和在它的分布面积。信号区与样本分布,产生的信号。像素的体积等于像素测量的'我'在该地区的像素(一)其高度(一)总信号。所以对像素的“i”:
VI = I I
总像素量,因此,从整个区域的总信号的总和:
| ; | ñ | ñ | |
| :V = | σV 我 | = | aΣI 我 |
| I = 1 | I = 1 |
综合强度是按功能括所有像素的强度值的总和,乘以圈/矩形的面积(数毫米2)。因此,综合强度=
(ΣI 我 - B)
在这里,B代表为背景像素的平均强度。这个公式计算控制或实验井的综合信号强度,从而建立了一个标准曲线。使用此标准曲线计算测试样品中的病毒滴度。浓度(强度)被定义为在一个确定的投资回报率的荧光目前的数量。测试样品中的浓度是calcula特德相对标准的定义在相同的图像浓度。计算精确的病毒滴度,绘制每个浓度标准的力度和装有长的插值曲线。通过比较该地区内的标准曲线的强度测试样品的浓度计算。
流感病毒感染小鼠的BAL液病毒滴度测定
流感活病毒颗粒在临床和实验室标本检测是至关重要的意义。因此,我们下次检查我们是否可以利用这种方法,在实验室样品,以确定病毒滴度。灌洗液收集非免疫小鼠和PR8病毒与已知量的飙升。尖刺的灌洗液体呈线性滴定列举的病毒滴度。用等分的尖刺灌洗流体感染MDCK细胞在96孔板,固定和抗-M2和红外染料结合secondar的染色Ÿ抗体。 如图3a所示的结果表明,尖刺BAL液中的病毒滴度检测和与PR8滴度标准曲线相关。使用标准曲线,精确的病毒数量的飙升和滴定的BAL液进行了量化。指数曲线拟合计算提供了一个措施,在尖刺BAL液( 图3B)计算病毒滴度。通过这种方法,我们获得了出色的计算和飙升的病毒滴度之间的相关性,验证这种方法( 图3C)。
接下来,我们分析了从PR8感染小鼠的BAL液。 PR8已被广泛使用在小鼠模型,以了解人类病理学和抗病毒的免疫力3。组小鼠滴鼻感染5000 PFU PR8。小鼠消瘦,驼背的外观,竖起皮毛和其他临床症状进行了监测。 0,2,4,7和感染后10天,处死和收集灌洗流体。利用这些实验室样品,MDCK细胞培养与BAL液系列稀释为17小时,在96孔板在50μL的最终体积。控制井担任已知滴度的股票PR8病毒感染的MDCK细胞生成标准曲线。细胞感染病毒后,被洗净,固定和近红外染料标记的二抗与抗M2的主要抗体染色。 MDCK细胞,模拟感染或治疗后感染滴度计算的背景荧光强度与同型对照。
BAL液分析表明,在实验室标本的病毒PR8是通过红外染料为基础的检测系统检测到。一个在BAL液中的病毒载量显着增加,观察2天4感染后( 图4A)。综合强度的计算表明,从天2和4灌洗流体后我nfection所载PR8病毒的显着水平( 图4B)。我们的结果表明,在一个渐进的,但显着的减肥PR8感染的早期阶段,显示了疾病的严重程度。然而,大多数小鼠开始恢复从疾病的症状和感染后7天内( 图4C),体重增加。小鼠在感染后10天没有任何检测PR8,说明清除病毒,这也与体重的增加和减少疾病的症状相当相关。
为了进一步延长此法的应用,我们测试了2009年人类流感A型(H1N1)隔离红外染料的抗体检测系统,并把它与实时PCR检测。从疑似病人获得合并鼻咽/咽喉拭子从临床样本分离。隔离是在MDCK细胞株的传播在密尔沃基卫生署实验室。测试结果是COMPA红色灵敏度红外染料为基础的方法来检查实时PCR检测( 图5)。结果表明,红外染料的抗体检测系统具有潜在的病毒载量检测低至10 3 TCID 50 /毫升,这是基于PCR的检测(10 TCID 50 /毫升)和秋季相比,在临床意义大多数患者样本的范围。这些结果提供了强有力的证据表明,红外染料为基础的检测系统具有足够的灵敏度和潜在的应用研究实验室和临床设置中的病毒滴度枚举。

图1。红外染料型流感病毒的免疫检测。(一)8玻片流感病毒感染的MDCK细胞共聚焦显微镜分析。免疫荧光显微镜分析表明,MDCK细胞单层贴壁基本完好,并与病毒衍生的中号加载2蛋白。基于红外染料和LI-COR的奥德赛系统的病毒滴度(BC)的定量分析。 (四)生成标准曲线和指数曲线拟合型材。在AD中提出的数据是代表5个独立的实验。
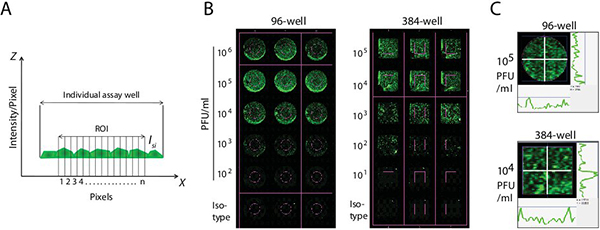
图2。 (一)综合荧光强度测量方法确定使用红外染料的病毒滴度 。一个定义的区域内的试验井率(ROI)标记的荧光强度来衡量。使用自动形状工具,得出的投资回报率的边界在中间试验井96 - 或384孔板。荧光测量单个像素(像素= N)内的投资回报率。综合强度是按功能括所有像素的强度值的总和,乘以圈/矩形的面积(数毫米2)。 (b)确定综合荧光强度在检测井。创造的投资回报率允许病毒滴定样品比较明确的背景井LI-COR公司的扫描仪。背景荧光定量模拟感染或继发性抗体单独控制和用于估算在综合强度试验井。 (三)收集的数据点内的投资回报率。介绍了两种对立的十字线(白)内的投资回报率来衡量各地以及荧光强度。右侧和下方的代表井的曲线代表沿着这些十字线的像素强度。

图3。 PR8尖刺灌洗液中病毒滴度的检测和定量。(一)MDCK细胞培养在96孔板中过夜和PR8的尖刺BAL液。 LI-COR的奥德赛系统板进行阅读。 (二)外生尖刺BAL液与标准曲线进行了比较。 (三)比较计算预计VIR人滴度。指数曲线拟合Y = 9.4784e 0.0014x。在交流中提出的数据是代表三个独立的实验。
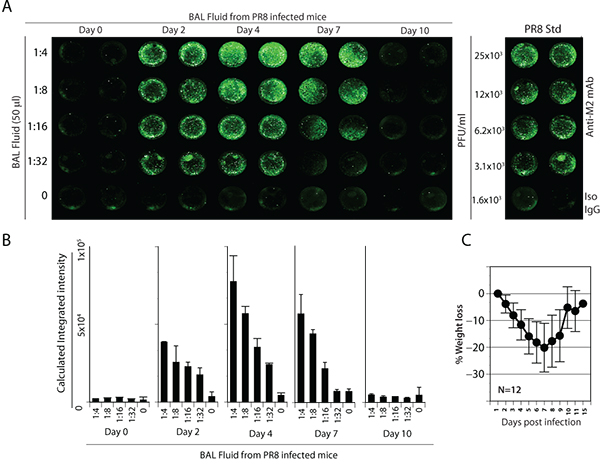
图4。流感病毒的检测和定量PR8感染小鼠灌洗流体(A)组小鼠滴鼻5000 PFU PR8感染。 MDCK细胞培养与BAL液系列稀释的最终体积为17小时50μL,在96孔板。细胞感染病毒后,被洗净,固定和红外染料标记的二抗与抗M2初级抗体染色。最右边的面板标准曲线。 (二)量化感染小鼠的BAL液中的病毒滴度。 (三)对小鼠过程中的重量损失PR8感染与病毒载量。在交流中提出的数据是代表三个独立的实验。
5重“SRC =”/ files/ftp_upload/3623/3623fig5.jpg“/>
图5。检测和量化2009年A型(H1N1)流感大流行(PDM)流感从人类的病人隔离。(一)红外染料型抗体感染MDCK细胞系的倍半滴定荧光系统检测。荧光的结果表明,该法具有潜力来检测病毒载量为10 3 TCID 50 / ml的低。 (二)从文化中提取核酸隔离串行已知滴度H1N1病毒的10倍稀释分离分析与疾病预防控制中心的实时PCR检测12。实时PCR检测限为10 TCID 50 /毫升。
讨论
最近的疫情,禽流感在东南亚和全球的猪流感的恐惧强加给公众健康和安全的巨大关注。关键的重点一直致力于为现有的和新的流感病毒株的疫苗。快速精确检测和精确的计算病毒滴度高通量技术的可用性,将极大地提高治疗效果。最常用的技术,计算病毒滴度包括斑块的形成和流感血凝试验。斑块形成实验首次估计噬菌体滴度,,雷纳托杜尔贝科通过计算动物病毒滴度4。若要执行此法,流感的股票或动物标本,如BAL液10倍稀释液准备和MDCK细胞单层接种0.1毫升分装到6孔板。该病毒可以吸附到广告的MDCK细胞dition的营养介质和琼脂糖。孵化期间,原感染的细胞释放子代病毒传播到邻近的细胞。流感病毒感染的细胞病变效应产生的感染细胞的圆形区域,被称为牌匾。每个斑块大概是单细胞与病毒复制的一个单一的病毒粒子感染后形成的。活细胞和斑块之间的对比,可以提高结晶紫等染料。此法的主要缺点是缺乏在实验的重现性和巨大的变化。另一项实验是用来确定流感病毒滴度血凝试验。对流感病毒表面的血凝素蛋白目前有效结合的N-乙酰神经氨酸含蛋白对哺乳动物和鸟类的血红细胞1。这种流感病毒和红细胞之间的相互作用,导致凝集在一个格子的形式。的L的凝集的伊维尔是用来估计在试样的流感病毒的滴度。红细胞凝集试验仅用于确定滴定已知病毒,不能用于菌种鉴定的目的。由于此法不区分活和死病毒,它是很难获得精确的计算病毒滴度。
目前流感感染的临床诊断是根据血清学检测,聚合酶链反应,直接试样免疫和细胞培养1,6。这里所描述的新方法,也有临床和实验室诊断的潜力。流感检测试剂盒Directigen流感(BD公司,圣何塞,加利福尼亚州)和BinaxNow(Binax公司,士嘉堡,ME)使用免疫层析法检测病毒抗原,如核蛋白7。使用这些工具包,病毒检测,在15分钟内就可以实现,但是,所有负样本必须进一步小号creened通过细胞培养方法。各种研究也报道了灵敏度低,这些套件,尤其是当感染轻度或低8。在我们的方法中,我们一贯检测低至100 PFU的病毒。这表明我们的技术检测临床标本中的H1N1病毒是有用的,即使是轻度感染。基于荧光的方法检测病毒抗原据报道,无论是鼻咽分泌物标本进行直接分析或接种到易感细胞病毒增殖和随后的分析9单层。然而,这些方法用于诊断目的的限制,不适合计算病毒滴度。的Q-PCR有助于识别病毒RNA存在,并没有估计活病毒的传染性。红外染料为基础的检测系统相比,这些化验,将有助于在临床和实验室样品的检测和病毒滴度枚举。在流感爆发的情况下,它是关键诊断数以千计的样品,在很短的时间内。我们的方法基于384孔板和红外扫描仪可以扫描时间(> 2000个样品)6板,因此提供了更大的优势超过其他直接荧光方法。快速处理数以千计的临床标本的可行性,可减少检测时间和成本,长度测试变异。 M2特异性抗体的使用提供了独立的H和N蛋白的应变差异的优势。在大多数的流感株感染人类的M2蛋白是相对保守的。如果与我们的系统结合的特异性抗体循环污渍,可以衡量的病毒滴度,并找出应变。然而,由于M2是金刚烷胺类药物的目标,突变可以出现,可能会改变这里使用的单克隆抗体结合位点。这代表了这个系统正在这些药物治疗的个体潜在的局限性。
多种试验样品检测用于枚举流感滴度。计算病毒滴度,50%组织培养感染剂量(TCID 50)和蛋尿囊液的检测,被广泛应用于1,10。然而,多天的要求,使这些方法不可靠。此外,在这些方法上的斑块数量的50%的变化计算提供了理论,但不准确的病毒滴定。斑块形成检测可在96小时内进行;然而,缺乏可重复性是一种病毒滴度计算主要关注的问题。这里描述目前的技术有几个明显的优势。首先,它是一致的结果具有高度重复性的技术。二,病毒滴度计算的基础上对定义的标准曲线相比,荧光强度的简单量化。第三,两个或两个以上的主要抗体,可以用于诊断多种血清型,在给定的样本。此外,红外染料标记的抗体有微量人自体荧光,并已被用于细胞成像11。紫外线或视觉辐射(300-600纳米)的结果,由于存在高量子高产的内源性荧光在高细胞自体荧光。这些措施包括芳香族氨基酸,脂质体颜料,吡啶核苷酸(NADPH),弹力蛋白,胶原蛋白和黄素辅酶。这使得它很难利用这些辐射的来源为探针,以量化的特定蛋白质表达的细胞的内在属性。相比之下,近红外染料激发和发射670-1000纳米之间。许多宿主细胞的分子和多环芳烃不要在此波长激发,由于光散射减少,发出极低的背景荧光。此外,窗口之间的背景和具体的检测,大大提高由于高消光系数的近红外荧光。耐光性,优异的信号噪声比,是非常量化病毒滴度有关。使用的microfluidic商会将通过机器人控制自动化筛选过程,可以让我们轻松测试具有高度传染性的临床标本。因此,利用这些方法在近红外染料的理想和高度可靠的枚举组织样本中的病毒滴度。
披露声明
我们什么都没有透露。
致谢
这项工作是在国立卫生研究院的一部分赠款以R01 A1064826-01,U19青年AI062627-01,NO1-HHSN26600500032C(SM)的支持。我们感谢我们的实验室成员讨论和技术帮助,蒂娜万岁严格审查的手稿。我们想感谢密尔沃基卫生署实验室的戴维·比娜,病毒培养和PCR。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| 牛血清白蛋白 | 亚特兰大生物 | S11750 | |
| PR8病毒 | 从托马斯中号莫兰博士 | ||
| 羊抗鼠IRDye @ 800 | 李-COR公司生物科学 | 926-32210 | 1:200稀释 |
| LI-COR公司的奥德赛红外扫描仪 | LI-COR公司的生物科学 | 9201-01 | |
| 384井平底板 | nalge NUNC国际 | 164730 | |
| 96井平底板 | nalge NUNC国际 | 165305 | |
| DMEM培养基 | invitrogen | 11965126 | |
| 培养基中 | Invitrogen公司 | 11875135 | |
| 碳酸氢钠 | Invitrogen公司 | 25080 | |
| L - 谷氨酰胺100X | Invitrogen公司 | 25030 | |
| trypson-EDTA | Invitrogen公司 | R001100 | |
| 丙酮酸钠 | Invitrogen公司 | 11360070 | |
| 抗M-2抗体 | 从托马斯中号莫兰博士 | ||
| 反NP单抗 | 疾病预防控制中心 | V2S2208 | 获得一个MTA |
参考文献
- Hirst, G. K. The agglutination of red cells by allantoic fluid of chick embryos infected with influenza virus. Science. 94, 22-23 (1941).
- Jonsson, N., Gullberg, M., Lindberg, A. M. Real-time polymerase chain reaction as a rapid and efficient alternative to estimation of picornavirus titers by tissue culture infectious dose 50% or plaque forming units. Microbiol. Immunol. 53, 149-154 (2009).
- Kalter, S. S. Hemagglutinating Behavior of Mouse and Egg-adapted Type A (PR8) Influenza Virus. Science. 110, 184-184 (1949).
- Dulbecco, R. Production of Plaques in Monolayer Tissue Cultures by Single Particles of an Animal Virus. Proc. Natl. Acad. Sci. U. S. A. 38, 747-752 (1952).
- Deyde, V. M., Nguyen, T., Bright, R. A., Balish, A., Shu, B., Lindstrom, S., Klimov, A. I., Gubareva, L. V. Detection of molecular markers of antiviral resistance in influenza A (H5N1) viruses using a pyrosequencing method. Antimicrob. Agents Chemother. 53, 1039-1047 (2009).
- Jonsson, N., Gullberg, M., Lindberg, A. M. Real-time polymerase chain reaction as a rapid and efficient alternative to estimation of picornavirus titers by tissue culture infectious dose 50% or plaque forming units. Microbiol. Immunol. 53, 149-154 (2009).
- Rahman, M., Kieke, B. A., Vandermause, M. F., Mitchell, P. D., Greenlee, R. T., Belongia, E. A. Performance of Directigen flu A+B enzyme immunoassay and direct fluorescent assay for detection of influenza infection during the 2004-2005 season. Diagnostic Microbiology and Infectious Disease. 58, 413-418 (2007).
- Landry, M. L., Ferguson, D. Suboptimal detection of influenza virus in adults by the Directigen Flu A+B enzyme immunoassay and correlation of results with the number of antigen-positive cells detected by cytospin immunofluorescence. J. Clin. Microbiol. 41, 3407-3409 (2003).
- Herrmann, B., Larsson, C., Zweygberg, B. W. Simultaneous detection and typing of influenza viruses A and B by a nested reverse transcription-PCR: comparison to virus isolation and antigen detection by immunofluorescence and optical immunoassay (FLU OIA). J. Clin. Microbiol. 39, 134-138 (2001).
- Reed, L. J., Muench, H. A simple method of estimating fifty percent endpoints. Am. J. Epidemiol. 27, 493-497 (1938).
- Doerr, A. Fluorescent proteins: into the infrared. Nat. Meth. 6, 482-483 (2009).
- Shu, B., Wu, K. H., Emery, S., Villanueva, J., Johnson, R., Guthrie, E., Berman, L., Warnes, C., Barnes, N., Klimov, A., Lindstrom, S. Design and performance of the CDC real-time reverse transcriptase PCR swine flu panel for detection of 2009 A (H1N1) pandemic influenza virus. J. Clin. Microbiol. 49, 2614-2619 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。