需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
DII的标签DRG神经元的研究轴突分支在小鼠胚胎脊髓整装准备
摘要
啮齿类动物脊髓感觉传入到定型预测提供了一个方便的实验系统研究轴突通过追踪单个轴突分支。
摘要
在这里,我们提出了一个技术标签成胚胎脊髓DRG神经元的小团体的运动轨迹,通过扩散染色使用的亲脂示踪剂1,1' -双十八烷基- 3,3,3',3' - tetramethylindocarbocyanine高氯酸盐 (DII)1 。与哪些基因突变的鼠标线的野生型轴索途径的比较,使测试的候选蛋白在轴突分支的控制,这是一种在神经系统的布线必要机制的职能作用。轴突分支使单个神经元的连接多个目标,从而提供了并行处理信息的物理基础。可区别于终端树枝状的轴突生长的中间目标地区产生影响。此外,取决于是否从生长锥的活动(分裂或延迟文胸分支的结果,可分为轴突分支形成不同的模式nching),或从萌芽进程中的轴突轴络脉称为间质性分支 2( 图1) 。
中央从背根神经节神经元的预测提供有用的实验系统研究轴突分支两种类型:当其传入轴突之间达成胚胎天,10至13(E10 - E13)背根进入区(DREZ)脊髓显示一个千篇一律的图案T或Y形分叉。产生两个女儿轴突在延髓或尾鳍的方向,然后进行,分别于背侧缘的线,只有经过等待期络脉从这些干轴突发芽渗透灰质(间质性分支)和项目,以在特定的中继神经元椎板脊髓他们进一步arborize(终端分支)3。 DII追查发现生长锥的脊髓背根进入区,似乎是在公关表明分叉分裂ocess是造成分裂生长锥4( 图2),然而,其他的选项,以及5讨论。
第一视频演示如何剖析DRG的附加的E12.5小鼠的脊髓。适用于录制后的少量标本的DII DRG的使用玻璃毛细管拉针。孵化步骤后,标记的脊髓是安装作为一个倒置的开卷准备,用荧光显微镜来分析单个轴突。
研究方案
1。解剖过程
注 :小鼠实验使用应遵循正式批准的关心和使用实验动物的指导方针。
- 前的准备,建立您的解剖显微镜,并打下了清扫,包括大,小剪刀,大齿镊,弯钳和四套杜蒙五号解剖钳(其中有两个内抛光技巧)所需的手术器械(详情参见特定的试剂和设备表)。在100毫米的Sylgard涂层的培养皿放在一张滤纸。倒入冷PBS在12孔板,100毫米的培养皿和12毫升管水井和留在冰上。移液器2毫升固定缓冲区(4%多聚甲醛PBS,pH值7.4),以及在每个第二个12孔板置于冰上。
- 麻醉后,牺牲在E12.5(E0.5指定检测阴道塞)定时怀孕大坝,放置鼠标3张纸巾,用70%乙醇浸泡腹部腹面的一面向上。
- 打开腹部盆腔腔,分离双侧子宫角和转移到冰冷PBS 100毫米的菜肴之一。
- 根据微观控制,使子宫壁与小,直剪刀纵形切口,切离每个胎盘羊膜囊。
- 从每个胚胎羊膜囊剥离,剪断脐带。
- 使用小剪刀,杀头的胚胎和基因组DNA的元首或其中的一部分预留是否应要求基因分型。随后,转让torsi的12孔板,用冷PBS各自的水井。
- 湿的PBS几滴在Sylgard培养皿滤纸和纸张上的位置与胚胎躯干背侧。为了更好地稳定,整顿它的尾巴和四肢远离身体。
- 工作约16X放大倍率解剖显微镜下,仔细地捏皮肤和胚胎脊髓以上的两双细尖镊子轻轻撕除。在中间开始,首先对尾部进行,然后从中间恢复对前侧。
- 湿胚胎不时有两个或三个滴的PBS,以防止它干燥。
- 为了防止,DRG的teared从脊髓时,它是从胚胎中删除分离的背根神经节和周围的软骨脊柱脊髓内抛光技巧罚款镊子刀片横向滑动运动。在胚胎的右侧中间开始,您对尾的方式工作,然后到前结束。之后,重复对方的过程。要小心,不要撕掉关联的DRG。
- 从胚胎分离完全放松的脊髓,拿起其cervic人用细镊子,拉出来一件对尾鳍结束。
- 附加DRG的淹没孤立的脊髓以及在洋溢着固定缓冲区的12孔板进行准备从剩余胚胎的脊髓。
- 修复脊髓冰至少有两个小时。
2。 DII - DRG神经元的标签
- 对于每一个被标记的脊髓,准备与微管拉拔两个玻璃针。我们使用一个萨特模式的P - 97电极拉马(程序设置:1热= 625,VEL = 35,时间= 175; 2 = 600,VEL = 25时间= 175;热加热,VEL = 630 =。 30,时间= 150)。
- 根据微观控制每个玻璃针的尖端沾在5%(W / V)溶液中乙醇的DII的三至五倍。乙醇的蒸发,创建一个针上一层薄薄的DII晶体。
- 一个放大了约40倍的解剖显微镜下工作,将其V脊髓entral方幻灯片上。使用弹簧剪刀,打开其整个长度的线,通过floorplate切割,让后来安装在一个倒置的开卷模式的准备(见C节)腹侧方。
- 与脊髓背侧幻灯片上的位置。然后手动的方法与玻璃针DII覆盖微观可视化的提示下,仔细皮尔斯每脊髓一侧的第二个DRG的电源线。 DII几乎没有痕迹应在刺穿背根神经节可见,以确保只有少数的神经元的标签。为第二针电源线的另一端。针对只有每秒DRG避免来自邻国的DRG,这可能会使个别的轴突的分化标记的轴突预测的重叠。
- 在室温下至少六个小时或4℃过夜,返回脊髓固定缓冲区,并在黑暗中孵育° C至染料DI沿着轴突ffuse质膜内。允许抵押品增长到脊髓的分析,如果需要一个较长的潜伏期(最多两天在4 ° C)。
3。安装和微观分析
- 以下染料扩散,位置单一脊髓背侧向下一个盖玻片的PBS下降。小心附加DRG的方向正确,横向和不混杂。吸干多余的液体和扁平化,在一个倒置的开卷模式,使用镊子线。
- 安装在显微镜幻灯片,用PBS的准备。
- 为了避免不必要的背景染色荧光标记的轴突预测的微观分析增加,应进行一天的安装。直到然后继续在黑暗中的幻灯片在4 ° C。
4。代表性的成果:
脊髓鼠标接收传入公关ojections从8对颈椎,胸椎13对,共60脊神经节的腰椎和骶部的DRG 4对5对。一些培训后与脊髓仍然附着的DRG的大部分可以从胚胎中分离下五分钟。此过程适用于隔离附带的DRG从E11.5到E13.5小鼠胚胎脊髓。然而,最好的结果是实现了从E12.5。这里所描述的标签程序示范结果如图3所示。在整个长度的脊髓背根神经节的标签,然后可以用来量化在不同的椎体水平( 图 4)轴突分支行为。

图1。计划描绘轴突分支的两个主要模式。 (一)分支,可能会导致分叉的生长锥的活动 - 在此间表示 - 以及复杂的终端乔木或(二)抵押物形成的轴突轴(间质性分支)。后一种模式是占主导地位的分支预测皮质和丘脑皮层的轴突6,7类型。

图2 DRG神经元传入的预测显示成胚胎脊髓轴突分支的两种类型:(1)在分叉DREZ的女儿分支络脉间质性分支(2)等待期后的形式轴突第一家分行。
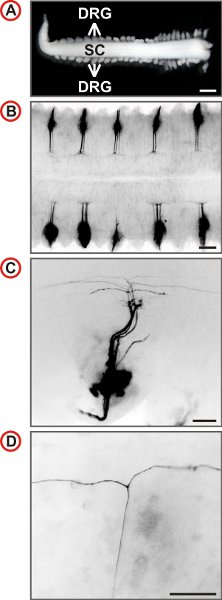
图3小鼠胚胎DRG神经元的单性轴索轨迹的可视化。 (一)附有背根神经节脊髓准备从E12.5小鼠胚胎。 (比例尺,1毫米。)(BD)DII标记的野生型小鼠在增加放大倍率DRG的背视图显示。在B每秒DRG的是labeleD通过DII。荧光图像是倒立,尾鳍是在左,C和D,横向是在底部。在C语言中少数的轴突标记,并在更高的放大倍率的T状分支的存在可以在脊髓DREZ确定。 (比例尺,250微米(二),100微米(C)和50微米(四)。)
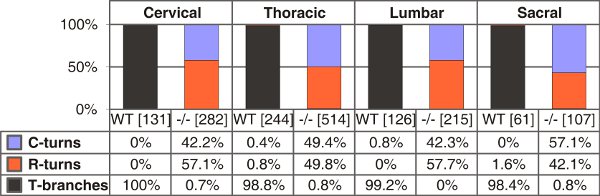
图4 T形分支,单延髓或尾鳍轮流在野生型和C型利钠肽(CNP)缺陷小鼠在E13.5的量化。计算单个轴突的数字括号内为各基因型的不同主干水平。 C型或R匝 - 仅在尾鳍或延髓方向的增长,分别。
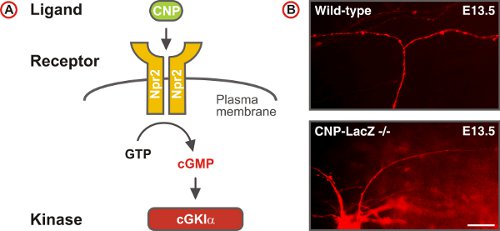
图5一个的cGMP信号通路触发脊髓DREZ感觉轴突分叉。 (a)计划CNP的配体,受体鸟苷酸环化酶Npr2和丝氨酸/苏氨酸激酶在胚胎DRG神经元cGKIα组成的cGMP信号通路。 Npr2从GTP生成cGMP的应CNP的刺激。 (二)投资收益跟踪单在野生型和CNP缺陷小鼠背根神经节神经元的轴突。 (比例尺,25微米)。
讨论
刻板的投影模式,轻松结合DII标签使用固定的组织编制,包括轴突分支形成两种类型的附有DRG的一个有利的模型来研究神经轴突分支胚胎脊髓。 DII分钟,使用镀膜玻璃针的应用程序允许 - 背根神经节的体积标签 - DRG神经元的小群体的可视化,从而个人轴突及其分支模式的分析对比。所描述的方法可以进一步改善iontophoretic注射的亲脂性的示踪从而进一步降低标记的神经元 8 。然而,这将是...
披露声明
作者什么都没有透露。
致谢
作者希望感谢阿利斯泰尔Garratt博士(最大德尔布吕克中心,柏林)有益的意见。这项工作是支持的协作研究中心(SFB665)德国研究会(DFG)。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论(可选) |
| 体视显微镜STEMI刚果(金) | 蔡司 | ||
| 磷酸盐缓冲液(PBS) | Biochrom公司 | L182 - 50 | |
| 多聚甲醛 | 默克公司 | 8.18715.1000 | |
| 标准的手术剪 | 精细科学工具 | 14001-13 | |
| 齿标准钳 | 精细科学工具 | 11021-14 | |
| 超等虹膜剪刀 | 精细科学工具 | 14088-10 | |
| 弯钳 | 精细科学工具 | 11003-13 | |
| 杜蒙五号罚款提示钳 | 精细科学工具 | 11254-20 | |
| 杜蒙5号镜面钳 | 精细科学工具 | 11252-23 | |
| Vannas,蒂宾根弹簧剪刀 | 精细科学工具 | 15008-08 | |
| 滤纸 | Fisher Scientific则 | FB59041 | |
| Sylgard 184 | 世界Precission仪器 | SYLG184 | |
| 100毫米的培养皿 | 格雷纳 | 663102 | |
| 12毫升的聚丙烯管 | 卡尔罗斯有限公司 | ECO3.1 | |
| 12孔培养板 | 碧迪 | 35-3043 | |
| 乙醇 | 默克公司 | 1.00983.2500 | |
| 火焰山/布朗微量拉马的P - 97 | 萨特仪器有限公司 | ||
| 硼硅玻璃毛细管 | 哈佛仪器 | 30-0066 | |
| DII(1,1' -双十八烷基- 3,3,3',3' -甲基- indocarbocyanine高氯酸盐) | Sigma - Aldrich公司 | 468495 | |
| 显微镜载玻片SuperFrost加 | 卡尔罗斯有限公司 | H867.1 | |
| 玻璃盖玻片 | 卡尔罗斯有限公司 | 1870.2 |
参考文献
- Honig, M. G., Hume, R. I. Dil and diO: versatile fluorescent dyes for neuronal labelling and pathway tracing. Trends. Neurosci. 12 (9), 333-333 (1989).
- Acebes, A., Ferrus, A. Cellular and molecular features of axon collaterals and dendrites. Trends. Neurosci. 23 (11), 557-557 (2000).
- Ozaki, S., Snider, W. D. Initial trajectories of sensory axons toward laminar targets in the developing mouse spinal cord. J. Comp. Neurol. 380 (2), 215-215 (1997).
- Schmidt, H. The receptor guanylyl cyclase Npr2 is essential for sensory axon bifurcation within the spinal cord. J. Cell Biol. 179 (2), 331-331 (2007).
- Gibson, D. A., Ma, L. Developmental regulation of axon branching in the vertebrate nervous system. Development. 138 (2), 183-183 (2011).
- O'Leary, D. D., Terashima, T. Cortical axons branch to multiple subcortical targets by interstitial axon budding: implications for target recognition and "waiting periods". Neuron. 1 (10), 901-901 (1988).
- Portera-Cailliau, C. Diverse modes of axon elaboration in the developing neocortex. PLoS. Biol. 3 (8), e272-e272 (2005).
- Gan, W. B. Vital imaging and ultrastructural analysis of individual axon terminals labeled by iontophoretic application of lipophilic dye. J. Neurosci. Methods. 93 (1), 13-13 (1999).
- Schmidt, H. C-type natriuretic peptide (CNP) is a bifurcation factor for sensory neurons. Proc. Natl. Acad. Sci. U. S. A. 106 (39), 16847-16847 (2009).
- Zhao, Z. Regulate axon branching by the cyclic GMP pathway via inhibition of glycogen synthase kinase 3 in dorsal root ganglion sensory neurons. Journal of Neuroscience. 29 (5), 1350-1350 (2009).
- Zhao, Z., Ma, L. Regulation of axonal development by natriuretic peptide hormones. Proc. Natl. Acad. Sci. U. S. A. 106 (42), 18016-18016 (2009).
- Schmidt, H., Rathjen, F. G. Signalling mechanisms regulating axonal branching in vivo. Bioessays. , (2010).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-41 (2000).
- Livet, J. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-56 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。