Method Article
小鼠腘窝淋巴结的活体成像
摘要
2 - 光子显微镜的最新进展已启用实时在原位成像动物模型的活组织,从而提高我们的能力,探讨在生理和病理条件下细胞行为。在这里,我们勾勒出执行小鼠腘窝淋巴结的活体成像所需的筹备工作。
摘要
淋巴结(LNS)是二级淋巴器官的战略,这是位于整个身体,使周围组织的外国总理适应性免疫反应的抗原捕获和演示。先天免疫和适应性免疫反应之间的并列,是一个理想的网站,以研究免疫细胞相互作用1,2号法律公告。树突状细胞(DCs)和巨噬细胞,淋巴细胞(T细胞,B细胞和NK细胞),包括散装骨髓衍生的细胞元素的LN。这些细胞是战略定位的LN,让自身抗原和潜在的外来抗原3-5有效的监测。其中淋巴细胞成功地遇到同源抗原的过程是在近年来激烈的调查,涉及整合分子接触,包括抗原受体,黏附分子,趋化因子和基质结构,如纤维网状网络2,6-12 。 前高分辨率实时荧光在体内成像,依靠静电成像的调查,只提供答案的形态,位置,建筑的发展。虽然这些问题是在我们的免疫细胞行为的理解的基础,这种技术的固有的局限性与不容许分析破译淋巴细胞贩运和影响细胞行为的动态环境线索。近日,发展活体双光子激光扫描显微镜(2P-LSM)的调查,以查看12-16 原位活淋巴结内的动态变化和单个细胞的相互作用。尤其是我们和其他人都在腘法律公告,其结构紧凑,密集的性质提供了多路数据采集的优势,在一个大的组织面积应用这项技术,图像细胞的行为和相互作用与不同的组织结构11,17-18 。它,我重要的是要注意,这种技术提供,超过explanted组织成像技术,需要破坏血液,淋巴流动,最终系统的细胞动力学的好处。此外,explanted组织有足够的时间非常有限的窗口,在该组织仍然可行后,外植体成像。成像时间与适当的水分和动物的环境条件的监测,可以显着延长,这活体技术。在这里,我们提出了一个详细的小鼠腘法律公告准备进行活体成像的目的的方法。
研究方案
1。鼠标持有人大会
- 覆盖100毫米的玻璃Petri网盘100毫米的塑料培养皿朝下盖顶部的盖子。玻璃应勉强接触的塑料盘的中心点。使用玻璃模具,跟踪标记的塑料盘上。
- 使用手电钻(即德雷梅尔)删除一个100毫米的塑料盘盖,创建一个月牙形的平台的一部分。这个新月形的塑料盖,将作为一个鼠标(图1a)躯干上部的支持。月牙形盖上钻两个孔,以确保用金属绞领带防毒面具。确保使用超级胶水或等效附着力强(图1b),玻璃的Petri盘边缘的塑料盖。
- 两个半球形的盖PCR扩增管(切铰链)为中心锚固腘皮瓣目的底部盘相距1厘米的胶盖。
2。鼠标的制备
注意:如果有足够的实践,应该能在20-30分钟,执行鼠标的准备和手术步骤。
- 麻醉与异氟醚(诱导的2至2.5%,1.5至2%的手术/影像)O 2的 1:1掺鼠标:1L/min的流量在空气混合使用IACUC批准的程序。一旦鼠标是麻醉,争取用胶带的鼻子防毒面具。判断鼠标是完全缺乏的脚趾和/或尾巴捏麻醉。异氟醚的水平可能会作相应的调整,以确保动物是完全镇静与稳定,非吃力60-80次/分钟呼吸频率。
- 使用电动微调,以消除头发上的鼠标右后腿和腹股沟区。
- 刷掉松散的头发剃光面积,用棉签轻轻涂于奈尔洗剂一个温和的外衣。初次申请一分钟后,取出奈尔和裸露的皮肤清洁用湿布纸巾。确保鼠标的清洁和干燥,然后再继续。
- 在右膝盖的剪刀与小2至3毫米的切口,暴露伸肌腱。
- 申请Vetbond沿鼠标持有人将被定位在鼠标的身体和腿部的中心。仔细持有人争取到鼠标,右膝盖下,暴露右腘窝。保护,以帮助稳定成像领域之间的2皮瓣持有人的Vetbond右膝肌腱。
- 舒展和磁带的胳膊和左腿持有人的上层平台。
- 使用捻领带,以确保在地方的防毒面具。
- 解剖显微镜下,将持有人。必须保持绝对静止的LN,独立的鼠标的呼吸运动。因此,必须采取预防措施,同时进行手术,以优化腿部的稳定性。确定,这将有助于最大尾的位置(通常头以上)稳定的右腿和磁带的尾巴向下。
3。手术
- 虽然剥离范围下,保持使用空间加热器或加热垫鼠标体温。它对于成像腘LN的成功,是至关重要的,以维持整个手术的正常体温,以及保持组织的水分不断暴露组织申请温暖的PBS。
- 用优碘消毒皮肤。用无菌剪刀,通过在合适的中期小腿皮肤正中切口,并继续削减垂直向上到右大腿上部分。
- 在顶部的垂直切口线两侧皮瓣,使两横的皮肤切口。
- 回缩下来与Vetbond皮瓣和胶水。拉扯皮肤绷紧申请Vetbond之前将进一步促进腿部的稳定,然而,确保皮肤张力不闭塞血流(即改变在vesseL颜色或直径)。继续下皮肤的其他领域的胶水,以确保稳定的腿前露出的LN。鼠标的大小将决定需要多少额外的皮肤胶水。通常情况下,大小鼠,将需要更多的皮肤被粘到持有人。
- 应位于腘窝内的LN向右或左腘静脉,根据持有人的鼠标的位置。仔细分离周围的脂肪组织和肌肉使用微解剖镊子和钳子号法律公告。为了最大限度地减少出血和创伤,用微解剖镊子单独组织splaying技术。仔细暴露腘法律公告没有危害的传入和传出的血管和传入淋巴管的完整性。
- 为增加组织稳定性,方形玻璃盖可放置在潮湿的LN,刚刚接触的法律公告,同时避免血管闭塞。玻璃盖可能SECUR用鼠标两侧造型粘土。
- 各种规格(如TRITC-葡聚糖,的70kDa最低)的荧光血管染料可能在这一点上介绍,静脉注射,以帮助突出的LN结构关系和诚信在成像。
4。 2光子成像采集**
- 一旦LN充分暴露,实现稳定,及时转移到显微镜保持在37室环境与一个可编程的温度反馈控制加热垫安装在显微镜阶段°C的整个鼠标持有人大会加入足够的无菌温水(37℃)PBS或HBSS中淹没的LN。体积会改变鼠标的大小和位置而定。另外,温暖的PBS或HBSS中,可直接应用于解剖号法律公告,通过细的玻璃吸管装蠕动泵和录音浸没透镜的目的列。液体的流动应该是这样的,镜头和组织之间,可以保持稳定的水柱。
- PBS或HBSS中温度保持在37°C使用与反馈探头加热垫。一个独立的温度探头应放置在鼠标持有人确认在PBS的温度范围36.5至37.5°C直肠探头也可用于监测核心体温的实验小鼠,整个成像会议。
- 使用外延荧光灯,以帮助指导下的目标LN的位置。获取荧光图像的堆栈,使用所需的细胞相互作用的(通常为10秒到1分钟之间每个XYZ图像堆栈)适当的时间间隔。
- 监测的动物经常在显微镜室通过目测或使用动物监测系统的状态。确定如果鼠标是完全缺乏脚趾和/或指甲掐麻醉,一个稳定的,非辛劳与呼吸频率60-80 breaths /分钟。异氟醚的水平可能会相应调整,以确保动物是完全镇静。有了适当的监测和水化,动物可成像为4-6小时,或者更长的时间。
- 成像实验后,安乐死的动物,在CO 2室使用IACUC核准的安乐死协议。动物不应该被允许安乐死前从麻醉中出现。
**此手术也可能是有用的活体成像比其他2P-LSM的其他形式。
5。代表结果
招募各种循环免疫细胞过继转移后,在不同速率的LN。 CD4 +和CD8 +淋巴细胞,这些细胞开始通过高内皮小静脉(HEV)的IV转移相当数量到达腘法律公告后2至4小时6,17-18分钟后抵达的LN。对于乙CELLS,大量积累后,8至24小时19。激活区议会应开始出现在排水腘法律公告8至16小时后脚掌注射3,11,16-17。图2a显示,即使没有其他的标志性建筑,如B细胞滤泡结构可以看出端倪2P-LSM的19下可见的圆球形细胞积累容易。如泛素-GFP的脾细胞(图2,补充视频1和2)的内源性荧光记者,可以跟踪这些天淋巴细胞迁移和行为长达一个星期不刺激下的生理状况。与多通道高灵敏度探测器,它有可能获得多重影像数据集,包括多个蜂窝伙伴17,19之间的结构信息以及相互作用的动力学。
当正确执行,认真监测和环境条件的手术方法,lymphocyTES应该表现出特征的迁移速度,在图2C,2D和其他地方13-14,16。淋巴细胞也可能会出现在迁移速度的差异,根据分区域进行成像的LN,所以额外的标志性建筑,如血管(引进船舶染料强调)将有助于确定整体成像质量(即适当的温度控制,创伤小(LN),等等),3,6,20。

图1。构建一个鼠标鼠标腘LN影像持有 )鼠标持有人大会的示意图; b)代表活体小鼠制备; C)完成鼠标持有人大会; d)关闭了手术后暴露腘法律公告意见。
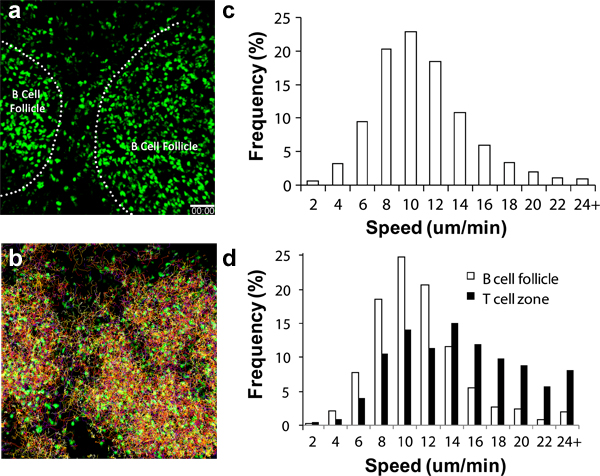
图2。绿色荧光蛋白+淋巴细胞迁移分析(一)在腘法律公告。腘法律公告2P-LSM的成像序列的三维快照在C57BL / 6受体小鼠过继转移1×7的GFP +淋巴细胞1天前成像。虚线表示B细胞滤泡的边界;(二)淋巴细胞的迁移轨道在1个小时的连续成像;三)整体淋巴细胞迁移速度分布。平均速度= 10.04±4.26微米/分钟(共15,125分析轨道); D)微分在B细胞滤泡细胞的细胞迁移的速度分配(开放的酒吧;意味着速度= 8.79±3.90微米/分钟;共1525轨道分析)和T细胞区(封闭式酒吧;平均速度= 13.77±5.93微米/分钟;共1250分析轨道)。比例尺= 50微米。
补充视频1。时间推移活体成像2P-LSM的鼠标腘在图2中描述的法律公告。共有1×10 7淋巴细胞分离FROM泛素-GFP的供体小鼠和C57BL / 6受体小鼠成像前24小时静脉注射继转入。一个XY系列(750微米×750微米)的荧光图像,通过固定的z栈(5微米的步骤,13个步骤)产生XYZ成像栈(750微米×750微米×65微米),这是每20秒重复共为60分钟,导致xyzt速度分析(图2C,2D)成像序列。播放速度= 450X。比例尺= 50微米。时间戳=分钟:秒。 点击这里观看补充视频 。
补充2视频放大成像序列中补充视频1在B细胞卵泡- T细胞区的边界。播放速度= 450X。比例尺= 25微米。时间戳=分钟:秒。 Ç舔这里观看补充视频。
讨论
在原位成像技术,特别是2P-LSM的,在高分辨率的最新进展一直伴随着由一个细胞在体内的动态行为研究的兴趣与日俱增。 4D成像技术在活老鼠腘法律公告允许这样的分析,在不间断的组织微环境内免疫细胞的动态行为。 2P-LSM的覆盖了整个可见光谱的多个探测器的使用,允许同时成像数据采集多个细胞群。现在可以通过在体内细胞特异性荧光记者结合使用差异标记细胞使用有机荧光细胞染料的人群继转移的小鼠(如泛素-EGFP-RFP的,或ECFP)使用(如CFSE标记SNARF-1,细胞追踪橙)审查范围内的LN细胞的机制和功能。此外差异跟踪Ç之间的相互作用的直接观察ELL的人群中,多重影像数据集,可以进行进一步的分析与市售的影像处理软件程序(如Imaris,位平面公司),以进一步阐明细胞的行为和功能。浩如烟海的可能性存在,使用这些在体内和硅片技术研究细胞相互作用机制。
这里所描述的实验方法的主要限制是在手术方法的固有技术的复杂性。这种技术要求严格的训练,成为熟悉的相关解剖和精确的技术程序和本议定书所规定的技能。进一步复杂化的因素包括号法律公告勘探过程中尽量减少组织损伤的困难,优化组织的稳定性,在成像和防止热和激光损伤的法律公告之前,在成像实验。扰动,这些因素将导致低于最优淋巴结ocyte蠕动,因此会干扰成像数据分析结果的正确解释。
披露声明
作者没有任何透露。
致谢
这项工作是由达纳基金会,圣Baldrick基金会,癌症研究所NCI的1R01CA154656,1R21AI092299 NIAID的,Gabrielle的天使基金会,现代汽车美国“希望的车轮”计划的拨款支持。
材料
试剂公司产品目录号码
| Name | Company | Catalog Number | Comments |
| 异氟醚,美国药典 | 百特医疗用品公司 | 国发10019-773-60 | |
| Vetbond | 3M | 1469SB | |
| 奈尔 - 脱毛乳液 | 奈尔 | ||
| PBS,1X | Cellgro | 21-040-CV | |
| 加热垫 | 瓦特隆 | ||
| 暖气片控制器 | 瓦特隆 | ||
| 空气和O 2 | 公司Airgas | ||
| 温度探头 | 哈佛仪器 | ||
| 镊子杜蒙#5 | 世界精密仪器公司 | 14101 | |
| 镊子,格雷夫鸢尾,7厘米弧形 | 世界精密仪器公司 | 14141 | |
| 剪刀 | Roboz手术仪器有限责任公司 | RS-5880 | |
| 100x20毫米的玻璃细胞培养皿盖 | 康宁 | 70165-102 | |
| 100x20毫米的聚苯乙烯细胞培养皿盖 | 康宁 | 430167 | |
| 优碘溶液(10的%Povidine碘外用溶液) | 普渡产品,LP | 国发67618-150-08 |
参考文献
- Bousso, P. T-Cell activation by dendritic cells in the lymph node: lessons from the movies. Nat. Rev. Immunol. 8, 675-684 (2008).
- Germain, R. N. Making friends in out-of-the-way places: how cells of the immune system get together and how they conduct their business as revealed by intravital imaging. Immunol. Rev. 221, 163-181 (2008).
- Huang, A. Illuminating the landscape of in vivo immunity: insights from dynamic in situ imaging of secondary lymphoid tissues. Immunity. 21, 331-339 (2004).
- Stefanova, I. Self-recognition promotes the foreign antigen sensitivity of naive T lymphocytes. Nature. 420, 429-434 (2002).
- Stefanova, I. On the role of self-recognition in T cell responses to foreign antigen. Immunol. Rev. 191, 97-106 (2003).
- Bajenoff, M. Fibroblastic reticular cells guide T lymphocyte entry into and migration within the splenic T cell zone. J. Immunol. 181, 3947-3954 (2008).
- Celli, S. Decoding the dynamics of T cell-dendritic cell interactions in vivo. Immunol. Rev. 221, 182-187 (2008).
- Mempel, T. R., Junt, T., von Andrian, U. H. Rulers over randomness: stroma cells guide lymphocyte migration in lymph nodes. Immunity. 25, 867-869 (2006).
- Worbs, T. CCR7 ligands stimulate the intranodal motility of T lymphocytes in vivo. J. Exp. Med. 204 (3), 489-495 (2007).
- Bajenoff, M. byways and breadcrumbs: directing lymphocyte traffic in the lymph node. Trends Immunol. 28, 346-352 (2007).
- Mempel, T. R. T-cell priming by dendritic cells in lymph nodes occurs in three distinct phases. Nature. 427, 154-159 (2004).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Miller, M. J. Autonomous T cell trafficking examined in vivo with intravital two-photon microscopy. Proc. Natl. Acad. Sci. U. S. A. 100, 2604-2609 (2003).
- Sumen, C., Mempel, T. R., Mazo, I. B., von Andrian, U. H. Intravital microscopy: visualizing immunity in context. Immunity. 21, 315-329 (2004).
- von Andrian, U. H., Mempel, T. R. Homing and cellular traffic in lymph nodes. Nat. Rev. Immunol. 3, 867-878 (2003).
- Bousso, P., Robey, E. Dynamics of CD8+ T cell priming by dendritic cells in intact lymph nodes. Nat. Immunol. 4, 579-585 (2003).
- Castellino, F. Chemokines enhance immunity by guiding naive CD8+ T cells to sites of CD4+ T cell-dendritic cell interaction. Nature. 440, 890-895 (2006).
- Halin, C. In vivo imaging of lymphocyte trafficking. Annu. Rev. Cell Dev. Biol. 21, 581-603 (2005).
- Qi, H. Extrafollicular activation of lymph node B cells by antigen-bearing dendritic cells. Science. 312, 1672-1676 (2006).
- Germain, R. N. An extended vision for dynamic high-resolution intravital immune imaging. Semin. Immunol. 17, 431-441 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。