Method Article
通过横向流技术检测在血液系统恶性肿瘤患者侵袭性肺曲菌病
摘要
提出了一种快速,准确点保健侵袭性肺曲霉病的试验。侧流技术的优势,使用绑定到一个特定的单克隆抗体黑曲霉抗原分泌在肺部感染。检测血清和支气管肺泡是兼容的,代表了新型疾病诊断的辅助测试。
摘要
侵袭性肺曲霉病(IPA),是一种在血液系统恶性肿瘤患者造血干细胞移植1的发病率和死亡率的首要原因。检测的“近期行动计划”表示诊断的一项艰巨的挑战,并在一个'黄金标准'的情况下,结合临床资料和微生物学和病理学在可行的情况下依靠。 IPA的诊断必须符合欧洲组织的研究和治疗癌症和美国国立过敏和传染病真菌研究组(EORTC / MSG)的定义“证明”,“可能”,“可能”侵入真菌病害的共识研究所。目前,没有核酸为基础的测试外部被验证为“近期行动计划”的检测和聚合酶链反应(PCR),不包括在当前EORTC /味精的诊断标准。
曲霉鉴定组织切片是问题,因为西米在与其他侵袭性真菌病原体3,证明鉴定菌丝形态larities需要隔离在纯培养的病原体。依靠活检标本的可用性文化为基础的方法,但这些都不是生病的病人总是访问,并不总是可行的繁殖产生的文化时获得。
曲霉发病的一个重要特征是血管的入侵,提供机会跟踪真菌免疫试验检测血清和支气管肺泡灌洗(BAL)流体的特性抗原签名分子的一个特点。这导致的发展的Platelia酶免疫(GM-EIA)的检测曲霉半乳甘露聚糖和“泛真菌检测(Fungitell测试)检测保守的真菌细胞壁成分(1→3)-β-D葡聚糖,而不是在缺乏这种成分在细胞壁1,4毛霉菌。是起诉周围这些测试的准确性1,4-6已导致最近开发的新一代单克隆抗体(MAB)为基础的检测1,5感染的替代指标的检测。
桑顿5最近一个曲霉特异性抗体(JF5)的产生,利用杂交瘤技术,其开发利用免疫色谱横向流动设备,点照护(POC)诊断为“近期行动计划”(LFD)。一个LFD的主要优点是它能够探测到活动以来单克隆抗体JF5只有5木耳的积极增长过程中分泌到细胞外的糖蛋白抗原结合。这是一个重要的考虑因素,如肺灌洗诊断“近期行动计划”,自曲霉菌孢子的吸入空气的共同组成部分时,使用的液体。该设备在诊断“近期行动计划”的效用已被证实感染的动物模型,利丰显示改善的敏感性和规范ificity相比的Platelia通用和Fungitell(1→3)β-D-葡聚糖检测7。
在这里,我们提出了一个简单的LFD的过程曲霉抗原检测人体血清和BAL液。它的速度和准确性在血液系统恶性肿瘤患者的近期行动计划“的诊断提供了一种新的辅助测试点照顾。
研究方案
1。血清和支气管肺泡灌洗液的收集,存储和制备
- 收集血液凝固允许在4°C和分装血清于-20°C间商店使用前未经处理的血液样本血清。支气管肺泡灌洗液(BAL),也应在-20°C储存为等分注:存储血清和BAL等分限制为靶抗原的降解样品反复冻融过程中重复检测的潜力。
- 解冻样品和血清和BAL样本彻底涡旋混合1分钟14,000转的离心机。
- 对于常规检测人血清样品,稀释血清与组织培养基(中医)1:1(V / V)。中医组成的RPMI-1640培养基,10%(V / V)胎牛血清,1%(V / V)为200mm L-谷氨酰胺的解决方案,和叠氮化钠作为防腐剂(0.02%W / V)。中期提前做好准备,可在4°C保存几个月。适用于100μL的dilut编辑血清对LFD的。
- 为人类灌洗液,从动物模型灌洗的液体,适用于100μL整齐的样品利丰,没有预先处理。
- 从动物模型的血清,稀释1:2(V / V)的血清磷酸盐缓冲液含4%(W / V)EDTA在沸水浴中,在14000转离心5分钟,3分钟热,适用于100微升利丰设备整齐上清。
2。血清和BAL的横向流动装置中的应用
- 储存在室温(23℃)的横向流动装置。在此温度下,设备的稳定,为12个月。删除设备,从他们的邮袋和水平表面的地方。
- 使用无菌枪头,适用于100微升血清或利落的BAL样本前处理设备释放端口。
- 允许试验,运行15分钟,在室温下,当时的测试结果应记录。注:流体在几秒钟内将是SEEN迁移一直在观察窗的硝酸纤维素膜的毛细作用。
3。 LFD的结果记录和解读
- 利丰组成的内部控制线(塑料外壳上的字母C表示)和测试线(由字母T表示)。控制线应始终出现,不论曲霉菌抗原在血清或BAL样本。这表明,该法已正常运行。
- 曲霉抗原的血清或BAL样本中,检测线也将出现在15分钟的示例应用程序。因为测试线的强度是曲霉抗原目前在样品量成正比,检测线可出现弱阳性(+),中度阳性(+ +)或作为一个强大阳性(+) 。然而,任何积极的测试线,无论强度,表明曲霉样品中的抗原存在。在日E的黑曲霉抗原的情况下,没有检测线就会出现,并把结果为阴性( - )记录。
4。代表结果
代表性的例子是阴性,弱阳性,中度阳性,强阳性,BAL和血清样品LFD的结果如图1所示。
抗原阳性LFD的测试(强和弱)或急性髓细胞性白血病(AML)患者的诊断,根据EORTC /味精诊断标准灌洗流体的负面LFD的测试结果如表1所示。包括在本表中有相应的临床和真菌学(半乳甘露聚糖和文化)的数据,和曲霉菌特异性PCR在圣Bartholomews医院8开发的测试,为每一个病人的结果。对疾病的诊断是基于宿主因素(嗜中性白血球减少症,长期使用糖皮质激素治疗,与其他公认的T细胞immunosuppressants),临床标准和通用的灌洗阳性(这里定义为通用指标值> 0.8)。根据2002年EORTC /味精指引10 12,13和16,患者被诊断为“可能”的宿主因素和临床标准或通用的积极性的基础上的保险业监督。根据修订(2008)EORTC /味精的指导方针,宿主因素和转基因阳性单独或宿主因素和临床标准将不会显示“可能”侵入性真菌感染,除非陪同下,分别从临床数据和真菌的证据支持。 6患者被诊断为“可能”保险业监督在2002年和2008年的指引,因为主机的因素,主要和次要的临床特点和转基因阳性。注,而利丰也不PCR检测既不是目前在EORTC /味精指引,有两个实验和商业半乳甘露聚糖试验表明曲霉抗原和核酸中存在的BAL样本之间的强有力的协议 6例和12 S的。试验证明疗效的利丰和PCR检测诊断国际音标额外的结果,可以发现8约翰逊等人 。
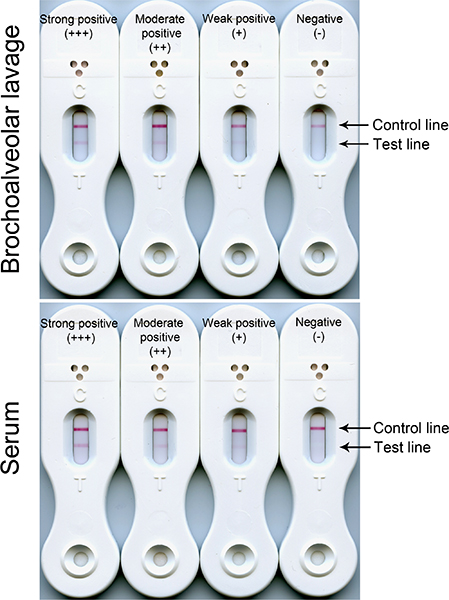
图1负(仅控制线)和阳性(控制和测试线)利丰测试使用血清和BAL结果。测试线反应的强度是成正比的靶抗原在血清和BAL样本的浓度。反应通常从弱(+),通过适度的(+),以强(+)。无论测试线强度,所有三个血清阳性反应,表明侵袭性肺曲霉病,由于曲霉抗原在血液中循环的存在。灌洗反应阳性(弱,中度或强)表示可能在肺部的致病性菌丝萌发的孢子和发展。
| 病人没有。 | 帕蒂耳鼻喉科信息 | 1临床标准 | 灌洗文化2 | 通用汽车环境影响评估指数3 | EORTC / MSG(2002)4 | EORTC / MSG(2008)5 | 曲霉 PCR检测结果 | LFD的结果 |
| 6 | - | 主要CT征象(结节和光环)和一个小 | 负 | 0.9(正面) | 可能 | 可能 | 积极 | 弱阳性(+), |
| 12 | 假定以前的真菌感染 | 没有大的,一个小 | 光滑念珠菌 | 6.43(强阳性) | 可能 | 没有 | 积极 | 强阳性(+ +) |
| 13 | 凝固酶阴性葡萄球菌ylococcus和E。大肠杆菌在血液中 | 没有大的,两个未成年的 | 负 | 0.25(阴性) | 可能 | 没有 | 负 | 负( - ) |
| 16 | 肺部感染 | 3次要标准,包括新的渗透,加上复数积液 | 负 | 0.16(阴性) | 可能 | 没有 | 负 | 负( - ) |
1结节或晕在电脑断层扫描,提示真菌感染
BALF中光滑念珠菌将被视为污染物,因为它是第二个最常见的酵母作为正常人体菌群的一部分分离
3指数> 0.8在通用环境影响评估测试灌洗是曲霉菌感染的指标
4基于2002年EORTC /味精诊断标准“possiblE','可能'或'证明'侵袭性真菌病10
5的基础上修订(2008)EORTC /味精诊断标准“可能”,“很可能”或“证明”侵袭性真菌病2
表1。BAL样本,可能近期行动计划“,并从控制AML患者(没有证据表明感染)急性髓细胞性白血病患者,LFD的测试和EORTC /味精感染的诊断结果。
讨论
“近期行动计划”明确鉴定,只有真正实现从活检标本的病原隔离,但在病得很重的患者往往是不可能恢复合适的样品和曲霉菌是从血很少可收回。而重大进展,已在使用胸部电脑断层扫描,在IPA诊断,提示是“光环”或“空气新月”的招牌,如肺“近期行动计划”的特点,是短暂的,或可以归结为呼吸文物真菌感染或其他11,12。因此,这些数据都辅以血清学技术,目标识别签名分子(GM和β-葡聚糖),真菌,病人的血清中循环,或者是在BAL液,痰液或尿液样本13。虽然这些测试显示令人满意的敏感性,他们缺乏足够的特异性或1,6一定的条件下遭受的干扰。
在这里可以提出LFD的“近期行动计划”的检测测试点照顾'IPA和攻击技术已用于迄今在测试中,检测病毒,细菌,寄生虫和毒素14-19最著名的诊断,怀孕在1988年首次推出单路径测试。在这里介绍的黑利丰, 曲霉菌单克隆抗体JF5固定多孔硝酸纤维素膜捕获区(测试线)。抗鼠免疫球蛋白固定在一个单独的区域膜担任内部控制(控制线)。血清或BALF中除了释放端口,单克隆抗体JF5胶体金释放垫共轭结合靶抗原和复杂的,然后沿通过毛细作用的多孔膜。单克隆抗体JF5固定在捕获区结合JF5-胶体金抗原复合物,造成红色测试线。任何绑定JF5-胶体金共轭结合的内部控制,表明该法已正常运行。这个结果在一个红色的控制线。
测试是快速,仅15分钟车程,到执行,是便宜的相比,基于对转基因和β-葡聚糖检测血清和BAL的测试,并且不需要昂贵的设备或广泛的实验室设施运行。此外,单克隆抗体JF5不交叉反应的药物,或已被证明的污染物,造成假阳性反应在通用汽车和β-葡聚糖试验1,4,6。一个额外的过流诊断测试的主要优势是LFDs能力检测活动,是曲霉菌的浸润性生长的指标。
在利丰过程中的一个关键步骤是需要读取结果,15分钟后血清或BAL样本中的应用设备。测试不应该被留时间超过15分钟,记录结果之前,今年5月偏置结果interpretati上。增强弱的反应将不会延长潜伏期。已被发现感染的动物模型血清热处理,以提高检测的灵敏度。测试的局限性在于它是定性的,并依赖于运营商的积极性的主观评价。根据血清和BAL样本( 图1)抗原含量的检测线强度的变化。然而,任何积极的反应(通过比较已知的底片决定)表示曲霉抗原,因此感染的存在。要限制对LFD检测的主观性,手持设备可允许LFD的测试线强度的量化,使建立抗原检测的阈值20。
利丰未来的发展,包括它的商业化和多重利丰的发展,同时允许其他侵袭性真菌病原体检测使用高度特异性的单克隆抗体3。
披露声明
我们什么都没有透露。
致谢
辉瑞制药有限公司资助博士桑顿表示感谢。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| 黑利丰 | 埃克塞特大学 | 可从相应的要求作者 | |
| 的RPMI-1640 | 西格玛 | R0883 | |
| L-谷氨酰胺 | 西格玛 | G7513 | |
| 胎牛血清 | biosera | S9100 | 在中药制剂,可用于其他来源的胎牛血清 |
| EDTA的 | Fisher Scientific则 | BPE120-1 |
参考文献
- Thornton, C. R. Detection of invasive aspergillosis. Adv. Appl. Microbiol. 70, 187-216 (2010).
- De Pauw, B., Walsh, T. J., Donnelly, J. P. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycology Study Group (EORTC/MSG) concensus group. Clin. Infect. Dis. 46, 1813-1821 (2008).
- Thornton, C. R. Tracking the emerging human pathogen Pseudallescheria boydii by using highly specific monoclonal antibodies. Clin. Vacc. Immunol. 16, 756-764 (2009).
- Pickering, J. W. Evaluation of a (1 -> 3)-β-D-glucan assay for diagnosis of invasive fungal infections. J. Clin. Microbiol. 43, 5957-5962 (2005).
- Thornton, C. R. Development of an immunochromatographic lateral-flow device for rapid serodiagnosis of invasive aspergillosis. Clin. Vacc. Immunol. 15, 1095-1105 (2008).
- Verweij, P. E., Mennink-Kersten, M. A. S. H. Issues with galactomannan testing. Med. Mycol. 44, 179-183 (2006).
- Wiederhold, N. P. Comparison of lateral flow technology and galactomannan and (1 -> 3)-β-D-glucan assays for detection of invasive pulmonary aspergillosis. Clin. Vacc. Immunol. 16, 1844-1846 (2009).
- Johnson, G. L., Bibby, D., Bustin, S. Detection of Aspergillus in broncho-alveolar lavage fluid using two biological assays; evidence of active infection. Mycoses. 54, 130-131 (2011).
- Malani, A. Candida glabrata fungemia: experience in a tertiary care centre. Clin. Infect. Dis. 41, 975-981 (2005).
- Ascioglu, S. Defining opportunistic invasive fungal infection in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international concensus. Clin. Infect. Dis. 34, 71-74 (2002).
- Denning, D. Early diagnosis of invasive aspergillosis. Lancet. 355, 423-424 (2000).
- Greene, R., Shibuya, K., Ando, T., Latge, J. -. P., Steinbach, W. J. . Aspergillus fumigatus and Aspergillosis. , 353-363 (2009).
- Klont, R. R., Mennink-Kersten, M. A. S. H., Verweij, P. E. Utility of Aspergillus antigen detection in specimens other than serum samples. Clin. Infect. Dis. 39, 1467-1474 (2004).
- Iweala, O. I. HIV diagnostic tests: an overview. Contraception. 70, 141-147 (2004).
- Ketema, F., Zeh, C., Edelman, D. C. Assessment of the performance of a rapid, lateral flow assay for the detection of antibodies to HIV. J. Acquir. Immune Defic. Syndr. 27, 63-70 (2001).
- Moody, A. Rapid diagnostic tests for malaria parasites. Clin. Microbiol. Rev. 15, 66-78 (2002).
- Parkash, O. Performance of a lateral flow test for the detection of leprosy patients in India. J. Med. Microbiol. 57, 130-132 (2008).
- Sharma, S. K. Evaluation of lateral-flow Clostridium botulinum neurotoxin detection kits for food analysis. Appl. Environ. Microbiol. 71, 3935-3941 (2005).
- Smits, H. L. Lateral-flow assay for rapid serodiagnosis of human leptospirosis. Clin. Diagn. Lab. Immunol. 8, 166-169 (2001).
- Faulstich, K., Wong, R., Tse, H. . Lateral Flow Immunoassay. , 157-185 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。