需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
微型计算机断层扫描成像制备小鼠冠状动脉血管逆行灌注和灌装
摘要
冠状动脉血管的可视化来推进我们的心血管疾病的认识是至关重要的。在这里,我们描述了在微型计算机断层扫描成像(μCT)准备,与不透X线的硅橡胶(Microfil)灌注小鼠冠状动脉血管的方法。
摘要
了解许多不同的疾病状态的可视化的血管变得越来越重要。虽然一些技术成像血管存在,很少有能够可视化作为一个整体的血管网,同时延伸到了一项决议,包括较小的船只1,2。此外,许多血管铸型技术破坏周围组织,防止进一步分析样品3-5。规避这些问题的方法之一是微型计算机断层扫描(μCT)。 μCT成像扫描分辨率<10微米,是能够产生三维重建血管网,并留下完整的后续分析组织(例如,组织学和形态学)6-11。然而,通过体外 μCT方法成像船只需要,船只可与不透X线的化合物填充。 μCT成像产生血管的准确表示是因为如此,然后船只的可靠和完整的灌装。在这个协议中,我们描述了μCT成像小鼠冠状血管,准备灌装技术。
两个占主导地位的技术填补了冠状动脉血管存在: 在体内通过主动脉插管和逆行灌注(或关闭主动脉弓分支)12-14日 ,或通过Langendorff灌流系统15-17 体外 。在这里,我们描述了在体内主动脉插管的方法已被专门设计,以确保填写所有船只。我们使用低粘度不透X线的化合物称为Microfil填补所有的毛细血管,以及动脉和静脉血管网双方可以通过最小血管灌注。血管灌注使用加压灌注系统的缓冲,然后填写Microfil。为了确保Microfil填补了小的阻力血管,结扎大枝emanating从主动脉,转移到冠状动脉Microfil。一旦填写完成后,挤压Microfil了一些船只,以防止心脏组织的弹性性质,我们结扎灌装后立即访问的主要血管的出口点。因此,我们的技术进行了优化,完整的充填和充填剂的最大保留,使完整的冠状动脉血管网的可视化 - 动脉,毛细血管和静脉的一致好评。
研究方案
1。开始前的准备
- 填写与血管舒张缓冲区(4mg / L的罂粟碱+ 1g / L的腺苷在PBS)或4%多聚甲醛(PFA)在PBS压力灌注装置两侧分别。
- 准备填补1:100肝素0.1毫升(5000U/ml股票)和弯曲针〜120度角的斜面向上1 1/2cc胰岛素注射器(带一个永久连接的29G半“针)。做用1毫升注射器装满0.3毫升饱和氯化钾溶液(1 26G半“针)相同。
2。暴露心脏插管主动脉
- 使用您选择的麻醉麻醉鼠标。 (我们使用过量氯胺酮/二甲苯胺噻嗪的混合物:腹腔注射130毫克/千克氯胺酮和8.8毫克/千克盐水甲苯噻嗪)
- 引脚上解剖托盘,腹面朝上麻醉鼠标。与正中切口打开腹腔,并收回皮肤暴露的器官。向一侧移动肠子暴露后腔静脉(PVC)的地区。
- 肝素溶液注入的PVC。当你提取针,包括针孔,用棉签涂药,以防止渗漏,保持几秒钟,直到PVC壁血栓和密封。等待2-3分钟肝素驱散整个鼠标流通的。
- 解剖的隔膜和肋骨,所以你可以观察心脏的跳动。慢慢注入KCl溶液在PVC,直到心脏逮捕。
- 删除下面的隔膜和消费的鼠标后部的所有机关,保持膜片地区前不变。取出膜片,小心削减附近的PVC膜片近端心的部分,所以很容易找到,在随后的步骤。
- 找到主动脉截止年底。 1前几毫米来回主动脉下方放置一个长6-0编织丝线米的切端缝合一倍自身。削减在一半不再缝合,所以有2件缝合主动脉。插入主动脉(图1A,B)的截止年底的angiocatheter,并配合双结每个缝合举行到位的angiocatheter和防止主动脉内泄漏出来的任何背压。
3。灌注Microfil注射的
- 的angiocatheter连接压力灌注装置(图2),并开始灌注到100-110毫米汞柱的驱动压力泵灌注设备,与扩血管缓冲(图1C)的船只。仔细检查缓冲区确保液通过冠状动脉灌注退出从PVC。继续灌注至少3分钟,或直到退出的PVC流体明确。 (继续下一个步骤,而灌流。)
- 解剖肋骨和脚背面(或删除)胸腔暴露心脏。一旦暴露,是CAreful不要让心脏干到心脏挤压滴缓冲区,从缓冲区纱布浸湿一块。扫清的胸腺暴露主动脉弓。改通过,而不是通过这些较大,低阻力血管(图1D)的冠状动脉结扎三大主动脉分支,使用6-0编织丝线,以确保流体。
- 灌注固定液15分钟的心脏,然后用清水冲洗至少2分钟舒张缓冲区。同时,结扎两个前腔Cavae Microfil防止泄漏注射后的心脏(图1E)。 PVC和主动脉周围的地方缝合,但不灌装后拧紧,直到他们。
- 准备Microfil(试剂表指定),并装入1 ml注射器。剥离托盘填充足够的水,以弥补导管(以免引入气泡从灌注管时,切换到Microfil注射器)。断开灌注APparatus从导管和连接准备Microfil注射器。
- Microfil直到注入主动脉冠状动脉良好的填充是显而易见的动脉(图1F,3A):首先将填补,Microfil“溢出”到毛细血管Microfil的颜色与组织刷新。一旦静脉端,Microfil的疏水性,导致它最初作为独立的领域出现,因为它从较小的船只出现。继续,直到连续列填充静脉注入Microfil。 Microfil是连续的血管内,完整的填充将是显而易见的,它是通过PVC退出。
- 填写完成后,迅速拧紧先前PVC和主动脉周围放置以防止从挤掉船只Microfil心脏组织的弹性性质的缝合线。
- 用湿纱布覆盖的心(从解剖托盘用清水浸泡),以防止其干燥,并让坐在室温约1小时,直到Microfil已聚合。避免对心脏的聚合过程中的任何外部的压力,如解除或转折点的心,试图得到一个早在心脏背面填写船只。这可能从一些船只挤Microfil成的心更弹性的面积,造成的Microfil休息。
- 取出心脏并固定在4%的煤灰发表于4一夜之间°C。然后将其存储在70%乙醇在4°C现在准备μCT成像心脏血管。
4。代表结果
Microfil有效灌注的容器,将有连续的,整个船只不间断Microfil(图3A)。可以用肉眼来判断冠状动脉血管的充盈程度;静脉epicardially位于18,可以很容易地观察(图3A,箭头);动脉,这是更心肌内18,也可以通过心脏的表面(图3A,箭头)可见。毛细血管充盈也是显而易见的,如心脏组织的毛细血管的密度非常高,因此,当的毛细血管填充,心肌组织将刷新Microfil的颜色(图3A,明星)。因此,任何未能填补的血管网络将成为Microfil缺乏(图3B,C),由于明显。
Microfil(图3B中的星号)的不连续性,经常出现因为Microfil的疏水性,会导致它收缩到自身造成充满血管内的“休息”。这些“休息”,可减少血管内的压力,如果维持从心脏血管的出口点,通过适当的领带权衡。其他的不连续性,可造成内microfil的气泡。为了防止空气引入,从灌注AP切换时,确保已完全淹没在水中的angiocatheter paratus的Microfil注射器。如果气泡据介绍,它往往可以被删除,只需继续Microfil灌注,直到泡沫已被推迟通过和冠状动脉血管。
血管网络可能没有填写完全的血管床的一部分,如果被封锁(图3B,箭头)。虽然肝素抑制血液凝块的形成,偶尔堵塞仍有可能出现由于不完整的肝素灌注前开始的程序,或由于其他未知因素。如果发生堵塞,还有的是,据我们所知,没有撞出的堵塞,完成血管填充的方法。如果太少,压力灌浆,Microfil将不能强迫所有的血管床和毛细血管网(图3C),也可以导致不完整的灌装。相反,压力太大,可能会导致毛细血管破裂,渗出到周围的组织Microfil(图3D)。
files/ftp_upload/3740/3740fig1.jpg“ALT =”图1“/>
图1。 Microfil灌注计划概述 。 (一)主动脉和PVC削减约膜片的水平。 (二),升主动脉插管与angiocatheter。 (三)血管舒张缓冲区灌注通过压力灌注设备(图)驾驶的船只,而(四)主动脉弓离断三个主要分支结扎。 (五)通过的冠状动脉灌注,而4%PFA是两个前腔Cavas的结扎。 (六)使用注射器,Microfil通过的冠状动脉灌注,直到它被发现从PVC退出。
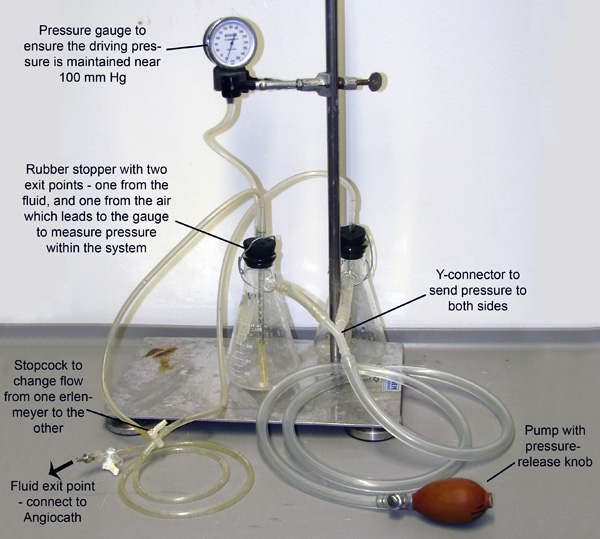
图2。灌流装置。加入两个锥形瓶,每个充满要么舒张缓冲区或4%的煤灰,通过连接到他们的sidearms管加压。该系统是通过人工抽水加压灯泡,压力表连接到瓶,允许压力的监测和维护。小管,延长橡胶瓶塞通过上下将每个烧瓶中的液体。步枪和手枪泵的流体压力进入每个烧瓶出这些小管。管,然后在活塞只允许液体从一个烧瓶流在时间合并。
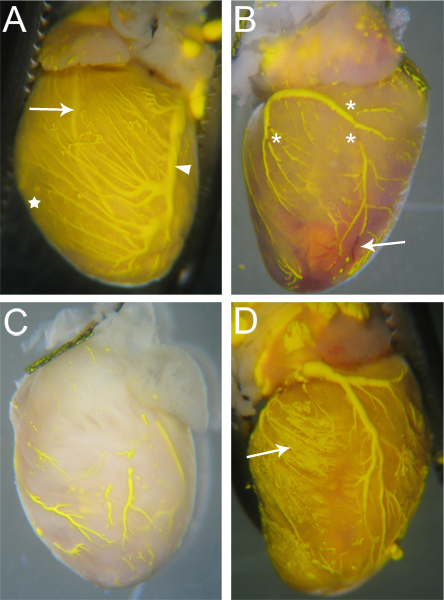
图3。申请Microfilled心中 。 (一)充满良好的船只将很少有休息的Microfil(如有),及心脏组织将色彩的Microfil的颜色填充毛细管(星,并与C比较)。两个动脉(箭头 - 左前降支)和静脉(箭头 - 左冠状静脉)通过心脏表面可见。 (B)在microfil休息(星号),以及在一些血管堵塞的心脏,阻止完整的麦克风rofil渗透。封锁的船只保持红色(箭头),血液灌注过程中不会刷新。 (C)心脏血管不完全充满。请注意该组织一直没有采取的Microfil黄色,表明Microfil没有渗透到毛细血管。 (D)心脏毛细血管爆裂灌浆,造成Microfil泄漏到周围组织(箭头)。
讨论
心脏组织有一个非常高的代谢需求,因此需要不断交付的冠状动脉血管的血液供应养分和氧气。疾病的冠状血管,降低因血管狭窄和阻塞的冠状动脉功能,可导致组织缺血缺氧,并把受影响的病人,心肌梗死和心脏肌肉造成不可弥补的损害的风险。一个更好地了解这些船只的疾病状态是必要的,关键我们的学习能力冠状动脉血管的可视化。在这里,我们提出了一个准备前体内成像小鼠冠状?...
披露声明
小鼠与制度的动物护理和使用华盛顿大学委员会批准,并按照由美国国立卫生研究院(NIH出版物,编号85-23出版实验动物护理和使用指南的方法处理, 1996年修订)。
致谢
我们感谢凯利·史蒂文斯博士的协议,迈克尔·西蒙斯博士,博士硖Hauch,一般性讨论实验室成员的初步试验。
这项工作是由NIH资助HL087513和P01号HL094374支持。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| 1毫升注射器 | 碧迪 | BD-309602 | |
| 1/2cc 29G半永久连接的针胰岛素注射器 | 碧迪 | BD-309306 | |
| 2“×2”的纱布垫 | Med101store.com | SKU的2208 | |
| 24G¾“Angiocath静脉导管 | 碧迪 | BD-381112 | |
| 26G半“表针 | 又长又“碧迪 | BD-305111 | |
| 腺苷 | 西格玛 | A9251 | 舒张缓冲PBS 1G /升(与罂粟碱) |
| 直角格雷夫钳 | 罚款科学工具 | 11052-10 | |
| 棉签涂药:“非无菌 | 卡地纳健康 | C15055-006 | |
| 弯曲的手术剪刀 | 罚款科学工具 | 14085-09 | |
| 解剖立体光源 | 尼康 | 不适用 | 不适用 |
| 解剖托盘,11.5 x 7.5英寸 | 科尔-帕默 | YO-10915-12 | 焦油充满牵制鼠标 |
| 精细弯钳 | 蛇牌 | FD281R | 需要两个 |
| 肝素5000 U / ml的股票 | APP的制药有限责任公司 | NDC的63323-047-10 | 1:100稀释水 |
| 氯化钾 | 费舍尔 | P217 | 在水中的饱和溶液 |
| 氯胺酮(Ketaset),100毫克/毫升股票 | 道奇堡,欧弗兰帕克,堪萨斯州,美国 | NDC 0856-2013-01 | 为130毫克/千克体重,混合二甲苯胺噻嗪在0.9%s艾琳 |
| microfil | 流技术 | MV-122(黄色)。其他颜色的选择也可以。 | 重量1:1混合,固化剂量的10%。只是前准备,以确保它是很好的混合,注射和涡 |
| 非无菌缝合:6-0,编织丝绸 | 哈佛仪器 | 723287 | |
| 罂粟碱 | 美国丽晶公司 | NDC 0517-4010-01 | 在舒张缓冲PBS 4毫克/升(与腺苷) |
| 多聚甲醛 | 西格玛 | P6148 | 准备为4%的解决方案 |
| 灌流装置 | 见图2 | ||
| 弹簧剪刀 | 罚款科学工具 | 15018-10 | |
| 甲苯噻嗪(Anased),20毫克/ GL股票 | 劳埃德实验室 | NADA的#139-236 | 为8.8毫克/公斤体重,氯胺酮,0.9%生理盐水混合 |
参考文献
- Couffinhal, T., Dufourcq, P., Barandon, L., Leroux, L., Duplaa, C. Mouse models to study angiogenesis in the context of cardiovascular diseases. Front. Biosci. 14, 3310-3325 (2009).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Krucker, T., Lang, A., Meyer, E. P. New polyurethane-based material for vascular corrosion casting with improved physical and imaging characteristics. Microsc. Res. Tech. 69, 138-147 (2006).
- Murakami, T. Blood flow patterns in the rat pancreas: a simulative demonstration by injection replication and scanning electron microscopy. Microsc. Res. Tech. 37, 497-508 (1997).
- Icardo, J. M., Colvee, E. Origin and course of the coronary arteries in normal mice and in iv/iv mice. J. Anat. 199, 473-482 (2001).
- Beighley, P. E., Thomas, P. J., Jorgensen, S. M., Ritman, E. L. 3D architecture of myocardial microcirculation in intact rat heart: a study with micro-CT. Adv. Exp. Med. Biol. 430, 165-175 (1997).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, R1267-R1279 (2002).
- Jorgensen, S. M., Demirkaya, O., Ritman, E. L. Three-dimensional imaging of vasculature and parenchyma in intact rodent organs with X-ray micro-CT. Am. J. Physiol. 275, H1103-H1114 (1998).
- Marxen, M. MicroCT scanner performance and considerations for vascular specimen imaging. Med. Phys. 31, 305-313 (2004).
- Zagorchev, L. Micro computed tomography for vascular exploration. J. Angiogenes. Res. 2, 7-7 (2010).
- Heinzer, S. Hierarchical microimaging for multiscale analysis of large vascular networks. Neuroimage. 32, 626-636 (2006).
- Dedkov, E. I. Synectin/syndecan-4 regulate coronary arteriolar growth during development. Dev. Dyn. 236, 2004-2010 (2007).
- Gossl, M. Functional anatomy and hemodynamic characteristics of vasa vasorum in the walls of porcine coronary arteries. Anat. Rec. A. Discov. Mol. Cell. Evol. Biol. 272, 526-537 (2003).
- Rodriguez-Porcel, M. Altered myocardial microvascular 3D architecture in experimental hypercholesterolemia. Circulation. 102, 2028-2030 (2000).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: The Langendorff technique of isolated heart perfusion. J. Mol. Cell. Cardiol. 50, 940-950 (2011).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff---still viable in the new millennium. J. Pharmacol. Toxicol. Methods. 55, 113-126 (2007).
- Toyota, E. Vascular endothelial growth factor is required for coronary collateral growth in the rat. Circulation. 112, 2108-2113 (2005).
- Lavine, K. J., Long, F., Choi, K., Smith, C., Ornitz, D. M. Hedgehog signaling to distinct cell types differentially regulates coronary artery and vein development. Development. 135, 3161-3171 (2008).
- Cheema, A. N. Adventitial microvessel formation after coronary stenting and the effects of SU11218, a tyrosine kinase inhibitor. J. Am. Coll. Cardiol. 47, 1067-1075 (2006).
- Lametschwandtner, A., Lametschwandtner, U., Weiger, T. Scanning electron microscopy of vascular corrosion casts--technique and applications: updated review. Scanning Microsc. 4, 889-941 (1990).
- Schneider, P. Simultaneous 3D visualization and quantification of murine bone and bone vasculature using micro-computed tomography and vascular replica. Microsc. Res. Tech. 72, 690-701 (2009).
- Manelli, A., Sangiorgi, S., Binaghi, E., Raspanti, M. 3D analysis of SEM images of corrosion casting using adaptive stereo matching. Microscopy Research and Technique. 70, 350-354 (2007).
- Alanentalo, T. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nat. Meth. 4, 31-33 (2007).
- Quintana, L., Sharpe, J. . Optical projection tomography of vertebrate embryo development. , 586-594 (2011).
- Walls, J. R., Coultas, L., Rossant, J., Henkelman, R. M. Three-Dimensional Analysis of Vascular Development in the Mouse Embryo. PLoS ONE. 3, e2853-e2853 (2008).
- Chalothorn, D., Clayton, J. A., Zhang, H., Pomp, D., Faber, J. E. Collateral density, remodeling, and VEGF-A expression differ widely between mouse strains. Physiol. Genomics. 30, 179-191 (2007).
- Behm, C. Z. Molecular Imaging of Endothelial Vascular Cell Adhesion Molecule-1 Expression and Inflammatory Cell Recruitment During Vasculogenesis and Ischemia-Mediated Arteriogenesis. Circulation. 117, 2902-2911 (2008).
- Carr, C. L., Lindner, J. R. Myocardial perfusion imaging with contrast echocardiography. Curr. Cardiol. Rep. 10, 233-239 (2008).
- Leong-Poi, H. Assessment of Endogenous and Therapeutic Arteriogenesis by Contrast Ultrasound Molecular Imaging of Integrin Expression. Circulation. 111, 3248-3254 (2005).
- Villanueva, F. S. Microbubbles Targeted to Intercellular Adhesion Molecule-1 Bind to Activated Coronary Artery Endothelial Cells. Circulation. 98, 1-5 (1998).
- Wei, K. Quantification of Myocardial Blood Flow With Ultrasound-Induced Destruction of Microbubbles Administered as a Constant Venous Infusion. Circulation. 97, 473-483 (1998).
- Beckmann, N., Stirnimann, R., Bochelen, D. High-Resolution Magnetic Resonance Angiography of the Mouse Brain: Application to Murine Focal Cerebral Ischemia Models. Journal of Magnetic Resonance. 140, 442-450 (1999).
- Kobayashi, H. 3D MR angiography of intratumoral vasculature using a novel macromolecular MR contrast agent. Magnetic Resonance in Medicine. 46, 579-585 (2001).
- Nezafat, R. B1-insensitive T2 preparation for improved coronary magnetic resonance angiography at 3 T. Magn. Reson. Med. 55, 858-864 (2006).
- Wagner, S., Helisch, A., Ziegelhoeffer, T., Bachmann, G., Schaper, W. Magnetic resonance angiography of collateral vessels in a murine femoral artery ligation model. NMR in Biomedicine. 17, 21-27 (2004).
- Cochet, H. In vivo MR angiography and velocity measurement in mice coronary arteries at 9.4 T: assessment of coronary flow velocity reserve. Radiology. , 254-441 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。