需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
过敏原诱发的哮喘小鼠模型
摘要
过敏性哮喘的实验小鼠模型为研究疾病的发病机制和开发新疗法提供了新的可能性。这些模型非常适合过敏的免疫反应,呼吸道炎症,肺的病理生理测量因素。
摘要
哮喘是一种发病率和死亡率的重要原因,影响约300万世界各地的人们。1超过8%的美国人口有气喘病,患病率增加。与其他疾病,呼吸道过敏性疾病的动物模型,极大地方便2基本病理生理学的了解,有助于确定潜在的治疗靶点,并允许可能的新疗法的临床试验。在几种动物模型过敏性气道疾病已开发,但小鼠模型特别有吸引力,由于成本低,随时可用,和良好的特点,这些动物的免疫系统。3多种转基因株系的可用性进一步提高吸引力这些模型。在这里,我们描述了两种小鼠模型过敏性气道疾病,无论是用人卵清蛋白作为抗原。腹腔注射致敏的初始模型,一个交付ERS的雾化,气管内交付的其他抗原的挑战。这两种模式提供优势互补,相互模仿人类哮喘的主要特征。
哮喘急性发作的主要功能包括夸张的气道反应,如乙酰胆碱(气道高反应性,AHR)刺激和丰富的嗜酸性粒细胞气道炎症。这些也都是过敏原的挑战突出的影响,在我们的小鼠模型,5,6和我们描述了测量他们的技术,从而评价实验操作的影响。具体来说,我们描述都测量气道高反应性,以及评估到气管和肺的炎性细胞浸润的方法7侵入和非侵入性技术。收集支气管肺泡气道炎症细胞,而肺组织病理是用来评估整个器官的炎症标志物。这些技术提供强大的工具,学习的方式,将不会在人类可能哮喘。
研究方案
一,过敏原致敏和挑战( 见图1)
答:对于气管挑战
- 初步敏,雄性或雌性C57BL / 6,BALB / c小鼠(6-8周龄)腹腔0天,第7天再次注入20微克的卵(卵,Sigma-Aldrich公司,圣路易斯,密苏里州)乳化0.2毫升无菌磷酸盐缓冲液(PBS)含有2毫克氢氧化铝(Sigma-Aldrich公司)或2毫克,氢氧化铝0.2毫升无菌作为对照PBS。
- 适当的挑战与抗原(例如,14天,16,18,20)。挑战过程如下。
- 麻醉小鼠腹腔内(IP)注射氯胺酮的混合物(90毫克/千克)和甲苯噻嗪(10毫克/千克)。确保鼠标完全是至少10分钟的麻醉。
- 在45度或更大角度的操作表面。将鼠标保持腹面向上的表面,在头顶部。
- 钩ţ根据前面的门牙hread举行的后脑勺。水平与另一个爪子,以确保气管是直和使用标签的磁带,抱腿。手术部位浸泡于70%酒精和棉签。
- 切口部位的局部应用布比卡因(0.25%的溶液0.1〜0.2毫升)。
- 聂皮肤上用钳子的喉咙,轻轻向外拉。请与垂直小切口手术剪。尽量减少切口的大小。
- 准备用50μL的PBS或0.1%的卵在PBS 1 ml注射器和重复移液器(Tridak步进,托林顿,CT)的插入。一方面采取吸管和使用其他组织举行镊子,暴露气管。
- 担任平行气管尽可能注射器,通过插入气管墙针和注入的解决方案。
- 保持鼠标在垂直方向注射后让时间解决方案,以解决在肺部。
- 轻轻地和无菌密切伤口面积镊子和密封缝合。
- 地方鼠标胸骨下一个加热垫,并允许它恢复,直至完全卧床。恢复后,返回鼠标动物保健设施和日常监察积液,炎症或感染,伤口裂开的迹象,直到伤口完全愈合。
B.通过雾化的挑战
- 敏感0天小鼠腹腔注射20微克的OVA(Sigma-Aldrich公司)在0.2毫升的无菌PBS含2毫克氢氧化铝(Sigma-Aldrich公司)或2毫克氢氧化铝作为控制在0.2毫升无菌PBS乳化。
- 第14天,提高腹腔注射致敏,如上所述。
- 在21 日,22日,23日,24 日和25 日的日子后,初步敏,挑战小鼠暴露30分钟雾化1%OVA或PBS仅通过超声波雾化器(Buxco研究系统,Wilmi的交付ngton,NC)。
- 地方小鼠人造板主室体积描记法室内至少10分钟,他们逐渐适应。
- 地点1毫升0.1%的卵在无菌PBS或无菌PBS,仅在下面的步骤4-6所述,通过喷雾器杯。 Nebulize为30分钟。
- 删除雾化杯和丢弃任何剩余的解决方案。
- 同时使用雾化室,雾化可以执行所有的老鼠。
二。乙酰甲胆碱气道高反应性的测定
答:非侵入性测量全身体积描记法(人造板;研究系统Buxco,威尔明顿,北卡罗来纳州)的气道高反应性
- 允许粉状乙酰胆碱瓶开幕前预热至室温(乙酰胆碱是非常吸湿性,如果允许吸收水分),将成为无用的团块。准备了200毫克/毫升无菌PBS原液,然后进行连续2倍稀释(例如,100,50,25,12.5%和60.25毫克/毫升)。保持解决方案的寒冷。
- 设备设置如下:连接的偏见流入口空气泵,雾化器,气藏采用紧身橡胶管和人造板出口人造板的主要入口。压力传感器连接,以弥合人造板的主要和参考室网点。连接压力传感器提供的电缆与前置放大器,前置放大器连接到电脑上使用特定的数据采集卡。
- 校准的前置放大器,使用该软件,根据制造商的建议。
- 地方小鼠人造板主室体积描记法室内至少10分钟,然后记录基线读数为3分钟(Penhbase)适应环境。
- 地方1毫升无菌PBS在喷雾器杯。 Nebulize 2分钟,然后在干燥阶段,额外的6分钟监测呼吸变量。删除雾化杯,并丢弃任何剩余的PBS。
- 地方1毫升6.25毫克/毫升乙酰胆碱在雾化杯和rEPEAT雾化2分钟加6分的监测周期。
- 12.5,25,50和100毫克/毫升乙酰胆碱重复测量,使用相同的2分钟雾化期间和6分钟监测周期。
- 从商会的小鼠,并返回他们自己的笼子。
- 笔芯喷雾器1毫升无菌PBS杯和运行另一序列冲洗油管。
- 关闭空气流动,拆解,并擦拭干净运行前的动物第二套商会。
B.创检测气道反应性的由电脑控制的换气扇(flexiVent SCIREQ公司,蒙特利尔,加拿大)
- 权衡鼠标和(IP)腹腔注射60毫克每公斤体重的戊巴比妥钠麻醉。
- 足够的麻醉,腹,背部为气管位置的小鼠。
- 用70%乙醇消毒颈部皮肤。我申请布比卡因(0.1〜0.2毫升0.25%的溶液)局部ncision网站。切割和打开的颈部皮肤。分离颈部肌肉,暴露气管。
- 使1 - 2毫米的细剪刀气管切口(一定不能割断气管)和气管导管插入谨慎。配合周围的气管缝合,以防止漏气。
- 在身体体积描记室打下鼠标和插入气管插管连接呼吸机。
- 启动机械通气。设置适当的呼吸频率和潮气/每搏输出量(150次/分和200μL,分别为20-G鼠标)。可以肯定,胸部呼吸机同步移动。如果鼠标“打架”与呼吸器(自主呼吸),注入更多的麻醉剂,并等待同步。
- 基线测量,另外3分钟保持下基线通风小鼠,然后2 ND阻抗测量。设置基线测量这2 ND用于钙ulate平均基线值。
- 窜从呼吸机的吸气流量通过超声波雾化器,提供PBS或乙酰甲胆碱(MCH)挑战(6.25,12.5,25,50和100毫克/毫升)。
- 每个的MCH挑战(6.25,12.5,25,50和100毫克/毫升),提供10毫升/公斤的Vt,在120次/分返回活塞,并采取阻抗测量。
第三。进入空域测量细胞浸润
A.执行支气管肺泡灌洗(BAL)
- AHR的测量后,安乐死与CO 2的鼠标,每个鼠标定位在其背部手术垫。
- 用70%乙醇浸泡的区域。
- 从小腹开始,剖开腹腔,去除皮肤/上部肌肉,肋骨走向向上。
- 一旦肋骨可见,用剪刀小心刺破隔膜。肺部应该远离膈肌折叠。尤其是CAreful尼克肺部或心脏。
- 切去胸腔,充分暴露肺/心(避免削减任何重大的血管保持血液充盈网站)。
- 使用27号针头(屋宇署注射器,富兰克林湖,新泽西州),穿刺心脏脑室,慢慢地小心地拉了回来收集血液的注射器1毫升注射器。照顾,以避免崩溃的心脏。
- 从这个使用标准协议的血液收集的血清。贮存于-70°C,直到使用。
- 切去皮肤和组织从喉咙直到气管透露。扫清足够的组织轻松的工作领域内的(再次,避免削减任何重大的血管)。
- 使用弯剪,切下的气管,清除路径。
- 通过气管下弯钳点,并抓住了一块缝合结束。画下气管的缝合线。
- 配合有关气管宽松的半结,喉咙低。
- carefully切开一个缺口,在套管的大小是足够的,上面的缝合线。
- 小心地插入孔和过去的缝合线的点下气管插管。轻轻地向前推进,直到套管只是出现在入口(太远肺部穿刺肺部;太短:崩溃气管试图恢复灌洗时)。
- 收紧缝合线和完整的结密封解决气管插管。
- 锁注射器套管(含1毫升PBS),并轻轻按压液体进入肺部。肺叶应单独慢慢地膨胀。不要过度填充。对于一个完整的生长鼠标0.9-1.0毫升,是绝对最大。 0.8毫升可能会更安全。锁定注射器松散插管,否则很可能造成损害时,试图以脱离。
- 退出润肺生津。如果遇到阻力(组织吸入套管),按导管慢慢进入肺部的进一步恢复删除。也可以尝试旋转的导管到位。如果所有的ELSé失败,退出套管的一部分的方式;气管是在这种情况下更容易崩溃。
- 脱离插管,注射器存款BAL液容器中,并重复2次,新鲜的PBS溶液。
- BAL解决方案,直到降速置于冰上。
- 使用BAL液和血清在OVA特异性IgE使用市售小鼠IgE的ELISA试剂盒(MD生物制品,圣保罗,MN)来衡量。
B.计数细胞,并确定差异
- 离心机〜600×G BAL液中5分钟,4°C。
- 重悬细胞沉淀在PBS轻轻,并保持在冰上。
- 加载标准纽鲍尔血球稀释细胞悬液,并计数细胞。
- 取出等分2×10 4细胞,在10至40为cytospins微升量。如果有必要,稀释细胞。
- 为cytospins,混合2×10 4细胞,130μLPBS和10μLFBS的。整个细胞混合DOUB细胞离心涂片乐漏斗和700转离心10分钟,采用双cytoslides重复样品。
- 允许的幻灯片,在室温下干燥1小时前染色。
- 染色使用区分快速染色(西门子,纽瓦克,DE)的幻灯片。
四。代表结果
过度挑衅刺激呼吸道收缩是临床哮喘的一个突出特点。我们介绍两种方法测量在OVA致敏和挑战小鼠气道高反应性乙酰胆碱:全身体积描记法( 图2)和强迫振荡使用的flexiVent的系统( 图3)。这两种方法都表明,致敏和挑战,产生在小鼠气道高反应性。
丰富的嗜酸性粒细胞气道炎症是临床哮喘小鼠呼吸道过敏性疾病的另一个突出的特点。在图4所示,致敏和挑战大大增加灌洗可以从呼吸道恢复细胞的总数量。嗜酸性粒细胞,并在较小程度上的数字,特别是增加中性粒细胞。
有证据表明,呼吸道过敏性疾病导致生产过剩IgE抗体致敏抗原。宣传和使用我们所描述的协议卵的挑战,增加治疗的小鼠的血清和BAL液( 图5)IgE水平。
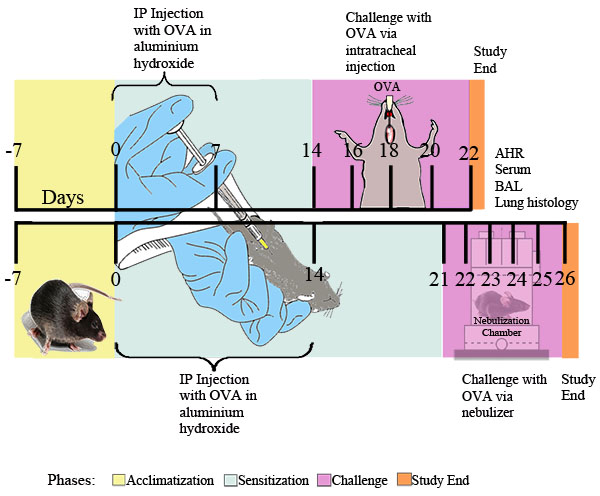
图1。 OVA诱发过敏性哮喘的实验模式。小鼠致敏两次IP 2毫克氢氧化铝乳化卵在0.2毫升的无菌PBS,0.2毫升无菌PBS单独或2毫克氢氧化铝与20微克,在由它指定的时间点挑战OVA或0.1%,无菌PBS溶液或每日前仅30分钟,以PBS或PBS雾化吸入1%卵posure交付通过超声波雾化器(Buxco)。二十四小时后,最后卵暴露,气道反应性测定。随后,BAL液,血液样本,肺细胞,组织收集作进一步分析。
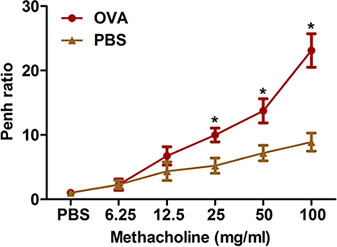
图2。由过敏原引起的气道高反应性的一种非侵入性方法的评估。的小鼠(每组4/group)是致敏和与卵质疑。二十四小时后,最后的挑战,吸入乙酰甲胆碱气道反应性测定采用在协议中所述的整体体积描记法。金边决心和金边的比例(平均超过分为平均金边与乙酰胆碱的8分钟的时间间隔8分钟的时间间隔在用PBS金边)表示。 * P <0.05与的PBS。
iles/ftp_upload/3771/3771fig3.jpg“/>
图3。评估过敏原引起的气道高反应性,侵入性的方法(强迫振荡)。小鼠(每组4/group)以OVA致敏和挑战。二十四小时后,最后的挑战,气道高反应性增加吸入乙酰胆碱的浓度被强迫振荡(flexiVent)在协议中所述的方法确定。 ,A,B)气道阻力)肺顺应性。 * P <0.05与的PBS。
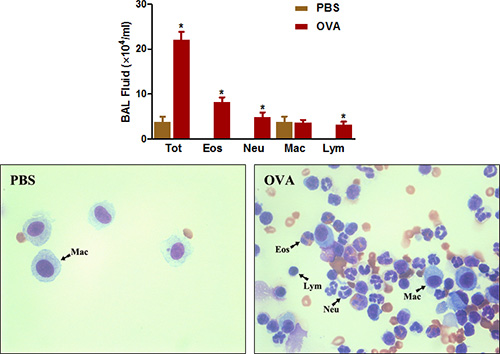
图4。 BAL液细胞计数。小鼠(每组4/group)以OVA致敏和挑战。二十四小时后,最后的挑战,( 前 ) BAL细胞和总细胞计数在协议中所述。 ( 底 )细胞离心涂片幻灯片为Prepared和与变化的快速染色。 TOT =总细胞,Eos的嗜酸性粒细胞;东大=中性粒细胞,MAC =巨噬细胞; LYM =淋巴细胞。 * P <0.05与的PBS。
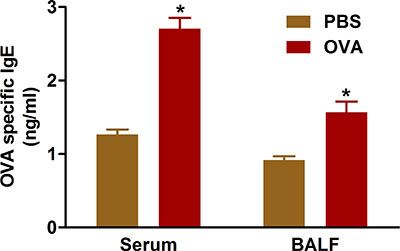
图5。 OVA特异性IgE水平 。小鼠(N = 4/group)以OVA致敏和挑战。二十四小时后,最后的挑战,IGE在BAL液和血清心脏穿刺采集的血液,在协议中所述的测量。 * P <0.05与的PBS。
讨论
呼吸道过敏性疾病的动物模型,为临床哮喘的相关研究提供了重要的工具。许多不同的机型,采用不同的物种和抗原,已被开发出来。鼠标,一个有吸引力的和常用的实验室物种,也为呼吸道过敏性疾病模型提供了优势。9,10虽然这种模式不模仿在各方面的哮喘,11与慢性疾病方面是特别困难的重现, 12,13我们确认这里,许多主要功能是复制。我们还表明,在人类哮喘,这?...
披露声明
亚特兰大VAMC IACUC委员会提出的指导方针和#V010-10根据协议规定,进行动物实验。
致谢
这项工作是由美国国立卫生研究院资助HL093196(RCR)和亚特兰大研究和教育基金会(于AREF)支持。
材料
| Name | Company | Catalog Number | Comments |
| 材料名称 | 公司 | 目录编号 | 评论 |
| 卵清蛋白 | Sigma-Aldrich公司 密苏里州圣路易斯 | A5503 | |
| 氢氧化铝 | Sigma-Aldrich公司 | 239186 | |
| 乙酰-β-methylcholine氯化 | Sigma-Aldrich公司 | A2251 | |
| 戊巴比妥钠盐 | Sigma-Aldrich公司 | P3761 | |
| 全车身体积描记法 (人造板)系统 | buxco研究系统 北卡罗莱纳州威尔明顿 | http://www.buxco.com | |
| FlexiVent | SCIREQ,公司 加拿大蒙特利尔 | http://www.scireq.com | |
| 光学显微镜 | 莱卡微系统公司 水牛城树丛,白细胞介素 | ||
| 细胞离心涂片4 | Thermo Scientific的 北卡罗来纳州阿什维尔, | ||
| 变化的快速染色 | 西门子 纽瓦克,DE | B4132-1A | |
| 重复移液器 | tridak 托林顿,CT | STP4001-0025 |
参考文献
- Braman, S. S. The global burden of asthma. Chest. 130, 4S-12S (2006).
- Akinbami, L. J., Mooman, J. E., Liu, X. Asthma Prevalence, Health Care Use, and Mortality: 2005-2009. National Health Statistics Reports. 32, 2005-2009 (2011).
- Bates, J. H., Rincon, M., Irvin, C. G. Animal models of asthma. Am. J. Physiol. Lung. Cell. Mol. Physiol. 297, 401-410 (2009).
- Drazen, J. M., Finn, P. W., De Sanctis, G. T. Mouse models of airway responsiveness: physiological basis of observed outcomes and analysis of selected examples using these outcome indicators. Annu. Rev. Physiol. 61, 593-625 (1999).
- Epstein, M. M. Do mouse models of allergic asthma mimic clinical disease. Int. Arch. Allergy Immunol. 133, 84-100 (2004).
- Blyth, D. I., Pedrick, M. S., Savage, T. J., Hessel, E. M., Fattah, D. Lung inflammation and epithelial changes in a murine model of atopic asthma. Am. J. Respir. Cell Mol. Biol. 14, 425-438 (1996).
- Martin, T. R., Gerard, N. P., Galli, S. J., Drazen, J. M. Pulmonary responses to bronchoconstrictor agonists in the mouse. J. Appl. Physiol. 64, 2318-2323 (1988).
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Gelfand, E. W. Pro: mice are a good model of human airway disease. Am. J. Respir. Crit. Care Med. 166, 5-8 (2002).
- Shapiro, S. D. Animal models of asthma: Pro: Allergic avoidance of animal (model[s]) is not an option. Am. J. Respir. Crit. Care Med. 174, 1171-1173 (2006).
- Zosky, G. R. Ovalbumin-sensitized mice are good models for airway hyperresponsiveness but not acute physiological responses to allergen inhalation. Clin. Exp. Allergy. 38, 829-838 (2008).
- Nials, A. T., Uddin, S. Mouse models of allergic asthma: acute and chronic allergen challenge. Dis. Model. Mech. 1, 213-220 (2008).
- Wenzel, S., Holgate, S. T. The mouse trap: It still yields few answers in asthma. Am. J. Respir. Crit. Care Med. 174, 1173-1178 (2006).
- Rayamajhi, M. Non-surgical Intratracheal Instillation of Mice with Analysis of Lungs and Lung Draining Lymph Nodes by Flow Cytometry. J. Vis. Exp. (51), e2702 (2011).
- Swedin, L. Comparison of aerosol and intranasal challenge in a mouse model of allergic airway inflammation and hyperresponsiveness. Int. Arch. Allergy Immunol. 153, 249-258 (2010).
- Gueders, M. M. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflamm. Res. 58, 845-854 (2009).
- Zhu, W., Gilmour, M. I. Comparison of allergic lung disease in three mouse strains after systemic or mucosal sensitization with ovalbumin antigen. Immunogenetics. 61, 199-207 (2009).
- Flandre, T. D., Leroy, P. L., Desmecht, D. J. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J. Appl. Physiol. 94, 1129-1136 (2003).
- Hoymann, H. G. Invasive and noninvasive lung function measurements in rodents. J. Pharmacol. Toxicol. Methods. 55, 16-26 (2007).
- Chong, B. T., Agrawal, D. K., Romero, F. A., Townley, R. G. Measurement of bronchoconstriction using whole-body plethysmograph: comparison of freely moving versus restrained guinea pigs. J. Pharmacol. Toxicol. Methods. 39, 163-168 (1998).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。