需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
增长结核分枝杆菌生物膜
摘要
结核分枝杆菌形成药物宽容生物膜时,在一定条件下培养。在这里,我们描述研究方法,培养结核病生物膜和确定药物宽容的,持久的频率。这些协议将在研究药物的耐受性机制的进一步研究有用肺结核 。
摘要
结核分枝杆菌 ,人类结核病的病原体,具有非凡的能力,对环境压力,包括抗生素生存。虽然M 的抗逆性肺结核是肺结核1长到6个月化疗可能的贡献者之一,这种病原体的特征表型相关的分子机制仍不清楚。许多微生物物种进化生存在紧张的环境中具有高度组织性,附着表面,称为生物膜2-4矩阵封装结构的自组装。在社区的增长似乎是首选的生存策略的微生物,并通过遗传成分,调节表面附着,细胞间的通信,以及合成胞外聚合物(EPS)的5,6来实现。用EPS环境胁迫可能是促进,也许在physiolo的gical适应个别杆菌异质微环境内的复杂结构生物膜7。
在最近的一系列文件中,我们建立的研究肺结核和耻垢分枝杆菌有强大的增长倾向有组织的多细胞结构,称为生物膜,它可以容忍50倍以上的抗结核药物异烟肼和利福平8-10最小抑菌浓度研究然而, 肺结核,有趣的是需要特定条件下形成成熟的生物膜,在顶尤其是9:1的比例:媒体以及有限的空气与大气的交换9。专门的环境条件的要求可能被链接到的事实, 研究结核病是预留的人类病原体,从而适应组织环境。本出版物中,我们证明培养的研究方法肺结核生物膜在一个瓶子和一个12孔板格式,这是方便的细菌以及遗传研究。我们已经描述为分枝杆菌弱毒疫苗株的协议7000肺结核,MC 2,删除在两个位点,panCD和RD1,关键是在体内生长的病原体9。这株可以安全地使用在BSL-2遏制结核病的病原体,从而避免了昂贵的BSL-3设施的要求理解基本生物学。与媒体适当的修改,该方法可以延长,生物膜增长的其他分枝杆菌培养物种。
总体而言,一个统一的协议将有助于培养分枝杆菌生物膜感兴趣的研究者在研究结核分枝杆菌的基本弹性特点。此外,日益增长的分枝杆菌生物膜清晰,简明的方法,也将有助于临床和制药INVestigators测试一种潜在的药物的疗效。
研究方案
1。越来越多的研究生物膜在250毫升皑皑的螺丝瓶的结核病
- 培养基的制备:溶解KH 2 PO 4,硫酸镁 0.5g的,4G的L-天冬酰胺,柠檬酸2G,0.05克枸橼酸铁铵,甘油水900ML 60ML0.5克。用NaOH调整pH值至7.0。高压锅,凉爽,刚开始实验前,加无菌水硫酸锌的终浓度为0.1%/ V由于MC 2 7000是泛酸缺陷型菌株还需要在终浓度10μg/mL组泛酸。
注:这是一个标准的用于结核分枝杆菌Sauton媒体组成。然而,如果需要其他专业媒体也可以用于其他分枝杆菌物种。
- 接种准备:成长研究 0.05%Tween-80的一个星期,或0.7至1.0外径600 7H9OADC 结核病 。铜在1:100稀释作为接种的lture可以直接使用。
- 免除Sauton媒体为25mL到250毫升螺杆皑皑聚苯乙烯瓶(康宁)。新增的接种250μl介质,瓶帽,非常紧密,在饱和湿度,37℃培养箱中放置3个星期,不受干扰。观察瓶,每天一次,以确保没有污染。
- 在第三周结束时,拧松瓶盖,让M 的进一步增长结核病在接口。在这个阶段如果盖不松动,然后在容器中的氧气浓度不足会减缓细菌的进一步增长。
2。生长分枝在12孔板结核病生物膜
- 在A1和A2节所述,媒体和接种准备7000 MC 2。
- 混合接种600μl媒体60ML。免除4.5米每个板以及L的混合物。盖上盒盖板。包装用封口膜板数次。 5周在37°C孵育板在加湿孵化原状。
3。确定研究药物宽容,持久的频率结核病生物膜
- 成长研究肺结核在12孔格式,B节的描述生物膜将共约5周。
- 一旦成熟生物膜(孵化后5周)注入到所需浓度下使用的吸管微尖的生物膜的媒体选择抗生素。
注:媒体下方药膜量减少至约3.0mL。因此,调查人员应据此计算药量。
- 涡流轻轻使抗生素彻底在介质中的扩散板。统计学意义的结果,注入antibi耳中的4口井。同时,注入抗生素溶解在其他四口井的相同体积的溶剂,留下的最后四个不变板井。板盖上盖子,并把周围新鲜封口膜板层。放置在孵化器,它所需的时间。
- 在孵化结束,开板和添加吐温80至终浓度0.1%(体积/体积)在每个井。漩涡整个板均匀分散的洗涤剂轻轻。室温孵育15分钟的板块。混合用吸管数次,使整个内容,可以均匀地转移到15mL的锥形管,每口井的内容。
- 在室温为10分钟,在4000rpm降速管的内容。悬浮颗粒,在新鲜的洗涤缓冲液(10%甘油和0.05%Tween-80的PBS)5ML。重复洗涤三倍。颗粒悬浮在洗涤缓冲液5ML。摇杆保持它为O在4 vernight°C。
注:虽然低温最初开发的耻垢分枝杆菌(以减少其生长过程中分散),用于结核分枝杆菌以及生长缓慢的物种最有可能在室温下轻摇没有任何结果的影响。在室温下摇动可能是必要的,如果在BSL-3设施的工作。
- 准备一个装有微尖(2-200μL)削减其广泛年底到适当的大小,装修的注射器和包装封口膜无菌注射器。通过尖端装注射器管的全部内容,并收集新鲜15ML管。重复此步骤5至6次,直到你观察一个相当均质的悬浮。
- 准备的悬浮板的稀释7H11OADC板连续稀释,确定可行的殖民地,在每口井的数量。在37°C间孵化器孵化三周板。确定的频率通过计算处理,溶剂处理板获得的抗生素获得的菌落数比生物膜中的人口,持久cy下载。
4。代表结果
在培养瓶时,M 的增长肺结核可以看出,在第一周结束的瓶子基地。第二周结束时,细菌在空气介质接口的片状增长可以看出,虽然在空气介质界面的增长始终是在第三周结束(图1A)可见。此时的细菌附着在容器内壁也被观察到。文化的发展,从这个点开始,主要发生在空气介质接口。液体表面之下的增长是显而易见的。通常情况下,结构成熟第五周结束(图1B)。如果是长期的培养,结构将开始下沉到容器底部。有趣的是,瓶盖拧紧,直到第三周结束的过程中迈出的重要一步,为不明原因的一个松散的皑皑瓶极大地阻碍开始对接口增长9。
在12孔的格式,在强大的空中媒体接口生物膜被认为是在每个井在五周(图2A)。如果不完全包裹板,然后差生物膜生长观察。在最坏的情况下,蒸发的重要媒体可以拖延的细菌的生长(图2B)。因此,包装纸板是必要的,既可以防止蒸发,以及为生物膜形成的环境(见前款)。
在用这种方法确定的生物膜可行杆菌的数量是相当重现。 M 的响应结核病生物膜与抗生素的性质不同。如利福平的杀菌抗生素,丧失活力如下bipha碳化硅的趋势9。中的活力迅速下降,在三到四个第一天由一个持久的阶段,在小的人口比例仍然完全顽抗抗生素,不论浓度抗生素或曝光时间。图3显示了成熟生物膜可行杆菌后7天接触到50μg/mL的利福平(比MIC高出50倍)。

图1A提前出现分枝结核病菌3周的潜伏期后对细菌的空气介质接口。

图1b。成熟的研究生物膜结核病在5周的潜伏期后的空气介质接口。
820/3820fig2A.jpg“/>
图2A。5周老M 的生物膜肺结核增长12以及格式。
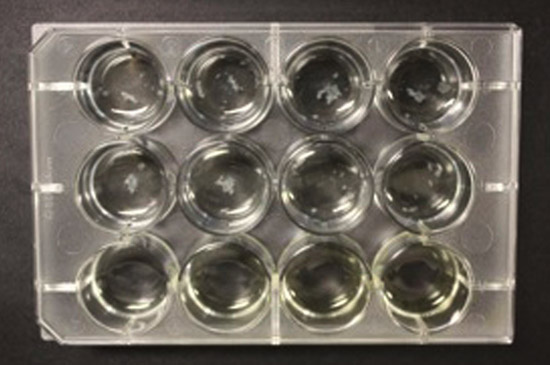
图2B。无封口膜结核分枝杆菌生物膜生长在12孔板一个失败的尝试。
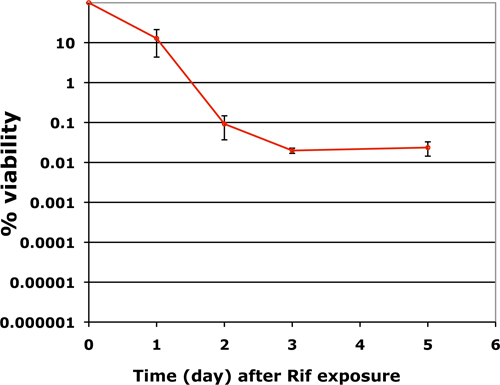
图3。一个有代表性的情节,显示研究药物宽容,持久的频率结核病生物膜生长在12孔格式和暴露利福平50μg/ml的七天。
讨论
肺结核(TB), 结核分枝杆菌感染引起的,仍然是一个全球公共卫生的重大威胁。估计无症状感染的病原体之一的人口占世界人口近三分之一,约900万新病例出现在诊所,每年有活动性肺结核约1.7万人死于感染每年11症状。巨大的疾病负担主要是由于缺乏疫苗和一个高度复杂的化疗,涉及多重的方案,超过六至九个月的管理作出贡献。长期化疗在很大程度上归因于表型的小亚群的病...
披露声明
我们什么都没有透露。
致谢
这项工作进行了卫生研究所和美国肺脏协会的财政支持。
材料
| Name | Company | Catalog Number | Comments |
| Incubator | VWR international | Model # 1923/25 | |
| Polystyrene culture bottles | Fisher Scientific | 03-374-300 | |
| 12-well tissue culture plate | VWR international | 62406-165 | |
| 50-mL conical tubes | VWR international | 89039-660 | |
| Rocker | Thermo Fisher Scientific, Inc. | 57019-662 | |
| Chromatographic refrigerator | VWR international | 55702-520 | |
| petri dish | VWR international | 25384-342 | |
| KH2PO4 (monobasic) | EMD Millipore | PX1565-1 | |
| MgSO4 | Fisher Scientific | M65-500 | |
| L-asparagine | Sigma-Aldrich | A4284-100G | |
| citric acid | Sigma-Aldrich | C1857-100G | |
| ferric ammonium citrate | Sigma-Aldrich | F5879-100G | |
| glycerol | EMD Millipore | GX0185-5 | |
| NaOH | Sigma-Aldrich | S8045-500G | |
| ZnSO4 | Sigma-Aldrich | Z4750-500G | |
| D-pantothenic acid | Sigma-Aldrich | P2250-25G | |
| Difco Middlebrook 7H9 Broth | BD Biosciences | 271310 | |
| Middlebrook OADC Enrichment | BBL | 212351 | |
| Tween-80 | Fisher Scientific | T164-500 | |
| 250mL storage bottle | Corning | 430281 | |
| 12 well plates | Falcon BD | 353043 | |
| rifampicin | Sigma-Aldrich | R3501-1G | |
| methanol | JT Baker | 9070-05 | |
| 10mlLsyringe | BD Biosciences | 301604 | |
| 1-200μL pipet tips | VWR international | 89079-458 | |
| parafilm M | VWR international | PM-996 | |
| 15mL centrifuge tube | Greiner Bio-One | 188-285 | |
| Difco Mycobacteria 7H11 Agar | BD Biosciences | 283810 | |
| NaCl | Fisher Scientific | BP358-1 | |
| KCl | Sigma-Aldrich | P9333-500G | |
| Na2HPO4 (dibasic) | Sigma-Aldrich | S0876-500G |
参考文献
- Saltini, C. Chemotherapy and diagnosis of tuberculosis. Respir. Med. 100, 2085-2097 (2006).
- Hall-Stoodley, L., Stoodley, P. Biofilm formation and dispersal and the transmission of human pathogens. Trends Microbiol. 13, 7-10 (2005).
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Blankenship, J. R., Mitchell, A. P. How to build a biofilm: a fungal perspective. Curr Opin Microbiol. 9, 588-594 (2006).
- Henke, J. M., Bassler, B. L. Bacterial social engagements. Trends Cell Biol. 14, 648-656 (2004).
- Kolter, R., Losick, R. One for all and all for one. Science. 280, 226-227 (1998).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Ojha, A. GroEL1: a dedicated chaperone involved in mycolic acid biosynthesis during biofilm formation in mycobacteria. Cell. 123, 861-873 (2005).
- Ojha, A. K. Growth of Mycobacterium tuberculosis biofilms containing free mycolic acids and harbouring drug-tolerant bacteria. Mol. Microbiol. 69, 164-174 (2008).
- Ojha, A. K., Trivelli, X., Guerardel, Y., Kremer, L., Hatfull, G. F. Enzymatic hydrolysis of trehalose dimycolate releases free mycolic acids during mycobacterial growth in biofilms. J. Biol. Chem. 285, 17380-17389 (2010).
- Dye, C., Lonnroth, K., Jaramillo, E., Williams, B. G., Raviglione, M. Trends in tuberculosis incidence and their determinants in 134 countries. Bull World Health Organ. 87, 683-691 (2009).
- Jindani, A., Dore, C. J., Mitchison, D. A. Bactericidal and sterilizing activities of antituberculosis drugs during the first 14 days. Am. J. Respir. Crit. Care Med. 167, 1348-1354 (2003).
- Carter, G., Wu, M., Drummond, D. C., Bermudez, L. E. Characterization of biofilm formation by clinical isolates of Mycobacterium avium. J. Med. Microbiol. 52, 747-752 (2003).
- Hall-Stoodley, L., Lappin-Scott, H. Biofilm formation by the rapidly growing mycobacterial species Mycobacterium fortuitum. FEMS Microbiol. Lett. 168, 77-84 (1998).
- Alibaud, L. Temperature-dependent regulation of mycolic acid cyclopropanation in saprophytic mycobacteria: role of the Mycobacterium smegmatis 1351 gene (MSMEG_1351) in CIS-cyclopropanation of alpha-mycolates. J. Biol. Chem. 285, 21698-21707 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。