需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
大鼠胚胎神经细胞的分离和培养:一个快速议定书“
摘要
我们描述了一个快速的方法分离和培养的海马和皮层神经细胞从老鼠胚胎。该协议允许在几乎纯神经细胞需要我们进行实验。
摘要
我们描述了一个快速的方法分离和培养E15-17大鼠胚胎海马或皮层神经元。程序可以成功地应用于老鼠和人类的初级神经元和神经祖细胞的分离。分离神经元无血清培养基均保持在几个星期。这些文化可用于核转染,免疫细胞化学,核酸制备,以及电。年老的神经细胞,也可以慢病毒转导效率,有效地减少,磷酸钙或脂质的方法,如脂质体转染。
研究方案
1。聚-D-赖氨酸(PDL)的制备
- 加入5毫升无菌DDH 2至5毫克的客运专线,获得1毫克/毫升的原液。
- 混合原液吹打几次。
- 立即使用或储存聚-D-赖氨酸的解决方案,在2-8°C。
2。聚-D-赖氨酸(PDL):涂层塑料细胞培养皿
- PDL原液稀释用无菌DDH 2 O的终浓度为10微克/毫升。
- 吸取足够的解决方案,覆盖养殖水面面积为60毫米的菜(3毫升)到60毫米的菜。
- 轻轻摇动,以确保甚至文化表面的涂层。
- 涂层板在室温(RT)孵育过夜。
- 第二天,通常一天的清扫,清除吸聚-D-赖氨酸的解决方案,并用3毫升无菌DDH 2 O简要重复此步骤。第二洗净后,完全去除水中的共同愿望。
- 板可以存储长达三个星期在4°C。
3。聚-D-赖氨酸(PDL)和层粘连蛋白:两玻片制备及玻璃涂料
- 在无菌DDH 2 O的混合客运专线(1毫克/毫升)和层粘连蛋白(1毫克/毫升)储备溶液至终浓度为10和5微克/毫升,分别。
- 吸取足够的成井的玻璃两腔的幻灯片,涵盖文化表面积(1毫升),每2以及双室玻璃幻灯片以及解决方案。
- 轻轻摇动,以确保甚至文化表面的涂层。
- 涂层板,在室温下孵育过夜。
- 第二天,删除聚-D-赖氨酸,层粘连蛋白涂层解决方案,通过吸入和简要洗两次以1毫升无菌DDH 2 O第二洗净后,完全去除水中的共同愿望。
- 玻片可以存储长达三个星期在4°C。
注:任何玻璃室幻灯片,可涂跟随着g此协议。我们经常使用的两玻片,因为每张幻灯片提供的控制测试实验设置(如未经处理与治疗,未转染与转染)。
4。神经解剖和文化
- 在37℃水浴中预热的下列试剂:
- 其原来的100毫升瓶装TrypLE快。
- Neurobasal/B27完全培养基( 见表一)。成交量回暖取决于电镀(如30毫升十60毫米镀菜)菜肴的数目。
- 4个60毫米培养皿和13毫升至15毫升的BD猎鹰高清晰度聚丙烯锥形管加入3毫升的冷休眠E解决方案。
- 添加25-30毫升冷夹层中( 见表二 ,个人通信,博士奥林匹亚梅乌奇)三个100毫米培养皿。这些板块,含有大量的中等,将用于冲洗后立即胚胎去除羊膜囊(步骤4.7和4.8)。
- 安乐死的CO 2孕鼠E17的定时根据公共卫生服务政策上的人文关怀和实验动物的使用和在制度上批准的动物护理和使用协议。
- 喷用70%乙醇的小腹和中间穿过一双剪刀暴露子宫和胚胎的皮肤和肌肉。
- 所有胎儿取出,并放置在无菌的100毫米菜含有超过冷夹层中(25-30毫升,见步骤4.3)。
- 削减使用的小剪刀从羊膜囊的胚胎,他们将在第二个100毫米冷夹层介质的菜。
- 在室温下轻轻倾斜5-10秒100毫米的菜洗胚胎。然后,漂洗胚胎转移到第三个100毫米的菜,含夹层介质。清洗多余的介质通常足以消除血液中的所有痕迹。然而,如果NEC需要的话,洗更多的时间,用100毫米的菜新鲜,含25-30毫升冷夹层介质。
- 使用体视显微镜和弯曲钳,每只老鼠胚胎的大脑提取拉出皮肤和颅骨。放置在一个60毫米的菜肴与冷休眠大肠杆菌(通常情况下,与菜不超过5%的大脑)置于冰上这些板块的整个大脑。
- 在一次菜,在解剖显微镜下,半球分开的,孤立的大脑皮质,消除脑和脑膜。
- 可选:沿中线切大脑,提取海马,并按照以下步骤分离海马神经元。
- 收集了15毫升清楚的锥形管含有13毫升冷休眠大肠杆菌的离开大脑皮层上冰,直到完成所有的夹层中的所有解剖皮质。由于其体积小,解剖海马可以在1.5毫升的Eppendorf管,而不是一个15毫升的管收集。如果需要在这一步的皮质,或海马可放置在cryotube含有1毫升的小瓶的Hibernate E + 2%B27的+庆大霉素(50微克/毫升)+ Fungizone 2-4皮质或2-4小瓶海马的比例(250毫微克/毫升)。脑组织,可存放于4℃在黑暗中长达一个星期(稍后的时间还没有被测试)。当需要时,用细钳脑组织转移至15毫升管中的Hibernateé,然后按照下面的协议,分离神经元。
- 管转移到组织文化引擎盖。允许皮质解决管底部,然后小心取出上清液。
- 15毫升锥形管加入13毫升的新鲜休眠E,允许的皮质定居在试管底部,小心取出上清液。重复此步骤2次以上,最后一次洗涤后,小心地取出所有的媒体。
- 酶消化,加入1-2毫升(根据数量的皮质;使用海马隔离)大脑皮质温暖训练班ypLE快。用封口膜密封管帽和管漂浮在37℃水浴10分钟。
- 喷用70%乙醇管前盖打开,并添加10毫升的Hibernate E.允许皮质定居在试管底部,去除上清。重复此步骤三次洗出TrypLE快。在最后一步,小心地取出所有介质。
- 轻轻磨碎(4-5倍)在2毫升的Neurobasal/B27完全培养基的皮质,用火抛光玻璃巴斯德(直径约1毫米)。要小心,以避免气泡。
- 重复使用无菌玻璃巴斯德吸管直径较小(即约1/2-3/4毫米直径的吸管)另外的4-5倍。不要使用巴斯德吸管比这个小,它会破坏细胞。
- 允许组织残片(一般很少,如果有的话)来解决。
- 转移到一个新的15 ml管上的单细胞悬液,留下组织落户件的。毛皮疗法稀释细胞悬液与Neurobasal/B27完全培养基10-12毫升。
- 拌匀,加入10μL细胞悬液490μl50X 1.5毫升的Eppendorf管中的计数解决方案( 见表三 )的稀释细胞计数。
- 对PDL涂层板板细胞密度在5.0×10 4 /厘米2。如果要执行核转,我们建议在高浓度(8-10×10 4 /厘米2)电镀细胞。
- 通常情况下,我们解剖实验9-10%的胎儿,约13×10 6个神经元E17的胎儿从每个派生。如果需要更多的胚胎,确保整个过程不会持续了两个多小时。
- 如果需要隔离,24小时后,10微米胞嘧啶β-D-阿糖(阿糖胞苷)可添加到每一道菜,为了防止神经胶质增生。然而,这一步是不需要自Neurobasal/B27介质,抑制神经胶质增生每制造商的建议(Invitrogen公司/ Gibco公司)。
- 神经元可用于经过4-5天, 在体外实验中,虽然确切时间取决于所需的分化阶段。我们有没有生存的显着减少( 图1)长达4周的培养神经元。
- 对于扩展的培养,每周更换培养液,用新鲜配制Neurobasal/B27完全培养基。
5。代表结果
玻璃玻片上培养的神经细胞受到免疫组化。 图1显示了固定后5天在文化和反MAP-2抗体,表明神经元突起immunolabeled皮质神经元的典型形象。
图2显示了文化3周后大鼠海马神经元的形象代表。一个完全分化的细胞,神经元形态,突出了MAP-2我mmunolabeling(MAP-2神经元的标记,AP-20单克隆抗体的克隆小鼠,基因TEX,尔湾,加利福尼亚州),按照标准的程序,如先前所述1。尼康的Eclipse E400直立荧光配备鄂西水族相机(Qimaging),机动Z轴,SlideBook5收购/反卷积软件(智能影像创新公司,丹佛,CO)显微镜图像的可视化。一系列每一个人的图片三维图像解卷积到一个二维图像和调整的信号,切断附近的最大强度,提高分辨率来解决。
图3显示了神经细胞的纯度。蛋白裂解DIV7大鼠神经细胞(CTX),并从人类神经母细胞瘤(GBM)的情况下获得的。正如预期的那样,是强烈的神经元蛋白MAP-2和星形细胞标志物GFAP阴性阳性神经细胞裂解的大紫荆勋章的蛋白质裂解为负f或地图-2阳性GFAP的。
虽然在我们的协议,我们已经使用几年解剖和冲洗介质的Hibernateé,最近我们已经探索它的一个额外和非常实用的使用,保存为进一步利用脑组织。 图4说明5(DIV5) 在体外天保持在4°C,在Hibernateé+ B27的一个星期后,他们从胚胎的原始解剖皮质分离的大鼠皮层神经元的文化。如前所述,PDL和层粘连蛋白涂在玻璃室幻灯片神经元接种。获取的图像解卷积使用SlideBook5收购/反卷积软件如上所述( 图2)。

图1。(Amaxa,龙沙,Walkersville,博士)pmaxGFP nucleofected与地图immunolabeled的皮质神经元的形象代表-2抗体,红色。原放大倍率100倍。
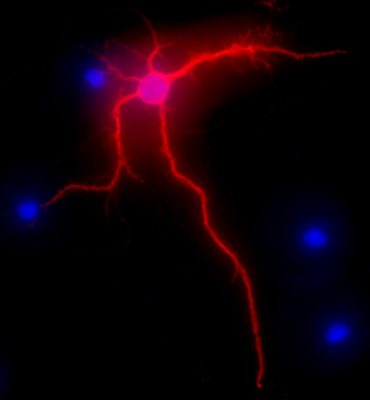
图2显示地图-2免疫标记,海马神经元培养3周后,红色的代表形象。 DAPI染色,在蓝色的,显示出细胞的细胞核。原来的40倍放大倍率。

图3 Western blot分析显示神经细胞培养的纯度。 30微克的大鼠神经细胞和人类的大紫荆勋章蛋白裂解分离,电泳和Western blot分析,按照标准程序1。抗MAP-2是从细胞信号转导(丹弗斯,马萨诸塞州)兔多克隆抗GFAP抗体单克隆鼠标Chemicon公司(Millipore公司,比尔里卡,马萨诸塞州),小鼠单克隆抗-GRB2抗体(BD转导实验室火花,MD)。 GRB2被用作装载控制。

图4 在体外 5天。代表照片(DIV5)留在皮质大鼠皮质神经元的Hibernate E +在4°C一周后,他们解剖B27的一个。 A)的双室玻璃幻灯片上培养的神经元相衬。原放大倍率20X。二)免疫荧光显示神经元的过程中MAP-2的表达,在绿色文化为星形细胞标记物GFAP阴性。 DAPI染色,在蓝色,表明细胞的细胞核。原来的40倍放大倍率。
Access restricted. Please log in or start a trial to view this content.
讨论
大鼠海马和皮层神经元的解剖和文化在这里介绍的方法,允许使用在化学上定义的介质( 图3)增长了近纯神经细胞进行实验。虽然近纯无血清培养基中培养神经元的协议已先前所述的2,3,4,也有我们的方法中作出了重要的变化。不同于传统的协议(即银行家等)5,我们已取代TrypLE快速,更温和的分解酶胰蛋白酶。我们也省略了两个步骤,这可能会影响神经细胞的完?...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有利益冲突的声明。
致谢
我们感谢社论援助乔娜埃利斯。项目描述奖号码R01MH079751(主持人:F.佩鲁齐)从国家心理健康研究所的支持。内容完全是作者的责任,并不代表国家精神卫生研究所或国立卫生研究院的官方意见。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 试剂 | 浓度 | ||
| 的Neurobasal | 98% | ||
| B27的 | 2% | ||
| glutamax | 0.5毫米 |
表一Neurobasal/B27完全培养基 。
| 试剂 | 浓度 |
| 葡萄糖 | 16毫米 |
| 蔗糖 | 22毫米 |
| 肝素钠 | 10毫米 |
| 氯化钠 | 160毫米 |
| 氯化钾 | 5毫米 |
| 的Na 2 HPO 4 | 1毫米 |
| KH 2 PO 2 | 0.22毫米 |
| 庆大霉素 | 50微克/毫升 |
| fungizone | 250毫微克/毫升 |
| pH值 | 7.4 |
| 渗透压 | 320-330 mOsm |
表二。夹层介质 。
| 试剂 | 量(μl) |
| Neurobasal/B27完整的介质 | 240 |
| 台盼蓝染色0.4% | 250 |
| 总 | 490 |
表三。 50X计算解决方案 。
表四。特定的试剂 。
| 试剂 | 公司 | 猫。数 |
| Hibernate的é | brainbits | 767171 |
| 的Neurobasal | Gibco公司,Invitrogen公司 | 21103-049 |
| B27的 | Gibco公司,Invitrogen公司 | 17504-044 |
| fungizone | Gibco公司,Invitrogen公司 | 15290-018 |
| 硫酸庆大霉素 | Sigma Aldrich公司 | G1264 |
| glutamax 200毫米 | Gibco公司,Invitrogen公司 | 35050 |
| TrypLE快递W / O酚红 | Gibco公司,Invitrogen公司 | 12604 |
| 胞嘧啶β-D-阿糖盐酸盐 | Sigma Aldrich公司 | C6645 |
| 聚-D-赖氨酸 | Sigma Aldrich公司 | P6407 |
| 层粘连蛋白1毫克/毫升 | Millipore公司 | CC095 |
| 肝素钠 | Sigma Aldrich公司 | H3375 |
| 台盼蓝染色0.4% | Gibco公司,Invitrogen公司 | 15250 |
| 设备 | 公司 | 猫。数 |
| 立体显微镜 | 奥林巴斯 | SZ61 |
| 大钳 | 福斯特 | 11022-14 |
| 细尖镊子 | 莫里亚 | MC40B |
| 微精尖镊子 | 莫里亚 | MC31 |
| 剃刀般锋利的剪刀 | roboz | RS-6820 |
| 微解剖剪刀 | 福斯特 | 91460-11 |
| 微解剖弯剪刀 | 福斯特 | 14067-11 |
| 玻璃2玻片 | 实验室康 | 154461 |
| 60毫米菜 | 屋宇署猎鹰 | 353002 |
| 100毫米菜 | 康宁 | 430167 |
| 15毫升管 | 屋宇署猎鹰 | 352099 |
| 1.5毫升冷冻管瓶 | NUNC | 375353 |
表五,特殊设备 。
参考文献
- Aprea, S. Tubulin-mediated binding of human immunodeficiency virus-1 Tat to the cytoskeleton causes proteasomal-dependent degradation of microtubule-associated protein 2 and neuronal damage. J. Neurosci. 26, 4054-4062 (2006).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Serum-free culture of rat post-natal and fetal brainstem neurons. Brain Res. Dev. Brain Res. 120, 199-210 (2000).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Method for serum-free culture of late fetal and early postnatal rat brainstem neurons. Brain Res. Brain Res. Protoc. 6, 91-99 (2001).
- Brewer, G. J. Serum-free B27/neurobasal medium supports differentiated growth of neurons from the striatum, substantia nigra, septum, cerebral cortex, cerebellum, and dentate gyrus. J. Neurosci. Res. 42, 674-683 (1995).
- Banker, G., Goslin, K. Culturing nerve cells. , The MIT Press. Cambridge. (1998).
- Eletto, D. Inhibition of SNAP25 expression by HIV-1 Tat involves the activity of mir-128a. J. Cell Physiol. 216, 764-770 (2008).
- Gualco, E. IGF-IR-dependent expression of Survivin is required for T-antigen-mediated protection from apoptosis and proliferation of neural progenitors. Cell Death Differ. 17, 439-451 (2010).
- Gage, F. H. Survival and differentiation of adult neuronal progenitor cells transplanted to the adult brain. Proc. Natl. Acad. Sci. U.S.A. 92, 11879-11883 (1995).
- Keyser, D. O., Pellmar, T. C. Synaptic transmission in the hippocampus: critical role for glial cells. Glia. 10, 237-243 (1994).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 (1997).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。