需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
阈上的神经活动的单细胞和单穗的分辨率的光学的方法记录
摘要
了解脊椎动物的中枢神经系统的功能,需要从许多神经元的录音,因为皮层的功能所产生的,在神经元中的人口水平。在这里,我们描述了一个光学的方法来记录阈上的神经活动与单细胞和单穗分辨率,抖动随机存取扫描。这种方法记录体荧光钙信号与高时间分辨率从多达100个神经元。最大似然的算法deconvolves的基本阈上的神经活动,自体荧光钙信号。这种方法可以可靠地检测具有较高的检测效率和低误报率的尖峰,可以用来研究神经元群和。
摘要
在脊椎动物的中枢神经系统的信息的信号往往是人口,而不是单个神经元的神经元。传播的阈上扣球活动涉及人群的神经元。直接寻址皮质功能的实证研究,因此需要高分辨率的神经元群体的录音。在这里,我们描述的光学方法和去卷积算法从多达100个神经元,单细胞和单穗分辨率记录神经活动。这种方法依赖于检测的瞬态与大脑皮质神经元的阈上电尖峰(动作电位)在体细胞内的钙离子浓度增加。高时间分辨率的光学记录的是,实现快速的随机访问扫描技术使用声光偏转器(AODs患者)1。双光子激发的钙敏感染料的查询结果在较高的空间分辨率在不透明的脑那朵起诉2。尖峰的荧光钙录音重构实现由最大似然方法。同时电和光学记录表明,我们的方法可以可靠地检测峰值(> 97%峰值检测效率),低利率的假阳性棘波检测(<0.003尖峰/秒),时间精度和高(约3 ms)3。可以用于这种秒杀检测的光学方法, 在体外和在体内的麻醉动物3,4的记录神经活动。
研究方案
1。光学装置(图1)
- 对于双光子激发的飞秒脉冲的红外脉冲激光系统被使用。高激光输出功率(在某些情况下,在890 nm波长大于2W)介绍了该系统的光学元件,以抵消巨大的损失。
- 由两个棱镜组成的甲prechirper系统赋予负的群速度色散(GVD)到激光脉冲之前的声光偏转器(季节AOD)补偿时间色散引入由AODs患者1。
- 两个季节AOD与大孔(10毫米的40倍水浸物镜NA 0.8)的激光束偏转,在两个维度。
- 100园/毫米的反射衍射光栅被置于13厘米背后的季节AOD补偿引入的季节AOD的空间色散,当使用短的激光脉冲。
- 的激光束被引导与两个中继望远镜到一个直立microsco的相机端口PE。
- 鸢尾花被放置在固定的时间间隔的光学元件的对准。
- 的二色性分束器的前面的目标发送到试样的红外激发光,并反映到检测器上的试样的荧光。
- 外延和transfluorescence的检测器(光电倍增管,光电倍增管)通过的目标和收集荧光信号 - 如果适用 - 通过冷凝器。
- 有色玻璃滤光片(BG-39,3-5毫米)被放置在检测器的前面,以防止激发光到达检测器。
- 数字 - 模拟转换器电路板(156.25 kHz的时钟速率),这反过来又驱动电压控制振荡器配备由计算机控制的AOD的偏转角。
- 从光电倍增管的信号通过一个低通巴特沃斯滤波器(截止频率为100千赫)中继,由一个模拟 - 数字转换器(156.25 kHz的时钟速率)之前被存储在数字化进行分析的计算机。
- 对准和电噪声通过记录荧光信号的分布的激光的光带和不带测试,在低和高的光电倍增管的增益,以及带和不带指示灯。扫描仪被正确设置和屏蔽时的荧光信号在高增益和带指示灯的分布的宽度比其他分布的荧光信号(图2)的宽度大得多。
2。实验过程
- 抖动随机存取扫描检测依赖于细胞内钙增加。甲大量的神经元,可以使用大剂量注射到神经组织5的酯形式的钙指示器(例如俄勒冈绿488 BAPTA-1 AM)被染色。
- 从每一个神经元胞体的几个地点都记录下来,很短的时间(“抖动”4个位置,每个位置6.4μs的电子= 25.6微秒记录,时间在每个周期中,图的每个神经元。 3C)。选择感兴趣的神经元组成一个完整的帧的256×256像素收购(图3A)。手动选择每个胞体的中心,以被记录在此图像。控制软件会自动添加3个点,围绕这一中心的距离在2μm。
- 荧光信号被记录在每个周期中,从各40个神经元(图3B)。这个过程被重复的整个持续时间的一个记录(5第二记录= 3255周期,1周期= 1.536毫秒)。
3。在线软件工具,以最大限度地提高棘波检测效率
- 穗从荧光体钙信号的检测依赖于一个高信号对噪声比(S / N)的体细胞荧光钙信号。通过增加激发光强度,可以实现高的S / N。然而,激发光强度,只能提高到一定的限度,因为光损伤。棘波检测是在一个很小的WINDO瓦特只激发强度的荧光信号具有高的S / N,但仅观察到非常小的光损伤3。为了确保所记录的信号是高的尖峰电压检测窗口内,我们在录音监控率(见方程式3.2)和下降的基线荧光光子使用在线分析。
- 每个神经元计算光子率约,从基线噪音很短的时间窗口(100-200)。的光子数(Nλ)和光子率(λ=λ/Δt的)分布拟合(σ)的相对荧光变化,用下面的公式计算出的荧光值:
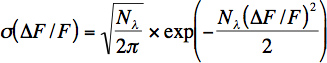
该方程表示光子散粒噪声的泊松分布与变量相对荧光变化的变化:ΔF/ F =(G * N 为λ(t)-G * N&林北京经济技术开发区,0)/ G * Nλ,其中G代表的光电倍增管和所有其他电子元件的累计收益。请注意,这个方程不正确地确定体内录音检测的光子的数目,因为有其他的噪声源(运动工件),在除了光子散粒噪声。然而,这个方程是有用的在体内的记录来估计噪声。
- 计算基线荧光从相同的时间窗,并绘制为时间的函数或试验。调整激光功率的,因为秒杀检测迅速下降,当超过这个限额保持在低于0.0002 / s的平均降幅为基准。
- 每10-20分钟再次获得一个完整的帧图像的神经元胞体的位置进行了验证。如果需要,记录位置被调节。可以调整一次,所有的神经元或单个神经元的位置。
4。重构n的荧光信号(反褶积穗定时)
- 荧光信号的钙瞬变是因为衰变产生的神经活动往往summate时间长(几百毫秒为单位)。一个反褶积方法重建穗和穗计时的荧光信号。
- 要确定最有可能的穗列车相关记录的荧光信号,不同的车型进行了比较。在这里,我们用遗传算法来确定模型 - 秒杀火车和尖峰时序 - 最大似然。
- 在不均匀的神经元群体的,秒杀诱发的钙信号可以改变神经元之间。对于无监督数据集的分析中,我们设计了一个算法,考虑到穗诱发的钙信号从神经元到神经元的变化。
- 为了避免大量的假阳性检测的收缩允许的振幅和衰减时间常数的m,它是非常有用的ODEL穗诱发的钙信号。被记录在一组单独的神经元在相同的实验条件下,使用同步电和光学记录相同类型的实验,从单穗诱发钙瞬变的幅度和衰减时间常数的联合分布。
- 到账户基线变化缓慢,并减少计算成本deconvolving,较长的录音分为几个较短的1-5秒的痕迹。
- 对于每个神经元和每个记录,去卷积算法可能测试了大量的模型(高达1,000,000个不同的模型或更多)。一个实验要加快反褶积,反褶积了10个不同的并行计算机。
- 解卷积后,尖峰数据进行分析,并进行检查。一个刺激周围的直方图,穗概率,发射率(平均穗数神经元)以自动的方式计算。
5。代表性的成果
成功的棘波检测铰链上所记录的荧光体细胞钙信号的高信号噪声比。只需使用高的激发率(激光功率),可能会导致在的不利影响photoeffects,生物材料(光损伤)。在抖动随机存取扫描光损伤表现为基线荧光减少,并降低穗诱发的钙离子荧光信号。减少在秒杀诱发的信号,可以迅速在故障检测峰值。只有一个非常小的窗口,激发棘波检测荧光信号强度高。在此窗口中的较高端是有限的光损伤,下端上的荧光信号,有一个低的信号 - 噪声比。对于急性片的皮层神经元光子率约400,000-1,500,000光子/ s的记录片表面约100微米以下时,我们使用的激光功率。当使用高亲和力指示器 - 这里俄勒冈绿488 BAPTA - 1 - 这足以检测个别尖峰信号。图。 3E示出了一个例子,在非常低的激发速率,检测窗口内的记录的一个例子,和在非常高的激发速率之一记录的荧光信号。
与其他技术相比,与单细胞和单穗分辨率记录神经活动,抖动随机存取扫描可以记录从一个较大数目的神经元从相同的,本地的人口,并例如是微创四极/多极录音相比。因此抖动随机存取扫描可用于记录许多神经元的神经活动信号的阈上活动(图4A),在人群中的神经元(大脑皮质可塑性)的神经活动的变化来衡量互信息,并传播的阈上活动通过种群的神经元14(图4B)
ALT =“图1”SRC =“/ files/ftp_upload/4052/4052fig1.jpg”/>
图1的抖动的随机访问扫描设置的光学设计。
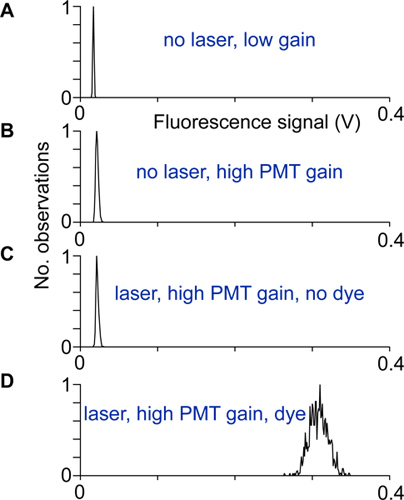
图2。对齐和测试:记录在不同的条件下荧光信号的分布。 A)没有激光和光电倍增管增益低,B)在较高的PMT增益,但没有激光光,由于光电倍增管的暗电流的分布更宽。 C)上的激光记录高PMT的增益。在B中所示的分布,该分布之间的差别将表示该激发光到达光电倍增管探测器。 D)的分布记录的荧光信号在神经元的胞体的高收益。如果没有其他噪声源的贡献,这种分布产生光子散粒噪声。
文件,“/>
图3:A)全画幅荧光图像检测并选择神经元胞体的位置,B)为一个周期的扫描路径,C)插图的抖动原则,在每个SOMA(圈)的几个地点之前记录的光束移动到下一个躯体,D)插图的两个D / A通道的输出。对于每一个神经元的胞体,荧光信号被记录在每个SOMA(S1-S4)从4个不同的点。各点的位置,由下式给出的x和y位置。的x和y可用于所有斑点的位置和所有的神经元被发送到数字 - 模拟转换器,在一个连续的方式。而梁之间移动两个神经元胞体,无信号获取(空白)。 E)的荧光信号的例子。注意每个例子一穗(与电生理细胞贴附记录)。
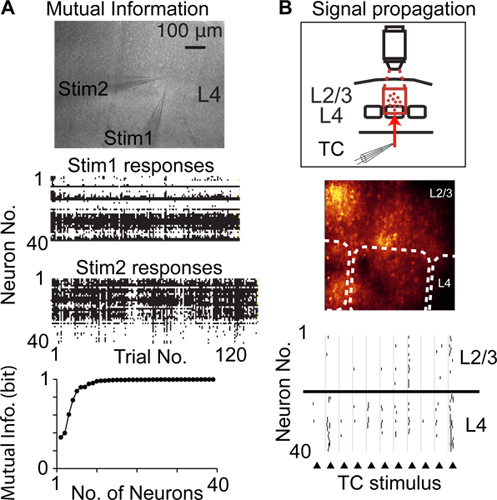
图4。研究CORTI校准功能,使用随机存取扫描抖动。 A)测量信号通过神经元群体的共同信息。上的图像显示的一种急性脑切片的显微照片和放置在相同的皮质层4(L4)的列中的两个刺激移液器。中心的图表显示了每次重复刺激的神经反应。下图显示了香农人口的神经元信号的互信息。 B)测量繁殖种群之间的皮层神经元的阈上扣球活动(信号传输)。上面的图示出的实验设计,中心的图像显示的荧光图像,虚线表示桶边界,低级的图表显示探测到的峰值响应于丘脑纤维(三角形)的电刺激。
讨论
间接地抖动随机存取扫描检测阈上扣球活动的增加与每穗在一个神经元的胞体在体细胞内的钙。胞内钙的增加,检测到由荧光钙染料。主要是从有限的信号 - 噪声比的钙荧光信号产生抖动的随机存取扫描的局限性。信号对噪声比是依次由光损伤,不允许使用高激发率限制。因为有限的信号 - 噪声比,穗的检测失败时,在某些神经元中,并也可能失败为持续和高频活动。例如,记录在体内时?...
披露声明
没有利益冲突的声明。
致谢
我们感谢兰迪Chitwood博士,批判性阅读的手稿。这项工作是支持的白厅基金会和斯隆基金会的赠款HJK。
材料
| Name | Company | Catalog Number | Comments |
| 的试剂的名称 | 公司 | 目录编号 | 评论(可选) |
| 光学元件是按顺序排列,从激光器 | |||
| 土卫六:蓝宝石激光 | 相干公司 | 变色龙超2 | 推荐输出功率(> 2W在900 nm) |
| 消色差镜头f = 30毫米 | 雷神实验室 | AC254-030-B | 为650-1050纳米涂层防反射(AR) |
| 消色差镜头f = 100毫米 | 雷神实验室 | AC254-100-B的 | AR 650-1050纳米 |
| 镜头f = 75毫米 | 雷神实验室 | LA1608-B | AR 650-1050纳米 |
| 镜头f = 175毫米 | 雷神实验室 | LA1229-B | AR 650-1050纳米 |
| 消色差镜头f = 300毫米 | 雷神实验室 | AC254-300-B的 | AR 650-1050纳米 |
| 消色差镜头f = 100毫米 | 雷神实验室 | AC254-100-B的 | AR 650-1050纳米 |
| 消色差镜头f = 100毫米 | 雷神实验室 | AC254-100-B的 | AR 650-1050纳米 |
| 声光偏转器 | Intraaction公司 | ATD 6510CD2 | |
| 反射型衍射光栅 | 新港 | 53-011R | 100线/ mm与65 MHz的带宽和扫描角度为45毫弧度的季节AOD |
| 21.6毫米布鲁斯特棱镜 | 拉姆达研究光学公司 | IBP21.6SF10 | |
| 有色玻璃 | 肖特 | BG-39 | |
| 分色镜 | 色度科技股份有限公司 | Z532RDC | |
| 光电倍增管模块 | 滨松 | H9305-03 | |
| DAC,ADC板 | 美国国家仪器公司 | PCI-6115 | |
| 俄勒冈绿488 BAPTA-AM | Invitrogen公司 | O-6807 |
参考文献
- Iyer, V., Hoogland, T. M., Saggau, P. Fast functional imaging of single neurons using random-access multiphoton (RAMP) microscopy. J. Neurophysiol. 95, 535-545 (2006).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73 (1990).
- Ranganathan, G. N., Koester, H. J. Optical recording of neuronal spiking activity from unbiased populations of neurons with high spike detection efficiency and high temporal precision. J. Neurophysiol. 104, 1812-1824 (2010).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nat. Methods. 7, 399-405 (2010).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proc. Natl. Acad. Sci. U.S.A. 100, 7319-7324 (2003).
- Pita-Almenar, J. D., Ranganathan, G. N., Koester, H. J. Impact of cortical plasticity on information signaled by populations of neurons in the cerebral cortex. J. Neurophysiol. 106, 1118-1124 (2011).
- Kerr, J. N., Greenberg, D., Helmchen, F. Imaging input and output of neocortical networks in vivo. Proc. Natl. Acad. Sci. U.S.A. 102, 14063-14068 (2005).
- Lin, B. J., Chen, T. W., Schild, D. Cell type-specific relationships between spiking and [Ca2+]i in neurons of the Xenopus tadpole olfactory bulb. J. Physiol. 582, 163-175 (2007).
- Zeng, S., Lv, X., Zhan, C., Chen, W. R. Simultaneous compensation for spatial and temporal dispersion of acousto-optical deflectors for two-dimensional scanning with a single prism. Opt. Lett. 31, 1091-1093 (2006).
- Otsu, Y., Bormuth, V., Wong, J., Mathieu, B. Optical monitoring of neuronal activity at high frame rate with a digital random-access multiphoton (RAMP) microscope. J. Neurosci. Methods. 173, 259-270 (2008).
- Vogelstein, J. T., Watson, B. O., Packer, A. M., Yuste, R. Spike inference from calcium imaging using sequential Monte Carlo methods. Biophys. J. 97, 636-655 (2009).
- Yaksi, E., Friedrich, R. W. Reconstruction of firing rate changes across neuronal populations by temporally deconvolved Ca2+ imaging. Nat. Methods. 3, 377-383 (2006).
- Hendel, T., Mank, M., Schnell, B., Griesbeck, O. Fluorescence changes of genetic calcium indicators and OGB-1 correlated with neural activity and calcium in vivo and in vitro. J. Neurosci. 28, 7399-7411 (2008).
- Ranganathan, G. N., Koester, H. J. Correlations decrease with propagation of spiking activity in the mouse barrel cortex. Front Neural Circuits. 5, 8 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。