需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
复制和β细胞功能评估Adenovirally转分离的啮齿动物胰岛
摘要
该协议允许一个确定调节功能的β细胞质量的因素,找到治疗糖尿病的潜在的治疗靶点。该协议包括一个精简的方法来评估胰岛细胞复制和β细胞功能,在离体大鼠胰岛细胞与腺病毒基因表达操纵。
摘要
主要是葡萄糖稳态控制的内分泌激素的胰岛素和胰高血糖素,胰岛β和α细胞分泌,分别。功能的β细胞质量是决定解剖β细胞质量以及β细胞的能力,以应对营养负荷。一个丧失功能的β细胞质量是中心1-3糖尿病的两种主要形式。而下降功能的β细胞自身免疫性1型糖尿病发作的质量结果,在2型糖尿病,这一递减的发展都无法适当分泌胰岛素的β细胞和β细胞的破坏从干部机制。因此,努力恢复功能的β细胞质量更好的治疗和糖尿病的潜在治疗至关重要。
正在努力找出刺激的复制和增强β细胞的功能,可以利用的分子途径。理想的情况下,治疗的目标,同时提高β细胞的生长和功能。也许更重要的虽然是一种策略,刺激β细胞的生长,以确定是否损害的β细胞功能(如某些癌基因),反之亦然成本。
由系统抑制或过度在离体大鼠胰岛靶基因的表达,可以增加功能的β细胞质量4-6找出潜在的治疗靶点。腺病毒载体可有效地过度或击倒蛋白在离体大鼠胰岛4,7-15就业。在这里,我们提出了一种方法来操纵利用腺病毒转导的基因表达和评估胰岛复制,并在离体大鼠胰岛β细胞功能( 图1)。这种方法已经被以前使用,以确定新的目标,调节β细胞复制或功能5,6,8,9,16,17。
研究方案
1。腺病毒介导和培养大鼠胰岛
- 准备加入所需数量的2毫升(载8毫米葡萄糖,10%胎牛血清,50个单位/ ml青霉素,50μg/ mL链霉素的RPMI 1640培养媒体)媒体6以及非组织文化的涂层板井。例如,一个典型的实验可能需要三口井 - 一个无病毒控制,病毒控制(例如,表达GFP的腺病毒),实验组。
- 暖板放置到组织文化的孵化器,为至少30分钟至37°C。
- 紧随6以及非组织文化的涂层板个别井大鼠胰岛分离18,19 100-200胰岛。第六胰岛细胞所需的胰岛素分泌和胸腺嘧啶掺入法。其余的胰岛细胞可用于RNA基因表达研究或蛋白质的免疫隔离的隔离。
[注:从这点出发,请遵循和生物危险材料的处理,使用,处置制度的协议。]
- 轻轻地旋转以及中心板带来的小岛。
- 直接吸取上盘中心的胰岛腺病毒。使用100-500多重感染(内政部,比靶细胞病毒蚀斑形成单位)。
- 让胰岛休息5分钟。
- 将组织文化的孵化器(37℃,5%CO 2)板块。
- 24小时后,轻轻地摇动板带来的胰岛井中心和转让使用P200的微管以及含有新鲜的媒体到一个新的胰岛。如果胰岛成为附着板,就可以轻轻抛下枪头。
[注:为了验证足够的传导efficienCY,控制病毒表达GFP的使用是有益的,如胰岛细胞,然后可以通过共聚焦显微镜成像核实渗透到胰岛核心的腺病毒。]
- 文化的胰岛额外的24-72小时,这取决于所需的时间从优化试验研究实验。例如,诱导的增殖反应,可能需要从24-72小时或击倒感兴趣的基因,可能需要48或72小时的时间。每天新鲜媒体的胰岛细胞转移。
- 对于最后24Ĥ实验,文化媒体,含1胰岛微居里甲基-3] -thymidine/ml媒体(一般为1微升胸苷/毫升媒体)。
[注:从这点出发,请按照下列机构的协议处理,使用,处置放射性物质。
2。胰岛素分泌试验
- 准备分泌缓冲液(SAB)的10X储备溶液(1.14 M氯化钠,氯化钾47毫米,12毫米KH 2 PO 4,硫酸镁 11.6毫米)和氯化钙 100X股票解决方案(0.25M氯化钙2)。这些股票的解决方案,可提前准备的时间,并在室温下储存。
- 新鲜的准备工作审计局(5 mL 10X审计局,1毫升1 M羟乙基100X 氯化钙 ,0.5毫升,0.28毫升35%的牛血清白蛋白,0.11克碳酸氢钠3,无菌水50毫升中)在50毫升50毫升锥形管和温暖至37°C的放置在37℃水浴。
- 吸取10毫升到15毫升锥形管工作审计局和增加66.8微升2.5米D-葡萄糖,准备高糖(16.7毫米)审计局。
- 新增44.8微升至2.5米D-葡萄糖,审计局的工作,其余40毫升,以备低血糖(2.8毫米)审计局。
- 标签三个1.7毫升,每6孔板以及离心管,加入1毫升的磷酸盐缓冲液(PBS)。
[注:由于胰岛是放射性,放射性物质的处理,使用,处置,请按照下列机构的协议。
- 每个离心管放入20个小岛。尽一切努力向每个离心管加入同等大小岛屿。例如,每管可包含5小,10中,5个大型的胰岛细胞( 见图1)。
[注:胰岛可以使用解剖立体或一个标准的显微镜可视化。]
- 胰岛后定居管底部的重力(〜2分钟),吸用微量的PBS及丢弃。
[注:作为替代,以重力沉降管,可在300 XG离心1分钟。]
- 预孵化,添加400μL低谷氨酸葡萄糖审计局,放入孵化器的组织文化(37℃,5%CO 2),60分钟前孵育管(盖打开)。吸预孵化低血糖审计局和丢弃。
- 基础胰岛素分泌,添加400μL的低血糖审计局,组织培养的孵化器(37℃,5%CO 2)放入管(盖打开),孵育60分钟。收集的低血糖审计局和保存胰岛素放射免疫分析法。
- 为刺激胰岛素分泌,添加400μL的高血糖审计局,组织培养的孵化器(37℃,5%CO 2)放入管(盖打开),孵育60分钟。收集高血糖审计局和保存胰岛素放射免疫分析法。
3。 TdR掺入实验
- 加入1 ml的PBS;重力管底部定居后的胰岛细胞,吸用微量的PBS,丢弃,重复此加强一次。
- 加入500μL冰冷的三氯乙酸(TCA,10%W / V),并在冰上孵育30分钟。
- 16 000 XG 3分,在4°C离心管
- 吸出TCA的,加0.3 N氢氧化钠80μL,孵育室温30分钟。在此期间,大力涡样品,每10分钟为5-10秒。
- 添加4毫升到7毫升液体闪烁计数管计数鸡尾酒经济安全。
- 加入50微升样品闪烁计数管,帽筒,简要动摇,在液体闪烁计数器计数。
- 根据制造商的协议使用的二喹啉酸(BCA)法和10μL的样品测量蛋白质浓度。
4。数据分析
- 按照制造商的协议执行的胰岛素放射免疫分析法。
- 正常化与蛋白质浓度的胰岛素分泌和TdR掺入数据entration。
5。代表结果
如图2所示的实验,以评估胰岛细胞复制和大鼠胰岛β细胞功能的例子。这个例子说明,假设“#6”强劲刺激胰岛β细胞功能不改变复制的基因的腺病毒过度。在顶部面板中,从胸腺嘧啶掺入法结果表明,越来越多的“基因#6”的表达,增加DNA的合成,TdR掺入测定。因为大部分在大鼠胰岛细胞的β细胞,它是可能的,这增加TdR掺入表明增加β细胞复制。然而,实验验证,必须要牢固树立。底部面板中,从胰岛素分泌试验的结果表明,过度的“基因#6”不改变β细胞的主要功能之一,即,我nsulin在低和高糖的分泌。与腺病毒治疗后的胰岛胰岛分离和健康质量指示倍,在低和高血糖浓度在胰岛素分泌增加。如果增加“基因#6”受损的β细胞功能的表达,这可能会反映在高,刺激葡萄糖浓度(16.7毫米)的胰岛素分泌减少。也可以执行一个不同的血糖浓度的剂量 - 反应曲线。
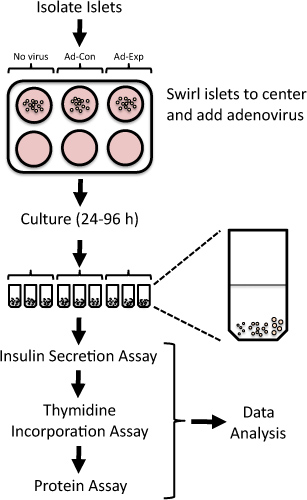
图1。协议的概述,以评估在离体大鼠胰岛细胞,腺病毒介导的基因表达改变后的胰岛细胞复制和β细胞功能。新鲜分离的大鼠胰岛腺病毒暴露24小时,然后培养96小时。在最后的24小时,胰岛素的分泌测量TdR掺入评估高,低血糖。
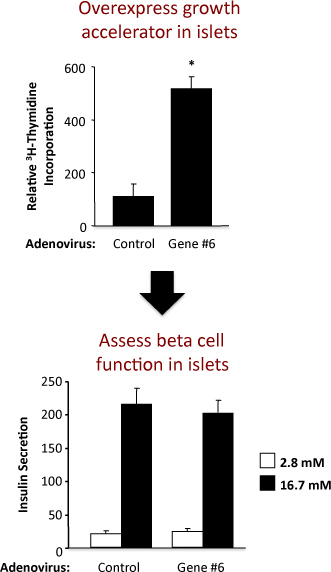
图2。使用控制腺病毒和腺病毒过度一个假设的基因标记“基因#6”的实验结果。顶部面板显示TdR掺入和底部面板的胰岛素分泌。
讨论
建立通路,可调制刺激的复制和增强β细胞的功能有关糖尿病的两个主要形式。因为功能的β细胞质量是依赖胰岛素分泌细胞的存在和功能上,评估这些因素,同时有它的优势。这个协议描述为确定一种蛋白质的过度表达或抑制是否会导致功能的β细胞质量的变化, 在体外培养 ,然后可以测试体内疗效的精简协议。
这个协议的一个限制是,胰岛是一种微型器...
披露声明
没有利益冲突的声明。
致谢
这项工作是格兰特DK078732支持由美国国立卫生研究院(的PTF)。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| RPMI 1640培养媒体 | Gibco公司 | 11879 | |
| 青霉素/ | Gibco公司 | 15140 | |
| 6孔板 | BD-猎鹰 | 35-1146 | 非TC治疗 |
| [甲基-3H]-胸苷 | Perkin Elmer公司 | NET027Z001MC | 1毫居里/毫升 |
| 微型离心管 | 丹维尔 | C2170 | 1.7毫升 |
| 氯化钠 | 西格玛 | 59888 | |
| 氯化钾 | 阿库罗斯福冈 | 42409 | |
| 锦2 </ SUB> PO 4 | 阿库罗斯福冈 | 20592 | |
| 硫酸镁 | 阿库罗斯福冈 | 41348 | |
| 氯化钙 | 阿库罗斯福冈 | 34961 | |
| 肝素钠 | 西格玛 | H0887 | 1个M解决方案 |
| 35%BSA | 西格玛 | A7979 | |
| 碳酸氢钠 | 阿库罗斯福冈 | 42427 | |
| D-葡萄糖 | 西格玛 | G8769 | |
| 氯乙酸 | Fisher Scientific则 | SA9410-1 | 10%W / V |
| 氢氧化钠 | 阿库罗斯福冈 | 12426 | |
| 闪烁计数管 | 萨尔斯塔特 | 58.536 | 7毫升,PP |
| 闪烁计数管帽 | 萨尔斯塔特 | 65.816 | |
| 安全的Econo计数鸡尾酒 | 零售物价指数 | 111175 | |
| 胰岛素的RIA | 西门子 | TKIN2 | |
| BCA分析套件 | Thermo Scientific的 | 23250 | |
| 设备 | |||
| 离心分离 | Eppendorf公司 | 5415R | |
| 闪烁计数管架 | 萨尔斯塔特 | 93.1431.001 | |
| 液体闪烁计数器 | Perkin Elmer公司 | 三,碳水化合物2910TR |
参考文献
- Ferrannini, E. beta-Cell function in subjects spanning the range from normal glucose tolerance to overt diabetes: a new analysis. J. Clin. Endocrinol. Metab. 90, 493-500 (2005).
- Weyer, C., Bogardus, C., Mott, D. M., Pratley, R. E. The natural history of insulin secretory dysfunction and insulin resistance in the pathogenesis of type 2 diabetes mellitus. J. Clin. Invest. 104, 787-794 (1999).
- Keenan, H. A. Residual insulin production and pancreatic ss-cell turnover after 50 years of diabetes: Joslin Medalist Study. Diabetes. 59, 2846-2853 (2010).
- Bain, J. R., Schisler, J. C., Takeuchi, K., Newgard, C. B., Becker, T. C. An adenovirus vector for efficient RNA interference-mediated suppression of target genes in insulinoma cells and pancreatic islets of langerhans. Diabetes. 53, 2190-2194 (2004).
- Fueger, P. T. Trefoil factor 3 stimulates human and rodent pancreatic islet beta-cell replication with retention of function. Mol. Endocrinol. 22, 1251-1259 (2008).
- Schisler, J. C. Stimulation of human and rat islet beta-cell proliferation with retention of function by the homeodomain transcription factor Nkx6.1. Mol. Cell Biol. 28, 3465-3476 (2008).
- Chan, C. B. Overexpression of uncoupling protein 2 inhibits glucose-stimulated insulin secretion from rat islets. Diabetes. 48, 1482-1486 (1999).
- Cozar-Castellano, I., Takane, K. K., Bottino, R., Balamurugan, A. N., Stewart, A. F. Induction of beta-cell proliferation and retinoblastoma protein phosphorylation in rat and human islets using adenovirus-mediated transfer of cyclin-dependent kinase-4 and cyclin D1. Diabetes. 53, 149-159 (2004).
- Icyuz, M. Adenovirus infection activates akt1 and induces cell proliferation in pancreatic islets1. Transplantation. 87, 821-824 (2009).
- Kaneto, H. Activation of the hexosamine pathway leads to deterioration of pancreatic beta-cell function through the induction of oxidative stress. J. Biol. Chem. 276, 31099-31104 (2001).
- Antinozzi, P. A., Berman, H. K., O'Doherty, R. M., Newgard, C. B. Metabolic engineering with recombinant adenoviruses. Annu. Rev. Nutr. 19, 511-544 (1999).
- Newgard, C. B., Becker, T. C., Berman, H. K., O'Doherty, R. M. Regulation of overexpressed hexokinases in liver and islet cells. Biochem. Soc. Trans. 25, 118-122 (1997).
- Becker, T. C., BeltrandelRio, H., Noel, R. J., Johnson, J. H., Newgard, C. B. Overexpression of hexokinase I in isolated islets of Langerhans via recombinant adenovirus. Enhancement of glucose metabolism and insulin secretion at basal but not stimulatory glucose levels. J. Biol. Chem. 269, 21234-21238 (1994).
- Csete, M. E. Adenoviral-mediated gene transfer to pancreatic islets does not alter islet function. Transplant Proc. 26, 756-757 (1994).
- Csete, M. E. Efficient gene transfer to pancreatic islets mediated by adenoviral vectors. Transplantation. 59, 263-268 (1995).
- Meng, Z. X. Activation of liver X receptors inhibits pancreatic islet beta cell proliferation through cell cycle arrest. Diabetologia. 52, 125-135 (2009).
- Ronnebaum, S. M. A pyruvate cycling pathway involving cytosolic NADP-dependent isocitrate dehydrogenase regulates glucose-stimulated insulin secretion. J. Biol. Chem. , (2006).
- Milburn, J. L. Pancreatic beta-cells in obesity. Evidence for induction of functional, morphologic, and metabolic abnormalities by increased long chain fatty acids. J. Biol. Chem. 270, 1295-1299 (1995).
- Szot, G., Koudria, P., Bluestone, J. Murine Pancreatic Islet Isolation. J. Vis. Exp. (7), e255 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。