Method Article
反向遗传学感染小鼠诺沃克病毒介导的恢复
摘要
诺如病毒肠胃炎尚未分子技术是表征的主要原因仍然是相对较新的。在这里,我们报告两个不同的反向遗传学方法对小鼠诺沃克病毒(MNV),本属的唯一成员,可在细胞培养繁殖的高效回收。
摘要
人类诺如病毒是人类胃肠炎(GE)全球大多数情况下,负责,并在那里亲近的人对人的接触是无法避免的,1,2的环境中经常出现的问题。在医院暴发的发病率增加,在过去几年中已有报道,造成重大影响自身的业务能力以及巨大的经济损失。由于人类诺如病毒无法完成生产感染的细胞培养3,确定新的抗病毒方法已经被限制。小鼠诺沃克病毒(MNV)密切相关的人类诺罗病毒,但最近的隔离可在细胞5传播开辟了调查这些病原体6,7的新途径。
在新的积极意义的基因组和亚基因组RNA分子的合成的MNV复制结果,其中后者对应到最后THI病毒基因组的路( 图1)。 MNV包含四个不同的开放阅读框(ORF),其中ORF1基因占据大部分的基因组,编码7个非结构蛋白(NS1蛋白-7)释放由聚易制毒化学。载的ORF2和ORF3内的亚基因组RNA地区和编码衣壳蛋白(VP1和VP2),分别为( 图1)。最近,我们已经确定了额外的ORF4重叠的ORF2,但在不同的阅读框的功能和线粒体的本地化的致病因子(VF1)8编码。
积极意义的RNA病毒,包括诺如病毒,复制发生在细胞质中造成新的不封顶的RNA基因组的合成。促进翻译病毒,病毒利用不同的策略,旨在招聘细胞的蛋白质合成机器9-11。有趣的是,诺罗病毒的翻译是由多功能的病毒蛋白底漆VPG共价连接到5月底的两个基因组和亚基因组RNA 12-14。这种翻译复杂的机制很可能是在有限的病毒恢复传统的反向遗传学方法效率的主要因素。
在这里,我们报告两个不同的策略,基于上一代小鼠诺罗-1(简称MNV谨)在5'端上限的成绩单。的方法之一,涉及体外病毒RNA的合成和封盖,而第二种方法需要的MNV细胞表达T7 RNA聚合酶基因的转录。这些反向遗传学的的MNV研究和小动物模型系统的可用性提供了一个前所未有的能力,解剖病毒复制和发病机制15-17序列的作用。
研究方案
1。 RNA转录和感染MNV恢复封顶
该协议旨在允许通过从cDNA 体外转录和随后在体外上限(1.1节)传染病MNV高效回收。皑皑的成绩单,然后转染细胞,恢复感染MNV(第1.2和1.3)。这种方法提供了最敏感的方法MNV与典型的产量超过10 5传染病的单位,每35毫米(直径)盘MNV细胞恢复。该协议的详细内容如下:
1.1传染病皑皑MNV成绩单合成:
- 消化质粒含有野生型MNV基因与NHE(PT7:MNV 3'Rz)我获得线性DNA NHE我承认后的3'端,MNV polyA的基因组尾( 图2)独特的酶切位点。线性化的质粒通常纯化使用硅胶柱(如GFX PCR DNA凝胶带 GE医疗纯化试剂盒 ),并在H 2 O洗脱
- 体外转录线性化的载体,用T7 RNA聚合酶,如先前所述17。许多商业试剂盒可用于这一目的,并提供了大量的RNA合成,如MEGAScript(生命技术)和RiboMAX(Promega公司)的重复性方法。转录反应通常是DNA酶消化前进一步的分析;然而,在许多情况下,这不是氯化锂的提纯要求如下所述不沉淀的DNA有效。
- 分析一个小的RNA转录反应等分,通常为0.5μL或更少的琼脂糖凝胶电泳,以确保转录反应曾效率和RNA是全长。虽然许多用户可能要运行的正确大小的RNA变性凝胶,我们通常使用非变性琼脂糖凝胶electrophorESIS作为一种快速的方法来分析RNA的完整性。从传染性cDNA克隆PT7生产:3'Rz MNV MNV基因组将运行在约3 KBP相对双链DNA上的一个非变性琼脂糖凝胶电泳( 图3)阶梯。
- 考虑其他方法可作为一种替代,如使用的安捷伦bioanalyser( 图3)获得快速分析的RNA的完整性。
- 注意:如果加载了太多的RNA,可能会遇到那个可怜的决议凝胶。采取非常谨慎,以确保使用无RNase的试剂,以避免在电泳RNA的降解,这可能会影响乐队的决议,琼脂糖凝胶电泳准备。的RNA加热到65°C间在冰上冷却,也可能在某些情况下帮助。
- 净化删除非法人的核苷酸的RNA样品。许多方法可用于包括硅胶柱为基础的方法,然而在这个协议中,我们通常使用氯化锂具有成本效益的替代品。为为此,加H 2 O,达到终体积100μL,然后加入40μl和氯化锂沉淀溶液 (氯化锂7.5米,50 mM的EDTA,pH值8.0,Ambion公司)于样品储存在-20°C至少30分钟。
- 颗粒的RNA离心12,000元xĞ4°C 15分钟。
- 去除上清,不要打扰半透明的RNA颗粒和洗150μl70%乙醇的照顾。在4°C离心 管12,000元xĞ15分钟。
- 除去乙醇和空气干燥的RNA,避免沉淀完全干燥,因为这将会使悬浮困难。
- 然后,悬浮成50-100μlRNA的存储解决方案 (Ambion公司)的的MNV成绩单。应小心,以确保所有的RNA已经解散。应该出现的RNA难以完全溶解,加热样品至60°C可能有助于悬浮它。任何不溶性物质,然后被删除bŸ离心之前RNA定量。纯化的成绩单是不封顶,并要求随后在体外封顶步骤是传染病(ScriptCap m7G旋盖系统,震中生物技术)。
- 量化分光RNA的。根据典型的转录反应的性质和规模,产量从50-150微克每100μL转录反应中的RNA。运行到1%琼脂糖凝胶电泳( 图3)100-300纳克的样品封盖反应之前,应分析RNA的完整性。
- 为了提高效率的RNA封顶,热MNV RNA转录60至70微克65°C加热10分钟,然后立即将管上冰。这一步可能会降低RNA结构上加盖任何抑制作用。脉冲管冷冻离心收集在加热过程中一步形成的水滴。
- 制造商(ScriptCap m7G建议准备一个覆盖反应混合物覆盖系统,震中生物技术)。简单地说,到100μL的最终反应体积增加60-70微克的MNV RNA。封顶反应混合物可能含有10旋盖x的缓冲区(500毫米TrisHCl pH值8.0,60毫米氯化钾,氯化镁12.5毫米)10μL,10μL10毫米的GTP 20毫米S-腺苷蛋氨酸,Scriptguard 2.5μL,0.5μL (100个单位),和4 Scriptcap酶液(40个单位)。
- 在成立的反应,保持转录的RNA在冰上,以避免退化。反应混合物拌匀,然后在37°C孵育1小时。注意:根据金额的上限所需的成绩单,反应的大小可以缩放。
- LiCl沉淀净化的RNA上面解释(见1.1.6)。 50-100μlRNA的存储解决方案(Ambion公司)的溶解沉淀和量化的RNA量。通常,RNA样品随后被归为1μg/μL。再次,检查所有的RNA已经解散。如果没有得到应有的溶解,热ţ他样品至60°C,允许其解散。通过离心除去不溶性物质之前RNA定量。
- 转染步骤之前,再次检查RNA的完整性。为了这个目标,运行到1%琼脂糖凝胶电泳( 图3)100-300纳克的样本量。
1.2霓虹灯介导的RNA转染入Raw264.7细胞恢复:
在一个宽容的细胞株为MNV传染性病毒颗粒的恢复是可能的,到electroporate上限将RAW264.7细胞,用霓虹灯转染系统(Invitrogen公司)MNV成绩单。 RAW264.7 MNV感染的细胞容易,支持病毒复制和随后的再感染的多轮。因此,典型的产量将接近48小时后在24小时后转,但> 10 7传染性单位的高峰期超过每毫升10 5传染性单位。
- 一天前移植sfection,种子RAW264.7细胞,在大约50%汇合。通常需要3转染两的T75细胞瓶。
- 转染当天,Dulbecco的改良Eagle培养基(DMEM培养基)含10%胎牛血清(FCS)的刮成单层细胞,以确保您生成一个单细胞悬液,重复移液。
- 确定血球使用台盼蓝排斥标注的非活菌活菌浓度。
- 颗粒细胞为5分钟和悬浮在培养液含有一个8×10 6细胞/ ml终浓度为10%胎牛血清1200×Ğ。
- 只是之前染,等分1毫升每2分钟的细胞转染和沉淀在1200×Ğ。删除媒体和500(不含2 /钙+镁)的PBS液洗细胞。降速1200×Ğ细胞再次为2分钟。注意:最好是保持尽可能长的细胞在DMEM由于长时间储存在PBS可能会损害细胞的存活率和转染率。
- 从管取出PBS和添加130(霓虹灯转染系统套件 ,Invitrogen公司)μl悬浮解决方案的最后一个6×10 7细胞/ ml的浓度。应小心悬浮细胞,避免形成气泡,这将导致在转染和妥协细胞存活的火花。
- 添加适量皑皑MNV成绩单细胞( 图2),一般为1.3微克上限的RNA加入到130μL重悬细胞,轻轻混合。然后,收集100μL的混合物,在100μl的霓虹灯转尖。应采取特别的照顾,以确保无气泡在电试管( 霓虹灯转染系统套件100μL尖)成立,因为这将导致实验失败。
- 1,700 V单脉冲为25毫秒,EN Electroporate细胞在脉冲火花的情况下,这将表明,样品中的气泡存在一定的。在火花的情况下应该发生,丢弃样品和重复转染。释放到细胞的Eppendorf管含有1毫升的无抗生素培养液含10%FCS。请注意每个尖端可重复使用相同的RNA样品三次,如果需要大量的转染细胞。
- 此后,分发进入预热抗生素免费培养液中含有适量含10%FCS的独立井管细胞。作为一般指引,步骤1.2.8中所产生的细胞悬液150μL,是为单井24盘板预热DMEM培养液含0.5毫升足够,而300μL12碟小菜以及适当预热DMEM培养液含有1毫升。
- 细胞在37°C和10%的CO 2为24至72小时。然后,由一个(或更多)的传染性病毒颗粒从细胞中释放冻结和解冻周期,并确定样品中的的滴度使用或者斑块检测或TCID50的病毒。注意,裂解物应离心1-2分钟,最大速度或通过0.22μm孔径过滤器过滤,以滴定前澄清。通常情况下,MNV达到滴度约为1×10 6 TCID50/ml在转染后24小时,并在转染后72小时内可达1×10 9。
- Raw264.7细胞后2至5的额外通道测序获救病毒的存在和稳定在PT7引入突变:MNV 3'Rz通常决定。
1.3恢复到BHK-21细胞的脂质体:
一个更直接,更经常更划算的,从皑皑的成绩单感染MNV恢复有效的方法是通过脂质体( 脂质体,2000年 ,Invitrogen公司)。鉴于Raw264.7细胞难以转染用脂质为基础的方法,我们通常使用超视距ER容易转染细胞系,如BHK-21,这是一个来自幼仓鼠肾成纤维细胞的永生行。作为标准的做法在我们的实验室中,我们使用的BSR-T7启动细胞,BHK-21细胞线的衍生工具,而这些细胞很容易转染和支持MNV复制,他们缺乏一个合适的受体,允许再感染的几轮。因此,从这个系统所产生的病毒产量是一个单一的病毒复制周期的迹象。尤其是使用这种方法时,检查病毒恢复突变的影响,因为它允许多个转染,在大幅降低成本相比霓虹灯介导的转染,也并不需要专门设备进行。这是值得注意的,等一应俱全,如人胚肾293T细胞的细胞株也支持的MNV但转染条件的有效恢复,首先应优化,以确保有效的RNA交付。
- 胰蛋白酶ISE 1单层BHK-21细胞(或BSR-T7细胞),种子7.5×10 5细胞在37°C到35毫米直径的菜,在无抗生素的培养基培养细胞,10%的CO 2过夜。一倍,在每块板的转染细胞的数量,如果是同一天播种计划,并允许细胞在37℃至10%的CO 2盘2-3小时坚持。需要注意的是,这种做法是合适的其他细胞,包括人类293T细胞,人肝癌细胞Huh7细胞和非洲绿猴COS7细胞。
- 从细胞中取出3毫升新鲜无抗生素媒体的媒体和更换,以确保最高的转染效率。
- 准备到100μL的Opti-MEM(Invitrogen公司)1-2微克皑皑MNV成绩单的混合物,它与4μL 脂质体2000年以前在100μL的Opti-MEM混合搅拌。彻底混合样品,吸取它向上和向下的15倍。离开混合物在室温下20分钟。
- 加入转染复合物含有细胞单层在下拉明智的时尚皑皑MNV成绩单,轻轻摇晃,在垂直方向的板块。
- 细胞在37°C和10%的CO 2为24至72小时。之后,传染性病毒颗粒从细胞释放的冻结和解冻,并确定由斑块检测或TCID50的病毒滴度。典型的产量达到约1×10 6 TCID50/ml。
2。直接从cDNA恢复细胞表达T7 RNA聚合酶的传染性MNV
该协议旨在允许由传染性质粒窝藏细胞中表达了T7 RNA聚合酶全基因组cDNA序列的转录MNV在细胞恢复。可用于不同的细胞系,通过这种方法恢复传染病MNV,虽然我们通常获得最高产量的BHK-21和BSR-T7 CELLS 15。我们通常使用的BSR-T7启动细胞,因为它们的成长速度比父母的BHK克隆行。鸡痘(鸡痘病毒)编码T7 RNA聚合酶(鸡痘病毒-T7)18作为辅助病毒功能,以推动该病毒的传染性病毒的RNA和随后的恢复( 图4)表达的细胞被感染。虽然BSR-T7细胞组成性表达T7 RNA聚合酶,这种表达是没有足够的抢救后转PT7感染鸡痘病毒-T7帮手的情况下的MNV:MNV 3'Rz。虽然从本系统的典型产量至少10倍,比上述低,这种方法提供了一个快速的方法,使衰弱突变的鉴定筛选突变。通常使用这种方法时,首先要评估的cDNA结构的可行性。如果构建要么失败产生传染性病毒,或出现在较低的水平比野生型感染性克隆的病毒产生,然后基于RNA的approa进行如上所述通道。
- Trypsinise 1单层BHK-21细胞(或BSR-T7细胞)和种子7.5×10 5细胞到35毫米的菜在无抗生素的培养基培养细胞在37°C和10%的CO 2过夜。新增一倍,在每块板的转染细胞的数量,如果是同一天播种计划,并允许细胞坚持2-3小时的板块,在37°C和10%的CO 2。
- 取出细胞培养基,每孔加700μL鸡痘病毒-T7( 图4)。一个感染复数(MOI),0.5〜PFU每单元根据基层鸡胚成纤维细胞滴定,一般使用。然而,值得注意的是,初级成纤维细胞生长的新制剂辅助病毒功能滴定确定高效的病毒恢复所需的剂量。鸡痘病毒-T7的传播和滴定的协议已被先前所描述的18个 。
- 在在37°C和1小时10%的CO 2 cubate到允许鸡痘病毒-T7感染细胞。然后,加入2毫升的无抗生素培养液含10%FCS,并增加一个小时的细胞于37°C和10%的CO 2,让T7 RNA聚合酶表达。
- 传染性质粒转染,首先要继续从被感染的细胞中删除媒体,用媒体2毫升(10%无抗生素培养液的FCS),终于用3毫升的媒体覆盖的单层细胞。不应添加抗生素的媒体,因为它们可能会干扰脂质体2000(Invitrogen公司)的效率。
- 准备1微克的野生型混合MNV传染性cDNA的质粒(如PT7:3'Rz MNV)100μL的Opti-MEM(Invitrogen公司)和混合4μL 脂质体2000(Invitrogen公司)以前与100μL的混合OPTI-MEM(Invitrogen公司)。混合反应彻底吸取它向上和向下15倍,并保持在室温坦佩组合rature为20分钟。
- 导致转染组合应再加入下拉明智的细胞单层板应在垂直方向轻轻动摇。
- 鸡痘病毒感染的T7,MNV质粒转染细胞在37°C和10%的CO 2为24至72小时。转染细胞与传染性质粒PT7:MNV 3'Rz通常呈现从1×10 4至5×10 4 TCID50/ml滴度。
3。代表结果
两个反向遗传学方法在细胞培养传染性MNV恢复高效, 如图5所示。感染MNV与超过10 5 TCID50/ml滴度皑皑MNV RNA转染Raw264.7细胞在24小时后恢复。同样,传染性质粒转染PT7:3'Rz MNV到BSR-T7细胞感染帮手鸡痘病毒表达T7(鸡痘病毒-T7),导致病毒滴度主要excee丁10 4 TCID50/ml( 图5)。合成的RNA和DNA分子获得这些病毒滴度值是在涉及自然VPG联RNA传染性病毒颗粒分离到相同的细胞( 图5)转染得到的相似。这些结果强调了恢复基因定义在细胞培养MNV变种的反向遗传学方法的高效率。
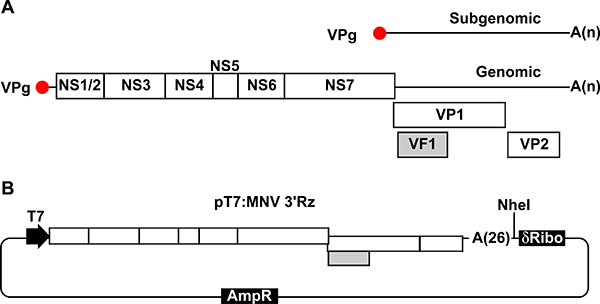
图1。插图MNV基因组和质粒传染性病毒的复苏。一,MNV基因组组织的示意图。每个蛋白质编码区域是作为一个单一的白框所示。 ORF1基因被翻译成7种不同的非结构蛋白(NS1蛋白/ 2到NS7),易制毒化学聚自我水解处理后释放。 2 ORF的编码主要衣壳蛋白VP1的ORF 3编码轻微帽SID蛋白VP2,ORF4的ORF2编码区重叠编码致病因子VF1。基因组和亚基因组RNA含有polyA的尾巴在其3'端可变长度的1。 B,质粒含MNV的cDNA使用在我们的反向遗传方法(PT7:MNV 3'Rz)。 MNV基因融合到了26残留在其3'端的多聚腺苷酸尾。位于下游截断的T7启动子序列,允许的T7驱动的转录,和独特的NHE我网站和编码后的自我切割核酶的DNA序列上游MNV cDNA序列。为确保RNA转录终止权后,在3'端的基因polyA的尾巴目前这些序列。
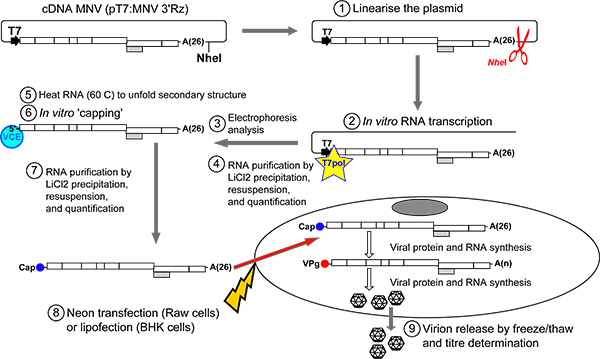
图2。概述MNV传染病从RNA的体外转录和上限恢复协议质粒PT7:MNV 3'Rz立即下游线性化使用的NHE我的限制酶(步骤1)的的MNV基因组序列。 DNA纯化后,MNV RNA转录生成在体外利用T7 RNA聚合酶(步骤2)。转录产品通常运行具有明显的流动性在2.5-3KB非变性1%琼脂糖凝胶(步骤3, 图3)。使用的是商业的无RNA酶的DNA酶,模板DNA被淘汰。 RNA,然后从自由核苷酸纯化LiCl沉淀(步骤4)。纯化的RNA产品,届时可能在体外被以前在65加热后加盖°C至展开的RNA二级结构(步骤5-6)。 LiCl沉淀净化后,RNA的转染入Raw264.7细胞( 霓虹灯转染系统 ,Invitrogen公司)或BSR-T7细胞( 脂质体2000年 ,Invitrogen公司)(步骤7-8)。一旦进入细胞内,皑皑的RNA转录将译成病毒的蛋白质会促进病毒转录复制到新的MNV RNA分子在其5'端含有一个适当的VPG分子。连续复制周期病毒翻译的陪同下,会产生大量的,将encapsidated生成传染性病毒颗粒的病毒的基因组。为了促进病毒从细胞中释放,冻结和解冻的一个或几个周期(步骤9)。病毒的产量可以由TCID50的或斑块检测程序,然后确定。
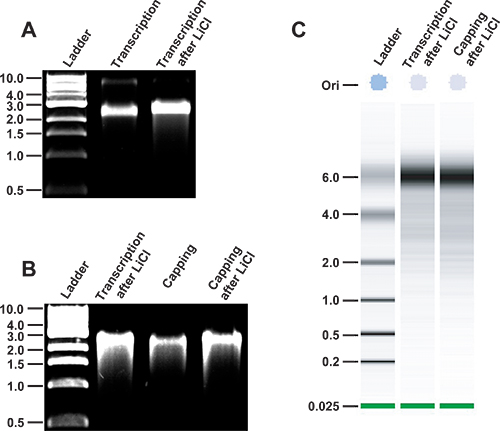
图3。 MNV RNA转录以及完整的协议分析。的MNV RNA的完整性, 在体外合成。首先线性化的质粒PT7:3'Rz MNV使用NHE我限制性内切酶。 DNA纯化后,MNV RNA转录生成在体外利用T7 RNA聚合酶(2车道)。然后提纯RNA是从自由核苷酸由LiCl沉淀(3车道)。转录产物1 kb的DNA梯(New England Biolabs公司,泳道1),非变性的1%琼脂糖凝胶上并行运行。非变性条件下的病毒转录的相对流动性是相似的双链DNA产品的2.5-3 KB。 ,MNV RNA的转录后封盖的完整性。 LiCl沉淀(2车道),以前纯化MNV转录酶封顶(泳道3)和(4车道)LiCl沉淀净化。 C, 安捷伦RNA 6000纳米芯片的的MNV成绩单(第二车道)和皑皑MNV成绩单(三车道),先前已在LiCl沉淀分析。一个单链RNA梯子并行运行。
=“pdflinebreak”> 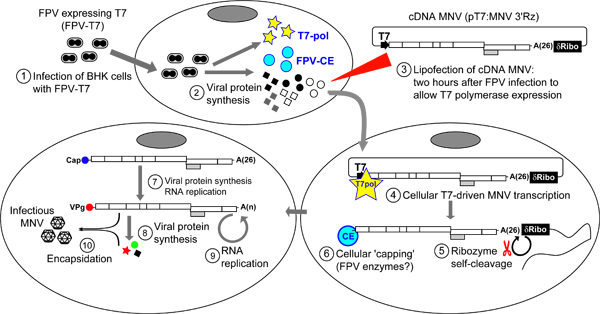
图4。从cDNA感染MNV恢复协议的概述。最初的BSR-T7(或染BHK)细胞与重组鸡痘病毒表达T7噬菌体RNA聚合酶(鸡痘病毒-T7)(步骤1)(鸡痘病毒)感染。受感染的细胞培养2小时前进一步的治疗,让鸡痘病毒蛋白的表达,其中包括重组的T7 RNA聚合酶(步骤2)。事后,PT7:3'Rz MNV转染细胞,通过脂质体2000(Invitrogen公司)(步骤3)。一旦进入细胞,PT7,MNV 3'Rz由T7 RNA聚合酶,其中synthesises MNV RNA转录(步骤4)确认。自裂解δ核酶在基因组的3'末端序列的存在保证谈话3'Terminus位于刚过polyA的尾巴(步骤5)。一些病毒转录细胞上限由鸡痘病毒封盖酶(步骤6)。将被翻译产生MNV这将催化的MNV转录复制的蛋白质产生MNV皑皑的成绩单。新合成的MNV含有适当VPG分子在其5'端的RNA分子将进行连续的复制周期,伴随着病毒翻译,这可能最终导致一代传染病encapsidated病毒。为了促进病毒从细胞中释放,冻结和解冻的一个或几个周期(步骤7)。病毒的产量可以由TCID50的或斑块检测程序,然后确定。
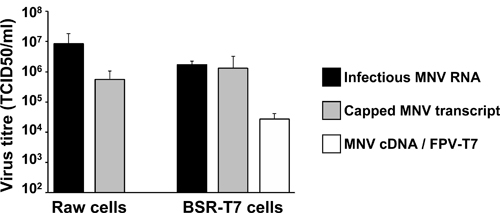
图5。代表从不同的反向遗传学中的文字描述方法获得的病毒滴度结果。灰色条代表霓虹灯在24小时后获得的病毒滴度转染2×10 6 Raw264.7细胞,或之后的2×10 6的BSR-T7 体外转录和皑皑MNV RNA细胞脂质体转染。白条代表通常PT7脂质体后获得的病毒滴度:,MNV 3'Rz(MNV的cDNA)到2×10 6 BSR-T7与鸡痘病毒表达重组T7 RNA聚合酶(鸡痘病毒-T7)2小时以前感染的细胞。作为阳性对照转成原材料和BSR-T7cells,我们通常使用2微克MNV感染的细胞,这些细胞包含VPG联系MNV RNA的高层次提取的RNA。阴性对照组已进行了要么MNV RNA或PT7:MNV 3'Rz编码移码突变(F / S模式),该废止的复制,导致在没有检测到病毒(数据未显示)。
讨论
在这里,我们已经说明了两个不同的反向遗传学的方法,允许在细胞培养感染MNV恢复。这两种方法都有效地绕过为VPG通过代细胞的核糖体,然后由公认的皑皑MNV成绩单病毒RNA基因的5'端共价联动的绝对要求。是更有效地在体外转录酶封顶传染病MNV转录比传染病质粒在细胞表达T7 RNA聚合酶的成绩单,其中可上限由鸡痘病毒封盖酶恢复。与这些反向遗传系统恢复病毒滴度类似VPG联病毒感染的细胞培养17( 图5)纯化的RNA转染获得这些。皑皑MNV RNA进入许可Raw264.7细胞的转染呈现比实验涉及的transfectio的病毒滴度较低只有1日志N含有病毒的VPG联的RNA( 图5)感染的细胞的总RNA。这实际上鼓励了进一步的调查,以确定是否可能导致病毒产量的增加,这可能揭示VPG相关的细胞的基本功能方面MNV传染性的VPG分子除了5'这些系统所产生的最终成绩单。尽管如此,我们认为这种反向遗传学系统作为一种高效,与其他RNA病毒反向遗传学系统目前使用的体外转录RNA滴度只有真正感染病毒颗粒19,20比10-100允许恢复。
总体而言,目前的方法构成了诺罗病毒分子生物学领域的重要一步和提供的工具,我们调查的职能作用的蛋白质和诺罗病毒基因组保守的RNA图案。这些方法已经与C的结合urrent小鼠模型,并已显示出MNV传染性cDNA的恢复是能够引起致命感染- > 80%STAT1的/小鼠在不到10天4,21。利用这一点,我们已经恢复了可行小鼠诺沃克病毒突变的衣壳蛋白和参与结合不同的宿主因素(PTB和选票详情规例)显示,在体内 21,22有点减毒表型的polypyrimidine道系统。此外,我们最近已表明,病毒缺乏表达能力从ORF4 VF1蛋白在细胞培养中有效地复制,但再次减少为WT MNV 8小鼠的毒性。这些研究,鼓励我们设计人类诺如病毒的减毒MNV可作为潜在的候选疫苗调查研究的基础版本。
披露声明
我们什么都没有透露。
致谢
这项研究是由威康信托高级奖学金颁发给伊恩·古德费洛,1居里夫人内欧洲奖学金(欧盟第七框架计划的欧洲研究理事会)授予阿曼多·阿里亚斯。我们要感谢给我们权限,使用安捷伦bioanalyser,帮助运行的RNA样品木卫一香港昌博士丽贝卡罗比和迈克·斯金纳博士。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
| 氯化锂沉淀解决方案 | Ambion公司 | AM9480 | |
| RNA的存储解决方案 | Ambion公司 | AM7000 | |
| MEGAscript T7启动脚本 | Ambion公司 | AM1333 | |
| ScriptCap m7G旋盖系统 | 震中生物技术 | SCCE0610 | |
| 霓虹灯转染系统 | Invitrogen公司 | MPK5000 | |
| 霓虹灯转染系统套件 | Invitrogen公司 | MPK1025 | |
| OPTI-MEM我 | Invitrogen公司 | 31985070 | |
| 脂质体2000转染试剂 | Invitrogen公司 | 11668-027 | |
| 安捷伦RNA的600纳米套件 | 安捷伦 | 5067-1511 | |
| 安捷伦2100 BIoanalyzer | 安捷伦 | G2939AA | |
| 插图GFX总DNA和凝胶带纯化试剂盒 | GE医疗集团 | 28-9034-70 | |
| RiboMAX大规模RNA生产系统-T7 | Promega公司 | P1300 |
参考文献
- Outbreaks of gastroenteritis associated with noroviruses on cruise ships--United States. MMWR Morb. Mortal. Wkly. Rep. 51, 1112-1115 (2002).
- Lopman, B. A. Epidemiology and cost of nosocomial gastroenteritis, Avon, England, 2002-2003. Emerg. Infect. Dis. 10, 2002-2003 (2004).
- Duizer, E. Laboratory efforts to cultivate noroviruses. J. Gen. Virol. 85, 79-87 (2004).
- Karst, S. M., Wobus, C. E., Lay, M., Davidson, J., Virgin, H. W. T. STAT1-dependent innate immunity to a Norwalk-like virus. Science. 299, 1575-1575 (2003).
- Wobus, C. E. Replication of Norovirus in cell culture reveals a tropism for dendritic cells and macrophages. PLoS Biol. 2, e432(2004).
- Bok, K. Inhibition of norovirus replication by morpholino oligomers targeting the 5'-end of the genome. Virology. 380, 328-337 (2008).
- Kim, Y., Thapa, M., Hua, D. H., Chang, K. O. Biodegradable nanogels for oral delivery of interferon for norovirus infection. Antiviral Res. 89, 165-173 (2011).
- McFadden, N. Norovirus Regulation of the Innate Immune Response and Apoptosis Occurs via the Product of the Alternative Open Reading Frame 4. PLoS Pathog. 7, e1002413(2011).
- Kormelink, R., van Poelwijk, F., Peters, D., Goldbach, R. Non-viral heterogeneous sequences at the 5' ends of tomato spotted wilt virus mRNAs. J. Gen. Virol. 73, 2125-2128 (1992).
- Shuman, S., Hurwitz, J. Mechanism of mRNA capping by vaccinia virus guanylyltransferase: characterization of an enzyme--guanylate intermediate. Proc. Natl. Acad. Sci. U.S.A. 78, 187-191 (1981).
- Jang, S. K., Pestova, T. V., Hellen, C. U., Witherell, G. W., Wimmer, E. Cap-independent translation of picornavirus RNAs: structure and function of the internal ribosomal entry site. Enzyme. 44, 292-309 (1990).
- Chaudhry, Y. Caliciviruses differ in their functional requirements for eIF4F components. J. Biol. Chem. 281, 25315-25325 (2006).
- Goodfellow, I. Calicivirus translation initiation requires an interaction between VPg and eIF 4. E. EMBO Rep. 6, 968-972 (2005).
- Herbert, T. P., Brierley, I., Brown, T. D. Identification of a protein linked to the genomic and subgenomic mRNAs of feline calicivirus and its role in translation. J. Gen. Virol. 78 ( Pt5 ), 1033-1040 (1997).
- Chaudhry, Y., Skinner, M. A., Goodfellow, I. G. Recovery of genetically defined murine norovirus in tissue culture by using a fowlpox virus expressing T7 RNA polymerase. J. Gen. Virol. 88, 2091-20100 (2007).
- Ward, V. K. Recovery of infectious murine norovirus using pol II-driven expression of full-length cDNA. Proc. Natl. Acad. Sci. U.S.A. 104, 11050-11055 (2007).
- Yunus, M. A., Chung, L. M., Chaudhry, Y., Bailey, D., Goodfellow, I. Development of an optimized RNA-based murine norovirus reverse genetics system. J. Virol. Methods. 169, 112-118 (2010).
- Arias, A., Perales, C., Escarmis, C., Domingo, E. Deletion mutants of VPg reveal new cytopathology determinants in a picornavirus. PLoS One. 5, e10735(2010).
- Werf, S. vander, Bradley, J., Wimmer, E., Studier, F. W., Dunn, J. J. Synthesis of infectious poliovirus RNA by purified T7 RNA polymerase. Proc. Natl. Acad. Sci. U.S.A. 83, 2330-2334 (1986).
- Bailey, D., Thackray, L. B., Goodfellow, I. G. A single amino acid substitution in the murine norovirus capsid protein is sufficient for attenuation in vivo. J. Virol. 82, 7725-7728 (2008).
- Bailey, D. Functional analysis of RNA structures present at the 3' extremity of the murine norovirus genome: the variable polypyrimidine tract plays a role in viral virulence. J. Virol. 84, 2859-2870 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。