需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
验尸报告组织心肌细胞核分离
摘要
心肌细胞核通过密度沉淀分离与1 pericentriolar材料(PCM-1)识别和排序流式细胞仪检测心肌细胞核抗体immunolabeled。
摘要
鉴定心肌细胞的细胞核已在组织切片挑战,因为大多数的战略仅依靠细胞质标记蛋白1。在罕见的事件,如心肌细胞增殖和凋亡需要的心肌细胞的细胞核的准确识别,分析细胞在病理条件下的稳态和重建。在这里,我们提供了一种方法来隔离验尸组织密度沉淀和免疫标记抗体对pericentriolar材料(PCM-1)和随后的流式细胞仪分选心肌细胞核。这一战略使一个高吞吐量的分析与新鲜组织和冰冻的档案材料,同样的工作的优势和隔离。这使人们有可能已经在生物银行收集研究材料。这项技术是适用和广泛的物种进行测试,适用于多种下游应用,如碳14约会3,细胞CYCLE分析,可视化胸腺嘧啶核苷类似物(如BrdU和IDU)4,转录组和表观遗传分析。
研究方案
1。分离心脏核
- 外套超离心管(贝克曼离心管#363664)10毫升1%BSA / PBS涂层解决方案。例管,并让他们旋转管旋转30分钟。删除的涂层解决方案,让空气干燥离心管(每管小鼠心脏单小鼠心脏,交替上升至5小鼠心脏或1克的心脏组织的分析,从不同的物种(如人类)可以处理在一管)。
- 以下所有步骤应在冰上进行。解剖用手术刀从新鲜或冷冻单元的小鼠心脏的左心室。请注意,此协议进行了优化,对小鼠心脏,但也可以适应老鼠或人类的心脏。另外,使用1克的心脏组织,从不同的物种。
- 用手术刀修剪成小隔间的标本。
- 组织块转移到一个50毫升的猎鹰裂解液15毫升钢管。
- 均质的心脏组织的T-25超Turrax探头均质(伊嘉)为10秒24,000转。
- 同等体积的裂解液30毫升稀释匀浆。
- 使用玻璃douncer(40毫升)进一步均质的组织和自由的原子核。执行一个大型的间隙杵八杆。
- 通过粗核隔离通过100μm和70μm的尼龙网格过滤器(BD Biosciences公司),连续。
- 原油核自旋向下隔离在一个冷冻离心机(4℃)10分钟在700 XG。
- 小心去除上清相管和擦拭纸巾筒内部。要小心不要打扰细胞核沉淀。
- 溶解粗核蔗糖缓冲5毫升的隔离,吸取解决方案几次上下。添加蔗糖缓冲另有25毫升溶解的颗粒。
- 加入10毫升新鲜制备的蔗糖缓冲涂层的超高速离心管(见第1.1步)。
- 仔细覆盖重悬细胞核从步骤1.9的缓冲蔗糖溶解的颗粒蔗糖缓冲增加了10毫升。
- 之前,他们到JS13.1自由摆动转子平衡离心管中,并放入高速离心机(贝克曼阿凡提的S-25)的转子。
- 在4°C的自旋核样本为60分钟13,000 XG。
- 当自旋已完成,取出管小心从转子和丢弃反相管上清液和擦拭用纸巾管内剩余的碎片。
- 溶解在细胞核存储缓冲区(国安局加上缓冲区)1毫升的核颗粒。注:加国安局包含1.5毫米胺作为一种DNA稳定。
- 进行步骤2.1中,心肌细胞核染色。
2。免疫组织化学染色的流式细胞仪
- 准备染色阴性对照。以细胞核样品20μL出等分和DD 980μL国安局加缓冲。
- 在1:500稀释到immunolabel心肌细胞核的核样本加入反pericentriolar的材料1抗体(兔抗 - PCM-1,阿特拉斯抗体)。加入相同的稀释步骤2.1准备,作为反PCM-1抗体阴性对照同型抗体。
- 孵育4℃过夜,阴性对照和样品管。
- 阴性对照和样品洗净至少一次与国安局加缓冲(降速管在10分钟的700 XG在冷冻离心机(4℃),弃去上清和细胞核沉淀溶于1毫升国安局加缓冲)。
- 添加抗兔荧光二抗(FITC或APC)在1:1000稀释阴性对照和样品管。
- 在4°C孵育1小时阴性对照和样品管。
- 阴性对照和样品洗净至少一次与国安局,加上缓冲区(700 XG降速管在冷冻离心机(4℃)10分钟。弃上清和细胞核沉淀溶于1毫升国安局加缓冲)。
- 进行流式细胞仪分析和排序。
3。流式细胞仪
- 大衣核收集管(猎鹰15毫升),1%BSA / PBS溶液,然后再开始流式细胞仪分选步骤1.1中所述。
- 过滤器通过30微米的细胞过滤器的样品和阴性对照和加载第一个阴性对照,流式细胞仪(屋宇署流入)。定义界定汗衫和核(单核),基于前向散射(FSC),前向散射脉冲宽度(FS脉宽)和侧散射(SSC)( 图2a和b)的第一和第二门。添加样品的DNA染色(DRAQ5(1:500)),可以帮助识别原子核人口的最初。
- 加载immunolabeled样品和定义的第三个门,隔离非心肌细胞的细胞核(PCM-1负)心肌细胞核(PCM-1,收集到阳性)。开始排序( 图2c和d)。
可选:为了分析核DNA含量(套数),并进行细胞周期分析,添加适当的DNA染色的原子核(如赫斯特33342或DRAQ5),( 图2e)。
- 经过流式细胞仪分选,放在冰核和重新分析,以确定排序纯度( 图3a和b)。
- 在15分钟的冷冻离心机在1500 XG分类收集管核自旋向下。
- 细胞核沉淀溶解在缓冲区与下游应用兼容。
4。代表结果
细胞核形态和完整性可以通过DNA污渍和评估( 图1)显微镜观察。评估成功的PCM-1的标签可以通过荧光显微镜和流式细胞仪( 图1和图2c和d)。 PCM-1-positive和消极的人群应彼此分开( 图2c和d)。约30%的所有核应该在小鼠左心室心肌细胞核( 图2d)。排序纯度可通过重新分析排序的细胞核( 图3a和b)评估。两个原子核的人群应该有一个排序纯度超过95%。
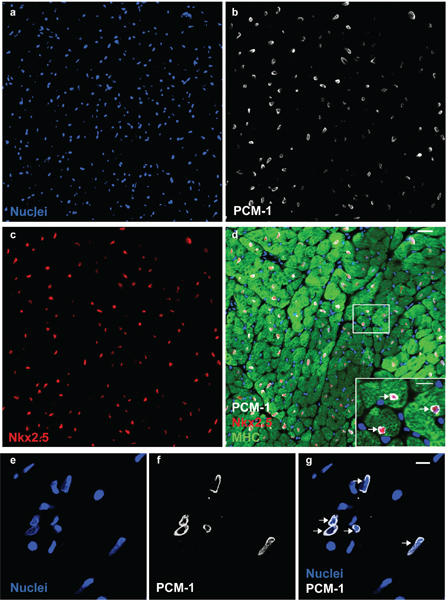
图1。 PCM-1识别心肌细胞核。心肌细胞核(一)与PCM-1(B)和Nkx2.5(三)在成年鼠心脏的抗体染色。 (四)PCM-1标记的细胞核周围心肌细胞的细胞质(肌球蛋白重链(MHC))和心肌细胞核的准确识别,记录PCM-1染色(比例尺为20μm和10表达的转录因子Nkx2.5微米(D,插图))。 (五)心肌细胞核分离可视化与DNA染色DRAQ5。 (f和g)CardiomyocYTE细胞核标记抗体对PCM-1(比例尺为10微米)。请注意,PCM-1 epinuclear染色组织切片的心肌细胞的细胞核和孤立的细胞核(箭头)模式。
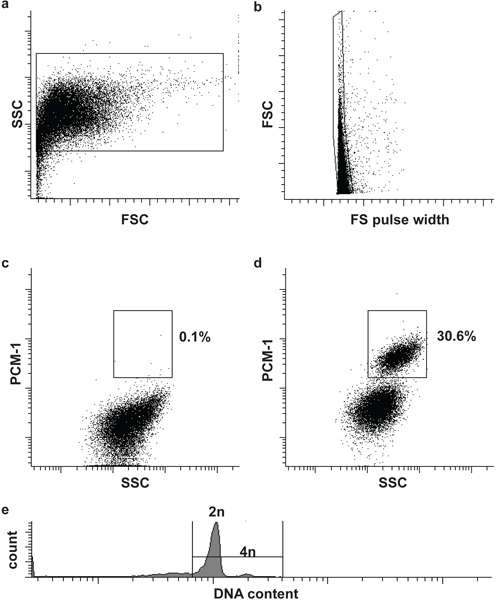
图2。流式细胞仪分选 (一) 心肌细胞的细胞核。心肌细胞核确定前向散射(FSC)和侧散射(SSC)。 (二)第二个门标识单核FSC和FS脉冲宽度5。 (C,D)荧光门使心肌细胞核的分离(PCM-1-阳性)和非心肌细胞(PCM-1负),从心脏组织的细胞核。 (五)鼠心肌细胞大多(> 80%)二倍体(2n),只有一小部分是四倍体(4N)6。请注意,人类心肌细胞中含有的多倍体核的频率较高(> 2N)7,8。

讨论
心肌细胞核的准确鉴定为2,3在心肌再生过程的分析是至关重要的。主要是基于传统技术从新鲜组织分离的心肌细胞细胞外基质蛋白消化酶和随后的间质细胞,低速离心净化。从胚胎干细胞(ESC)的生活心肌的进一步净化可进行免疫标记表面标志物,如9或10 SIRPA线粒体染料,固定的心肌细胞可以识别如肌球蛋白重链(MHC)或核蛋白质,如细 胞质标记GATA4或Nkx2.5。然而,N...
披露声明
没有利益冲突的声明。
致谢
我们要感谢马塞洛·托罗用流式细胞仪的协助下。这项研究是由瑞典的心脏和肺脏基金会,欧盟委员会第七框架计划“CardioCell”,瑞典研究理事会,亚洲电影大奖保险和ALF的支持。转播是由德意志研究联合会的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1。裂解液 | |||
| 试剂名称 | |||
| 0.32米蔗糖 | |||
| 10毫米的Tris-HCl(pH值= 8) | |||
| 5毫米氯化钙2 | |||
| 5 mM的醋酸镁 | |||
| 2.0毫米EDTA | |||
| 0.5毫米EGTA | |||
| 1 mM的数码地面电视 |
| 2。蔗糖缓冲 |
| 试剂名称 |
| 2.1 M蔗糖 |
| 10毫米的Tris-HCl(pH值= 8) |
| 5 mM的醋酸镁 |
| 1 mM的数码地面电视 |
| 3。原子核存储缓冲区(国安局加上) |
| 试剂名称 |
| 0.44中号蔗糖 |
| 10毫米的Tris-HCl(pH值= 7.2) |
| 70毫米氯化钾 |
| MgCl 2的 10毫米 |
| 1.5毫米精 |
| 试剂和设备 | 公司 |
| 同型兔IgG-CHIP级,#ab37415 | abcam |
| 兔抗-PCM-1抗体,#HPA023374 | 阿特拉斯抗体 |
| 驴秒。抗体,抗兔Alexa的488福陆公司,#21206或等效秒。荧光抗体 | 生命科技 |
| DRAQ5 | biostatus |
| 细胞过滤30微米,70微米和100微米 | BD公司 |
| 玻璃douncer(40毫升)杵“L” | 厂商VWR(惠顿实业公司) |
| 的T-25的超Turrax均质 | 的IKA德国 |
| 分散工具S25的N-18Ğ | 的IKA德国 |
| 贝克曼阿凡提离心机 | 贝克曼 |
| 猎鹰管15毫升和50毫升 | 厂商VWR |
| 贝克曼离心管#363664 | 贝克曼 |
| JS13.1自由摆动转子 | 贝克曼 |
| 涌入流式细胞仪 | 贝克曼 |
| 管肩 | 厂商VWR |
参考文献
- Ang, K. L. Limitations of conventional approaches to identify myocyte nuclei in histologic sections of the heart. American journal of physiology. Cell physiology. , 298-1603 (2010).
- Bergmann, O. Identification of cardiomyocyte nuclei and assessment of ploidy for the analysis of cell turnover. Experimental cell research. 327, 188-194 (2011).
- Bergmann, O. Evidence for Cardiomyocyte Renewal in Humans. Science. 324, 98-102 (1126).
- Walsh, S. Cardiomyocyte cell cycle control and growth estimation. Cardiovascular Research. , 1-31 (2010).
- Spalding, K., Bhardwaj, R. D., Buchholz, B., Druid, H., Frisén, J. Retrospective birth dating of cells in humans. Cell. 122, 133-143 (2005).
- Adler, C. P., Friedburg, H., Herget, G. W., Neuburger, M., Schwalb, H. Variability of cardiomyocyte DNA content, ploidy level and nuclear number in mammalian hearts. Virchows Arch. 429, 159-164 (1996).
- Herget, G. W., Neuburger, M., Plagwitz, R., Adler, C. P. DNA content, ploidy level and number of nuclei in the human heart after myocardial infarction. Cardiovascular Research. 36, 45-51 (1997).
- Adler, C. P., Friedburg, H. Myocardial DNA content. ploidy level and cell number in geriatric hearts: postmortem examinations of human myocardium in old age. Mol. Cell Cardiol. 18, 3953-39 (1986).
- Dubois, N. C. SIRPA is a specific cell-surface marker for isolating cardiomyocytes derived from human pluripotent stem cells. Nature. 29, 1011-1018 (2011).
- Hattori, F. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature Methods. 7, 61-66 (2010).
- Fransioli, J. Evolution of the c-kit-Positive Cell Response to Pathological Challenge in the Myocardium. Stem Cells. 26, 1315-1324 (2008).
- Elliott, D. A. NKX2-5(eGFP/w) hESCs for isolation of human cardiac progenitors and cardiomyocytes. Nature Methods. 8, 1037-1040 (2011).
- Laflamme, M. A. Evidence for Cardiomyocyte Repopulation by Extracardiac Progenitors in Transplanted Human Hearts. Circulation Research. 90, 634-640 (2002).
- Srsen, V., Fant, X., Heald, R., Rabouille, C., Merdes, A. Centrosome proteins form an insoluble perinuclear matrix during muscle cell differentiation. BMC cell biology. 10, 28 (2009).
- Spoelgen, R. A novel flow cytometry-based technique to measure adult neurogenesis in the brain. Journal of neurochemistry. 119, 165-175 (2011).
- Soonpaa, M. H., Kim, K. K., Pajak, L., Franklin, M., Field, L. J. Cardiomyocyte DNA synthesis and binucleation during murine development. The American journal of physiology. 271, H2183-H2189 (1996).
- Olivetti, G. Aging, cardiac hypertrophy and ischemic cardiomyopathy do not affect the proportion of mononucleated and multinucleated myocytes in the human heart. J Mol Cell Cardiol. 28, 1463-1477 (1996).
- Okada, S. Flow cytometric sorting of neuronal and glial nuclei from central nervous system tissue. Journal of cellular physiology. 226, 552-558 (2011).
- Matevossian, A., Akbarian, S. Neuronal Nuclei Isolation from Human Postmortem Brain Tissue. J. Vis. Exp. (20), e914 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。