Method Article
高通量顺序酶联免疫吸附试验的急性移植物抗宿主病的生物标志物的验证
摘要
多个候选生物标志物的高吞吐量的验证可以通过顺序ELISA进行,以尽量减少冷冻/解冻循环和使用珍贵的血浆样品。在这里,我们演示了如何依次进行验证六种不同的血浆生物标志物的酶联免疫吸附 1-3
摘要
偏发现蛋白质组学研究策略有可能确定大量的新型生物标志物的检测,在临床上可以提高诊断和预后,并可能有助于指导治疗干预。当大量的候选蛋白,它可能是难以验证的候选生物标志物的及时和有效的方式,从患者的血浆样本是事件驱动的,有限的,不可替代的量,如在发病的急性移植物抗宿主病(GVHD),异基因造血干细胞移植(HSCT)的一个潜在的危及生命的并发症。
在这里,我们描述的过程中,执行6验证的移植物抗宿主病(GVHD)的蛋白质的市售的ELISA试剂盒:IL-2Rα5星 ,TNFR1 6,肝细胞生长因子7,IL-8 8,elafin 2,和REG3α3(也称为PAP1)以顺序的方式,以尽量减少冻融循环,解冻的血浆和血浆的使用。对于此过程中,我们进行了酶联免疫吸附顺序确定样品稀释倍数作为建立在我们的实验室制造商ELISA试剂盒和协议细微的调整,以方便最优顺序ELISA性能。由此产生的血浆生物标志物的浓度可以被编译和重大的发现在患者队列分析。虽然这些生物标志物是目前仅用于研究目的,将其纳入临床护理,目前正在临床试验中。
此技术也可应用于在同一样品上执行多个感兴趣的蛋白/细胞因子ELISA试剂盒()提供的样品不需要与其它试剂混合。如果ELISA试剂盒不配备预涂覆板,96孔半孔板或384孔板可以使用,以进一步减少使用的样本/试剂。
引言
3个器官系统功能障碍:急性移植物抗宿主病(GVHD),异基因造血干细胞移植(HSCT)的非复发死亡率(NRM)的首要原因,是衡量皮肤,肝脏和胃肠道(GI)道4。急性移植物抗宿主病通常发生移植后2至8个星期,但以后可能会出现,往往是临床上区分其他造血干细胞移植后的并发症,如预处理方案的毒性,感染或药物副作用。通过使用蛋白质组策略和高通量的验证,使用连续的ELISA,我们已经确定了6种蛋白质的浓度升高开始时,移植物抗宿主病的临床表现。 IL-2Rα,TNFR1,HGF和IL-8,组合成4的生物标志物面板时,可诊断移植物抗宿主病发病的临床症状,并能独立预测造血干细胞移植后生存期的移植物抗宿主病(GVHD)的严重性1。 Elafin,移植物抗宿主病的生物标志物的SK,可以区分移植物抗宿主病(GVHD)的皮疹和疹因其他原因(如药疹)和可以预测移植存活2。我们最近确定REG3α的作为生物标志物,移植物抗宿主病的下消化道,靶器官与NRM。的等离子REG3α浓度能够可靠地识别移植物抗宿主病造血干细胞移植后腹泻的原因和相关的诊断肠道活检组织学,移植物抗宿主病的严重程度。胃肠道移植物抗宿主病发病REG3α浓度也可以预测移植物抗宿主病治疗和NRM 3的响应。将这些经过验证的移植物抗宿主病(GVHD)的生物标志物进入临床护理临床试验,目前正在调查中。
这些实验是在接受造血干细胞移植治疗的患者,在2000年至2010年间的移植物抗宿主病(GVHD)发生的时间,是不可替代的,数量有限的小收集的血浆等份。由于这些样本的珍贵性,我们已经开发出一种MET排泥测量多个血浆蛋白浓度,在一个有效的,可重复的方式,以消除过量的冻结 - 解冻周期,解冻时间和血浆使用。此技术也可应用于在同一样品上执行多个感兴趣的蛋白/细胞因子ELISA试剂盒()提供的样品不需要与其它试剂混合。如果ELISA试剂盒不配备预涂覆板,96孔半孔板或384孔板可以使用,以进一步减少使用的样本/试剂。稿件侧重于技术方面的测量移植物抗宿主病(GVHD)的生物标志物。
研究方案
1。实验第0天:样品制备和ELISA检测涂层钢板捕获抗体,IL-2Rα,REG3α和肝细胞生长因子
- 血浆的等分试样以进行分析样品将被拉到,解冻,并在12,000 rpm离心10分钟以分离在底部和顶部从血浆中的脂质对血栓纺丝。到一个96孔V底板上,从每个样品中加入150μl未稀释的等离子体将被镀(源板)由手动移液,根据预先定义的映射。等分试样将在封口膜包裹,并在整个过程中保持在潮湿的腔室中,在4℃,不长于72小时。
- IL-2Rα和HGF捕获抗体将会重组,每个制造商的规格和50μl稀释成各自的96孔高结合半孔板中,然后将其密封,并温育过夜,在4℃下的各孔镀覆另外,许多板,可以在37℃下干燥,并保存在4℃,供以后使用,取决于ING上的蛋白质的稳定性。
- 将根据制造商的协议,使用制造商的包被缓冲液和25μl稀释REG3α捕获抗体将被镀在384孔Nunc公司马克西SORP板的各孔中,然后密封,并温育过夜,在4℃下
2。实验第1天:IL-2Rα的酶联免疫吸附(图1)
- 洗涤的IL-2Rα的试验板,在TBS与BLOTTO中断,标准重组,一个8点的标准曲线制备按制造商协议。
- 洗涤后的板的分块步骤之后,加入50μl未稀释的血浆镀在重复从源板的ELISA试验板,和50μl的每个标准镀一式两份。板密封并在室温下孵育2小时,在平板上旋转器设定为300rpm。
- 回收等离子体从IL-2Rα的酶联免疫吸附试验板,并重新设置在未稀释等离子体源板。 ELISA完成每个制造商协议(与调整一半孔板的卷)的各孔的光密度,使用读板器设置为450-570纳米,将被读取,并且数据保存和分析。
3。实验第1天:REG3αELISA(图1)
- 将被转移到一个单独的V形底部源板10微升未稀释的血浆。制造商提供的稀释缓冲液的90微升被加入到各孔中,以创建一个1:10稀释源板。
- REG3αELISA法进行每个制造商的协议(384孔板调整与卷)和各孔的光密度值,将被设置为450-620 nm的用酶标仪读取,并且将被保存的数据和分析。
4。实验第1天:Elafin和的TNFR1测试涂层钢板捕获抗体
- Elafin和TNFR1捕获抗体的重组和稀uted每个制造商的规格和50μl接种到各自的96孔高结合半孔板中,然后将其密封,并在室温下温育过夜Elafin的各孔中,并在4℃下TNFR1。
5。实验日1-2:HGF ELISA(图1)
- 完成后IL-2RαELISA和保证测试并不需要重复,60微升未稀释的血浆将转移到一个新的源板,然后被加入到各孔60微升1×PBS的1%BSA的作出1:2稀释血浆源板。
- 洗涤HGF的试验板,在TBS与BLOTTO中断,标准重组,一个8点的标准曲线制备按制造商协议。
- 洗涤后的板的分块步骤之后,加入50μl的1:2稀释血浆镀上的酶联免疫吸附试验板,一式两份,每一个标准的50微升镀一式两份。该板被密封并在室温下温育过夜,在平板上旋转器设置在300 RPM。
- 1:2稀释血浆肝细胞生长因子酶联免疫吸附试验板被收回,并放置在1:2的稀释血浆源板。 ELISA完成每个制造商协议(与调整一半孔板的卷)的各孔的光密度,使用读板器设置为450-570纳米,将被读取,并且数据保存和分析。
6。实验第2天:Elafin ELISA
- 将被转移到一个新的源板10微升未稀释的血浆,然后在1×PBS中的1%BSA的190微升将被添加到每个孔中,使200微升血浆dluted 1:20。
- Elafin ELISA法,根据制造商的协议(与卷调整半孔板),以及各孔的光密度,将被设置为450-570 nm的使用平板读取器读出,并保存的数据和分析。
7。实验大Y 2:TNFR1 ELISA
- 将被添加到1:20源板(现在1:20等离子体含有100微升),得到125微升1:25稀释血浆25μl的1%BSA的PBS。
- TNFR1 ELISA的每个制造商协议完成(与调整一半孔板的卷)和各孔的光密度,使用读板器设置为450-570纳米,将被读取,并保存的数据和分析。
8。实验第2天:IL-8 ELISA
- 1:2稀释血浆的60微升转移到一个新的源板,然后被添加到各孔中,使一个1:6的稀释血浆源板180μl的IL-8的稀释剂。
- 的IL-8 ELISA的每个制造商协议完成(与调整一半孔板的卷)和将被读取各孔的光密度值,使用平板读取器设置为450-570纳米,和保存的数据和分析。
一旦所有的ELISA试剂盒已经完成,unuseD存量等离子体将被替换成解冻的等分试样,并冷冻,以备将来使用。
结果
生物标志物的工作流程和时间安排详列于表1和表2分别。一旦完成后,6个不同的蛋白质的浓度,现在已经被量化相同的血浆样品中,总共使用了150μL血浆。电镀样品一式两份,每份每次测试允许内部的质量保证,与CV的小于10%是最佳的。如果执行的顺序ELISA在多个板,一致的高标准的光密度是优选的,并允许改进的板间的测量的可靠性;看评估在ELISA性能不一致的( 图2),板之间的可比较的标准曲线外径。在我们的实验室中观察到的各生物标记物的开发时间,使用四甲基联苯胺比色法基板和高浓 度的外径在表3中列出。
tp_upload/4247/4247fig1.jpg“ALT =”图1“/>
图1 IL-2Rα,REG3α和肝细胞生长因子ELISA试剂盒的工作流程。血浆样品后已镀上的IL-2Rα的酶联免疫吸附试验板,它被回收,使稀释的源其他的ELISA板。对于肝细胞生长因子酶联免疫吸附,血浆回收1:6稀释平板IL-8的准备。 点击查看大图 。
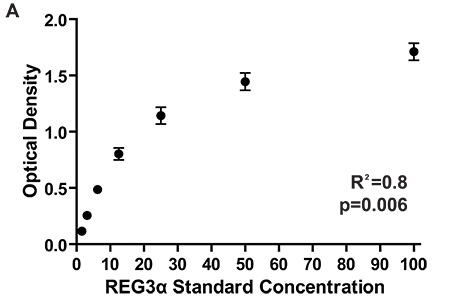
图2的7种不同的ELISA板,测量对应于测试的初始REG3αGI移植物抗宿主病的生物标志物报告3 1084例REG3α浓度的标准曲线的光学密度。板块之间的一致消耗臭氧层物质保证板块之间的一致的蛋白浓度测量。蛋白质的浓度血浆样品中通过对比样品的光密度的标准曲线的光密度计算。
| 实验第0天 | 1。准备样品 |
| 2。 IL-2Rα,HGF和REG3α的捕获抗体 | |
| 实验第1天 | 1。 IL-2RαELISA的 |
| 2。 REG3αELISA | |
| 3。 HGF ELISA(通过抽样电镀) | |
| 4。 Elafin捕获抗体和肿瘤坏死因子受体 | |
| 实验第2天 | 1。 HGF ELISA完成 |
| 2。 Elafin ELISA | |
| 3。 TNFR1 ELISA | |
| 4。 IL-8 ELISA | |
| 5。重新冻结未使用的血浆 |
表1。移植物抗宿主病生物标记物的工作流程概观
| 0天 | 样品制备和隔夜捕捉身体孵化 | ||||||
| ELISA | IL-2Rα | REG3α | HGF | Elafin | TNFR1 | IL-8的 | |
| 时间(小时) | 0.0 | 闭塞 | |||||
| 1.0 | 样品镀 | ||||||
| 3.0 | 回收血浆样品,检测抗体 | ;样品制备(1:10稀释) | |||||
| 4.0 | 样品镀(1:10) | ||||||
| 5 | 链霉亲和素-HRP | 检测抗体 | |||||
| 5.5 | TMB | 链霉亲和素-HRP | |||||
| 6 | 读板机 | TMB | 封锁,准备样品(1:2稀释) | ||||
| 6.5 | 读板机 | ||||||
| 7 | 样片镀(1:2) | 捕获抗体(过夜培养) | 捕获抗体(过夜培养) | ||||
| 第2天 | |||||||
| 时间(小时) | 0.0 | 回收血浆,检测抗体 | 封锁,准备样品(1:20) | ||||
| 1.0 | 样品电镀(1:2) | ; 1:20的样品进一步稀释到1:25稀释 | |||||
| 2.0 | HRP | 样品电镀(1:25) | |||||
| 2.5 | TMB | ||||||
| 3.0 | 读板机 | 检测抗体 | |||||
| 3.5 | 准备样品(1:6稀释) | ||||||
| 4.0 | 检测抗体 | 样品电镀(1:6) | |||||
| 5 | HRP | ||||||
| 5.5 | TMB | ||||||
| 6 | 读板机 | HRP | 检测抗体 | ||||
| TMB | |||||||
| 7 | 读板机 | TMB | |||||
| 7.5 | 读板机 | ||||||
| 完成后 | 原料血浆替换装冻结以备后用 | ||||||
表2。进行酶联免疫吸附的时间表。
| 等离子稀释因子 | 高标准浓度 | 基板的开发时间(分钟) | 高OD | 曲线 | |
| IL-2Rα | 1:1 | 2000皮克/毫升 | 5 | 1 | 线性 |
| HGF | 1:2 | 4000皮克/毫升 | 22 | 2.1 | 4 - 参数 |
| IL-8的 | 1:6 | 200皮克/毫升 | 12 | 2.7 | 4 - 参数 |
| REG3α | 1:10 | 100纳克/毫升 | 12 | 1.7 | 4 - 参数 |
| Elafin | 1:20 | 2000皮克/毫升 | 20 | 1.9 | 4 - 参数 |
| TNFR1 | 1:25 | 800皮克/毫升 | 8 | 2.7 | 线性 |
表3。ELISA详情6移植物抗宿主病(GVHD)的生物标志物。
讨论
顺序ELISA这里介绍的方法可以用于测量多个血浆蛋白,这可能是难以获取和/或不可替代的,如从人类受试者的样品与罕见疾病或血浆样品从小鼠9,10获得关于小体积的血浆。通常执行的顺序的ELISA在增加血浆稀释因子的顺序,用ELISA试剂盒需要血浆稀释的≥1:10通常不需要被回收的,虽然如果需要的话,可以做到。的能力来执行顺序的酶联免疫吸附由等离子体与其它试剂混合,或为不同的稀释液所需要的等离子体的ELISA试剂盒/协议的限制,这排除了重新使用一个样本ablility由于担心不兼容的缓冲/试剂会干扰与一个特定的测试的性能。通过精心规划,10个或更多的ELISA试剂盒可以执行相同的血浆样本。
ENT“>个人实验室可能需要调整血浆稀释,以便有根据预期的血药浓度的蛋白质样品从考试科目的兴趣可解释的结果。实验室设备的差异,可能会导致在需要优化的孵化和色度发展次,洗涤次数和/或洗浸泡时间,以优化任何给定的ELISA法。为了增加高通量能力和准确性,在成本效益的方式进行分析,使用机器人的液体处理平台,能够分析在384孔板上堆积单元和一个自动洗板推荐。该设备可以提高准确度和精密度由多个用户进行分析,并提供分析的一致性,以减少间和批内变异。
我们使用顺序ELISA的可复用平台的原因有两个:1)大部分的新型蛋白质的抗体对不能很容易地珠或其它材料上,以及共轭耗时和昂贵的; 2)单独的ELISA测定是更精确的比复用微阵列或珠粒,继发没有交叉反应性11。如果建立了一种可靠的方法来执行多路复用,珠为基础的微阵列,它可以是能够替换的顺序ELISA过程,但可能是有限的共轭的抗体的能力,珠和/或期望的蛋白质由数量进行了分析。
披露声明
没有利益冲突的声明。
致谢
国立卫生研究院资助RC1-HL-101102,P01-CA039542,T32-HL007622,哈特韦尔基金会,和多丽丝公爵慈善基金会的支持下。 Paczesny博士是研究员埃里克·哈特韦尔基金和艾米Strelzer的Manasevit研究计划。
材料
| Name | Company | Catalog Number | Comments |
| 的试剂的名称 | 公司 | 目录编号 | 评论 |
| 人类IL-2 R字母DUOSET | R&D Systems公司 | DY223 | |
| 人肝细胞生长因子DUOSET | R&D Systems公司 | DY294 | |
| 人类IL-8 OptEIA KIT II | Becton Dickinson公司 | 550999 | |
| AB匹配总成人PAP1(REG3α)的工具包 | MBL国际 | 5323 | |
| AB比赛UNIVERSAL套件 | MBL国际 | 5310 | |
| 人类sTNFRI/TNFRSF1A DUOSET | R&D Systems公司 | DY225 | |
| 人类Trappin-2/Elafin DUOSET | R&D施茎 | DY1747 | |
| 96 - 孔聚苯乙烯锥形底板 | Thermo Scientific的 | 249570 | 用于等离子体源板 |
| Costar公司半井的高结合96 - 孔板 | 康宁 | 3690 | 对于IL-2Rα,HGF,TNFR1和elafin ELISA试剂盒 |
| Nunc公司384给MaxiSorp板 | Nunc公司 | 464718 | 对于REG3αELISA |
| 胎牛血清磷酸盐缓冲液,1个 | Thermo Scientific的 | SH30256.02 | |
| 牛血清白蛋白组分V,热休克治疗 | Fisher Scientific则 | BP1600-100 | |
| 在TBS的拦截器BLOTTO | Thermo Scientific的 | 37530 | IL-2Rα肝细胞生长因子和TNFR1酶联免疫吸附阻断剂 |
| Dulbecco的磷酸盐缓冲液 | Gibco公司 | 21600-069 | 洗涤缓冲液,肝细胞生长因子IL-2Rα,Elafin和TNFR1酶联免疫吸附 |
| TMB过氧化物Susbtrate | Kirkegaard和佩里实验室 | 50-76-00 | |
| 吐温20 | Acros Organics公司 | 233362500 | 洗涤缓冲液,肝细胞生长因子IL-2Rα,Elafin和TNFR1酶联免疫吸附 |
| 硫酸 | Sigma-Aldrich公司 | 84720 | (稀释到2N)的一站式解决方案 |
参考文献
- Paczesny, S. A biomarker panel for acute graft-versus-host disease. Blood. 113, 273-278 (2009).
- Paczesny, S. Elafin is a biomarker of graft-versus-host disease of the skin. Science Translational Medicine. 2, 13ra12 (2010).
- Ferrara, J. L. Regenerating islet-derived 3 alpha is a biomarker of gastrointestinal graft-versus-host disease. Blood. , (2011).
- Ferrara, J. L., Levine, J. E., Reddy, P. Graft-versus-host disease. Lancet. 373, 1550-1561 (2009).
- Miyamoto, T. Serum concentration of the soluble interleukin-2 receptor for monitoring acute graft-versus-host disease. Bone Marrow Transpl. 17, 185-190 (1996).
- Holler, E. Role of tumor necrosis factor alpha in acute graft-versus-host disease and complications following allogeneic bone marrow transplantation. Transplant. Proc. 25, 1234-1236 (1993).
- Okamoto, T. Increased hepatocyte growth factor in serum in acute graft-versus-host disease. Bone Marrow Transpl. 28, 197-200 (2001).
- Uguccioni, M. Elevated interleukin-8 serum concentrations in beta-thalassemia and graft-versus-host disease. Blood. 81, 2252-2256 (1993).
- Osuchowski, M. F., Siddiqui, J., Copeland, S., Remick, D. G. Sequential ELISA to profile multiple cytokines from small volumes. J. Immunol. Methods. 302, 172-181 (2005).
- Osuchowski, M. F., Remick, D. G. The repetitive use of samples to measure multiple cytokines: the sequential ELISA. Methods. 38, 304-311 (2006).
- Schweitzer, B. Multiplexed protein profiling on microarrays by rolling-circle amplification. Nat. Biotechnol. 20, 359-365 (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。