需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
枚举主要外周血白细胞人口多中心临床试验,使用全血表型分析
摘要
在这份报告中,我们展示了染色和分析步骤,新鲜全血进行列举主要的先天免疫和适应性白细胞种群的表型分析。执行这些程序在多中心临床试验的背景下,我们强调的注意事项。
摘要
外周血白细胞的超低温保存的被广泛用来保存在临床试验中的细胞的免疫应答的评估,为便于和标准化的免疫学评估提供了许多优点,但在此过程中的有害影响已被观察到一些细胞亚群,如粒细胞,B细胞和树突状细胞1-3。含量测定新鲜的白 细胞在体内的细胞状态,给出了更准确的图片,但往往是难以执行的背景下,大规模的临床试验。新鲜的细胞检测是依赖于志愿者的承诺和时限,如果费时,他们的应用程序可以是不切实际的,由于实验室工作人员的工作时间要求。此外,在多个中心进行试验时,与要执行的检测的资源和培训实验室可能不会被位于足够接近临床站点。为了解决这些问题,我们已经开发开发了一个11-色抗体染色面板,可以使用Trucount管(Becton Dickinson公司,圣何塞,加利福尼亚州)的表型和外周血内列举主要的白细胞种群,得到更强大的细胞类型特异性的信息比检测诸如全血细胞计数(CBC)或分析与市售面板设计Trucount管,染色只有少数细胞类型。染色过程很简单,只需要100微升新鲜全血,需时约45分钟,使其成为可行的标准的血液处理实验室执行。它改编自BD Trucount管技术数据表( 8/2010 )。在中央检测实验室,可以在散装提前准备染色的抗体鸡尾酒,运到现场处理实验室。可以是固定的彩绘管冻结装运中央多色流式细胞仪分析检测实验室。从这种染色面板生成的数据可以被用来追踪干预有关的白细胞浓度随着时间的推移的变化,并可以很容易地得到进一步的发展,以评估特定细胞类型的兴趣的激活状态。在这份报告中,我们展示了使用血液处理实验室技术人员进行染色新鲜的全血和步骤来分析这些染色样品在中央检测实验室支持的多中心临床试验的程序。视频详细信息的过程,因为它是在艾滋病疫苗试验网络(HVTN)的临床试验抽血的背景下进行。
研究方案
注:为了保护从光的荧光标记的抗体在生物安全柜的灯不亮,执行所有步骤。
1。抗体染色面板准备
- 于表1中可以发现的抗体染色面板。抗体浓度应与全血通过滴定定义,并使用相同的流式细胞仪,将用于获得染色表型样本的设备和程序。
- 一旦确定适当的染色滴度,所有的抗体结合成一个单一的混合物,的锁帽筒。添加流洗涤缓冲液(2%热灭活的小牛血清的Dulbecco PBS),使总体积为100μl。缩放的混合物被染色的样本的数目。该混合物在4℃下,可以存储多达八个星期。
2。染色法
- 如果采集的血液是被用于其他目的,在广告CONDITION(供电状态)这个实验中,设定的等份,留出更多的时间敏感的程序进行,将剩下的血。的等分试样可以在室温下贮存长达4小时静脉穿刺后没有显着的细胞的损失。
- 验证在Trucount管和标签的管,以确定被染色的样品的底部,有一个完整的珠粒料。 HVTN临床试验,实验室数据管理系统(前沿科学和技术研究基金会,纽约州Amherst)用于标记和跟踪染色样品。
- 记录的所有试剂的批号和到期日期。记录的Trucount的管珠计数管包装袋上的制造商所提供的数,确保包装袋上的批号相符的批号管。
- 使用反向移液管准确移液管100微升的全血到Trucount管,上面的金属固定器。避免弄脏血液向下侧的管。
- 使用到Trucount管经常(向前)移液技术,吸移管100微升的混合抗体染色面板(请参阅表1)。盖上管和旋涡在低速混合约15秒。目视检查管,以确保在胎圈的颗粒完全溶解。
- 在黑暗中在室温下(15-30℃)15分钟,孵育Trucount管。
- 如果有必要,10×FACS裂解液的等分试样稀释到1X使用DIH 2 O。添加900微升1×FACS裂解溶液的试管。
- 盖上管盖和涡彻底在低速下混合约15秒。向下推盖牢固地插入锁定与实验室膜管和密封的位置上。
- 管存放在-65°C至-95°C,直到样品是准备运送到中央分析实验室,或在内部进行分析。样品是稳定的在这个阶段,在至少四个星期。如果运输或化验IMMEdiately,该步骤可以被省略。
3。航运
注:以下说明利用的绝缘运输系统的SAF-T-PAK,专门用于运输B类豁免生物活性物质,根据国际航空运输协会(IATA)的规定。如果分析的样品在相同的位置,作为染色发生,到第4条。
- 样品可立即发货染色后,一旦被冻结在-65°C到-95°C。各管缠绕在染色标本中完全箔和地点。将染色标本盒里面多袋防漏的吸收材料。
- 特卫强袋和密封防漏胶袋,内容收入囊中的空气尽可能少。
- 将样品包(二次包装内的标本)内的棕色盒子内。
- 将内部的褐色B牛里面的泡沫塑料胸部,确保到缩进以防止移位。
- 填充泡沫塑料胸部用干冰(约8公斤),将盖子盖紧,放在胸前。
- 装运箱和船舶用胶带牢牢生物物质,B类(UN3373)用适当的干冰(UN1845)标记的;按照国际航空运输协会PI-650的说明。
- 一旦收到,样本被存储在-65℃至-95℃,直到对它们进行分析。
4。解冻和流式细胞仪分析
- 从冷冻机中取出染色的样品的流式细胞仪上收集之前,在黑暗中在室温下解冻。如果在一个以上的样品收集数据,规范流程,所有的管子惊人的融化,使管不是停留在室温下超过1小时,每。
- 应配备适当的过滤器,例如在BD LSR使用四个激光流式细胞仪获得的样品II。使用标准的流式细胞仪的校准和荧光补偿方法进行数据收集4。
注意:不要设置5在收集过程中的散射或侧面散射阈值。 Trucount珠可以尽可能最低的低于阈值设置这些参数造成的一个子集珠在分析过程中不占。如果需要的仪器设置阈值,设置尽可能低的青色通道的阈值。因为CD45 +白细胞染色与面板将是青色,Trucount珠还发出荧光,在上午青色通道,这应该可以适当地收集所有相关数据。
- 涡样品管,持续5秒,然后再装上流式细胞仪。 Trucount珠荧光高度的多种渠道。在收集过程中发现高双阳性的人口是PE Cy5和APC(结肠门珠RS是最容易区分的珠子从细胞可能会有所不同,这取决于仪器)。选择您的停止门珠门,并记录数据,直到至少有20,000收购珠。
- 使用合适的软件分析数据,作为FlowJo(Treestar,亚什兰,OR)等。 图1显示了用于分析不同的白细胞人口从有代表性的控制抽血的门控方案。
5。 Trucount计算
- 每个Trucount管含有荧光微球的冻干颗粒。在添加液体的管,和涡旋,珠粒应成为同样分布在整个样品。珠颗粒的数量略有不同批号和管的储物袋上可以找到。
- 栅极Trucount珠和如在图1中所示的细胞群,以确定事件计数为每个人口。的事件的数量的比较我n的珠珠最初的总数在管的栅极连接到将允许您确定样品收集的,然后可以被用来确定的绝对浓度( 即 ,细胞/微升),为每个人口的比率。可以使用下面的公式,用于此目的:细胞浓度(细胞/微升的全血)= [#人口事件/(#珠事件/#总珠球团)] / 100微升。
6。代表性的成果
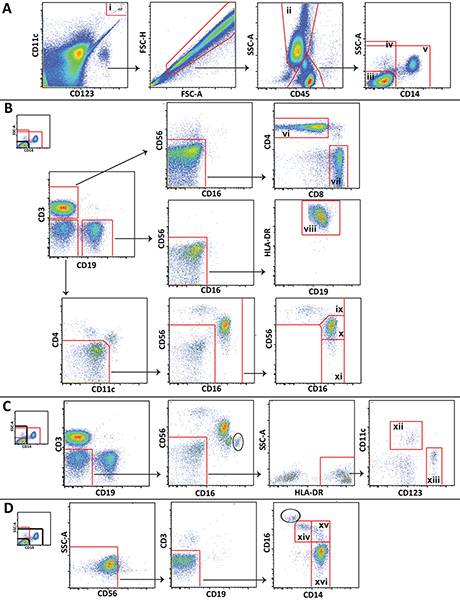
图1。使用的浇注方案的主要白细胞人口数据从健康志愿者代表进行分析。 A)Trucount珠(I)的门控,排除细胞。粒(二)所划定并的lympohcytes和单核细胞分为3 popluations:CD14阴性淋巴细胞(ⅲ),(ⅳ)所有CD14阴性细胞,和非淋巴细胞(ⅴ)。 B)CD14阴性细胞是门控区分CD4 +Ť细胞(六),CD8 + T细胞(七),乙细胞(八),CD56明亮的NK细胞(九),CD56昏暗的NK细胞(X),和CD56阴性NK细胞(十一)。 C)所有的CD14阴性细胞的门控来区分髓系(xii)及浆细胞(ⅹⅲ)的树突状细胞。 D)非,lympocytes的选通,区分非古典(十四),中级(十五),古典(十六)单核细胞。 点击此处查看大图 。
使用我们提出的面 板,也可以加以区分的更具体的,未示出在图1中( 例如 ,NKT细胞或嗜中性粒细胞)的细胞亚群,和门控方案可以扩展或修改,以满足特定的学习需要。某些门控步骤所示,该方法是独特的。特别需要注意的,包括栅极和排除栅极周围绘制Trucount珠放置在另一个上面,一个栅极珠粒进行计数,和一个排除珠粒从蜂窝的分析( 图1A)。此外,淋巴细胞,单核细胞和粒细胞,因为不容易被区分全血中,因为它们是在外周血单核细胞的前向散射和侧向散射光,浇注使用这些细胞CD45表达和侧向散射光往往是必要的( 图1A)。在部分地块高CD16的表达( 图1C和图1D)是有区别的,不能分离淋巴细胞和单核细胞CD45和侧向散射光的污染粒细胞(圆圈内)。污染的粒细胞的数量通常是很小的,并且它们不干扰与单核细胞和NK细胞的门控。
Access restricted. Please log in or start a trial to view this content.
讨论
在这份报告中,我们提出了一个珠列举流式细胞仪新鲜全血中的白细胞人口为基础的方法,并覆盖所需的参数的多中心临床试验中使用的集中样品分析。这种方法的基础上,优化的BD Trucount协议,并允许其可靠的多中心临床试验中使用的设置。染色法很简单,大约需要45分钟来执行,使血液处理实验室技术人员来执行它,并冻结和运送样本到中央分析实验室进行分析是可行的。该试验仅需要100微升...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有利益冲突的声明。
致谢
我们感谢他们协助发展这种方法,手稿和视频杰西卡·琼斯,埃里卡·克拉克,康斯坦茨Ducar,唐娜·史密斯,罗伊·刘易斯,百合Apedaile,乔安妮·威斯纳,德文·亚当斯,科里·麦克贝恩和斯蒂芬Voght。
这项工作是由比尔和梅林达·盖茨基金会CAVD授予38645(MJM)和美国国立卫生补助UM1 AI068618和U01 AI069481(MJM)的支持。 EA-N。由美国国立卫生研究院资助T32 AI007140支持。我们感谢詹姆斯·B·彭德尔顿慈善信托基金的慷慨设备捐赠。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
| Trucount绝对计数管 | BD Biosciences公司 | 340334 | |
| 10X FACS裂解解决方案 | BD Biosciences公司 | 349202 | |
| B类及豁免的运输系统,绝缘 | SAF-T-PAK | STP-320 | |
| 单克隆抗体CD45 AmCyan | BD Biosciences公司 | 339192 | |
| CD3 FITC单克隆抗体 | BD Biosciences公司 | 349201 | |
| CD8 PerCp-CY 5.5单克隆抗体 | BD Biosciences公司 | 341051 | |
| CD4的Alexa Fluor 700单克隆antibo的DY | BD Biosciences公司 | 557922 | |
| HLA-DR ECD单克隆抗体 | Beckman Coulter公司 | IM3636 | |
| 单克隆抗体CD14 V450 | BD Biosciences公司 | 560349 | |
| 单克隆抗体CD19 PE | BD Biosciences公司 | 555413 | |
| CD16 APC-H7单克隆抗体 | BD Biosciences公司 | 560195 | |
| CD56 PE-CY7单克隆抗体 | BD Biosciences公司 | 335791 | |
| 表面CD11c APC单克隆抗体 | BD Biosciences公司 | 559877 | |
| CD123 PE-Cy5标记的单克隆抗体 | BD Biosciences公司 | 551065 |
参考文献
- Taylor, M. J., London, N. J., Thirdborough, S. M., Lake, S. P., James, R. F. The cryobiology of rat and human dendritic cells: preservation and destruction of membrane integrity by freezing. Cryobiology. 27, 269-278 (1990).
- Reimann, K. A., Chernoff, M., Wilkening, C. L., Nickerson, C. E., Landay, A. L. Preservation of lymphocyte immunophenotype and proliferative responses in cryopreserved peripheral blood mononuclear cells from human immunodeficiency virus type 1-infected donors: implications for multicenter clinical trials. The ACTG Immunology Advanced Technology Laboratories. Clin Diagn Lab Immunol. 7, 352-359 (2000).
- Boonlayangoor, P., Telischi, M., Boonlayangoor, S., Sinclair, T. F., Millhouse, E. W. Cryopreservation of human granulocytes: study of granulocyte function and ultrastructure. Blood. 56, 237-245 (1980).
- Perfetto, S. P., Ambrozak, D., Nguyen, R., Chattopadhyay, P., Roederer, M. Quality assurance for polychromatic flow cytometry. Nat Protoc. 1, 1522-1530 (2006).
- Brando, B., Barnett, D., Janossy, G., Mandy, F., Autran, B., Rothe, G., Scarpati, B., D'Avanzo, G., D'Hautcourt, J. L., Lenkei, R., Schmitz, G., Kunkl, A., Chianese, R., Papa, S., Gratama, J. W. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42, 327-346 (2000).
- Bull, M., Lee, D., Stucky, J., Chiu, Y. L., Rubin, A., Horton, H., McElrath, M. J. Defining blood processing parameters for optimal detection of cryopreserved antigen-specific responses for HIV vaccine trials. J. Immunol Methods. 322, 57-69 (2007).
- Kantor, A. B., Roederer, M. The handbook of Experimental Immunology. Herzenberg, L., Blackwell, C., Weir, D. 43, 1-49 (1996).
- Hulspas, R. Flow cytometry and the stability of phycoerythrin-tandem dye conjugates. Cytometry A. 75, 966-972 (2009).
- Le Roy, C., Varin-Blank, N., Ajchenbaum-Cymbalista, F., Letestu, R. Flow cytometry APC-tandem dyes are degraded through a cell-dependent mechanism. Cytometry A. 75, 882-890 (2009).
- Mandy, F., Brando, B. Enumeration of absolute cell counts using immunophenotypic techniques. Curr. Protoc. Cytom. Chapter 6, Unit 6(2001).
- Vuckovic, S. Monitoring dendritic cells in clinical practice using a new whole blood single-platform TruCOUNT assay. J. Immunol Methods. 284, 73-87 (2004).
- Lichtner, M. Circulating dendritic cells and interferon-alpha production in patients with tuberculosis: correlation with clinical outcome and treatment response. Clin. Exp. Immunol. 143, 329-337 (2006).
- Hosmalin, A., Lichtner, M., Louis, S. Clinical analysis of dendritic cell subsets: the dendritogram. Methods Mol. Biol. 415, 273-290 (2008).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。