Method Article
新洲形成的助手依赖型腺病毒载体介导的基因转移对糖尿病小鼠肝
摘要
我们描述了肝形成新胰岛STZ(链脲佐菌素)诱导的糖尿病小鼠的转基因Neurogenin3(Ngn3)和β细胞素(BTC)的使用依赖辅助腺病毒载体(HDAd)和反转高血糖。我们的方法的优点帮手依赖型腺病毒载体,其高度有效的体内转导和持久的基因表达。
摘要
1型糖尿病是由T细胞介导的胰腺中产生胰岛素的细胞的自身免疫性破坏引起的。到现在为止仍是主要的胰岛素替代治疗,因为胰岛移植一直受到捐助者的情况和需要长期应用免疫抑制剂。胰岛细胞生长因子诱导胰岛新生转基因Neuogenin3(Ngn3),胰岛血统定义特定的转录因子和β细胞素(BTC),有的可能治愈1型糖尿病。
(ADS)的腺病毒载体高效基因转移载体,但初代广告有几个缺点, 在体内使用。助手依赖的广告(HDAds)是目前最先进的广告开发,以提高广告的初代的安全性和延长转基因表达1。他们缺乏的慢性毒性,因为他们缺乏病毒的编码序列2-5只保留广告顺 EL对此语句所必需的载体的复制和包装。这使得高达36 kb的基因的克隆。
在这个协议中,我们描述的方法来产生HDAd Ngn3和HDAd-BTC,并提供这些向量STZ诱导的糖尿病小鼠。我们的研究结果表明,注射的的HDAd,NGN3和HDAd-BTC会引起“新的胰岛细胞在肝脏和挫折糖尿病小鼠高血糖。
研究方案
1。 HDAd穿梭载体克隆的基因治疗
- 克隆小鼠NGN3和BTC的cDNA到pLPBL1的质粒载体,其中包含一种普遍存在的伸长因子-1启动子(BOS)和多聚A信号。完成后,验证序列分析的载体,再亚克隆表达盒到pΔ28HDAd穿梭质粒6。
- 月刊PmeI位HDAd穿梭载体释放的质粒骨架,纯化的DNA用苯酚/氯仿/异戊醇提取,随后用乙醇沉淀并重组转染级水。
2。助手依赖型腺病毒载体生产
HDAd载体生产涉及多个步骤,需要认真遵守,以获得最佳效果。
2.1转染
- 前两天转染116细胞,种子7成6-cm培养皿中,以达到70-80%汇合的转染当天。
- 三个小时转染前,去除培养基和新鲜的生长培养基中加入5毫升[MEM培养基与10%FBS和1%的PSG(青霉素,链霉素和谷氨酰胺),Invitrogen公司]。
- 转染116细胞与从步骤1.2)中的10微克DNA,根据制造商的说明使用的ProFectionR哺乳动物转染试剂盒购自Promega公司。
- 第二天,洗涤细胞,用1ml的生长培养基中的2倍。加入0.1毫升的PBS中含有的钙和镁的辅助病毒(HV)在500载体颗粒(vp的)/细胞(PBS + +)和覆盖层的细胞。轻轻地摇动的的菜肴均匀分布的HV每10分钟。
- 60分钟后,加入1.5毫升的维持培养基(MEM,5%FBS,1%,PSG)。
- 添加1毫升维护介质的第二天。
- 观察细胞的细胞病变效应(CPE - 细胞变得圆润和分离)。大于80%的细胞显示2天,感染后的CPE。
- 收集粗细胞裂解物(CVL,细胞和培养基),一个西元10%体积的40%蔗糖和存储在-80℃下被标记为的CVL通道0 - (CVL-P0)。
2.2矢量放大
- 冷冻(-80°C,3-5分钟)/解冻(37°C,1-2分钟)的3倍。
- 覆盖0.5毫升CVL辅以高压在200 VP /细胞融合的116细胞在6厘米的菜,和岩石的菜轻轻地,每5分钟。 30分钟后,加入1毫升的维持培养基。
- 加入1毫升的维持培养基中的第二天。 2天后,大部分细胞显示CPE。
- 收集的CVL和存储,在-80°C(CVL-P1)所描述的步骤2.1.8)。
- 重复上述步骤3次,CVL P2-P4。
- 提取DNA(的DNeasy血液和组织试剂盒,Qiagen公司制)从0.2毫升CVL收集在P1-P4,并通过qPCR使用HV-HDAd特定的引物( 表1)分析的载体扩增。使用的通道中,HDAd指数扩增相对向HV(P3 在图2中)的subsequen吨程序。
- 合作用0.5毫升CVL和HV 200 VP /细胞感染90%融合的116细胞在15cm菜。摇滚的菜轻轻每5分钟。 30分钟后,加入10 ml维持液。
- 24小时后,加入5毫升的维持培养基。
- 在1500 XG离心收集细胞完全感染后48小时5分钟。
- 重新悬浮细胞在1毫升的PBS + +的含4%蔗糖(P5),并冷冻于-80℃C.
2.3大型HDAd生产
- 为了制备用于感染的细胞悬浮培养的116细胞,转移汇合116细胞在8×15-cm培养皿中,喷丝成3升烧瓶中,并悬浮生长培养基添加了5%FBS,0.1毫克/毫升潮霉素和1%(Joklik改性的MEM培养基PSG)的最后1 L,并在CO 2培养箱中孵育在60rpm的8与纺丝。
- 每天2天(共2 L)的新鲜培养基中加入0.5 L。
- 计数细胞的第三天。细胞已经准备好使用,如果达到吨Ø总细胞数1×10 9。
- 冻结/解冻P5 3倍。
- 在1,000 xg离心5分钟,通过离心收集细胞从3升旋转瓶。保存100毫升上清液重新悬浮的细胞。
- 转移到250毫升的转瓶细胞。添加P5和HV / vp的200细胞的细胞,并孵育1小时,在37℃下以每分钟60转。
- 传递细胞中3 L旋转瓶,加入2 L悬浮生长介质。 1毫升细胞悬浮液转移到一个孔中,在12孔板中,观察细胞的CPE。
- 培养细胞2天,在CO 2培养箱中,在60rpm下旋转烧瓶。
- 通过离心收集细胞,并重新悬浮用15ml的100mM的Tris-HCl(pH 8.0)中,并储存在-80℃下(P6),直到纯化。
2.4矢量净化
- 加入1.0毫升的5%脱氧胆酸钠的P6。轻轻混匀,在室温下孵育30分钟。
- 加入400μl的2 M的MgCl 2,300μl的核糖核酸酶A(10毫克/毫升),和300μl的DNA酶I(10毫克/毫升),并在37℃下孵育1小时。
- 在室温下以6,000 xg离心10分钟,离心收集上清。
- 消毒NVT 65超速离心管(Beckman公司)紫外光照射下,1小时的组织培养罩。
- 添加低密度CsCl溶液(1.25克/毫升), 底层 2.8毫升高密度CsCl密度溶液(1.41g/ml),然后覆盖 5-6毫升上清液2.8毫升填充管的颈部。使用100毫米的Tris-HCl(pH值8.0),以填补管,如果必要的。
- 离心机在10℃下以50,000转的30分钟,在10℃下采用NVT-65转子与贝克曼LE-80K。
- 擦拭面积与穿刺针的70%乙醇中,并收集22-G针的侧穿刺( 图3a)配备有3毫升注射器的低级乳光带。有时,一个非常微弱的辅助带下面可以看到比较突出的矢量带。尝试获得尽可能多的日Ë矢量带,没有帮手带。这是可以接受的,即使在此步骤中的一些辅助带被吸入,因为它会在随后过夜离心下面分离。
- 将所收集的频带到一个新的灭菌的超速离心机管。填充管的脖子上覆盖1.35克/毫升的氯化铯密度解决方案。
- 离心机在10℃下以50,000转过夜。收集的的乳光带( 图3b)。
- 传输带透析盒(幻灯片一仪,热科学),10,000 MWCO。
- 对3 L的蒸压提斯-HCl,pH值7.2的10mM含有2mM MgCl 2和4%的蔗糖,在4℃过夜透析。
- 从透析盒中取出HDAd载体。等分试样20微升物理滴度和50微升的DNA表征。 (注:对于Ngn3载体,重复“P6”三次获得足够的向量自产量的HDAd NGN3的差到HDAd BTC或HDAd空的。)
2.5表征HDAd载体
- 确定物理滴度(vp的/毫升)使用光密度(OD)。加入20μl的载体或20微升透析缓冲液380微升的TE缓冲液中含有0.1%SDS和孵育在56℃下进行20分钟的。在260 nm处测量OD。的物理滴度= OD260×1.1×10 12×20(vp的/毫升)。
- 通过定量PCR分析HV污染。使用50μL等分的DNeasy组织/血液DNA提取试剂盒(Qiagen公司)提取DNA。稀释1000倍的DNA,并采取5微升定量PCR分析助手和载体特异性引物( 表1)。该辅助污染应该是小于1%,如在图4A中示出。
- Southern杂交分析矢量结构。进行Southern blot分析使用的探头的反向末端重复序列(ITR)。代表性的结果示于图4B。
- 确定在体外药效。感染被称为1000 VP /细胞一式四份的116细胞在12孔板与HDAd载体。 48小时后,收集细胞,提取RNA,以确定NGN3和BTC基因表达的定量RT-PCR( 表1)。代表性的结果示于图5。
3。治疗糖尿病小鼠的HDAd-NGN3和BTC
3.1诱导的糖尿病小鼠注射HDAd载体
- STZ准备0.1M柠檬酸缓冲液,调节pH值至4.3-4.5。过滤通过一个0.22毫米的针头式过滤器。用无菌水稀释至0.01 M柠檬酸钠pH值4.2-4.5。在该溶液中溶解适量的链脲佐菌素(Sigma公司),以达到最终浓度为12.5毫克/毫升。在此浓度下有没有降水。记住这STZ溶液在4°C,直到使用。使温度在注射前立即注入溶液至室温。 STZ溶液shoulD是准备新鲜的每一天,注射5-10分钟内被溶解。
- 注射这种的STZ溶液腹腔(10微升/克,实现了剂量为125微克/克体重),在晚上5-7时之间(前灯被关闭鼠标设施和老鼠开始喂积极),连续两天9。
3.2监测小鼠血糖和注射的HDAd向量。
- 6小时,并测量体重和血糖小鼠每周一次,直到有快速的小鼠高血糖(≥250mg/dl)时。使用单键血糖仪,血液收集尾剪断。一旦血糖≥250毫克/分升,复检血糖在48小时后6小时,以确保持续的高血糖和高血糖是治疗的目标范围内:250-500毫克/分升速度快。
- 治疗持续性高血糖小鼠HDAd载体经尾静脉单次静脉注射。矢量的总剂量为6×10 11 VP所有治疗组(0.25毫升):5×10 11 VP Ngn3 +1×10 11 VP BTC联合组5×10 11 VP Ngn3 + 1×10 11 Ngn3集团副总裁和1×10 11 VP BTC + 5×10 11 VP空载体BTC组6×10 11 VP空载体作为对照组。
- 尾静脉注射。把老鼠变成Tailveiner抑制器(TV-150,布伦特里科学公司),并用温水尾静脉扩张,用70%的酒精清洁的尾巴。注射部位的手的拇指和食指之间保持尾巴下面,用另一只手的注射。在注射之前,请确保在注射器中有没有气泡(30 1/2 G针1毫升注射器)。插入针,缓慢注入矢量。如果是在静脉针,一个闪光的血液可能会被视为针的枢纽,也没有什么注射时的阻力。取出针后,保持注射部位用纱布止血,然后返回小鼠TO机笼。
如果针是不是在静脉注射有显着的电阻和一个小皮下水疱出现。这时拔出针头,在不同的网站,然后再试一次。
3.3治疗的HDAd,Ngn3 + HDAd-BTC的影响分析。
- 显示器6小时空腹血糖和体重,每周矢量化后处理。
- 每2周测定胰岛素(小鼠胰岛素ELISA试剂盒,Mercodia)和肝酶(AST和ALT无限试剂,Thermo Scientific的)使用商品化试剂盒的腿从大隐静脉或尾静脉采集血液。
- 鼠标放置在一个无上限的50毫升Falcon管中,在封闭端的孔。
- 鼠标的头是在封闭端的管和在该管的开口侧的腿和尾巴。收集血液从左腿,延长管外部的左腿和轻轻捏皮肤固定腿部的拇指和食指之间的大腿。
- 使用剃须刀去除毛发从胫/小腿区域,以暴露隐静脉小腿的横向侧上,这是本。用70%的酒精清洁刮胡后的肌肤,让它干燥。
- 用25号针头穿刺大隐静脉,收集血液Microvette的CB300管(萨尔斯塔特),并把管上的冰。
- 按穿刺部位用纱布止血,然后返回笼子里的老鼠。
- 离心管,以3,000 xg离心5分钟,取上清液,并储存在-20℃下以供进一步分析。
3.4在治疗6周后进行葡萄糖耐量试验(GTT)。
- D-葡萄糖(Sigma公司),在蒸馏水中溶解,使15%的葡萄糖(15克/ 100毫升)和无菌过滤的葡萄糖。
- 6小时快速小鼠。使用暖垫暖老鼠和收集的血液(0分钟时间点)。然后注入1.5 g / kg的D-葡萄糖的ip(10微升/克的15%葡萄糖)。
- 关口LECT血液在15,30,60,120分钟。
- 在所有这些样品测量血糖和胰岛素。
3.5组织分析,以评估表达的载体和评估的诱导胰岛新生。
在所有这些步骤所需要的可靠的解释结果的控制,包括:(1)空载体治疗的糖尿病小鼠(2)非糖尿病小鼠(3)非糖尿病患者胰腺的胰岛表达的阳性对照作为具体激素和转录因子。
- 在治疗3周和6周后收获肝脏和胰腺。分成2片,第一捕捉冷冻在液氮中储存于-80℃下进行RNA和蛋白质的提取,和第二过夜进行免疫组化分析,用10%福尔马林固定。
- 一个标准的协议和提取RNA分析的胰岛激素和转录因子的表达,以及与Ngn3和BTC到confir米向量表达,在肝脏中通过定量RT-PCR,使用特异性引物9,10。
- 从肝脏中提取胰岛素和C-肽酸 - 乙醇萃取法和量化的商业ELISA试剂盒(超灵敏胰岛素测定,Mercodia,C-肽ELISA试剂盒,和光)。
- 执行免疫染色胰岛的具体激素(胰岛素,胰高血糖素,PP,SST)沿与胰岛特异性转录因子石蜡包埋的第9,10。中的表达,还可以确认的NGN3和BTC的免疫染色。
4。代表性的成果
我们克隆的cDNA插入pΔ28载体无处不在的启动eIF2a(BOS)和驱动产生的的HDAd,Ngn3和HDAd-BTC Ngn3和BTC。正如在图2中示出,相对HV污染降低显着(这意味着更多的载体扩增和更少的辅助扩增)在通道3。因此,我们使用P3为后续向量生产。后的第一次氯化铯的不连续梯度和超速离心,我们收集的最低矢量频带,然后收集HDAd载体在第二超速离心( 图3)相对应的频带的乳光。纯化HDAd载体有不到1%的HV污染( 图4A)通过qPCR和没有帮手污染,可见南部的印迹( 图4B),表明载体注射到小鼠体内足够的质量。进一步的分析,包括感染116细胞的基因表达。的mRNA表达水平的NGN3和BTC高10,000倍以上,与那些在非感染的细胞( 图5)相比,在载体感染细胞的。
HDAd-Ngn3-BTC给予STZ诱导的糖尿病小鼠经尾静脉注射空载体注入和HDAd-BTC注射的糖尿病小鼠作为阴性对照。高血糖被推翻,葡萄糖刺激的胰岛素分泌两个HDAd-Ngn3 HDAd-BTC,但不与单一的基因载体或控制空载体( 图6)处理的小鼠中的处理的小鼠中被恢复。 HDAd Ngn3-BTC治疗诱导胰岛新生和进行定量测定总的胰岛素和C-肽含量( 图6E)与非糖尿病患者,糖尿病空载体治疗的小鼠作为对照。的存在下,以等摩尔比的C-肽和胰岛素确认确实是被在肝脏中合成,在肝脏中被检测到的胰岛素。 RT-qPCR的证实,肝的HDAd Ngn3-BTC治疗的小鼠表达的胰岛激素和转录因子9。免疫组化显示治疗HDAd-NGN3的和HDAd-BTC的小鼠肝脏中的胰岛素阳性细胞,但与对照载体( 图7)处理的小鼠中,观察没有胰岛素阳性细胞。我们也确认有没有残留的Ngn3-BTC汤治疗胰腺中的胰岛细胞ð比较小鼠到众多非糖尿病胰腺胰岛。媒介(NGN3和BTC)沿与胰岛特异性沿袭转录因子(PDX-1和Nkx6.1)的表达也被评估肝脏( 图7)的免疫染色。
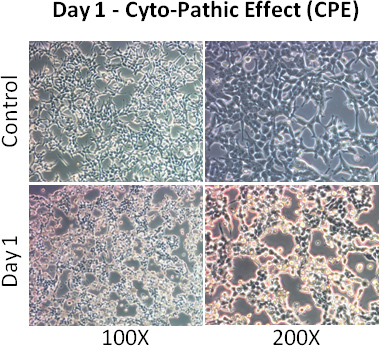
图1。流程图的使用依赖于辅助病毒系统对糖尿病小鼠的基因治疗。和BTC,NGN3,在磁带驱动一个无处不在的BOS启动,被克隆到HDAd班车(pΔ28)载体。 HDAd产生的几个步骤,包括转染连续传代扩增,然后通过矢量净化和大规模感染。特征的质量后,HDAds STZ诱导的糖尿病小鼠经尾静脉静脉内注射到。由测量血糖,体重,GTT和分析基因表达治疗的效果进行评估在肝脏中。
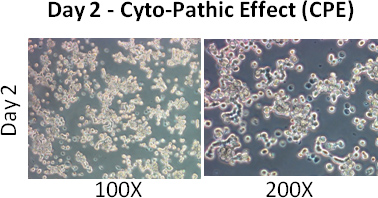
图2测定的HDAd矢量扩增。的DNA,从通道P0到P4,使用DNA提取试剂盒(Qiagen公司)提取。 DNA稀释1000倍和5μLDNA用于实时PCR(qPCR)的。 Helper和载体特异性引物的使用。标准曲线所产生的系列稀释液(10 -5〜1毫微克/毫升)的质粒和HV HDAd穿梭载体质粒(上面板)。使用的载体和辅助病毒的拷贝数的标准曲线的Ct值被计算和被绘制为HDAd / HV比的总病毒(辅助+ HDAd)的百分比。因此,相对矢量放大的计算公式为:[矢量拷贝数/(矢量+辅助病毒拷贝数)]。在所示的例子中(底部面板)的HDAd矢量扩增在P4趋于稳定,而相对HDAd / HV增加在P3。因此,P3被选择用于随后的步骤。
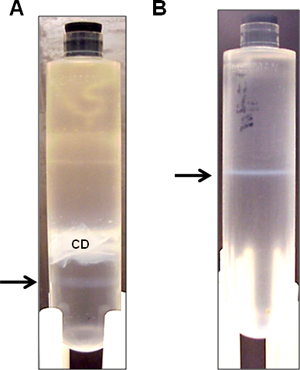
图3。代表HDAd载体带不连续氯化铯密度超速离心后。从3L的微调文化,而不是顺序氯化铯密度梯度纯化HDAd载体。 (A)在第一密度梯度超速离心,一个单一的的乳光载体带是可见的(箭头)低于不透明细胞碎片(CD)。的乳光带(箭头所示)的第二密度梯度离心收集。 (B)在第二次密度梯度离心,乳白色的带(箭头)收集透析。
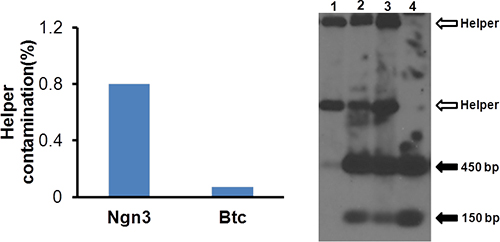
图4。辅助病毒污染的分析。 DNA提取50μL纯化的病毒和帮手污染是一个作为图2 ssessed。该图显示了辅助HDAd NGN3和HDAd-BTC的污染是小于1%。
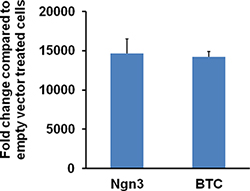
图5。 HDAd载体的结构分析。Southern印迹进行如前所述(欧卡K, 等人 )。泳道1:辅助病毒的DNA,泳道2:P3; 3巷的DNA:DNA从P4巷4:vectopr纯化。开放的箭头表示辅助病毒衍生频带和填充的箭头表示来自HDAd矢量的ITR频带。
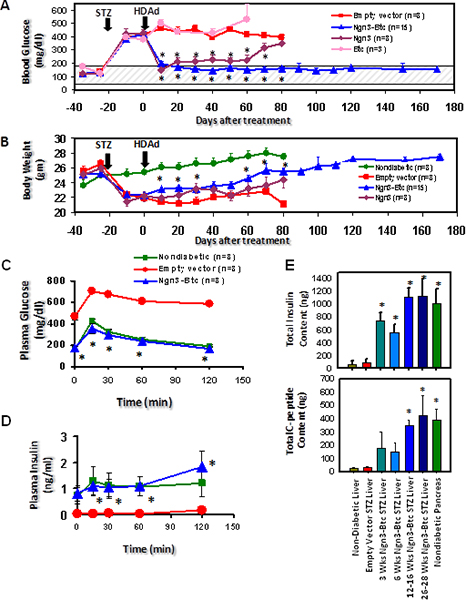
图6。感染116细胞的HDAd,Ngn3或HDAd-BTC矢量NGN3或BTC的表达水平。 116细胞在12孔板中在1000 vp的2天/细胞感染的HDAd Ngn3或HDAd-BTC或空载体。策LLS的收获,用Trizol试剂提取总RNA。定量RT-PCR进行使用Ngn3或BTC-特异性引物。相对Ngn3或增加了10000倍的细胞感染HDAd-NGN3的HDAd-BTC BTC mRNA的表达。数字2009年从Dev.Cell,转载月,16(3):358-73,Yechoor等。人,爱思唯尔的许可。
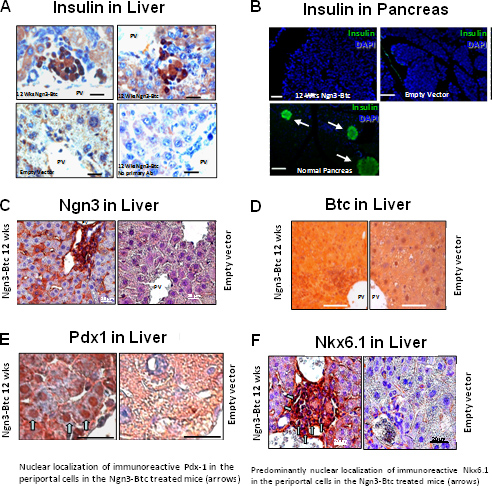
图7。的 HDAd NGN3和HDAd-BTC到STZ诱导的糖尿病小鼠的基因转移导致糖尿病和诱导胰岛新生的肝的逆转。 (A)血浆葡萄糖(B)处理HDAd-NGN3的HDAd-BTC STZ诱导的糖尿病小鼠的体重。 (C)等离子在IP-GTT在6个星期后的血糖和胰岛素治疗。 (D)的代表治疗12周后,在肝脏中的胰岛素染色。 * P <0.05(与空载体组)。这个数字是转载自开发。 CEL升2009年3月16(3):358-73; Yechoor 等人 ,爱思唯尔的许可。
| 名称 | 正向引物 | 反向引物 | |
| 帮手 | GACCATCAATCTTGACGACC | ATGTCGCTTTCCAGAACCC | |
| 向量 | TTGGGCGTAACCGAGTAAG | ACTTCCTACCCATAAGCTCC | |
| Ngn3 | AAGAGCGAGTTGGCACTCAG | TCTGAGTCAGTGCCCAGATG | |
| BTC | GCACAGGTACCACCCCTAGA | TGAACACCACCATGACCACT | |
表1引物序列。
讨论
已开发HDAds克服的弱点,初代广告,并利用基因治疗中的应用。然而,技术挑战仍然存在。例如,HDAd需要HV,HDAd的包装和矢量放大初代广告是效率不高。 HV是一个第一代的广告和高压妥协的任何污染的有效性HDAd。因此,高效的转染和每个串行通道的最佳条件是关键的。载体生产的另一个关键参数是应使用哪个通道(P1-P4),悬浮细胞作为接种物被直接用于随后的通道5。我们的经验,获得最好的结果是,通过使用其中HDAd载体的比例显着增加在下面的通路( 图2中的P3)的通道。 HDAd载体的收益率取决于对转基因盒。两种转基因表达载体生产,因为这两个基因是无处不在的推手。 NGN3是一种转录因子,并,BTC是一种生长因子,这表明HDAd表达载体的转录因子,这可能会影响细胞谱系抑制载体扩增表达生长激素,而有助于在载体的复制和包装。
随着糖尿病假设流行病的程度,需要新的方法来恢复B-细胞团。在这份报告中,我们描述的方法来利用HDAd载体的优势,对胰岛的血统定义的转录因子,Ngn3的胰岛细胞生长因子基因转移,β细胞素诱导胰岛新生的肝脏门静脉周围地区。要评估的有效性在此,重要的是选择具有稳定的高血糖小鼠,并确保适当的控制总是包含。对于这种转基因实验,空载体治疗糖尿病小鼠应始终使用。此外,单独使用HDAd NGN3和HDAd-BTC治疗的糖尿病英里行政长官用于测试的这两个基因在胰岛新生的个人贡献。作为我们的数据表明,Ngn3本身就足以诱导胰岛新生,但添加的生长因子,BTC,供应,以增加的响应,导致胰岛新生鲁棒诱导。同样重要的是测试的矢量表达式确实取得了在靶组织,肝和也证明,经处理的小鼠中的血浆胰岛素测定还没有来自残留在胰腺胰岛胰腺癌的证明的情况下,通过糖尿病小鼠的胰岛。
综上所述,用于基因转移的HDAd - 载体系统的优点在于它的高的克隆能力,有效转和持久的基因表达与最小的慢性毒性,以及作为非整合载体基因组的性质,在肝脏到宿主染色体。的主要限制是参与的复杂的步骤,在其生成和其体内应用主要限于肝脏与最流行 的广告血清型5。可诱导胰岛新生血浆胰岛素和葡萄糖耐受性糖尿病小鼠的胰岛细胞的血统定义的转录因子,Ngn3随着胰岛细胞生长因子,β细胞素的转基因在肝脏中通过诱导胰岛新生的完全恢复。在这份报告中,我们显示的最佳方案,以产生高品质的HDAd NGN3和HDAd-BTC,并展示诱导和评估胰岛新生,逆转高血糖对糖尿病小鼠肝脏中的技术。
脚注:病毒载体和细胞株这里描述的是可以从Vector生产的核心实验室,糖尿病研究中心,贝勒医学院( http://www.bcm.edu/mcb/index.cfm?pmid=7731 )。也可用于产生的HDAd病毒( 如 Microbix biosyst的一些商业试剂盒埃姆斯公司制)。
披露声明
没有利益冲突的声明。
致谢
这项工作是由美国国立卫生研究院的资助:R03 DK089061-01(VKY),美国国立卫生研究院:K08 DK068391(VKY);糖尿病和贝勒医学院的内分泌学研究中心(DERC - P30DK079638),试点和可行性研究的资助DERC(VKY);青少年糖尿病研究基金会:JDRF奖5-2006-134(VKY)。
材料
| Name | Company | Catalog Number | Comments |
| 的试剂的名称 | 公司 | 目录编号 | |
| ProFectionR哺乳动物转染试剂盒 | Promega公司 | E1200 | |
| 的DNeasy血液和组织工具包(50) | Qiagen公司 | 69504 | |
| PERFECTA SYBR Green超,ROX | 广达生物科技公司 | 95055-500 | |
| 脱氧胆酸钠 | 西格玛 | D6750-25G | |
| MEM粉 | Invitrogen公司 | 61100087 | |
| 青霉素链霉素 | 西格玛 | 15140122 | |
| FBS | 亚特兰大生物 | S11150 | |
| L-谷氨酰胺 | Invitrogen公司 | 25030-081 | |
| 潮霉素B | 西格玛 | H0654-1G | |
| MEM EAGLE JOKLIK | 西格玛 | M0518-10L | |
| 核糖核酸酶 | 罗氏公司 | 10109169001 | |
| DNA酶I,II级 | 罗氏公司 | 10104159001 | |
| 链脲佐菌素 | 西格玛 | s0130 | |
| 玻璃转瓶 | 康宁 | 4500-3L | |
| 玻璃转瓶 | 康宁 | 4500-250 | |
| 滑动A-仪检测板 | PIERCE CH | PI66380 | |
| 管optiseal聚allomer,11.2毫升 | Beckman Coulter公司 | 362181 | |
| 氯化铯1公斤 | JT4042-2 | VWR | |
| 贝克曼LE-80K | Beckman Coulter公司 | 最佳LE-80K超高速离心机 | |
| 过滤器 | VWR | 28143-338 | |
| 离心管500米升 | 康宁 | 431123 | |
| tailveiner阻挡 | 布伦特里科学,INC | TV-150 | |
| 胰岛素,鼠标ELISA | Mercodia | 10-1247-01 | |
| microvette CB300 | 萨尔斯塔特 | 16.443.100 | |
| D-葡萄糖 | 西格玛 | G8270 | |
| 鼠标C-肽酶联免疫吸附测定试剂盒 | Wako纯化学工业有限公司 | #631-07231 | |
| 豚鼠抗胰岛素抗体 | Abcam公司 | ab7842 | |
| 山羊抗PDX1抗体 | 克里斯托弗·莱特博士的礼物 | ||
| 鼠抗Ngn3抗体 | β细胞生物学协会, 大学。宾夕法尼亚州 | AB2013 | |
| 鼠抗Nkx6.1 mRNA的抗体 | β细胞生物学协会, 大学。的Pennsylvania | F64A6B4 | |
| 抗β细胞素抗体 | 细胞科学 | PAAQ1 | |
| ALT(谷丙转氨酶)显色剂SET。 | 东元电机诊断 | A526 - 120 | |
| / AST(SGOT),彩色端点试剂组 | 东元电机诊断 | A561-120 |
表2。特定的试剂和设备。
参考文献
- Parks, R. J. A helper-dependent adenovirus vector system: removal of helper virus by Cre-mediated excision of the viral packaging signal. Proc. Natl. Acad. Sci. U. S. A. 93, 13565-13570 (1996).
- Kim, I. H., Jozkowicz, A., Piedra, P. A., Oka, K., Chan, L. Lifetime correction of genetic deficiency in mice with a single injection of helper-dependent adenoviral vector. Proc. Natl. Acad. Sci. U.S.A. 98, 13282-13287 (2001).
- Belalcazar, L. M. Long-term stable expression of human apolipoprotein A-I mediated by helper-dependent adenovirus gene transfer inhibits atherosclerosis progression and remodels atherosclerotic plaques in a mouse model of familial hypercholesterolemia. Circulation. 107, 2726-2732 (2003).
- Oka, K. Long-term stable correction of low-density lipoprotein receptor-deficient mice with a helper-dependent adenoviral vector expressing the very low-density lipoprotein receptor. Circulation. 103, 1274-1281 (2001).
- Nomura, S. Low-density lipoprotein receptor gene therapy using helper-dependent adenovirus produces long-term protection against atherosclerosis in a mouse model of familial hypercholesterolemia. Gene Ther. 11, 1540-1548 (2004).
- Ng, P. A high-efficiency Cre/loxP-based system for construction of adenoviral vectors. Hum. Gene Ther. 10, 2667-2672 (1999).
- Palmer, D., Ng, P. Improved system for helper-dependent adenoviral vector production. Mol. Ther. 8, 846-852 (2003).
- Oka, K., Chan, L. Helper-Dependent Adenoviral Vectors. Current Protocols in Molecular Biology. , 16.24.1-16.24.23 (2005).
- Yechoor, V. Neurogenin3 is sufficient for transdetermination of hepatic progenitor cells into neo-islets in vivo but not transdifferentiation of hepatocytes. Dev. Cell. 16, 358-373 (2009).
- Yechoor, V. Gene Therapy with Neurogenin 3 and Betacellulin Reverses Major Metabolic Problems in Insulin-Deficient Diabetic Mice. Endocrinology. , (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。