Method Article
在体外合成的原住民,纤维长间距“和”分段长间距胶原蛋白
摘要
简单和可重复的过程进行了描述为三个组件从一个共同的商业可用的I型胶原蛋白单体结构不同的胶原蛋白。本机类型,纤维长的间距或节段性长间距胶原可以构造不同的条件,长为300nm,直径为1.4 nm的单体建筑块露出。
摘要
胶原纤维是存在于动物组织中的胞外基质中,以提供结构的脚手架和机械强度。这些原生胶原纤维的特性条纹〜67 nm的周期,并通过分层组件的I型胶原蛋白的单体,这是300nm的长度和直径为1.4 nm的在体内形成,在体外 ,通过不同的条件的影响单体建筑块被曝光,独特的结构,尺度到50微米,可以构建,不仅包括原生型纤维,但也纤维的长间距和段长间距胶原蛋白。这里,我们提出了从一个共同的市售的胶原单体形成三个不同的胶原结构的程序。使用的协议,我们和其他人在过去的出版,使这三种类型,通常会导致结构的混合物。特别,unbanded纤丝常用found时,天然胶原蛋白,和原生纤维时,纤维长间距胶原蛋白经常出现。这些新的程序,有生产所需的胶原纤维类型几乎完全的优势。所需的结构的形成,验证通过成像,使用原子力显微镜。
引言
胶原蛋白是一类的结构的蛋白质,有从三个多肽链组成的三螺旋结构。这些三重螺旋单体进一步组装在一个层次化的方式,逐步形成更大的结构。有至少28基因不同胶原蛋白类型已被确定1。相结合,胶原蛋白使在动物体内蛋白质总量的30%,与Ⅰ型的主要形式会计高达90%的胶原蛋白2。 I型胶原的皮肤,韧带,肌腱和骨骼fibrillous结构。原子力显微镜(AFM)和电子显微镜(EM)的图像的类型奴才原生胶原纤维通常显示绑扎带的特性期间〜67 nm的(通常被称为D-条纹)3-5。
I型胶原蛋白的单体是三股螺旋的异三聚体组成的两个相同的α1(I)链和一个α2(Ⅰ)链,每一个多千个氨基酸长。它是尺寸为300nm的长度和直径为1.4 nm的长而薄的。 I型胶原蛋白的单体,可以容易地获得通过打破自然形成的高阶结构6。我们7和许多其他8-10所示,这些水溶性单体建筑块然后可以被用来重建在体外 ( 图1)的D-带状纤丝。
在除了到纯的胶原纤维,其他两个高阶胶原结构已被发现在体外形成的,使用相同的单体建筑块。这两种结构是纤维长间距(FLS)和节段性长间距(SLS)的胶原蛋白( 图1)。 FLS胶原蛋白是一种天然胶原fibrillous构造类似,但其特征在于由一个较大的条带比天然胶原蛋白11 在体外周期性,FLS胶原蛋白时,α1-酸性糖蛋白的胶原蛋白单体结合形成 12。 FLS胶原蛋白在体内观察到,虽然很少13。 SLS胶原蛋白被描述为微晶对准,因为单体的寄存器中,如在一个晶格14。 SLS胶原形成时,胶原的单体结合的三磷酸腺苷(ATP)的15。自然发生的SLS的胶原蛋白已被观察到在培养基中的成纤维细胞,但不是在提取的组织样本,可能是由于它的小尺寸和缺乏可区分的地形特征16。
这份手稿的目标是提出详细的程序以及FLS的天然胶原蛋白纤维和SLS胶原蛋白,即使是最没有经验的研究人员可以重现。使用市售的先进起始原料,我们试图让尽可能简单的协议,仍可靠地工作。我们还详细介绍了如何使用原子力显微镜表征不同的胶原蛋白结构作出的s表示。这项工作将有利于研究人员谁想要研究一个或多个这些高阶胶原蛋白的结构和/或其他应用程序中使用它们的前体,但目前缺乏的专业知识,或根本不想工作,同时组织样本。
研究方案
注:在所有的协议中所用的水的电阻率> 18MΩ.cm.
1。原生胶原纤维
- 结合6微升水,20微升的200mM的Na 2 HPO 4,调节pH值至7,用HCl和400 mM KCl中,在微量离心管中,混合10微升。
- 胶原蛋白单体(〜3毫克/毫升在0.01N的HCl中)中加入4μl的微量离心管中,混合。该解决方案应该是无色透明的。
- 将微量离心管中,反应混合物中含有的热块已预先加热到37℃,为3至4小时,离开。在这一点上,该溶液应是稍微混浊的,并含有主要是原生胶原纤维。
2。纤维长间距胶原蛋白
- 透析1毫升胶原蛋白单体(〜3毫克/毫升在0.01N的HCl),使用12-14 kDa的MWCO膜对400毫升水,换水4倍以上的期间,在室温下24小时。透析collag烯单体,还没有立刻使用,可以存储在4℃下以供将来使用。
- 结合20微升水,20μl的3毫克/毫升在水中的α1-酸性糖蛋白和20μl的透析过的胶原蛋白在微型离心管中的单体。该解决方案应该是无色透明的。
- 发表的微量离心管中,将反应混合物在室温下30分钟。在这一点上,解决的办法应该是阴天,包含FLS胶原纤维为主。
3。分部长间距胶原蛋白
- 结合67微升水,60微升的100mM甘氨酸-HCl缓冲液在pH 3.3和40微升10毫克/毫升在水中的ATP在微量离心管中并混合。
- 胶原蛋白单体(〜3毫克/毫升在0.01N的HCl中)中加入33μl的微量离心管中,混合。该解决方案应该是无色透明的。
- 发表的微量离心管中,将反应混合物在室温下2小时。在这一点上,仍然会出现明确的解决方案,但应包含多为SLS胶原蛋白。
4。原子力显微镜表征
- 顺劈一块云母的表面上附着的AFM基板覆盖的云母表面用一块胶带,然后剥离它扔掉。检查磁带事后确认,整个层的云母裂解,以减少凹凸的表面上,并确保旧的样本被去除,如果云母被重用。
- 应用20微升的胶原纤维溶液新鲜解理的云母基板。静置5分钟。
- 用清水轻轻冲洗掉的胶原蛋白纤维的解决方案。可取的做法是不适用的水直接喷云母基板的中心,但在边缘处,以允许它流过样品。
- 根据温和的表面干燥的氮气流。可取的做法是直接的流的边缘处,而不是在中心云母基板。
- 在200×放大倍率的光学显微镜下,本地和FLS胶原蛋白样品应显示的纤维团块。 SLS胶原蛋白会是不可见的。
- 三个不同的胶原蛋白结构的原子力显微镜观察到的独有特性。一般情况下,我们的形象天然胶原蛋白纤维在间歇接触模式下使用硅原子力显微镜探针与原子力显微镜,,而FLS和SLS胶原蛋白纤维,我们通常使用硅氮化物原子力显微镜探针在接触模式的AFM图像。我们这样做,因为时间和成本的考虑。硅原子力显微镜探针通常比硅氮化物原子力显微镜探针,使它们特别适用成像窄的条带结构的天然胶原蛋白纤维更清晰。然而,硅AFM探针更容易发生由胶原蛋白样品的污染比氮化硅AFM探针,并需要经常更换。因此,我们保留使用的多为硅原子力显微镜探针成像原生分辨率的胶原纤维是一个更大的必要性,我们在间歇接触模式下运行海峡翁其一生中的效用。
我们建议最初的100×100μm2的扫描表明至少有一些胶原蛋白的结构。从那里,放大扫描尺寸为10×10微米2,然后2×2μm2至观察母语和FLS的胶原蛋白,或更细的功能的SLS胶原束带周期性。这也是一个好主意,检查至少有两个其他地区的胶原蛋白样本,以验证初始扫描代表。
结果
天然胶原蛋白
反应混合物〜0.3毫克/毫升胶原蛋白单体在100 mM磷酸盐的100 mM KCl pH值为7时,在37°C为3-4小时内将产生一个解决方案,包含原生型胶原纤维清晰〜67 nm的D-带,没有unbanded纤维。
在200×放大倍率的光学显微镜下,可以正常看到的几个原纤维团块云母基板上,特别是当由微分干涉相差(DIC)的显微镜( 图2)观察。在一个典型的示例中,一个随机的100×100μm2的由AFM扫描通常会显示至少有几个是5-50微米长的纤丝,( 图3A-C)。个人,分隔的胶原纤维可以很容易地确定在这个阶段。 512×512像素2图像扫描,放大到10×10μm2的扫描尺寸显示所有的纤维带状( 图3D-F )。为了准确地测量的条纹的周期性,它是最好的可放大到一个2×2μm2的扫描尺寸( 图3克-ⅰ)。
捆扎周期性可以通过简单地测量和平均几个波峰或波谷之间的纵向距离的确定。或者,如果AFM软件允许,一个二维傅里叶变换也可用于沿纵向截面, 图4示出的原纤维和相应的纵向横截面的AFM高度图像。
FLS胶原蛋白
1毫克/毫升μ1-酸性糖蛋白和〜1毫克/毫升胶原蛋白单体在水中,在室温下放置30分钟,将反应混合物中,将得到的溶液的FLS胶原纤维。
团块的相似,所观察到的情况下的固有的胶原蛋白,纤维,可以很容易看到的云母基板上,在光学显微镜下,在200×m个agnification。在一个典型的示例中,一个随机的100×100μm2的由AFM扫描通常会显示至少有几个原纤维。有了一个512×512像素的2图像扫描尺寸,束带周期性可以测量由缩放到一个10×10μm2的扫描( 图5a),或更准确地与一个2×2μm2的扫描( 图5b)。图5c显示的纵向横截面的FLS纤维。
SLS胶原蛋白
将反应混合物中的2毫克/毫升的三磷酸腺苷和〜0.5毫克/毫升的100mM甘氨酸-HCl缓冲液中在pH 3.3中的胶原蛋白单体在室温下放置2小时,将得到的溶液的SLS胶原。
通常情况下,SLS微晶不会是在光学显微镜下可见。的AFM需要确认存在的SLS微晶。在一个典型的样本,通常会显示一个随机的100×100μm2的扫描原子力显微镜许多点。放大成10×10μm的2个扫描通常会显示几个的SLS晶体( 图6a)。和2×2μm2的扫描( 图6b)示出了一个SLS微晶的更细微的结构。
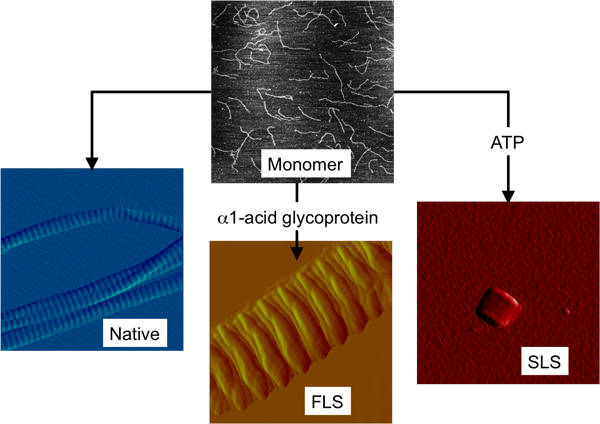
图1的结构不同的三个形式的胶原纤维由胶原单体,可以在体外形成。胶原蛋白单体和三高胶原蛋白结构的原子力显微镜图像描绘都在同一规模的大小(2×2微米2)。
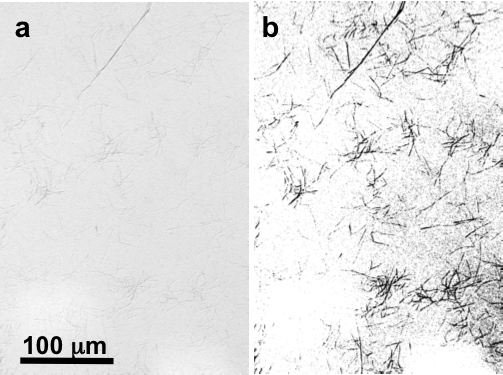
光DIC显微镜的天然胶原蛋白纤维云母不变(一)及(b)阈值和强化吨〜200倍的数字图像如图2所示。Ø突出的纤维。

图3。云母的天然胶原蛋白纤维上的原子力显微镜图像。间歇接触模式AFM幅度图像显示。

图4(一)0.5×1μm2的间歇性接触模式AFM高度图像(垂直刻度= 100纳米)和(b)的纵截面的原生胶原纤维。

图5。AFM图像在云母表面的的FLS胶原蛋白纤维。 (一)10×10微米接触模式AFM偏转图像,(B)2×2μm的接触模式AFM的偏转形象和(c)纵的FLS胶原纤维的横截面。

图6。SLS胶原蛋白在云母表面的原子力显微镜图像。间歇接触模式AFM幅度图像显示。
讨论
纯化胶原单体是稳定的,在低pH值和温度,并形成原生胶原纤维基本上涉及提高胶原单体溶液的pH和温度。从单体带状的胶原纤维重组程序已经存在了50年以上。我们的实验室使用在我们的最初的研究与胶原蛋白15年前7基于程序的过程总结由Chapman和同事于1986年10。的胶原蛋白纤维形成在该在先的工作条件下分别为0.18毫克/毫升的胶原蛋白单体的Na 2 HPO 4 / KH 2 PO 4(I = 0.2,pH7.4)缓冲液中于34℃下这和其他的程序,我们已经试过的缺点是有总是unbanded纤维形成所需的带状纤维一起。我们的新的条件是〜0.3毫克/毫升的胶原蛋白单体在100mM磷酸的100 mM KCl留在37℃下,在pH为7的为3-4小时。的多项式dure本文所述的天然胶原蛋白纤维在各方面的不同,从前面的过程。但最明显的是,我们增加了一倍的离子强度,提高缓冲液的浓度和加入100 mM KCl中。增加离子强度专门带状的胶原纤维形成比较一致的结果。
根据我们的经验,此过程中并没有产生原生型胶原的唯一时间是胶原单体溶液时,是过去制造商的建议使用日期。当发生这种情况时,所观察到的范围从更少的原纤维都unbanded许多仍观察到的原纤维,但为主unbanded。请注意,过期的胶原蛋白单体往往还是可以成功地用于天然胶原蛋白,但它失败时,一定要购买新的胶原蛋白单体。
第一个,确定由Highberger 等人 FLS是17的胶原蛋白制剂计入OrekhovicH 等人,18。进一步的研究导致Highberger和施密特得出这样的结论:这是α1-酸性糖蛋白,促进形成FLS 12。我们后来能够复制的程序FLS胶原蛋白相结合,市售的胶原单体和α1-酸性糖蛋白在低pH条件下,慢慢地使pH值上升透析对水的混合物为24小时11。我们现在提出这一程序的变形例的,通过对水透析胶原单体的第一和简单地组合,α1-酸性糖蛋白在水中以形成FLS胶原。 FLS胶原组件这里描述的条件是少得多的时间耗费。的胶原单体仍然需要预透析的对水,但它可以做到在批量,然后储存在4℃下稳定地,直到它被使用。这个新的程序产生带状的胶原纤维为主FLS。
根据我们的经验,α1-酸糖蛋白质与低级合并的蛋白质和水的含量,并通过推理较高的糖含量,是为成功作出FLS纤丝至关重要。我们通常用来检查与制造商,α1-酸性糖蛋白很多,我们有一个联合%的蛋白质和水分含量为82或更少。和作为与天然胶原蛋白的合成,胶原蛋白单体就是太旧的程序,也可以导致在未能产生FLS胶原。此外,用于透析的水的纯度的是在此过程中的关键。例如,对偶〜8兆欧,而不是18兆欧水在胶原溶液中不会形成FLS胶原蛋白的胶原蛋白单体透析。
胶原纤维类型,最容易使SLS胶原蛋白。制备SLS最早被描述由施密特和同事15。我们发表了适应该程序在12年前SLS胶原蛋白用市售科尔阿根14。过程只是需要结合2毫克/毫升ATP和0.5毫克/毫升0.05%(体积/体积)中的胶原蛋白单体在pH 3.5的乙酸,和离开该混合物在室温下过夜。
根据我们的经验,关键的方面是,必须加以控制的SLS装配反应溶液的pH值。 SLS组装的基本条件(pH值3.6-3.9),在聚合晶体团块。酸性条件下(pH值2.9-3.2),更薄,更分离的晶粒比组装了理想的条件下,pH值3.3-3.5。反应pH值超出这个范围(<2.8> 4)不要产生任何SLS胶原蛋白。在过去,我们调整将反应混合物的pH值通过加入乙酸。为了简化该过程,甚至进一步,在这最后,我们介绍的甘氨酸-HCl缓冲液来控制pH值。
三个不同的胶原蛋白结构由上述协议的字符ISTIC的功能,只能分辨的纳米级分辨率的仪器能够。本机和FLS胶原蛋白的特点是带周期性〜67 nm和270 nm处。 SLS的胶原蛋白的最长尺寸仅仅是〜360nm的。我们已经介绍了,特别是我们如何使用原子力显微镜表征三种不同的胶原蛋白结构。然而,任何AFM工作在接触或间歇接触模式与任何AFM探针具有<10纳米半径也应该是能够形象这些胶原结构。此外,电子显微镜可以是已被用于表征这些胶原结构19。
这些程序的主要优点是,他们生产所需的胶原蛋白为主建设。唯一的其他形式的胶原蛋白,在这些反应中发现的原料单体,这是经常的AFM图像的背景中可见。在本机和FLS胶原的情况下,他们可以来自大部分的unrea地容易地分离反恐执行局单体所产生的本地或FLS胶原蛋白颗粒与水的重复离心和洗涤。
我们已经提出了用于制造本机,FLS和SLS胶原蛋白采用先进的,市售的起始原料,简单和可靠的程序。在所有这些过程中所用的胶原蛋白单体纯化的形式市售。 α1-酸性糖蛋白和ATP也都可以买到。
披露声明
没有利益冲突的声明。
致谢
我们要感谢所有过去的许多本科生,研究生和博士后的学生贡献自己的时间和精力在我们的实验室研究胶原纤维形成的。自然科学和工程研究理事会,加拿大,不断为我们的胶原蛋白的研究提供资金。
材料
| Name | Company | Catalog Number | Comments |
| 材料/试剂 | 公司 | 目录编号 | 评论(可选) |
| I型胶原蛋白单体 (〜3毫克/毫升,以0.01 N盐酸) | 收购Inamed 高级BIOMATRIX | 5409 5005-B | 批号1261443(2.9毫克/毫升,pH值2.1) 批号1629346(3.2毫克/毫升,pH值2.1) 地段第6006(3.2毫克/毫升,pH值2.1) |
| ATP | 研究生物化学国际 | A-141 | FBJ-1194A地段 |
| 从牛血浆α1-酸性糖蛋白 | Sigma-Aldrich公司 | G3643 | 批号051K7440(89.8%) 批号011K7410(82%) 批号065K7405(71.2%) 批号063K7495(71.9%) 批号117K7535(75.9%) (蛋白质+水含量) |
| α1-酸glycopr的otein从人血浆 | Sigma-Aldrich公司 | G9885 | 地段128H7606(70.9%) 的地段049K7565V(68%) (蛋白质+水含量) |
| 云母 | 特德·佩拉 | 53 | |
| Pointprobe - 硅SPM传感器 | 纳米世界 | NHC | 硅原子力显微镜探针,我们使用的间歇接触模式 |
| Veeco的纳米探针提示 | Veeco公司 (现在布鲁克AFM探针) | NP-S | 氮化矽原子力显微镜的探针,我们使用的接触模式 |
参考文献
- Kadler, K. E., Baldock, C., Bella, J., Boot-Handford, R. P. Collagen at a glance. J. Cell Sci. 120, 1955-1958 (2007).
- Abraham, L. C., Zuena, E., Perez-Ramirez, B., Kaplan, D. L. Guide to Collagen Characterization for Bio Studies. J. Biomed. Mat. Res. 87B, 264-285 (2008).
- Baselt, D. R., Revel, J. -. P., Baldeschwieler, J. D. Subfibrillar Structure of Type I Collagen Observed by Atomic Force Microscopy. Biophys. J. 65, 2644-2655 (1993).
- Petruska, J. A., Hodge, A. J. A Subunit Model for Tropocollagen Macromolecule. Proc. Natl. Acad. Sci. U.S.A. 51, 871-876 (1964).
- Smith, J. W. Molecular Pattern in Native Collagen. Nature. 219, 157-158 (1968).
- Gross, J., Highberger, J. H., Schmitt, F. O. Extract of collagen from connective tissue by neutral salt solutions. PNAS. 41, 1-7 (1955).
- Gale, M., Pollanen, M. S., Markiewicz, P., Goh, M. C. Sequential assembly of collagen revealed by atomic force microscopy. Biophys. J. 68, 2124-2128 (1995).
- Wood, G. C., Keech, M. K. The formation of fibrils from collagen solutions. Biochem. J. 75, 588-597 (1960).
- Williams, B. R., Gelman, R. A., Poppke, D. C., Piez, K. A. Collagen Fibril formation. J. Biol. Chem. 253, 6578-6585 (1978).
- Holmes, D. F., Capaldi, M. J., Chapman, J. A. Reconstitution of collagen fibrils in vitro; the assembly process depends on the initiating procedure. Int. J. Biol. Macromol. 8, 161-166 (1986).
- Paige, M. F., Rainey, J. K., Goh, M. C. Fibrous long spacing collagen ultrastructure elucidated by atomic force microscopy. Biophysical Journal. 74, 3211-3216 (1998).
- Highberger, J. H., Gross, J., Schmitt, F. O. The interaction of mucoprotein with soluble collagen; an electron microscope study. PNAS. 37, 286-291 (1951).
- Ghadially, F. N. . Ultrastructural pathology of the cell and matrix. , (1988).
- Paige, M. F., Goh, M. C. Ultrastructure and assembly of segmental long spacing collagen studied by atomic force microscopy. Micron. 74, 355-361 (2001).
- Schmitt, F. O., Gross, J., Highberger, J. H. A new particle type in certain connective tissue extracts. PNAS. 39, 459-470 (1953).
- Bruns, R. R., Hulmes, D. J. S., Therrien, S. F., Gross, J. Procollagen segment-long-spacing crystallites: their role in collagen fibrillogenesis. PNAS. 76, 313-317 (1979).
- Highberger, J. H., Gross, J., Schmitt, F. O. Electron microscope observations of certain fibrous structures obtained from connective tissue extracts. JACS. 72, 3321-3322 (1950).
- Orekhovich, V. N., Tustanovsky, A. A., Orekhovich, K. D., Plotnikova, N. E. O prokollagene kohzi. Biokhimiya. 13, 55-60 (1948).
- Lin, A. C., Goh, M. C. Investigating the ultrastructure of fibrous long spacing collagen by parallel atomic force and transmission electron microscopy. Proteins. 49, 378-384 (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。