Method Article
固体支持基于膜的电
摘要
在这里,我们提出了一个基于固体产电膜转运特性及其应用重点支持膜的电生理方法。
摘要
的电生理的方法,我们提出基于在坚实的支持膜(SSM)组成的十八烷硫醇的化学吸附层上的金涂层的传感器芯片和磷脂酰胆碱单层之上。该组件被安装到一个反应杯中系统包含参比电极,氯化银焊丝。
吸附膜片段或包含感兴趣膜蛋白的蛋白脂质体后,快速的解决方案交换用于诱导的膜蛋白转运活性。在单一解决方案交换协议的两个解决方案,一个非激活和活化的解决方案,是必要的。的流是由一个法拉第笼内的加压空气,阀和油管系统。
生电转运活性的动力学是通过获得的SSM和蛋白脂质体或膜碎片之间的电容耦合。因此,该方法只产生transien吨电流。该峰值电流指在固定的传输活动。可重构的时间依赖转运电流电路分析。
此方法特别适用于原核的转运或真核转运蛋白从细胞内的膜,这是不能进行调查,通过膜片钳或电压钳方法。
引言
在这里,我们展示了一个新的电生理方法的基础上支持了坚实的表征产电膜蛋白膜(SSM)。
的固体支持物包括一个薄的金层在载玻片上,传感器芯片。用于绑定的alcanethiol试剂的硫醇基团的亲水性的金表面。此后,自组装完成的卵磷脂好的单层SSM的形成。
为了测量生电反应的膜蛋白,蛋白脂质体或膜碎片被吸附到的SSM( 图1)。含蛋白质的膜和SSM形成电容耦合的膜系统。因此,上面的含蛋白质的膜的电荷易位可以通过电容耦合检测通过SSM。这种方法产生的瞬态电流。该峰值电流指在固定的传输活动。时间依赖的转运立方米可重构电路分析rrents。
的传感器芯片安装到一个反应杯中系统( 图2)。比色皿有一个圆柱形的比色皿17微升量(净体积与o型圈安装)。弹簧插针建立接触到放大器。一个出口连接器的主要部分的顶部螺合,并进行参比电极,氯化银焊丝。
的比色皿,安装在一个法拉第笼。它是连接到的流体的通路,这是用来诱导响应快速解决交换( 图3)的膜蛋白转运活性。在单一解决方案交换协议的两个解决方案,一个非激活和活化的解决方案,是必需的。流是由加压空气的使用了阀的控制软件上的计算机或手动开关的接口盒上。
研究方案
1。设置的装置基于SSM的电生理学
有关详情载于我们的技术出版物,也包含我们的比色皿的示意图和照片,并成立1,2两。不同的解决方案交换配置和流动协议还讨论了在我们的方法中纸2。
在下面,我们添加了一个最近的一些改进和技术细节,这是直接相关的视频演示。
阀门控制和数据采集
接口盒包含商业的USB数字输出/模拟输入接口(NI USB 6009美国国家仪器公司)和阀驱动器。控制溶液的流速,并负责数据采集。阀门正常驱动与12五,然而,快速开关阀驱动电压高达18 V的,在视频中我们使用12 V电源。
阀驱动电路基板可以操作4个阀。它是制造由车间的马克斯普朗克生物物理研究所。由计算机或手动控制阀可以通过在前面板上的开关。后者则是方便的冲洗和清洗程序。在测量过程中,接口盒使用计算机控制的一个阀门控制和数据采集软件(SURFE 2 R软件,生物科学IonGate)。
2。准备工作
在本节中,编制一个基于SSM的电生理实验中提到的不同的协议。
2.1使脂质的解决方案,形成了SSM
- 混合25μl的十八烷基胺(5 mg / ml的氯仿)和375微升Diphytanoylphosphatidylcholine。(在氯仿中的20毫克/毫升)在GLAS小瓶。
- 使用旋转蒸发器和连续的氮气流中,蒸发氯仿约30分钟。
- 取出摇动从玻璃小瓶壁由用500μl的正癸烷的脂质。最终的脂质浓度为15毫克/毫升,1:60(w / w的)十八烷胺。
- 将该溶液转移到玻璃储存小瓶。脂质溶液存放于-20℃下
2.2参比电极的氯化
参考电极都必须在氯化由于磨损定期。
- 取出剩余的老氯化银层前加氯消毒过程中使用细砂纸。
- 将银线一起在0.5mA时的15分钟到1M的盐酸溶液中的铂电极和氯化。加氯消毒完成后,银线改变它的颜色同质暗灰色。
2.3的聚丙烯酰胺凝胶电桥的下游
- 含有100mM KPI,在pH = 7的100mM KCl和6制备溶液%丙烯酰胺。
- 添加0.3%APS(10%股份)和TEMED 0.6%,短期内混合溶液用吸管。
- 混合的解决方案后,立即用吸管注入30微升的混合物空凝胶桥容器。在注射过程中,重要的是要避免产生气泡。
- 凝胶聚合在一个20分钟的孵育时间。
- 聚合后的凝胶桥被存储在溶液中(100mM的KPI pH为7,100毫米氯化钾)。为了延长寿命的凝胶桥溶液贮存于4℃下
2.4测量解决方案的下游
电气文物由于溶质与SSM强相互作用,组成不同的解决方案进行交换时产生的。因此,编制的解决方案是关键的一步。在溶液的制备过程中采取以下预防措施,以尽量减少解决方案交换文物。
- 使非激活和激活的解决方案,从一个批处理中,调节pH和离子强度。
- 高盐的背景有助于减少解决方案交换文物。
- 分批次解决方案分为两卷。
- 添加活化化合物的活化溶液。使用一种代偿性化合物在非活化溶液,以保持尽可能相似的渗透压和离子强度,这两种解决方案。
- 如果储存在4℃的解决方案,确保所有的解决方案在开始测量前达到室温,因为即使是很小的温度差异可以产生伪影。
3。 Â基于SSM的电生理实验
在这里,我们提出了一个基于SSM-的电生理实验的典型协议。
3.1准备SSM设置
而SSM设置在不使用管填充用30%的乙醇/水溶液中,以避免细菌的生长。
- 用纯净水清洗系统从油管中除去乙醇,在安装前的比色皿。更换乙醇与水的容器的容器。使用高压(0.6〜1.0巴),用20-30毫升的水清洗系统。
- 使用KPI的100mM缓冲液,在pH 7.6或非活化溶液重复清洗步骤。
- 确保无气泡保持流体系统中的。
3.2安装试管
- 将O形圈,参比电极
- 存储解决方案以及凝胶桥连接参考电极。
- 满油的出口连接与非活化缓冲液中,插入O形环和连接凝胶桥完成参考电极组件。要特别小心无气泡凝胶桥交界处和出口溶液流量通路。
- 预装的主要部分的CUVEtte的通过增加弹簧接触销(连接到放大器)的入口管(连接到终端阀),将O形圈(密封为SSM)和螺钉。
- 用一个镊子,传感器芯片的存储解决方案(10毫米硫醇乙醇)。
- 使用吸管,洗去剩余的溶液约。 5毫升的纯酒精。
- 干燥氮气下电极。
- 准确地放置在传感器芯片上的基座部分的比色皿,使进口孔的主要部分的比色皿的圆形传感器的有源区。
- 加入1μl的脂质溶液的传感器芯片的有源区。确保,黄金脂质层被完全覆盖。
- 后,立即加入脂质溶液,通过添加预组装的主要部分关闭的比色皿。
- 进入法拉第笼安装试管之前,确保所有表面完全干燥。
- 康恩ECT放大器的弹簧接触引脚和终端阀入口管。法拉第笼里面的螺丝,然后修复试管。
- 用螺丝将出口连接器最佳的比色皿。最后的出口管连接到出口连接器和参比电极的电压发生器。
- 反应杯后,立即安装系统用缓冲液洗涤,在0.6巴。导致自发SSM形成的。
3.3测量膜参数
要检查的SSM质量,电容和电导测量使用的函数发生器。
- 使用函数发生器,适用于100毫伏的直流电压测量电导。
- 计算的电导电流衰减显示膜电容器的充电。在电容完全充电被测电流产量膜电导欧姆定律。为了简单起见,我们使用的是铜目前的1秒后的电压被施加到计算出电导G = I / U。
- 应用三角形的AC电压50 mV峰值到峰值的幅度和频率0.5 Hz的频率来测量电容。
- 计算出电容:将所得的矩形波电流的幅值表示的电容器的充电电流。的电容C等于转移电荷Q =IΔt除以ΔU= 100毫伏。 (ΔU是所施加的电压为50 mV的两倍,因为我的差电流的正负负斜率的三角波电压。)
- 监控膜重复大约每10分钟的电气参数。 30至40分钟,直到达到恒定值。与KPI缓冲液在高的压力在约0.6至1巴的范围内,在两者之间进行清洗。
- 估计质量的SSM:优化参数的取值范围为0.1至0.2纳秒和2〜3.5 nF的。 0.8以上NS和低电容高电导低于1 nF的指示的SSM不能正确形成。上述4 nF的电容高可能意味着活动区域没有完全覆盖的SSM。
- 如果参数不是在最佳的范围内,该膜应该被丢弃,另一个SSM编写的,使用新鲜制备的电极片。
3.4检查解决方案交换文物
膜参数已检查后,应测试解决方案交换工件测量缓冲区。
- 将各溶液容器的流体系统。
- 流体系统中除去气泡,用手动阀。
- 使用数据采集软件,选择你想在你的实验中使用的流协议。
- 调整至0.6巴的压力,并开始测量。
- 理想情况下没有神器电流除了从机械阀切换文物外,应测量或他们应该多SMA缪勒比预期的蛋白质交通信号。如果溶液交换工件的观察,尝试优化缓冲液和/或程序的编写,然后再继续实验。
3.5添加蛋白质样品
一般蛋白脂质体或膜碎片冷冻贮存在-80℃。对于一个测量约30微升的等分部分是必要的。
- 与非活化溶液冲洗SSM。
- 冰解冻蛋白质样品。
- 3个10秒的超声处理周期交替进行10秒冷却时间间隔在冰上。脂蛋白体超声浴超声波破碎。对于膜碎片的前端超声波破碎仪(50W,30千赫,1毫米超声焊极直径,强度20%,周期0.5)被使用。最后超声步骤后不把样品上冰,但立刻注入到试管。
- 拧下插座连接器与参考电极ASSEmbly。
- 用吸管,吸30微升的蛋白质样品,并安装枪头出口孔。
- 在非活化的通路打开手动阀到废液容器,注入到试管体积的蛋白脂质体。要小心,不要将空气注入试管体积与传感器。
- 去除枪头之前,关闭手动阀,以防止进一步解决流动。
- 允许的蛋白脂质体吸附到1〜2小时的温育时间的SSM。另外,也可以孵育过夜。
3.6 SSM基于实验的一般程序
- 暖机时间的测量缓冲液在4℃下储存,如果所有测量缓冲区必须在室温下在开始测量前,以避免文物。
- 变化的解决方案时,首先清洁管内的溶液的容器中,用非模糊化的组织,然后将新的瓶。
- 在开始测量之前,请使用手动阀,以去除气泡,这可能已经从不断变化的过程。
- 调整的压力,只是在开始测量前。我们经常使用的压力为0.6巴,在为特定的阀和管配置产生约1.0毫升/秒的流速。
- 的前几个测量可以进行陆续笔直的,并应被拒绝,直到峰值电流保持恒定。如果溶液的pH值不同的孵育时间至少为3分钟,在开始测量之前,需要调整的蛋白脂质体的内pH值。
- 现在的设置是准备测量。为了降低噪音应至少3次测量,取平均值。
3.7控制测量
在一系列的测量破败的信号可能会出现由于蛋白质降解或吸附的损失。每个SSM实验我应该包含重新一个破旧的控制。这是通过重复测量具有相同的解决方案。的最小的的破旧的控制装置,一个测量在开始和在实验结束时,使用相同的解决方案。
我们建议做破旧的控制,最高峰幅度在实验中,你想到哪里的条件下。这使得它更容易量化的破败的信号。
可以被量化的信号断开,通过比较两个破旧的控件的峰值振幅。所得的百分比值可以用来校正测得的信号,通过假设一个线性时间依赖的破旧。
3.8神器控制
如果可能的话,通过抑制感兴趣的蛋白质实验后的结果来验证您。剩余的信号是可能的解决方案交换文物。的信号,然后校正测得的工件。
3.9实验结束后,
- 洗净20-30毫升的纯净水和20〜30毫升的30%乙醇/水体系。当该系统在不使用时,乙醇溶液避免了细菌的生长。
- 这种清洗过程后,从系统中释放压力,并关闭所有的仪器。
- 从法拉第笼中取出试管,下马。可以清洗与水和纯乙醇的比色皿的所有部分,如果需要,通过使用浴超声波破碎仪。
- 把GLAS烧杯中,用纯乙醇在传感器芯片。超声处理约1〜2分钟,用浴超声波破碎仪的烧杯中。
- 干燥氮气下的传感器芯片。
- 在存储传感器芯片相差的光在的10mM Octadecanthiol的乙醇溶液。约30分钟的孵育时间后,在传感器芯片可以重用。
结果
到现在为止,基于SSM的电是用来描述超过20转运,大多是原核起源, 例如 MELB 心情,NhaA 4和5 PutP的(6)总结。但也真核转运蛋白从细胞内的膜, 例如 ClC7 7,以及离子通道, 例如 ,已被研究的烟碱型乙酰胆碱受体8。
在这里,我们提出一个例子测量糖/ H +转运蛋白拉齐从大肠杆菌脂蛋白体至少有85%的右侧出面向拉齐在LPR 5 月9日,10。我们专注于导致这种转运蛋白最小的动力学模型的主要步骤。
1。野生型拉齐的电生理特性
第一步是生电的反应,通过测量不同pH值的一般表征( >图4),底物浓度( 图5)和基板。来验证该技术中,K M和pK值的文献中给出的再现。
pH值的依赖拉齐显示了两种不同的产电反应。电容耦合的电流增加在pH为5,pH为8.5,而且还改变其形状。在碱性条件下观察到稳定状态运输,而pH值呈酸性仅产电的快速反应依然。为了区分从快速生电反应,我们用电路分析重建转运电流( 图6)的稳态信号。
在pH为7的单相的信号变成双相。这也说明,有两种不同的生电反应。预计从转印充电(积分的信号),这两种反应约6%和94%的总的传输周期electrogenicity。
ove_step“> 2。分配生电反应要分配两个产电的特定步骤的反应,在反应周期拉齐,E325A拉齐的变种测量( 图7)。这种变异只显示乳糖交换,但所有活动的交通工具,因为缺乏抑制质子释放。快速瞬态信号E325A LACY的代表和所有测得的pH值是恒定的。的形状和振幅的信号是信号拉齐,在酸性条件下的野生型相似。此外,我们观察到一个小的负相后峰值电流下降,这是快速的瞬态电流测量电容耦合系统的特征。因为乳糖结合和释放是不产电,快速瞬态必须与产电乳糖结合后的构象转变。
它是已知的质子释放步骤是汇率limiti纳克拉齐营业额中乳糖的浓度梯度驱动的传输模式。在这种情况下,我们预计增加的传输速率与碱性pH值,因为质子释放的青睐。这是稳定状态的情况下运输相关野生拉齐信号。此外,它可以通过pH梯度测量所示,只有内的pH值影响拉齐(未发表)的稳定状态下运输。因此,可分配给大生电反应的质子释放步骤。
3。测量动力学分析
运输费率和关闭的产电反应鉴定后确定使用SSM设置具有很高的时间分辨率约4.5毫秒。这是唯一可能的条件下,当一个反应占主导地位的信号。在这种情况下的速率常数可以是来自于所考虑的时间分辨率的信号中的瞬态电流使用迭代最小二乘卷积算法( 图8)。最后确定的速率常数以及建议最小的动力学模型( 图9)用于的转运动力学模拟。模拟曲线重现SSM另外证明动力学模型的数据。

图1。吸附的蛋白脂质体的几何形状上的SSM。SSM形成的传感器芯片,一个结构化的金涂层的载玻片上。为了测量生电反应的膜蛋白,蛋白脂质体或膜碎片被吸附的SSM。两种膜可以形成一个电容耦合的系统。这就是为什么只有瞬态电流检测。
tp_upload/50230/50230fig2highres.jpg“/>
图2。 SSM比色皿进行。传感器芯片的传感器芯片和参考电极之间的比色皿的底座和比色皿头夹持。参比电极是隔离的由聚丙烯酰胺凝胶盐桥的流动通路。
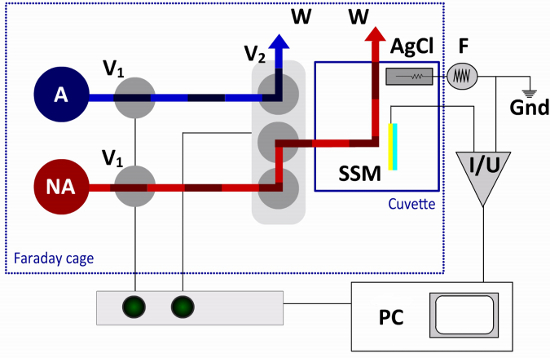
图3。流体通路和电气电路的SSM设置在单一解决方案交换协议只有一个非激活(NA)和激活(A)的解决方案是必需的。流是由两个2通阀(V1)和一个终端阀(V2)。阀的开关来激活和非激活的解决方案的终端,指挥的比色皿和到废液容器(W)的其他解决方案的解决方案之一。的传感器芯片(SSM)连接到放大器(I / U),而氯化银参比电极()函数产生器(F)连接到外部电路。甲计算机(PC)和一个接口盒用于阀的操作和数据采集。
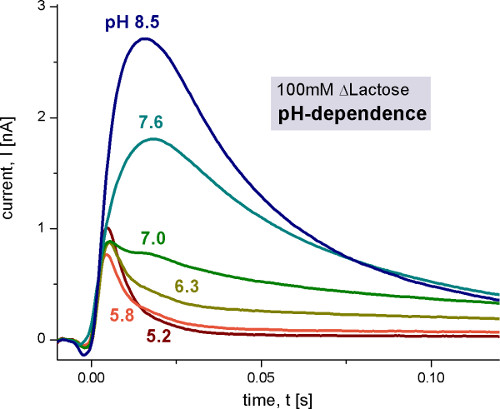
图4。测量与野生型LACY的100 mM的乳糖浓度在不同pH值跳跃后的蛋白脂质体的瞬态电流的非活化的溶液含有100mM的葡萄糖,而活化溶液含有100 mM的乳糖。所有溶液均在指定的pH值用1mM DTT的100mM磷酸钾缓冲液中制备。在此测量条件的详细信息,下面的数字,请参阅9和10。
ftp_upload/50230/50230fig5highres.jpg“/>
图5。平均归峰值电流测量与野生型拉齐后,乳糖浓度脂蛋白体在不同的浓度和pH值跳跃 K M值是从双曲线配合。
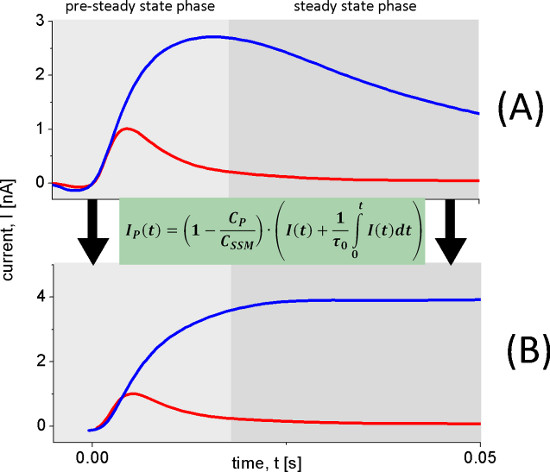
图6。重建转运电流的瞬态电流(A)用于重建转运电流(B)进行测量后与野生型拉齐脂蛋白体在pH 8.5(蓝色曲线),pH值5.2(红色线)100毫米乳糖浓度跳转。在pH 8.5的营业额持续观察,而在pH值5.2快生电反应发生。该重构的当前(B)清楚地观察到这一点。
files/ftp_upload/50230/50230fig7.jpg“ALT =”图7“FO:内容宽度=”4英寸“FO:SRC =”/ files/ftp_upload/50230/50230fig7highres.jpg“/>
图7。瞬态电流测量了100毫米,在pH 5.2的乳糖浓度跳与E325A LACY脂蛋白体后,拉齐变种抑制质子释放步骤的运输周期,因此运输缺陷。小的负分量,观察到的是在电容耦合的系统中测量的快速瞬态电流的特性和快速的生电反应后的膜电容的放电引起的。其时间常数π0是由系统( 图1)的电容和电导。
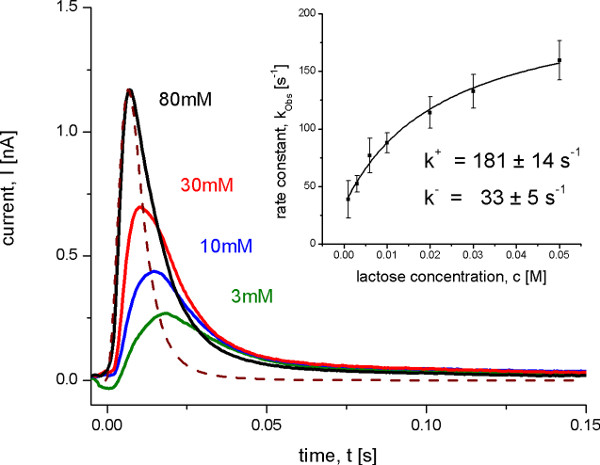
图8。与野生型拉齐脂蛋白体测量瞬态电流AFTEŗ不同的乳糖浓度跳跃在pH值为5.2,在这些条件下被观察到,但没有稳定的状态运输产电后,乳糖结合构象转变。虚线表示的传递函数表示的系统的时间分辨率。插图示出的打开和关闭从观测到的速率常数kobs的双曲线适合的数据的速率常数的测定。观察到的速率常数确定一个迭代最小二乘卷积算法10瞬态电流。
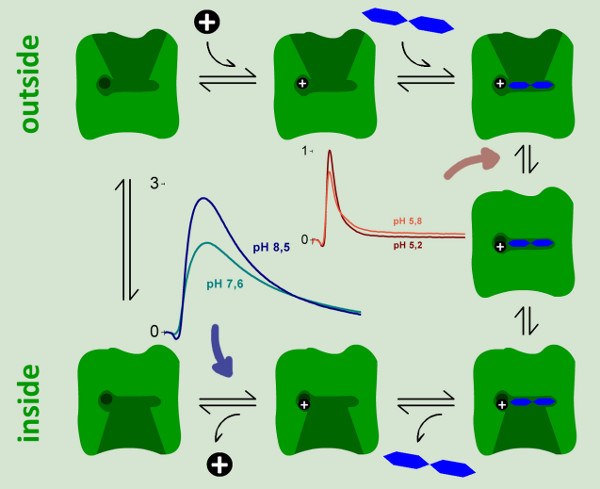
图9所示。拉齐。产电步骤的反应周期的动力学模型可以被识别和特征SSM测量。强生电的反应较〜94%的总电荷位移反应周期只观察到在中性和碱性pH值。它可以被分配到的质子释放步骤(蓝色箭头)。观察时,在酸性pH值连续营业额抑制野生型拉齐的了弱生电的一步。我们分配后乳糖结合,它代表的反应周期中的总电荷位移的6%产电的构象转变的反应。
讨论
1。基于SSM算法的电生理的优点与常规方法相比
基于SSM-电已经证明了自己的电工具箱作为一个有价值的工具。它是在哪里惯例电,即补丁钳和电压钳方法,可以不被应用尤其有用:除了一些罕见的例外细菌转运可以不进行调查,因为对细菌的小尺寸和因为使用电压钳或膜片钳方法它们很难在哺乳动物细胞或卵母细胞中表达。但也有关生理哺乳动物转运可以进行调查。在这种情况下,基于SSM算法的电生理转运蛋白从细胞内的膜,并在药物发现的,因为它的稳健性和自动化潜力的筛选应用是有吸引力的。
SSM-basedUsing传统的电,时间分辨表征运输orters是具有挑战性的。由于营业额转运低巨型补丁“或”全细胞“配置是必需的,其中有一个固有的低时间分辨率的解决方案交换实验。并发症是可以克服的使用光解基板释放。然而,只有有限数目的衬底都适合于这种方法。在这里,快速地解决在SSM交流提供了独特的机会,使用任意基板具有很高的时间分辨率进行电生理研究。
2。限制和关键步骤
在膜片钳和电压钳技术相比,基于SSM算法的电不能被用于施加电势。转运特性,因此仅限于运输模式不依赖于膜电位。
在一般情况下,基于SSM的电生理学有不同的(生电)转运没有限制。但电压CL放大器或膜片钳方法可以有优势,如果细胞内的组件,如结合蛋白所需要的蛋白质的功能。
限制可能会出现,如果解决方案交换创建大神器电流。发生这种情况时,基板与的SSM像亲脂性化合物的情况下强相互作用。工件控件,可用于修正测量出的信号。此外,高的盐,背景在所有测量的缓冲区可以被用来减少工件。但在情况下,工件的大小是可比较的蛋白质信号,它几乎是不可能的,从工件分离蛋白相关信号。幸运的是,高文物是不寻常的,优化的解决方案交换。
有几个成功地实现了一个基于SSM的电生理实验的关键步骤。蛋白质样品的准备是最重要的部分。如果脂蛋白体使用,确保重建titution过程产生清洁,可再现的样本足够LPR和转运为导向以正确的方式。的LPR可以检查冷冻断裂电子显微镜和方向,如果抗体可通过酶联免疫吸附实验。
只使用SSM孵化蛋白质样品的最佳参数。蛋白质的注入是另一个关键的一步。超声处理是必不可少的,在注射过程中,应避免气泡。样品孵化后的测量本身是至关重要的,因为气泡会从传感器芯片除去吸附的蛋白质样品。因此,应始终去除气泡,改变后的解决方案。不过信号破败可能发生。要纠正一个可能的信号断开,这是必不可少的在实验过程中,以完成破旧控制的。
3。专业系统
SSM设置可以根据其应用修改。此外吨这里是完全不同的,高度专业化的设置。
是不对称的条件下, 例如 pH梯度下的可能性来衡量蛋白质信号。要建立内部和外部的蛋白脂质体的第三解决方案的不对称的缓冲组合物,静息的解决方案,已被引入,这需要一个双交换配置。在这里,非活化和休息的解决方案之间的一个额外的三通阀的切换是必需的。
为了增加系统的时间分辨率,我们开发了一种替代缺乏终端阀,但使用不同的不同的比色皿的流动通路。这里激活和非激活溶液的交界处比色皿内,位于前面的SSM 3毫米。这种设置非常适合于快速运输过程动力学分析。低至2毫秒的时间分辨率,可以显示。
商业f来自ully自动化系统旨在用于药物筛选的一个显着更高的吞吐量。一种可移动单元收集的解决方案,而且将它们注射到传感器表面,在96孔板中在一个标准的微量滴定板的格式。
披露声明
没有利益冲突的声明。
致谢
我们感谢J.加西亚塞尔马,我斯米尔诺娃和R. Kaback的贡献拉齐测量和E班贝格的支持和有益的讨论。
材料
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Waterbath Sonicator | Bandelin | RK 52 H | |
| Tip Sonicator | Hielscher Ultrasonics GmbH | UP50H | |
| 2-way valve | NResearch, West Caldwell, USA | NR225T011 | |
| Terminal valve | NResearch, West Caldwell, USA | NR225T031 | |
| Manometer | Greisinger electronics | GDH 14 AN | |
| Faraday cage | Max Planck Institute of Biophysics | ||
| Cuvette | Max Planck Institute of Biophysics | ||
| 100 ml solution containers | Kartell | 1623 | |
| O-rings | Seal Science Inc. | ||
| Oscilloscope | Tektronix | TDS 1002 | |
| Reference electrode | Max Planck Institute of Biophysics | ||
| Function generator | Max Planck Institute of Biophysics | ||
| Tubings | SAINT-GOBAIN Performance Plastics | AAC00006 | |
| Sensor chip | Fraunhofer Institut für Schicht und Oberflächentechnik | ||
| Interface box | Max Planck Institute of Biophysics | ||
| Amplifier | Keithley | 427 | |
| Manual cog | Vygon GmbH | 876 | |
| USB analog-to-digital converter | National Instruments | 6009 | |
| Regeants | |||
| 1,2‑Diphytanoyl-sn-glycero-3-Phosphatidylcholine | Avanti Polar Lipids, Inc. | 850356 | |
| Acrylamide/Bis-acrylamide | Sigma Aldrich | A3574 | |
| Ammonium persulfate | Sigma Aldrich | A3678 | |
| D-(+)-Glucose | Sigma Aldrich | G8270 | |
| Dithiothreitol | Sigma Aldrich | 43819 | |
| Ethanol absolut | VWR AnalaR NORMAPUR | 603-002-00-5 | |
| Natural E. coli lipids polar extract | Avanti Polar Lipids, Inc. | 100600 | for LacY reconstitution |
| n-Decane | Sigma Aldrich | D901 | |
| Octadecanethiol | Sigma Aldrich | O1858 | |
| Octadecylamine | Sigma Aldrich | 74750 | |
| Potassium chloride | Merck | 1049360500 | |
| Potassium phosphate dibasic | Sigma Aldrich | P3786 | |
| Potassium phosphate monobasic | Sigma Aldrich | P9791 | |
| Tetramethylethylenediamine | BIO RAD | 1610801 | |
| α-Lactose monohydrate | Sigma Aldrich | L8783 | |
参考文献
- Seifert, K., Fendler, K., Bamberg, E. Charge transport by ion translocating membrane proteins on solid supported membranes. Biophys. J. 64, 384-391 (1993).
- Schulz, P., Garcia-Celma, J. J., Fendler, K. SSM-based electrophysiology. Methods. 46, 97-103 (2008).
- Garcia-Celma, J. J., et al. Rapid activation of the melibiose permease MelB immobilized on a solid-supported membrane. Langmuir. 24, 8119-8126 (2008).
- Mager, T., Rimon, A., Padan, E., Fendler, K. Transport mechanism and pH regulation of the Na+/H+ antiporter NhaA from Escherichia coli: an electrophysiological study. J. Biol. Chem. 286, 23570-23581 (2011).
- Zhou, A., et al. Charge translocation during cosubstrate binding in the Na+/proline transporter of E.coli. J. Mol. Biol. 343, 931-942 (2004).
- Ganea, C., Fendler, K. Bacterial transporters: charge translocation and mechanism. Biochim. Biophys. Acta. 1787, 706-713 (2009).
- Schulz, P., Werner, J., Stauber, T., Henriksen, K., Fendler, K. The G215R mutation in the Cl-/H+-antiporter ClC-7 found in ADO II osteopetrosis does not abolish function but causes a severe trafficking defect. PLoS ONE. 5, e12585(2010).
- Schulz, P., Dueck, B., Mourot, A., Hatahet, L., Fendler, K. Measuring ion channels on solid supported membranes. Biophys. J. 97, 388-396 (2009).
- Garcia-Celma, J. J., Smirnova, I. N., Kaback, H. R., Fendler, K. Electrophysiological characterization of LacY. Proc. Natl. Acad. Sci. U.S.A. 106, 7373-7378 (2009).
- Garcia-Celma, J. J., Ploch, J., Smirnova, I., Kaback, H. R., Fendler, K. Delineating electrogenic reactions during lactose/H+ symport. Biochemistry. 49, 6115-6121 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。