需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
协议相对液力评估的三单张聚合物阀
摘要
已续期开发聚合物阀门的兴趣。这里,目的是为了证明修改一个商业脉冲复印机的可行性,容纳三单张几何定义一个协议,目前聚合物阀流体动力学数据,在本地和人工瓣膜在近乎相同的条件下收集的数据相比。
摘要
目前可用的人工心脏瓣膜,异种移植,同种的限制,在该地区的三单张聚合物瓣膜的发展已经促使近期回潮。然而,聚合物阀流体动力学功能的初步评估鉴定的协议是至关重要的设计过程的早期阶段。传统体外脉冲复印机系统未配置,以适应灵活的三单张材料,此外,本地和人工心脏瓣膜,在相同的测试条件下,在一个相对的情况下需要作出评估聚合物阀功能,使测量过程中从不同的变异工具是可以避免的。因此,我们进行了水动力评估的i)本地(n = 4时,平均直径D = 20毫米),二)双向单张机械(N = 2,D = 23毫米)和iii)聚合物阀门组(n = 5, D = 22毫米),通过使用市售的脉冲复制器系统(ViVitro实验室公司,维多利亚,不列颠哥伦比亚省)的修改,以适应三单张阀门的几何形状。在佛罗里达大学开发的三单张硅阀,包括聚合物阀门组。甲中的比例为35:65的甘油与水的混合物被用来模仿血液物理性质。瞬时流量计量的左心室和主动脉单位的接口,而的压力录得的心室和主动脉的位置。双性恋单张及当地阀门从文献资料是用来验证的流量和压力读数。下面的水动力指标进行了报道:正向流量压力下降,主动脉根部的意思是方正向流量,主动脉瓣关闭,泄漏量返流,收盘transaortic,渗漏,总能量损失。代表结果表明,动力指标从三个阀门组能够成功地将组装成一个定制的市售脉冲复印机系统和subsequentlY,客观地比较提供聚合物阀设计,功能方面的见解。
引言
心脏瓣膜病往往导致退行性瓣膜钙化1,风湿热,心内膜炎3,4或先天性出生缺陷。当阀门出现损坏,引起管腔狭窄和/或关闭不全瓣脱垂并不能进行手术修复,本土阀门通常是人工瓣膜替换。当前可用的选项包括机械阀(笼式球阀,倾斜盘阀等 ),同种移植,和生物瓣膜(猪和牛的阀门)。机械阀通常建议年轻的患者,根据其耐用性,但患者须继续抗凝治疗,以防止血栓并发症5。同种生物的人工心脏瓣膜一直有效的选择,以避免血液稀释剂治疗,然而,这些阀门有纤维化的风险升高,钙化,变性,导致阀故障6和免疫原性并发症。组织工程阀门被调查作为一项新兴的技术7-9,但仍然有许多有待发现。替代耐用,生物相容性,人工心脏瓣膜,心脏瓣膜疾病患者的生活质量需要改善。同样,这种阀门设计可以取代使用生物瓣经导管瓣膜技术,导管方法的潜力转化患者选择的治疗心脏瓣膜病10。
诚如,一个成功的心脏瓣膜替代现行标准应具有以下性能特点:1)允许正向流动与可接受的小型平均压差下降; 2)防止逆行流可接受小返流; 3)抗栓塞; 4)抵抗溶血; 5)抗血栓形成; 6)具有生物相容性; 7)是在体内诊断技术兼容; 8)交付和植入目标人口9)保持固定一次放置10)有一个可以接受的噪音水平; 11)具有重复性的功能; 12),维持其功能为合理的寿命,符合其泛型类; 13)一个合理的架子,维护其功能和不育生活在植入前。“11。一些现有的瓣膜的缺点可能被克服的聚合物阀被认为是生物相容的聚合物的生物稳定性,抗水解,抗氧化,和有利的机械性能,如基于顶端候选人特别是高强度和粘弹性,弹性聚合物可提供材料的变形,类似本土阀的动态。弹性体可以定制,以模仿软组织属性,它们可能是唯一的人造材料,生物性,并能承受耦合, 在体内 ,流体引起的,弯曲和拉伸应力,但移动的方式类似健康本地阀动作。此外,弹性体可以是大规模生产的各种各样的大小的信息,存储轻松,预期是符合成本效益的设备,并可以在结构上与纤维增强材料增强。
采用高分子材料组装一个三单张阀的概念并不新鲜,在过去的50年12月放弃了,这是主要是由于阀经久耐用有限,一直受到一些研究调查。然而,随着新型制造方法的出现,13,14,加固高分子材料15,16和潜在的无缝集成聚合物阀经导管瓣膜技术的替代品,有最近被重新开发聚合物阀门作为一个潜在的兴趣和活动当前可用的商业阀的可行的替代方案。在这个光中,一个协议,用于使这些阀的测试,以评估水动力的功能是第一步在评估过程中,但一般市售脉冲模拟器系统不配备,容纳三单张阀设计,并包含一个环形间距插入市售心脏瓣膜( 如倾盘,双向单张机械心脏瓣膜)。其次,聚合物阀门是一项新兴技术,其流体力学只能在一个相对范围内评估。即使本机的心脏瓣膜的压力和流量的数据是可用的,所以重要的是,进行测试猪主动脉阀,这是人类阀生物相似,使用相同的搏动模拟器,用于评估的聚合物阀以便解释测量的差异,可能取决于系统。因此,这项研究的目标是演示如何市售脉冲模拟器可以配备容纳三单张阀的结构组件和系统评估聚合物阀门流体动力指标在相对续转比较机械和天然猪心脏瓣膜同行的。在我们的例子中,小说三单张有机硅聚合物阀以前开发的大学的佛罗里达州13包括聚合物阀门组。
研究方案
1。准备
- 设计并制作一个组件,以适应一个三单张阀的几何。这将包括在最小的阀保持器缝合的瓣叶的管,以容纳阀保持架及周边配件将组件固定到脉冲复制器系统。在我们的例子中,我们使用的市售的脉冲复印机系统可从ViVitro实验室公司(维多利亚,不列颠哥伦比亚省)。阀保持架的设计,以及前处理和后处理的组件的配置如图1中所示。
- 需要在使用前将底漆整个循环。这包括两个步骤:ⅰ)清洗整个环路系统使用肥皂溶液和水洗涤,包括在使用前更换任何退化管,和ii)连接到环路的工具的校准,即所使用的泵,流量探针,压力传感器(通常是心房,主动脉和心室的位置测量)。校准可以初始化ially进行,用1%食盐水之前,应重复使用模拟血液甘油溶液。
2。主动脉瓣切除术
- 获得4个新鲜的猪心,从美国农业部批准的屠宰场(机构动物护理和使用委员会(IACUC)批准可能需要)的主动脉完好无损。在我们的例子中,我们解剖协议IACUC佛罗里达国际大学(议定书“批准文号:11-020)批准。心,用去离子水冲洗,并将其放置在一个盛器,填充有1%抗生素和抗真菌剂/无菌磷酸盐缓冲盐水(PBS)溶液和运输冰流体动力测试实验室。
- 心中解剖盘,小心地取出心包。定位腹侧正面临着你的心。目视检查,并确定心脏的四个腔室,并找到完整的主动脉主动脉弓。
- 分离心脏重量ö半部横跨约0.75水平下方的环形带, 即主动脉和左心室之间的交界处。小心地分离出完整的主动脉仍连接到左心室组织分部。
- 检查位于主动脉瓣在主动脉根部,升主动脉和下侧的环形带之间的区域,确保没有任何损坏或钙化的任何迹象。
- 分裂主动脉〜1在该环形带的上方和下方的环形带的左心室组织分部分离,以分离主动脉瓣( 图2a)。
3。聚合物和Native阀缝合过程
- 将每个阀的基础上,与后支架的基础上的阀保持架内的心脏瓣膜。在每个阀门在固定的地方后,暂时用一个回形针,但要小心,不要损坏或牙尖commissures。
- 插入缝合于针。开始缝合在阀保持架的底部,通过将注射针刺入第一孔,从外侧到内侧,使得针可能会很容易地从底部拉出。以循环的方式,开始垂直缝合阀的阀门支架的职位。
- 沿圆周的保持器和安全的持有人的职位的前端周围的附加 的缝合的缝合( 图2b)中的进展情况。可以去除回形针( 图2c),当阀门完全使用缝线固定的3个职位,并在阀支架( 图2d和2e)的圆周。
4。液力评价
注意:实际协议将取决于所使用的特定的脉冲复制系统。所有的信息caontained所用的,ViVitro脉冲,速印机SYSYTEM(ViVitro实验室,温哥华,BC)。
- 双向单张VA绿萼
- 设置脉冲复印机系统70次/分钟的心脏速率。
- 选择的流波形驱动泵(的ViVitro系统的情况下,S35的波形被选定为所有流体动力学测试)。在我们的实验中使用的特定的波形示出由Lim 等 (2001)17。
- 开启对放大器和活塞泵。热身15分钟。
- 将双向单张阀( 图2f)在主动脉的位置。
- 涂抹真空油脂的所有路口的设备可能发生泄漏的地方。
- 倒入心房室甘油/盐水液体。需要注意的是的搏动复印机系统运行在2 L的液体:35%/ 0.7升甘油和65%/ 1.3 L的盐溶液。盐溶液的制备使用常见的盐溶解在去离子水中的浓度为9毫克/毫升(重量/体积)。
- 打开,已经被放置在主动脉的位置上的流量传感器。
- 校准日ê泵。
- 继续其次由压力传感器流量传感器校准。同样的泵,只需按照指示由ViVitest软件(ViVitro Labs公司)为每个校准标签下的流量和压力。
- 一旦校准完成后,启动泵在低转速,直到流体填充主动脉舱。检查是否有泄漏。使用真空油脂如有必要。
- 关闭两个停止公鸡(主动脉和心室传感器的)到打开位置。
- 提高泵的转速,直到每搏输出量达到80毫升/节拍。
- 允许系统运行10分钟,直到流稳定。流量稳定,可以验证通过观察波形显示在屏幕中的流量和压力。低到没有周期之间的变化是系统稳定的一个很好的指标。
- 在ViVitest软件,选择采集模式。
- 点击收集10个周期。
- 从分析模式,C舔桌子上,并保存该文件。还可以用照片捕捉选项ViVitest保存图像的波形。
- 母语和聚合物阀门
- 对于聚合物和动物阀,按照同样的步骤3.1.1 - 3.1.3双向单张阀指令。
- 阀支架放置与缝合阀玻璃管内的定制组件。夹在中间管件的顶部和底部,并就地与横向的螺钉和螺母固定。
- 将组件之间的的主动脉腔室和原来的主动脉瓣支架。
- 继续步骤3.1.5 - 3.1.16双向单张阀指令。
5。后处理
- 流量和压力波形
- 平均的波形采集的, 即主动脉压(AP),左心室压力(VP),流量(Q)对每个收集到的数据。
- 对于每个组的阀(聚合物,猪Ñ积极行动的主动脉瓣和双向单张),绘制相应的AP,VP和Q随时间变化的关系,在同一小区。
- 对于AP,叠加正常,主动脉阀18,和双向单张瓣膜19地块从文献为验证目的。
- 水动力指标
- 对于测试的每个阀,下面的流体动力度量计算:a)前流动压力降和最大跨瓣压差(TVP),二)主动脉根均方(RMS)的前向气流率,三)主动脉前向气流,关闭,泄漏总返流量,D)底阀口面积(EOA),电子)远期transaortic,流动,收盘时,泄漏和总能量损失。
- 正向流压降计算从TVP的读数,并可以分为3个时间段,P:TVP,F:正向流量和H间隔:间隔0 TVP开始和结束0流量开始和结束的时间间隔。最大TVP是马ximum记录的压力梯度跨瓣的主动脉和心室压力读数。
- RMS正向流速(Q 有效值 )提供了一个有用的指标为量化前向流速的大小,如下所示:

其中“n”是时间点的总数收集,“Q 我 ”是收集,以'我'的瞬时流量测量。 - 前进,主动脉关闭和泄漏量的计算基于以下的时间间隔,远期:开始向前流经阀(T O),年底前向流量(T 1);结算:从T 1至实例(T 2)阀门关闭;泄漏:从T 2至年底的心脏周期(T 3)。总返流量是简单相加的CLOSING和泄漏量。
- 为20,P,F和H的3个时间间隔期间的平均TVP上述各期间的EOA血液属性的基础上,可以计算:
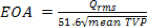
- 能源损耗被定义如下:21日 :
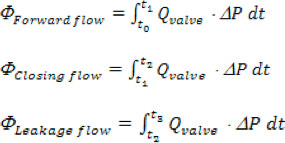
- 对于测试的每个阀,下面的流体动力度量计算:a)前流动压力降和最大跨瓣压差(TVP),二)主动脉根均方(RMS)的前向气流率,三)主动脉前向气流,关闭,泄漏总返流量,D)底阀口面积(EOA),电子)远期transaortic,流动,收盘时,泄漏和总能量损失。
结果
代表的流量和压力波形示于图3,图4和5。在样本大小的地块,平均每个组的测试,这是阀门中,n = 5,4,2阀的聚合物,天然猪和双向单张组,分别。列于表1中的平均流体力学度量和这些样本的大小的平均值的标准误差。
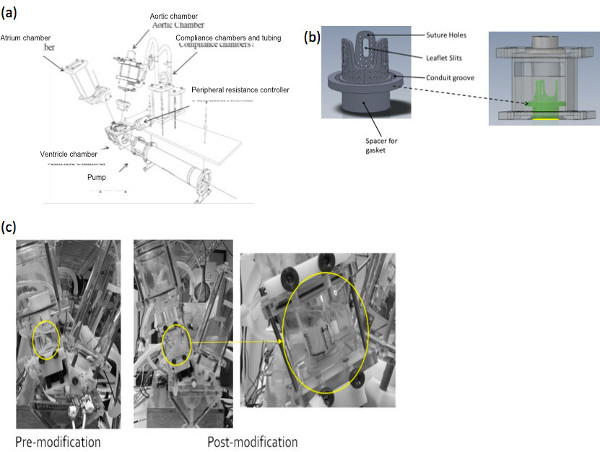
图1。 (一)实施的Windke...
讨论
在本研究中,我们已经展示了实用程序的修改市售搏动复印机单元,容纳三单张阀的几何形状,使流体动力学的聚合物和天然猪阀的测试可以执行。特别是在我们的案例中,系统改良是一个的左ViVitro心脏和全身模拟器通过ViViTest的数据采集系统(ViVitro系统公司,维多利亚,不列颠哥伦比亚省,加拿大)控制系统( 图1a)。然而,该系统是没有不同,不同的试管中 ,都利用一种...
披露声明
什么都没有透露。
致谢
批种子佛罗里达大学 - 医学院表示感谢。研究生研究(曼努埃尔·萨利纳斯)支持在生物医学研究计划 - 研究计划,科学强化(MBRS RISE)奖学金:NIH / NIGMS R25的GM061347通过少数机会。从华莱士的H. Coulter基金会通过佛罗里达国际大学的财政支持,也感谢生物医学工程系。最后,感谢他们协助学生在实验过程中不同阶段的:玛拉基书萨特尔卡马乌码头,肯德尔·阿姆斯特朗和亚伯拉罕·阿方索。
材料
| Name | Company | Catalog Number | Comments |
| Pump | ViVitro Labs | http://vivitrolabs.com/products/superpump/ | |
| Flow Meter and Probe | Carolina Medical | Model 501D | http://www.carolinamedicalelectronics.com/documents/FM501.pdf |
| Pressure Transducer | ViVitro Labs | HCM018 | |
| ViVitro Pressure Measuring Assembly | ViVitro Labs | 6186 | |
| Valve holder | WB Engineering | Designed by Florida International University. Manufactured by WB Engineering | |
| Pulse Duplicator | ViVitro Labs | PD2010 | http://vivitrolabs.com/wp-content/uploads/Pulse-Duplicator-Accessories1.pdf |
| Pulse Duplicator Data Acquisition and Control System, including ViViTest Software | ViVitro Labs | PDA2010 | http://vivitrolabs.com/products/software-daq |
| Porcine Hearts and Native Aortic Valves | Mary's Ranch Inc | ||
| Bi-leaflet Mechanical Valves | Saint Jude Medical | http://www.sjm.com/ | |
| High Vacuum Grease | Dow Corning Corporation | http://www1.dowcorning.com/DataFiles/090007b281afed0e.pdf | |
| Glycerin | McMaster-Carr | 3190K293 | 99% Natural 5 gal |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | MT21031CV | 100 ml/heart |
| Antimycotic/Antibiotic Solution | Fisher Scientific | SV3007901 | 1 ml in 100 ml of PBS/heart; 20 ml for ViVitro System |
| NaCl | Sigma-Aldrich | S3014-500G | 9 g/L of deionized water |
| Deionized Water | EMD Millipore Chemicals | Millipore Deionized Purification System. 1.3 L for ViVitro System, 200 ml for heart valve dissection process |
参考文献
- Rajamannan, N. M., et al. Calcific aortic valve disease: not simply a degenerative process: A review and agenda for research from the National Heart and Lung and Blood Institute Aortic Stenosis Working Group. Executive summary: Calcific aortic valve disease-2011 update. Circulation. 124, 1783-1791 (2011).
- Marijon, E., Mirabel, M., Celermajer, D. S., Jouven, X. Rheumatic heart disease. Lancet. 379, 953-964 (2012).
- Karaci, A. R., et al. Surgical treatment of infective valve endocarditis in children with congenital heart disease. J. Card. Surg. 27, 93-98 (2012).
- Knirsch, W., Nadal, D. Infective endocarditis in congenital heart disease. Eur. J. Pediatr. 170, 1111-1127 (2011).
- Korossis, S. A., Fisher, J., Ingham, E. Cardiac valve replacement: a bioengineering approach. Biomed. Mater. Eng. 10, 83-124 (2000).
- Ghanbari, H., et al. Polymeric heart valves: new materials, emerging hopes. Trends Biotechnol. 27, 359-367 (2009).
- Mol, A., Smits, A. I., Bouten, C. V., Baaijens, F. P. Tissue engineering of heart valves: advances and current challenges. Expert Rev. Med. Devices. 6, 259-275 (2009).
- Ramaswamy, S., et al. The role of organ level conditioning on the promotion of engineered heart valve tissue development in using mesenchymal stem cells. Biomaterials. 31, 1114-1125 (2010).
- Sacks, M. S., Schoen, F. J., Mayer, J. E. Bioengineering challenges for heart valve tissue engineering. Annu. Rev. Biomed. Eng. 11, 289-313 (2009).
- Zamorano, J. L., et al. EAE/ASE recommendations for the use of echocardiography in new transcatheter interventions for valvular heart disease. J. Am. Soc. Echocardiogr. 24, 937-965 (2011).
- ANSI/AAMI/ISO. Cardiovascular Implants - Cardiac Valve Prostheses. Assoc. Adv. Med. Instrum. 71, (2005).
- Gallocher, S. L. . Durability Assessment of Polymer Trileaflet Heart Valves PhD thesis. , 313 (2007).
- Carroll, R., Boggs, T., Yamaguchi, H., Al-Mously, F., DeGroff, C., Tran-Son-Tay, R. Blood Cell Adhesion on Polymeric Heart Valves. , (2012).
- Pierre, K. K., Salinas, M., Carroll, R., Landaburo, K., Yamaguchi, H., DeGroff, C., Al-Mousily, F., Bleiweis, M., Ramaswamy, S. Hydrodynamic Evaluation of a Novel Tri-Leaflet Silicone Heart Valve Prosthesis. , (2012).
- Cacciola, G., Peters, G. W., Schreurs, P. J. A three-dimensional mechanical analysis of a stentless fibre-reinforced aortic valve prosthesis. J. Biomech. 33, 521-530 (2000).
- De Hart, J., Cacciola, G., Schreurs, P. J., Peters, G. W. A three-dimensional analysis of a fibre-reinforced aortic valve prosthesis. J. Biomech. 31, 629-638 (1998).
- Lim, W. L., Chew, Y. T., Chew, T. C., Low, H. T. Pulsatile flow studies of a porcine bioprosthetic aortic valve in vitro: PIV measurements and shear-induced blood damage. J. Biomech. 34, 1417-1427 (2001).
- Gutierrez, C., Blanchard, D. G. Diastolic heart failure: challenges of diagnosis and treatment. Am. Fam. Physician. 69, 2609-2616 (2004).
- Shi, Y., Yeo, T. J., Zhao, Y., Hwang, N. H. Particle image velocimetry study of pulsatile flow in bi-leaflet mechanical heart valves with image compensation method. J. Biol. Phys. 32, 531-551 (2006).
- Chandran, K. B., Yoganathan, A. P., Rittgers, S. E. . Biofluid Mechanics: The Human Circulation. , 277-314 (2007).
- Akins, C. W., Travis, B., Yoganathan, A. P. Energy loss for evaluating heart valve performance. J. Thorac. Cardiovasc. Surg. 136, 820-833 (2008).
- Fung, Y. C. . Biomechanics: Circulation. , (1997).
- Keener, J., Sneyd, J. . Mathematical Physiology, II: Systems Physiology. , (1998).
- Quick, C. M., Berger, D. S., Noordergraaf, A. Apparent arterial compliance. Am. J. Physiol. 274, H1393-H1403 (1998).
- Wang, Q., Jaramillo, F., Kato, Y., Pinchuk, L., Schoephoerster, R. T. Hydrodynamic Evaluation of a Minimally Invasive Heart Valve in an Isolated Aortic Root Using a Modified In Vitro Model. J. Med. Devices. 3, 011002.1-011002.6 (2009).
- Baldwin, J. T., Campbell, A., Luck, C., Ogilvie, W., Sauter, J. Fluid dynamics of the CarboMedics kinetic bileaflet prosthetic heart valve. Eur. J. Cardiothorac. Surg. 11, 287-292 (1997).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。