需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
芯片上的压力诱导抗生素易感性测试
摘要
我们开发了一个用于快速抗生素易感性检测的微流体平台。流体以高速通过在微流体通道底部固定的细菌。在压力和抗生素的存在下,易感菌株会迅速死亡。然而,耐药细菌可以在这些紧张的条件下存活下来。
摘要
我们已经开发出一种快速微流体方法,用于在压力型环境中进行抗生素易感性测试。流体以高速通过在微流体通道底部固定的细菌。在压力和抗生素的存在下,易感菌株会迅速死亡。然而,耐药细菌在这些紧张的条件下存活下来。这种方法背后的假设是新的:作为抗生素靶点的生化途径的压力激活可以加速抗生素易感性测试。与标准抗生素易感性检测方法相比,在抗生素应用过程中省略了限速步骤 - 细菌生长。该方法的技术实施是标准技术和创新方法的结合。该方法的标准部分包括细菌培养协议、多晶硅氧烷 (PDMS) 中的微流体通道定义、荧光细胞生存能力监测以及细菌计数的批量图像处理。该方法的创新部分是利用培养介质流进行机械应力应用,使用酶来损伤而不是杀死细菌,以及使用微阵拉基板进行细菌附着。开发平台可用于抗生素和非抗生素相关药物的开发和测试。与标准的细菌悬浮实验相比,该药物的效果可以在受控时间段内反复打开和关闭。在同一实验过程中,可以重复观察相同的细菌种群。
引言
细菌耐药性的上升加剧了对基于表型的快速抗生素易感性测试的需求,以保障我们药物的最终手段。标准易感性测试基于细菌生长抑制,在抗生素的存在下需要多个小时(8-24)小时才能完成。我们在一个微型流体平台上开发了一种新的抗生素易感性测试,该平台依靠生物合成途径的压力激活来加速抗生素的作用。
微流体规模的抗生素易感性测试具有有效样品使用的优势,因为它们需要少量细菌。此外,微流体设备可以多路复用,以便在多个条件下测试多个样本1,2。最近,一些用于抗生素易感性检测的微流体方法被报道为3-9。在这些方法中,细菌生长在纳米和皮奥利特液滴3,7,在微流体通道4-6,8的全体积,或作为单一细菌电局部到通道9的底部表面。虽然这些测试是在微流体通道中进行的,但它们都监测微生物在存在和缺乏与传统方法类似的抗生素时的增长。生长测量 通过 光学密度、pH敏感染料或明亮的场/相对比度或荧光图像进行。虽然其中一些测试比传统方法更快,但它们各自被动地检测抗生素耐药性。换句话说,这些方法仍然要求用户等待细菌生长作为最终读出。
相比之下,我们开发了一种利用剪切和酶应力相结合的方法来激活抗生素敏感的生化途径10。用这些抗生素挑战压力细菌会产生更快的易感性测试。对抗生素有抗药性的细菌能够承受压力。另一方面,易感细菌会被合并的压力迅速杀死。用荧光死细胞污渍用显微镜测量一小时后细胞死亡的百分比,定义了细菌的表型(耐药性与易感性)。
要成功实施我们的方法,细菌必须固定在微流体通道的底部表面。这样,细菌可以承受各种压力,同时在单平面显微镜下成像。涂层显微镜玻璃滑梯用于细菌固定。幻灯片由制造商预涂,带有环氧酶组,用于非特异性蛋白质结合。这些环氧酶与细菌表面蛋白质的非特异性结合使细菌与滑动表面共度。
菌株在抗生素缺乏(控制)和存在(实验)的情况下在相同的条件下(剪切+酶应激)下进行测试。每个通道的相位对比度和荧光显微镜照片每两分钟自动拍摄一小时。然后通过比较实验通道中死细菌的百分比和控制通道中的细菌来进行耐药性指定。一小时后,细胞死亡率大于1%的样本被认为容易受到感染,而小于0.5%的死亡表明存在抵抗力。这两个截止点之间的百分比被认为是不确定的,必须再次测试样本。
微流体通道在 PDMS 中定义,这是微流体设备11的首选材料。PDMS 在波长广泛、生物相容、惰性、可渗透到气体中且对液体的渗透性较低:因此,它非常适合这些实验。
机械/剪切应力是由室温介质流过固定细菌而产生的。(注意:将介质变暖至 37 °C 对检测结果没有显著影响。自动注射器泵通过微流体通道(200μm x 400 μm)以1ml/min的流速强制介质(含有死细胞污渍+/-抗生素,以及可选的酶应激器),以6.25 kPa的剪切力或6,000秒-1的剪切速率。这个比率等于或超过先前研究的 葡萄球菌的剪切应力。
这种酶,溶酶,被选中进行初步实验,因为它对 葡萄球菌 细胞壁造成直接损害。溶酶素(0.7 ng/ml)的浓度足以造成细菌细胞壁损伤,但不足以在实验时限内在没有抗生素的情况下导致细菌细胞死亡。正确指定细菌易感性不需要溶酶素,但它确实增加了结果,导致易感菌株的细胞死亡增加。相比之下,剪切应力对检测功能至关重要。当甲氧西林敏感金 黄色葡萄球菌 株在没有流动的情况下用溶酶素和牛皮林治疗时,在实验过程中不会记录细胞死亡。
细胞的生存能力被监测与荧光死细胞污渍12。染料的选择基于其选择性地污渍只损坏细胞的能力,它对活细胞的无毒性,以及它的低背景荧光,这使得它能够直接添加到细胞介质没有额外的步骤。选择荧光染料浓度为 0.25 μM 是为了在 1.6 秒的荧光激发光暴露时间内达到可接受的信号水平。
在我们的初步研究中使用了β-乳酸,牛皮林。耐甲氧西林 的金黄色葡萄球菌 (MRSA)物种对牛皮林具有抗药性,在实验的时间范围内不会显示出任何明显的细胞死亡。初步研究确定了50微克/毫升的浓度。抗生素浓度较低,耐药菌株和易感菌株之间的分离较少,而高浓度不会在实验结果上产生明显差异。
我们以前曾报道过一项试验的成功开发,该测试将直接影响细菌细胞壁13 的机械和酶应力与抑制细胞壁生物合成的抗生素14,15相结合。这些原理证明实验是在MSA和甲氧西林敏感性 金黄色葡萄球菌 (MSSA)的小组中进行的。然而,在选择适当的实验参数时,我们的方法应适用于多种细菌和多种抗生素。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 制作 PDMS 层(图 1)
- 以10:1的比例大力混合PDMS和固化剂。为了去除气泡,在室温下将粘稠的混合物在真空室中分解1小时。
- 在秤上,将 PDMS 缓慢地倒在铝模具上。从中心倒入,保持模具水平。请务必将引脚揭开。一旦达到目标重量,停止浇注。
我们的模具需要 4 克 PDMS 和 0.4 克固化试剂。 - 将模具放在烤箱内,并在 37 °C 的夜间固化。
替代固化时间为 2 小时,60 °C 或 1 小时在 90 °C。 - 沿着模具边缘解剖固化的 PDMS 层,然后用一对钳子小心地将其从模具表面剥落。用 70% 的乙醇和 Q 尖清洁模具表面。
2. 根据图 2 组装流单元
PDMS 的标准组装与玻璃滑梯通过氧气等离子体处理两个表面,确保 PDMS 和显微镜玻璃滑梯之间的无泄漏粘合。在所提出的协议中,等离子处理将破坏玻璃滑梯上的化学涂层。因此,滑梯是压力密封的,而不是血浆处理。
- 将玻璃窗放入流动单元袋中。
- 将涂层玻璃滑梯放在流动单元口袋内的玻璃窗上,将活动侧向上放置 PDMS 层,上面有面向下的通道。将 PDMS 滑动置于通道输入与金属板中的通孔对齐的方式。轻轻地将空气从两层之间推出。
- 翻转 PDMS/玻璃滑动组件,使 PDMS 面向玻璃窗。将 PDMS 通道输入与金属板中的通孔重叠。
- 将压力板放在顶部并拧紧螺丝。
- 将组装的流细胞放在显微镜下。将显微镜放大到 60X,并预先对齐通道位置。
3. 准备日志相细菌
- 实验前一天:接种50毫升穆勒欣顿肉汤,其中含有2%的NaCl(MH2)与细菌菌落。在 37 °C 的夜间 250 rpm 摇动。
一个或两个细菌菌株可以在一个实验中研究所描述的设置。 - 实验前:将50微升的隔夜细菌培养成50毫升MH2介质。在 250 rpm 下摇动 3 小时,在 37 °C 时摇动,以确保细菌处于日志阶段。
4. 在需要实验解决方案组件前至少 10 分钟加热
- 在室温下解冻荧光染料(5毫米库存)和溶酶素(10微克/毫升库存)。
- 将牛皮林粉加热至室温。
5. 准备和加载细菌悬架
- 3 小时亚文化结束后:在 2 分钟内服用 10 毫升细菌培养和离心机,1,650 x g。
- 在1毫升新鲜MH2介质中去除超自然和再喷发细菌。
- 将短长度的管子连接到 1 毫升 Luer 锁注射器上。用 1 毫升介质冲洗注射器管。在管道中留一点介质,以避免在细菌悬浮中抽取气泡。
- 将 0.7 毫升 1 型细菌放入注射器中。用细菌类型1填充流动细胞的两个通道。注意液体在 ca之后出现在通道的另一边。150微克。
通道的透明度随着充满细菌而变化。 - 如果试验多种细菌类型,则重复细菌2型的加载过程,进入流动细胞的两个剩余通道。
- 将流动细胞置于37°C的孵化器内45分钟,使细菌沉淀并附着在滑动表面。
6. 准备并加载实验解决方案
- 通过混合 14μl 的荧光染料库存 (5 mM) 和 126 μl 的 MH2 介质,准备 140 μl 的 0.5 mM 荧光染料溶液。
- 在 40 毫升 MH2 介质中稀释 10 毫克牛西林,以获得 250μg/ml 牛丙林的最终浓度。
- 准备130毫升控制溶液,最终浓度为0.25微米荧光染料和0.7 ng/ml溶酶素。为此,混合 65μl 荧光染料(0.5 mM)、9.12 μl 溶酶素库存(10μg/ml)和 130 毫升 MH2 介质。
- 准备130毫升抗生素溶液,最终浓度为0.25微米荧光染料,0.7克/毫升溶酶素,50微克/毫升牛皮林。为此,混合 65μl 荧光染料 (0.5 mM)、9.12μl 溶酶素库存 (10 μg/ml)、26 毫升氧化铝 (250 微克/毫升) 和 104 毫升 MH2 介质。
- 用控制液填充两个 60 毫升注射器和两个 60 毫升注射器与抗生素溶液。将溶液包裹在铝箔中,以避免试剂的光诱发降解。
过满的注射器,以弥补因管道冲洗造成的损失。 - 轻拂从注射器中去除气泡。用实验解决方案将输入管连接到尖端并填充。
- 将注射器安装到泵上。先将注射器放在体积最小的位置,然后锁定柱塞位置。将其余的注射器安装到泵上,必要时挤压柱塞。
- 将泵速度设置为 1 毫升/分钟,泵体积设置为 60 毫升。用泵冲洗,直到从所有注射器中看到稳定的液体流。
7. 在显微镜下设置流动细胞
- 从离心机中取出流动细胞,将其安装到显微镜阶段(图3)。
- 将输入/输出管连接到每个流单元通道(每个通道一个输入/一个输出)。
将输出收集到四个不同的容器中,可以测量各个通道的输出量。
8. 运行60分钟实验
- 检查步骤 2.5 中的预对齐位置。如果显微镜视场不集中在通道和/或失去对焦时,调整设置并保存新位置。
由于加载细菌的高密度,在流量开始前可能无法精确对焦。 - 将相位对比采集时间设置为 10 msec,将荧光采集时间设置为 1,600 msec。
- 在启动流量之前,为每个位置获取相位对比度和荧光图像。
这给出了加载细菌密度的定性估计。 - 启动液体流动,并立即检查显微镜是否聚焦在通道底部。
- 在流量的第一分钟内拍摄目标区域的相位对比度和荧光图像。
- 在第一组图像之后每 2 分钟获取一次图像,直到发生 60 分钟的流量。必要时重新集中注意力。
9. 消毒流动细胞
- 在烧嘴(100毫升)中制作10%漂白剂溶液。用10毫升的混合物填充4 x 20毫升注射器。调试注射器并将其连接到流动单元。
通道需要1-2分钟才能清除细菌。 - 将泵速度设置为 1 毫升/分钟,泵体积设置为 3 毫升。运行3分钟。
- 用 60 毫升 DI 水填充 4 x 60 毫升注射器。调试注射器并将其连接到流动单元。
- 将泵速度设置为 1 毫升/分钟,泵体积设置为 30 毫升。运行30分钟。
- 监测显微镜下的通道清洁。
- 拆解流单元。丢弃已使用的环氧滑梯。将流动细胞组件浸泡在 DI 水中 20 分钟。空气干燥。
10. 分析图像和生成数据
- 计算每个图像中的细菌数量。
开放访问软件,蜂窝程序用于执行批次图像处理16。细胞程序程序的高级别轮廓在 表1中总结。相对比图像 (Np)中存在的细菌数量给出了细菌总数。荧光图像 (Nf)中可见的细菌数量会提供死亡细菌的数量。 - 计算正常化的细菌细胞死亡百分比作为时间函数。
- 将单个图像的 Nf 和 Np 导入数据分析软件。
- 在t=T的分数(Nf/N p)给出的特定时间点计算每个通道中死细菌的分数。
- 减去实验开始时存在的死细菌的分数(t = 1 分钟),用于控制和实验通道。
- 用以下等式从实验通道中存在的死细菌中减去每个时间点中存在的死细菌的分数:
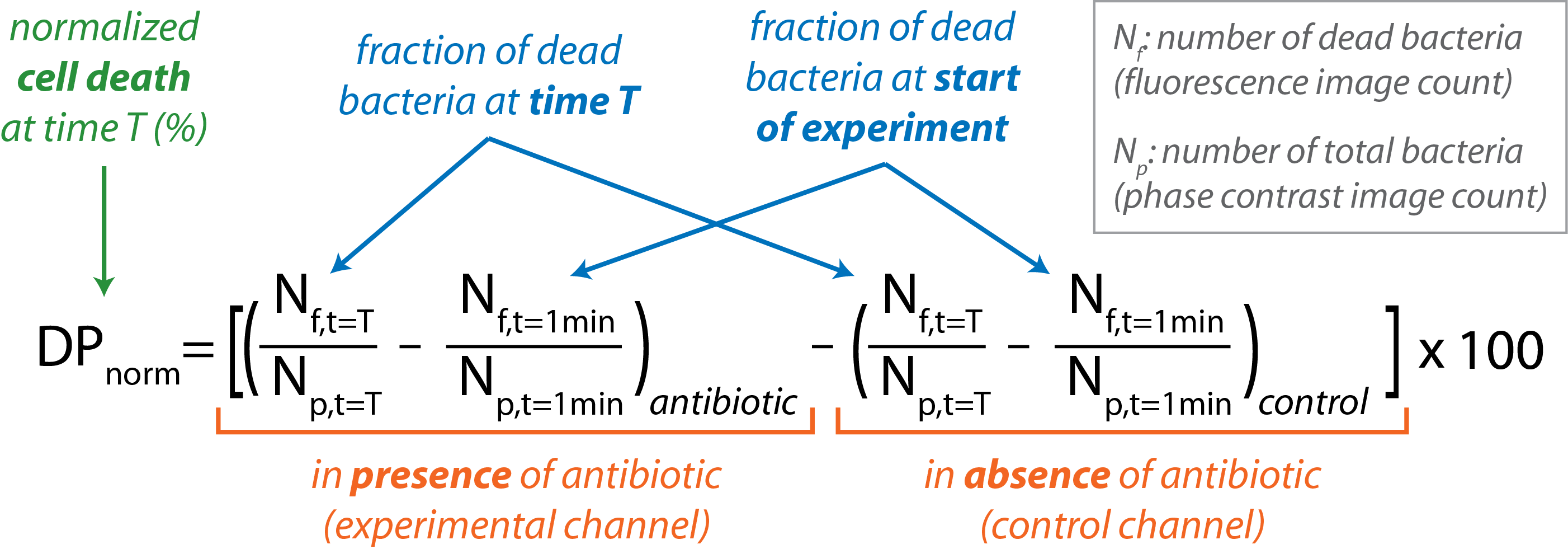
- 图形DP规范 与t的实验过程。
请注意,细胞死亡百分比大于 1% 的样本被认为易感,而小于 0.5% 的死亡表示耐药性。这两个截止点之间的百分比被认为是不确定的,必须再次测试样本。 - 使用电子表格来总结和分析不同实验的结果。
Access restricted. Please log in or start a trial to view this content.
结果
图4中提供的数据表明,在含抗生素的微流体通道中,金黄色葡萄球菌菌株会随着时间而发生反应。在 1 分钟和 1 小时实验结束时获得的相位对比图像显示在图 4A和B中。分析的 1 小时数据以图 4C显示,细菌以红色突出显示(共 5,828 个)。相应的荧光图像显示在图4D和E中。分析的 1 小时数据显示在图 4F...
Access restricted. Please log in or start a trial to view this content.
讨论
在一组对甲氧西林敏感和耐甲氧西林金 黄色葡萄球菌 株10的实验中,对所提出的协议进行了验证和优化。因此,该协议未经修改应直接适用于其他菌株的 金黄色葡萄球菌 和其他抗生素与影响细菌细胞壁生物合成的行动机制。 除金黄色葡萄球菌外,细菌类型可能需要压力参数的变化:可溶性(酶)和机械应力。如果在葡萄 球菌 以外的细菌物种的测试中需要可?...
Access restricted. Please log in or start a trial to view this content.
披露声明
微流体方法正在申请专利:索尔-布吉A、沙龙A、卡拉什尼科夫M、维尔茨H、发明人:细菌抗生素耐药性/易感性专利PCT/US10/33523快速检测的方法和设备。
致谢
我们感谢弗劳恩霍夫制造创新中心的工程师和学生。感谢安德烈亚斯·普林森、霍尔格·维尔兹、道格·福斯、大卫·查金和苏东树博士在实验系统的设计、加工和自动化方面所做的帮助。我们感谢朱莉娅·库卡茨、梅兰妮·齐默尔曼、尼科·克雷茨马尔、蒂姆·甘贝尔、乔希·维拉努埃瓦、米诺里·希米祖和卡塔日娜·库利加在测试实验协议和数据收集方面提供帮助。我们感谢哈佛大学和麻省理工学院广泛研究所成像平台的安妮·卡彭特博士和马克-安东尼·布雷博士帮助开发CellProfiler的图像分析程序。国家过敏和传染病研究所的R21AI079474和1R01AI101446部分支持了该项目。内容完全由作者负责,不一定代表国家过敏和传染病研究所或国家卫生研究院的官方观点。该项目也得到了美国弗劳恩霍夫的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| SYTOX Green | Invitrogen Corporation | S7020 | Dead cell fluorescence stain |
| Bovine Serum Albumin (BSA) | Sigma Aldrich, Inc | A9418-5G | Used for lysostaphin storage |
| Sodium Acetate | Sigma Aldrich, Inc | S8750-500G | Used for lysostaphin storage |
| Lysostaphin | Cell Sciences | CRL309A | Arrives as 1 mg solid. For storage: Dissolve in 20 mM sodium acetate. Mix with BSA solution to final concentration of 1% BSA and 100 µg/ml lysostaphin for storage |
| Oxacillin salt | Sigma Aldrich, Inc | 28221-1G | Antibiotic |
| Mueller Hinton Broth | Fisher Scientific | DF0757-17-6 | |
| Sodium chloride | Sigma Aldrixh | S3014-500G | 2% added to Mueller-Hilton broth prior to autoclaving |
| 1 ml, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 14-823-2F | |
| 2 oz, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 309653 - 60 mL | Overfill to ~65 ml |
| Microscope | |||
| Inverted Fluoresccence Microscope Olympus IX-70 | Cambridge Scientific | 9349 | |
| 60X, Fluorescence/Phase contrast objective | Olympus Corp. | LCPlan F1 60x/0.70 Ph2 | |
| Retiga 12-bit monochrome CCD camera | QImaging | RET-4000R-F-M-12-C | |
| Microscope automation | |||
| Shutters phase contrast/fluorescence | PRIOR Scientific | H204/H202 | |
| X/Y Stage | PRIOR Scientific | H107AENN | |
| Focus motor | PRIOR Scientific | H122 | |
| Joystick for XYZ control | PRIOR Scientific | CS152EF | |
| Proscan Controller | PRIOR Scientific | H3-XY2 | |
| Image Acquisition Software | Fraunhofer CMI | ||
| Flow Cell Assembly and PDMS | |||
| Flow Cell | BU Scientific Instruments Facility/Fraunhofer CMI | 3333-1044 | Engineering drawings were produced by Fraunhofer CMI |
| Glass window | Fraunhofer CMI | 3333-1054 | Glass window was cut to the proper size at Fraunhofer CMI |
| BOROFLOAT Window 50 mm x 50 mm | Edmund Optics Inc. | NT48-543 | |
| Sealing plate | BU Scientific Instruments Facility | 3333-1045 | |
| Epoxide glass slide | Arrayit Corporation | SuperEpoxy 2 | |
| PDMS master | Fraunhofer CMI | 3333-1053 | Master machined in aluminum or brass with UPM-0005 (ultrapresicion fly-cutting machine) |
| PDMS slide design | Fraunhofer CMI | 3333-1053 | |
| Tubing | |||
| Nut, Super flangeless Tinytight, headless, 1/16 in, PEEK, green | IDEX Health Science | M-644-03 | Flow cell inputs/outputs are tapped for this ferrule |
| Ferrule, Tinytight, 1/16 in, 6-40, .030 in TH, PEEK w/ SS lock ring, black | IDEX Health Science | M-657 | |
| Nut, Super flangeless Tinytight, headless, 1/16-1/32 in, 1/4-28, PEEK, natural | IDEX Health Science | P-255 | |
| Ferrule, Super Falngeless, 1/16 in, Tefzel (ETFE), yellow | IDEX Health Science | P-259 | Fits Luer-lock adapter |
| Tubing, Teflon FEP, .030 in x 1/16 in x 20 ft, green | IDEX Health Science | 1520G | |
| Adapter, quick connect female Luer to female 1/4-28, PEEK, red | IDEX Health Science | P-658 |
参考文献
- Mairhofer, J., Roppert, K., Ertl, P. Microfluidic systems for pathogen sensing: a review. Sensors. 9, 4804-4823 (2009).
- Yager, P., et al. Microfluidic diagnostic technologies for global public health. Nature. 442, 412-418 (2006).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab Chip. 8, 1265-1272 (2008).
- Cao, J., et al. Uncovering toxicological complexity by multi-dimensional screenings in microsegmented flow: modulation of antibiotic interference by nanoparticles. Lab Chip. 12, 474-484 (2012).
- Chen, C. H., et al. Antimicrobial susceptibility testing using high surface-to-volume ratio microchannels. Anal. Chem. 82, 1012-1019 (2010).
- Churski, K., et al. Rapid screening of antibiotic toxicity in an automated microdroplet system. Lab Chip. 12, 1629-1637 (2012).
- Eun, Y. J., Utada, A. S., Copeland, M. F., Takeuchi, S., Weibel, D. B. Encapsulating bacteria in agarose microparticles using microfluidics for high-throughput cell analysis and isolation. ACS Chem. Biol. 6, 260-266 (2011).
- Kim, K. P., et al. In situ monitoring of antibiotic susceptibility of bacterial biofilms in a microfluidic device. Lab Chip. 10, 3296-3299 (2010).
- Peitz, I., van Leeuwen, R. Single-cell bacteria growth monitoring by automated DEP-facilitated image analysis. Lab Chip. 10, 2944-2951 (2010).
- Kalashnikov, M., Lee, J. C., Campbell, J., Sharon, A., Sauer-Budge, A. F. A microfluidic platform for rapid, stress-induced antibiotic susceptibility testing of Staphylococcus aureus. Lab Chip. 12, 4523-4532 (2012).
- McDonald, J. C., Whitesides, G. M. Poly(dimethylsiloxane) as a material for fabricating microfluidic devices. Acc. Chem. Res. 35, 491-499 (2002).
- Roth, B. L., Poot, M., Yue, S. T., Millard, P. J. Bacterial viability and antibiotic susceptibility testing with SYTOX green nucleic acid stain. Appl. Environ. Microbiol. 63, 2421-2431 (1997).
- Francius, G., Domenech, O., Mingeot-Leclercq, M. P., Dufrene, Y. F. Direct observation of Staphylococcus aureus cell wall digestion by lysostaphin. J. Bacteriol. 190, 7904-7909 (2008).
- Jordan, S., Hutchings, M. I., Mascher, T. Cell envelope stress response in Gram-positive bacteria. FEMS Microbiol. Rev. 32, 107-146 (2008).
- Koch, A. L. Bacterial wall as target for attack: past, present, and future research. Clin. Microbiol. Rev. 16, 673-687 (2003).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100 (2006).
- Kohanski, M. A., Dwyer, D. J., Collins, J. J. How antibiotics kill bacteria: from targets to networks. Nat. Rev. Microbiol. 8, 423-435 (2010).
- Kohanski, M. A., Dwyer, D. J., Hayete, B., Lawrence, C. A., Collins, J. J. A common mechanism of cellular death induced by bactericidal antibiotics. Cell. 130, 797-810 (2007).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。