Method Article
使用微流体芯片实时成像和损伤研究的响应
摘要
果蝇幼虫对于实时成像,由于其半透明的角质层和强大的遗传学一个有吸引力的模型系统。本协议描述了如何利用单层PDMS设备,被称为“幼虫芯片的细胞过程的3 龄幼虫果蝇的神经元内的实时成像。
摘要
实时成像是研究细胞生物学过程的重要技术,然而,这可以在活的动物进行挑战。 果蝇幼虫的半透明的角质层,使之成为有吸引力的模式生物实时成像研究。然而,对于实时成像技术的一个重要挑战是无创和固定在显微镜定位的动物。该协议介绍了在聚二甲基硅氧烷(PDMS)微流控装置,我们称之为'幼虫芯片的固定化和成像果蝇幼虫的简单和易于使用的方法。幼虫芯片是由一个连接到一个薄的玻璃盖玻片上,其中,经申请通过注射器真空的,固定不变的动物,并带来腹侧结构如神经索,节段性神经和身体紧密贴合身的PDMS微室的壁肌肉,在靠近盖玻片。这使得高分辨率成像,更重要的,避免使用ANE的sthetics和化学品,有利于各种生理过程的研究。由于幼虫从固定很容易恢复,他们可以很容易地进行多个成像会议。这使得随着时间的推移课程从几小时到几天纵向研究。本协议描述一步一步如何准备芯片以及如何利用该芯片在3 龄幼虫的神经元活动的实时成像。这些事件包括轴突,钙反应,损伤,以及光电转换蛋白质长距离和时间尺度上的贩卖时间推移研究细胞器的快速运输。该芯片的另一个应用是研究再生和退化的反应性轴索损伤,所以该协议的第二部分介绍了一种新的,简单的程序,由一个节段神经挤压伤周围神经轴突内。
引言
果蝇, 果蝇 ,已被用作模式生物超过100年,并已证明在定义基本信令和那些保守从无脊椎动物到人的发展途径。实时成像是研究细胞机制的重要途径,以及简单的身体构造和果蝇幼虫的半透明角质层,使之成为有吸引力的系统实时成像,特别是因为有可用于表达荧光标记的蛋白质在特定细胞类型的许多遗传工具。
对于实时成像技术的一个重要挑战是无创性固定和定位动物的显微镜。传统的固定方法包括解剖1,2或使用氯仿,这两者杀死动物。该麻醉剂醚4和异氟烷5-8也被使用。虽然麻醉剂有很多优点,他们也抑制神经活动和重要的生理(包括心跳)9-11,因而会影响学习进程,对动物产生压力。还有人的安全问题,用乙醚和异氟烷的工作。
我们已经开发了一个无毒品的方法来固定果蝇幼虫在单层的PDMS微流体装置,我们称之为'幼虫芯片的12。该协议将介绍如何获得或使幼虫芯片,以及如何利用它实时成像在早期上演3 龄幼虫。该芯片是由一个舒适合身的微室,其中,当应用程序通过一个注射器真空,通过温和的机械力无法移动的动物。该固定化方法带来腹面的结构,如神经索,节段性神经和体壁的肌肉,在靠近玻璃盖玻片。这使得这种结构具有高数值孔径的高分辨率成像TURE(高倍率)的目标。
幼虫芯片比其他传统技术的优点包括以下内容:(一)利用幼虫芯片的替代化学品的使用,允许在体内成像未麻醉的动物。 (ⅱ)幼虫从芯片(相对于对异氟烷8,13个2小时的恢复期)释放后立即恢复。这使得成像在广泛的时间尺度上,从毫秒到分钟,小时和天数。 (ⅲ)利用PDMS,这是一个可透气的材料,使得能够对氧气/空气从环境中不断扩散到身体的幼虫。 (iv)该芯片是容易和安全的使用,以及(v)它是可重复使用,并能以最小的成本来制造。
除了 使用该幼虫芯片指令,该协议将提供其用途,研究在第3龄幼虫的神经元活动的几个例子。这些措施包括axona的实时成像升运输,钙反应,损伤,以及光电转换蛋白质长距离和时间尺度上的贩卖时间推移研究。
该芯片的另一个应用是研究神经元对轴突损伤。对于这个额外的步骤是由一个节段神经挤压伤周围神经轴突内(部分3)中所述。这个简单的测定,可以根据标准的解剖显微镜,它允许许多动物在同一时间待处理既快速和可重复地进行。细胞应答的损伤可以通过在幼虫芯片实时成像来研究。
研究方案
1。制作的PDMS芯片
为了使从SU-8模具的PDMS芯片,按照步骤1.1-1.7。如果一个芯片上的手,但需要组装使用,请跳到步骤1.8。
- 混合45克PDMS基地和4.5g的从PDMS包在一个小的一次性塑料容器固化剂(10:1比例)的,并把它们彻底地使用塑料搅拌棒。
- 放置在容器中的真空容器( 如干燥器)10分钟,以除去任何气泡。
- 将SU-8的模具在一个150毫米直径的塑料培养皿的底部,并慢慢地在模具上浇注PDMS混合物。小心不要产生气泡,而浇注PDMS。
- 在650℃下进行4小时固化的PDMS在烘箱中(或培养箱)。
- 从烤箱中取出固化PDMS/SU-8模具,让它冷却几分钟。
- 用剃刀刀片,切割沿的SU-8模具的边缘固化的PDMS和SU-8的模具中取出。
- 除以PDMS平板成用剃刀刀片从个人的PDMS芯片。
- 使用21政点胶针头,拨开PDMS芯片在真空口孔( 图1A所示)。
- 以一个23政胶针头,并从其根部弯曲针尖几次打破针从锁轮毂通风报信。
- 插入23号针头尖端插入一小片的聚乙烯管,使管覆盖针的至少一毫米。然后用刀片切断多余的管道远离针。这创建围绕针的一端的塑料环,当插入到真空进气口,将形成密封。
- 对于倒置显微镜( 图1B和2A-B)使用方法:将23政针尖进入真空口的孔。对于一个堂堂正正的显微镜( 图1C和2C-D)用途:捅第二孔的PDMS芯片的一面与21政散开nsing针,这个孔将提供访问来自侧面的第一洞。然后将23政针尖与管环入侧孔。将一片双面胶带在PDMS芯片的顶部,以密封的顶部孔( 图1C)。
- 取一块聚乙烯管的长度为大约20厘米。管子的一侧连接到被插入到真空端口针尖。
- 油管的另一端连接到三通阀的端口之一(见'3路活塞'中的物料清单)
- 附上20 ml注射器进剩下的两个端口中的一个。最后一个端口是开放的环境。
2。利用幼虫芯片实时成像
- 清洁的PDMS芯片与透明胶带。附上一张带芯片的底部。确保磁带触摸整个PDMS表面,然后撕下胶带。
- 重复上述步骤2〜3倍,以确保有是将PDMS芯片的表面上没有颗粒或油(从以前的实验中保留)。由于PDMS芯片是可重复使用,这是很重要的,以除去油残余物,因为它可以影响PDMS的粘附到玻璃,并导致不充分的密封。
- 早期的转移( 即觅食)3 龄幼虫含有水的培养皿中。 (本觅食3 龄期幼虫是在食品,而不是培养瓶中的一侧)。洗澡的幼虫在水中以去除培养基。
- 取一只干净的玻璃盖玻片,然后将一小滴卤烃油700在其中心。
- 使用镊子,轻轻地拿起一个干净,从水中早期上演3 龄幼虫(幼虫应该是〜3.5-4毫米长)。将动物简单地在一个轻量级的擦拭或纸巾去除多余的水,然后把它滴上了油。下拉应足够小,使得幼虫的气管不包衣。让幼虫站Ÿ滴上了油,持续10秒。
- 从油滴取出幼虫,然后将其放置在干净的玻璃盖玻片。
- 幼虫转移到另一个干净的玻璃盖玻片。这一步去除多余的油。
- 注意幼虫方向。成像的神经线和节段性神经,幼虫的腹侧应该坐在盖玻片。它的背侧,其特点是两条纵向气管导管,应朝上。注:这是幼虫喜欢自然的方向。
- 轻轻将PDMS芯片上的幼虫的顶部。幼虫应对准到微室的中心中间,而其尾部朝向真空端口。讲究的是幼虫不接触腔的边缘。这是前部和后部的气管终端尤其重要。注意:这一步是在立体显微镜下最好的做法。
- 反推的玻璃盖玻片的PDMS芯片来实现良好的密封。确保幼虫完全是通过在PDMS芯片接触到玻璃盖玻片的微室封闭。
- 开关上,使得所述注射器可以将空气从PDMS微容器(通过管),以产生真空的三通阀。
- 用一只手,紧紧握住PDMS芯片/玻璃盖玻片。用另一只手去拉注射器推杆。撤销2-2.5毫升的空气,直到感觉到阻力在注射器手柄,创造真空。真空产生的PDMS芯片,油和盖玻片界面之间形成紧密的密封,并限制了幼虫的流动性。
- 切换阀关闭,以使PDMS芯片是从注射器并从环境中分离。因此,相对稳定的真空度被保持在微室,而不需要用于保持注射器柱塞。
- 检查体视下的幼虫,以确保在整个动物体被放置在微容器内,并且该动物是不动的。气管应该是可见的。的其余PDMS芯片应与盖玻片接触。注:参见图2E和2F动物的例子在芯片正确固定。一些不正确的取向示于图2G和2H。
- 将幼虫芯片(PDMS芯片+玻璃盖玻片)上的显微镜。幼虫芯片,管和注射器,应当谨慎处理,以避免从盖玻片的PDMS芯片的脱离。对于一个堂堂正正的显微镜,修复芯片到显微镜载物台的'顶'侧用双面胶带( 图1C)。
- 使用高放大倍数的物镜(油镜,40-63X推荐)来定位感兴趣的动物的结构(次),进行成像。在某些情况下,较低的放大率,可能需要切换到较高的放大倍率之前确定用于成像的所需区域。
- 当成像完成时,通过切换阀的位置释放真空这是开放的环境。
- 分离从盖玻片的PDMS芯片。幼虫应立即能动。
- 使用镊子从微室取出幼虫,轻轻将幼虫在葡萄汁液琼脂平板上进行恢复。
3。诱导神经挤压伤幼虫节段性神经
- 按照上面的步骤2.3隔离年初上演所需基因型的3 龄幼虫。按照步骤2.3中所述洗澡幼虫在水中取出食用。
- 使用标准的飞二氧化碳麻醉工作站,与CO 2垫保持在解剖体视显微镜,制服幼虫。放置对CO 2垫1-2分钟后幼虫应该成为immotile。
- 现在把一个单一的麻醉幼虫到葡萄汁琼脂平板上的体视显微镜下。把动物腹侧形象化腹神经索和通过角质层的神经节段( 图3)。确保幼虫完全是immotile。
- 使用Dumostar号-5钳,捏节段的神经紧紧地穿过角质层5-10秒。当这样做正确,角质层保持完好和体壁不刺穿。注意:该损伤可在沿前后体轴的不同位置进行,只要在腹神经索,唾液腺,小肠和不被损坏。最有效的损伤部位是朝向第三腹节的端部, 如图3D。伤在这个位置损害最神经是最容易不杀动物重现。
- 受伤后,将动物,使其腹部面朝下放在葡萄板。它应该能移动它的头和吃。如果损伤是成功的,那么幼虫的后半部将陷入瘫痪。
- 保持对葡萄汁琼脂平板上的受伤的动物在25°下根据实验目的所需的时间。对于运动神经元,近端残端开始在8-10小时伤14的萌芽,和远端残端开始于10个小时15变质。对于IV级哒感觉神经元,近端残端开始萌芽中4-6小时,和远端残端开始在伤后3-4小时内变质。注意:适当的Gal4的驱动程序和荧光记者,发芽和可变性在幼虫芯片观察(例如,参见图6)。
结果
幼虫芯片是由单层PDMS块中,(a PDMS芯片),其设计以示意概述在图1中。 (另请参见设计自己的模具的补充DXF文件)。幼虫微室,真空端口和外围通道( 图1A)是140微米的凹槽中的PDMS芯片。该芯片被定位在一个最早期的上演3 龄幼虫,这依赖于盖玻片的顶部油( 图1B和1C)。盖玻片和PDMS芯片之间的油玻璃接口允许应用程序后,一个温和的真空要创建一个密封。此密封捕集幼虫在腔内,并且由于早期的上演3 龄幼虫比腔稍厚,密封腔室产生的动物的身体有些收缩,有效地固定化,并限制其运动。在这种固定状态下,某些腹体结构,如腹神经索和节段性推近盖玻片。这是有利的成像,因为在固定化状态下这些结构可以的40X和63X目标的工作距离内的所在。释放真空后,幼虫可以很容易地从微室除去,允许要执行的附加实验。这种纯机械固定的方法后可以达到1小时12连续固定期间保持90%的幼虫存活的。
真空是由一个简单20毫升注射器,因此整个单元很容易从一个立体显微镜,在那里进行的室内定位,以共聚焦或落射荧光显微镜,在那里进行实时成像传输创建。该注射器被连接到通过聚乙烯管和23政分送针晶(以除去锁集线器)的真空端口,如在步骤1.6-1.14说明。对于倒置显微镜,油管和注射器经由芯片(图1B,图2A和2 B)的顶部相连接。为直立显微镜,它们是通过在芯片的一侧的端口(图1C,2C和2 D)连接。对于倒置显微镜的配置是更容易使用。注射器被拉到建立一个温和真空(约10磅),其结合油玻璃-PDMS接口以形成盖玻片和PDMS的设备之间的紧密密封,诱捕和在腔室中固定的幼虫。
幼虫进入微室的位置(步骤在协议2.7-2.10)可以有效的固定和生存( 图2E-H)的关键。如果动物是太大室,( 图2G),或者如果它的头部或气管成为捕捉腔室的边缘和盖之间唇( 图1H),那么就不太可能存活的过程。
以下是使用该芯片的幼虫,研究各种细胞反应的神经元(图4-7,电影S1和S2的电影)的几个例子。
快速轴突运输的成像:幼虫芯片被用来对图像进行各个外设轴突内的突触小泡的驱动蛋白介导的转运(图4和电影S1)的顺行(〜1.0微米/秒)和逆行(〜0.8微米/秒。这些小泡的)移动可容易地研究了从收集在旋转盘共聚焦显微镜电影。
定位为动物显微激光:采用紫外脉冲染料激光( 图5和电影S2),感觉神经元树突横断协议的使用吨他的方法可以显微16,17别处找到。高效固定化技术允许在受伤的神经元( 图5)的快速时间尺度的变化,如(由基因编码的Ca 2 +指示剂GCamp3.0 18检测到的)改变细胞内钙,待检测和测量。
研究损伤再生和退化的反应:如果动物被允许成像会话之间休息,幼虫芯片被用来研究那些发生在一个大的时间尺度细胞的活动。例如,无论是“再生”和退行性反应性轴索损伤,其发生在15小时的时间尺度,可以成像在幼虫芯片( 图6)。在这个例子中,章鱼胺能运动神经元的轴突通过节段性神经损伤( 图3),在该协议的第3部分描述受伤。近端轴突残端,它经历新的萌芽,和远端轴突,形成静脉曲张,然后通过Wallerian变性的过程中变得支离破碎,可在伤后进行成像,并研究在不同的时间间隔。
跟踪photoconvertible荧光蛋白随时间的体内:photoconvertible荧光蛋白质,其荧光在暴露于UV光的变化不可逆)的发展,使人们能特异标记的蛋白质的子集,一个小区内,并跟踪标记的蛋白质的命运随着时间的推移19 ,20。这种技术是在细胞培养物最常进行的,然而,随着幼虫芯片1可以在体内定义的细胞内追踪遗传编码photoconvertible蛋白质。作为一个例子,我们展示了Denda2-α-微管蛋白融合蛋白,表达于IV类哒感觉神经元,可在细胞体进行光转换( 图7A和的7 B)。的光转换蛋白质的运输然后可以随时间跟踪:两天之内,我们可以检测到的感觉神经元的轴突末端,这在于约1 mm远离在细胞体( 图中的原始位置中的显著量光转换蛋白质的7A和7℃)。
所有所描述的实施例( 图4-7和影S1和S2)通过使用旋转盘共聚焦系统,它由一个尼普科夫CSU10扫描器和C9100-50 EMCCD相机成像时,安装在Axio上观察用63X(1.5 NA)油浸物镜,并使用Volocity采集软件驱动。
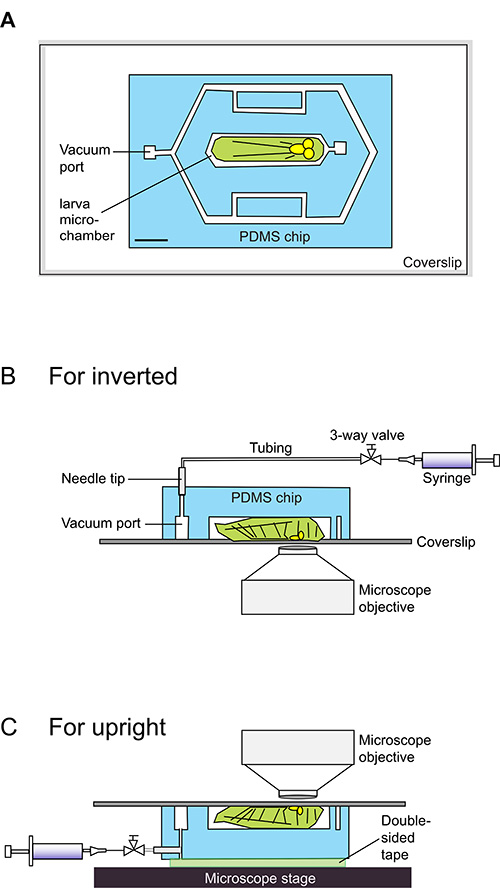
图1。 卡通示意图采用幼虫芯片。
(A)本幼虫芯片包括将PDMS芯片,在淡蓝色的指示,附着于玻璃盖玻片。该芯片包含140微米厚的微流体通道,以白色显示。中央微室的设计紧贴早日上演3 龄幼虫果蝇 (漫画化的浅绿色)。提供了包含可用于设计模具精确尺寸甲DXF文件作为辅助数据。比例尺= 1.5毫米(BC)侧看法原理图加载幼虫成幼虫芯片。幼虫坐在腹面朝下放在盖玻片,其车身谎言140微米深的微容器内。一个20毫升注射器被连接到真空进气口和用于诱导温和的真空。卤化烃油的PDMS-玻璃接口绑定的真空成密封,制约了幼虫在微室。这种密封是容易逆转通过释放从注射器中的压力后,该动物立即重新获得动力。为直立显微镜(B)所示 ,将注射器真空是通过从芯片的顶聚乙烯-50管连接。对于倒置显微镜(C),这些连接从芯片的一侧进行,而芯片的“顶”是通过双面胶带附着到显微镜载物台上。
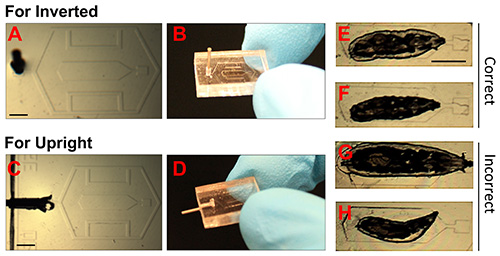
图2的PDMS芯片和幼虫的正确定位图像。
(AD)。照片显示的倒置和正置显微镜的PDMS芯片。在23政分配针尖已经插入到真空口,它使通过管道连接到真空(注射器)。比例尺= 1.5毫米(EH)。 固定果蝇幼虫的明场图像,E和正确地固定动物f的例子。在F中的较小的动物是优选的,如果多个图像在较长的时间尺度(> 12小时)的形式进行。G显示一种动物太大, 和 H示出了一个小动物被错误地定位。比例尺= 1.5毫米。 点击这里查看大图。
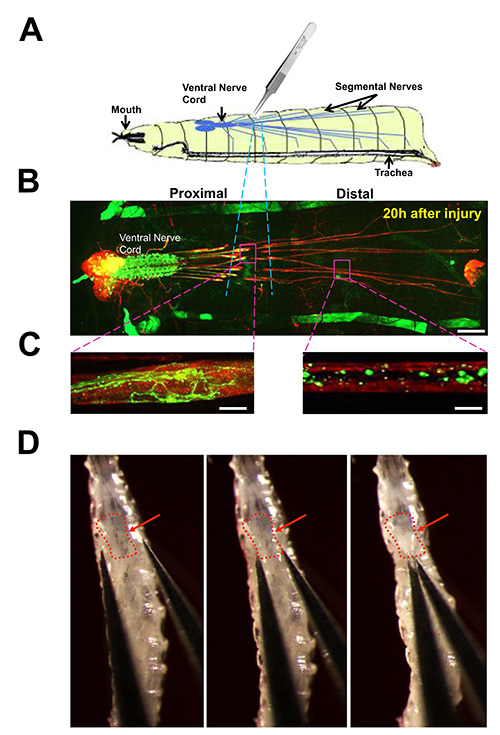
神经节段在果蝇幼虫图3。神经挤压伤。
(一)神经损伤检测的卡通。内的第 3节段的神经龄幼虫被捏腹部角质层与5号钳压碎。(二)查看幼虫的神经系统从动物解剖20小时。对神经细胞膜抗HRP抗体(红色)免疫染色突出了脑叶,腹神经索,并包含运动神经元和感觉神经元轴突长节段的神经。个人运动神经元的一个子集是通过驱动UAS-mCD8-GFP(绿色)的表达与M12-Gal4的驱动程序标签。细胞体,并从这些神经元的树突在于腹神经索,而它们的轴突通过节段性神经投射到体壁肌肉。 (此驱动也驱动在肌肉12的GFP表达为每个幼虫hemisegment,它们一起可以被看作是对动物的任一侧上的前 - 后条纹)。通过粉碎破坏该地区是突出了蓝色虚线。比例尺= 70微米(C)近拍意见受损的轴突,伤后20小时的。左:在近端轴突经历了萌芽和新的增长点。右:远端轴突是零散,很少有绿色荧光蛋白剩余,由于Wallerian变性和碎片的清除。比例尺=在早期的3 龄幼虫的神经美眉10微米(D)图像。红色箭头指向的腹神经索。美眉的位置是迈向第三部分的底部,如在协议文本(协议3)所述。在D图像最初发表在J.细胞生物学杂志191,211-223,DOI:。10.1083(2010) 点击此处查看大图。
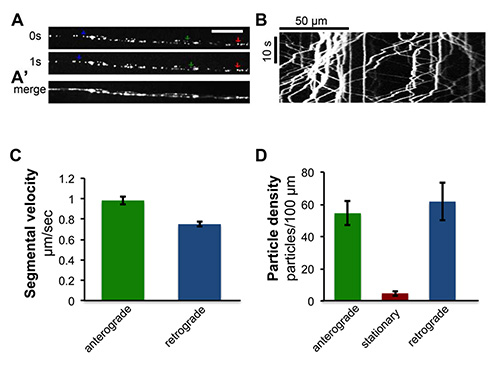
图4。的肽突触小泡轴突运输的时间推移成像的大鼠心房利钠肽心钠素标有绿色荧光蛋白,UAS-ANF-GFP 21,在特定的运动神经元内使用EVE-RRA-Gal4的驱动器22来表示。节段性神经的实时成像揭示ANF-GFP的快速运输的轴突标记肽囊泡。又见电影S1。运动神经元的轴突(一)从现场时间推移成像单帧。绿色,红色和蓝色箭头表示顺行的实施例中,静止的和逆行囊泡,分别。比例尺= 5微米(A')从电影个人时限使用ImageJ进行了合并。(二)从ANF-GFP的运输时间推移成像产生的kymograph,从单一帧跨越一分钟的集合生成使用'多Kymograph“插件中的ImageJ 23成像时间(C)定量平均节段性速度的,这是从分割的痕迹kymographs斜坡计算。绿色条PRESENTS顺行节段性速度(N = 543)和蓝色条提出从10 kymographs囊泡逆行段速度(N = 548)。颗粒密度(D)的量化。颗粒密度由顺行的数目(以绿条显示),每100微米的轴突长度固定的(在红色条显示)和逆行(蓝色栏中显示)的粒子从10 kymographs测量。在此图中的数据也被以前在Ghannad-Rezaie 等发表,PLoS一7(1),e29869,DOI:0.1371/journal.pone.0029869(2012)。
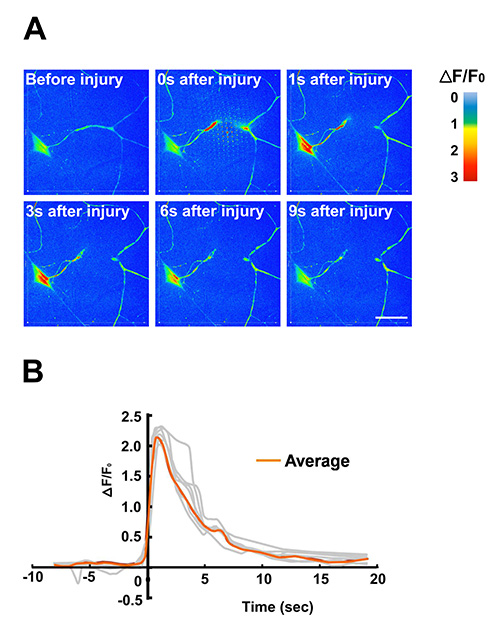
图5。利用幼虫芯片激光显微和钙成像。
从IV级感觉神经元树突是由具有高功率激光脉冲从脉冲紫外激光染料横断。协议对使用本方法的显微可以在其他地方16被发现。有效地固定在幼虫芯片允许通过实时成像进行研究细胞内钙水平的快速变化。在这个例子中,该基因编码的钙指示剂GCaMP3.0表达于IV级树突分支(C4da)感觉神经元使用PPK-Gal4的驱动程序。(A)时间推移GCaMP3.0强度的图像根据颜色是假的有色强度刻度来表示变化的强度随着时间的推移。单个帧分别提取5帧/秒的拍摄上旋转盘共聚焦显微镜拍摄的动画( 动画S2)。钙动力学(二)量化响应激光显微外科。单个神经元胞体的GCaMP3.0荧光强度(ΔF/F0)的归一化倍数变化对时间作图(N = 7,以灰色显示)。平均ΔF/F0是橙色代表。 1-2秒之间观察到损伤后GCaMP3.0强度的峰值的增加。背景减去从原始G-CaMP3.0荧光强度。在此图中的数据也被以前在Ghannad-Rezaie 等发表,(2012)PLoS一7(1):e29869。 DOI:10.1371/journal.pone.0029869 12。
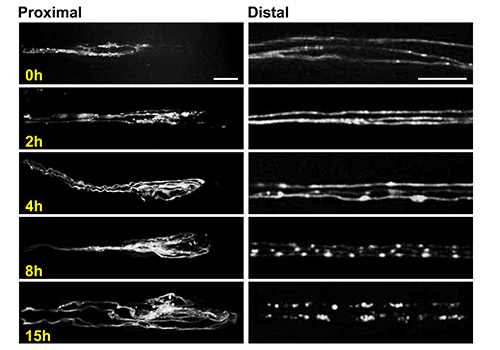
利用幼虫芯片图6。成像轴突发芽和变性。近端残端(左)和远端残端章鱼胺运动神经元轴突在损伤后不同时间点(右)代表共聚焦图像。拍摄图像在相似的位置, 如图3C所示 。这些神经元通过使用TDC驾驶UAS-mCD8-RFP的转基因表达标记2-Gal4的驱动程序24,25。胞体对这些神经元在于腹神经索24。三个单独的轴突可以在单个节段神经中可以看出,并且很容易从彼此解决。这是个别的细胞活动,如轴突退化的碎片,这是在15小时对这些神经元完成的研究的一个理想的情况。图像,使用该芯片的幼虫在63X的放大倍率在旋转盘共聚焦显微镜活的动物获得的。比例尺=10μm的左面板(近端树桩)和20微米的右侧面板(远端残端) 点击此处查看大图。
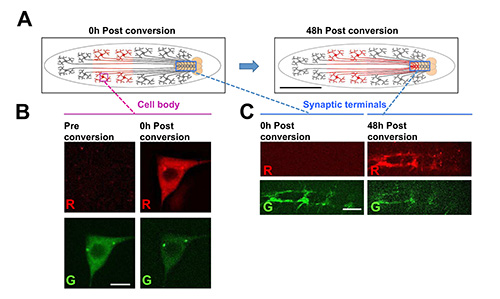
图7。利用幼虫芯片在很长的时间和距离在活的动物跟踪光转换荧光蛋白。
在这个例子中,photoconvertible荧光蛋白Dendra2 19,稠合的α-微管蛋白的融合蛋白,是从UAS-Dendra2-α-微管蛋白基因中第IV类树突分支(C4da)的感觉神经元表达的,使用PPK-Gal4驱动子26(A)示意图的光转化实验。该C4da神经元的细胞体位于在外围,并通过节段的神经轴突延伸,以形成在神经索突触末端。细胞体的一个子集内的动物的后半Dendra2-α-微管蛋白进行光转化通过UV照射时间为6秒使用标准DAPI过滤器与Hg灯(左动画片)。时间后,将光转换Dendra2-α-微管蛋白可以在腹神经索的突触末端进行检测。这表明微管蛋白已被tran已留着之上(〜1-2毫米)长的距离。 Dendra2-α-微管蛋白在IV级感觉神经元胞体比例尺= 1毫米(B)示例图像之前和光转化后。比例尺=5μm的(C)在任0小时或48小时的细胞体的光转换后突触末端为IV级感觉神经元的示例图像。光转换Dendra2-α-微管蛋白在时间后突触末端的特定外观意味着蛋白质从细胞体前往轴突末端。光转化和成像各时间点是在幼虫芯片进行的。比例尺= 15微米。 点击这里查看大图。
电影S1。激光显微和C4da神经元的钙成像。的脉冲紫外激光用于横切一个整洁进制树突分支。激光诱导离断快速增加GCaMP强度,开始在损伤部位,并到细胞体。 UAS-GCaMP3.0 18使用C4da特定PPK-Gal4的驱动器26的表达。这些电影都是假的颜色来表示GCaMP3.0的相对强度水平。的延时成像用旋转圆盘共聚焦显微镜在5帧/秒进行的。
电影S2。 ANF-GFP在快速运动神经元轴突运输。
大鼠心房利钠肽心钠素标有绿色荧光蛋白,UAS-ANF-GFP 21,用前夕-RRA-Gal4的驱动器22特定运动神经元内的表达。幼虫神经节段内的这些肽囊泡运输的影像是在300毫秒/帧的幼虫芯片使用一个转盘共聚焦显微镜。
补充图1(DXF文件)
DXF文件的硅模具制造。该文件是专门为负性光刻胶掩膜(黑面具提交的SU-8)一个4英寸的硅片上。第二行包含5个模具制作本协议中使用的幼虫芯片。这些芯片(第2行)都包含一个〜5.4毫米×1.5mm的室内设计,以适应初级阶段3 龄幼虫。第一行(行1)包含一个较大的腔室(〜5.4毫米×2毫米),而第三行(第3行)包含一个较小的腔室(〜4.4毫米x1.5毫米)。这些可能与较大和较小尺寸的幼虫被利用,分别。比例尺= 2毫米。
讨论
制作或者获取的幼虫芯片:
幼虫芯片由PDMS嵌段(称为'PDMS芯片')连接到玻璃盖玻片。在步骤1中的协议描述了用于制备和使用幼虫芯片,假设一个SU-8模具是可用的程序。在SU-8模具是由光刻图案的硅片上一个140微米厚的SU-8光刻胶层(详见Ghannad-Rezaie 等。12)微细加工。由于SU-8模具的微细加工需要访问专门的设备,我们建议从微细加工设备订购它( 例如 ,在LNF设施在密歇根州14的大学),或从代工发送它们所提供的芯片设计作为一个补充文件。如果一个人希望改变PDMS芯片( 例如用于不同大小的幼虫使用)的设计,可处理DXF文件( 例如 AutoCAD的)一个CAD软件都可以使用。一个SU-8模具也可以按照蒙代尔指示作出内部等 27许多读者可能会发现它方便简单地获得样品的PDMS芯片来尝试这种技术制造自己的芯片之前。这将免费供索阅。
利用微流控'幼虫芯片的实时成像的:
在幼虫芯片的固定化方法避免了使用麻醉剂,而是涉及压力,通过真空的应用,以限制动物的运动。而动物可以在芯片固定生存多小时12,较短的固定时间(5-15分钟)的建议。这是足够的时间用于成像的许多感兴趣的细胞事件,包括改变细胞内钙,或快速轴突运输。这也有足够的时间在活的动物随意处理,如基于激光显微手术,漂白,和photoconver锡永。
研究纵向在更长的时间周期中的单个动物的活动,动物可以被放置在芯片和成像多次,由休止期隔开。葡萄汁琼脂平板是理想的成像会话之间休息,因为它们提供了一种简单的食物来源和湿度。多个成像会议确实会影响幼体成活率在一定程度上,因为每个会话进行的破坏动物的一些风险(见第2部分中的故障排除,下同)。动物可以常规成像> 5倍以上两天的过程中具有高于50%的存活率。因为这些动物不麻醉,它们在芯片中的真空释放后立即是健康和能动。因此,没有必要对成像会话之间的恢复时间,因此在会话之间的时间间隔是灵活的,可以进行调整,以实验的目标。
故障排除:
最常用的技术是起诉与幼虫芯片和建议的解决方法有以下几种:
(1) 将动物移动过多,过多的流动性可与成像目标的干扰。这在幼虫芯片最常见的原因是:a)该动物是太小的芯片,或b)在固定步施加的真空压力就会大打折扣。在此协议中描述的幼虫芯片是专为初上演3 龄幼虫。为动物的最佳尺寸是3.5-4毫米的长度(沿前后轴)。以确保该真空压力是足够的,拉注射器2-2.5毫升,或直到感觉到阻力在手柄。一个指示,该真空是工作是在外围通道的小气泡可以看出慢慢移向真空源。另一个指示是盖玻片应始终与芯片行进时,芯片从顶部升起(这是用于输送腔室的推荐方法一旦幼虫被定位和真空度上)。真空可能会受到损害,如果有在管子的裂纹,或者如果有油的油管。这可以通过替换23政分配针尖和聚-50管(从步骤1.6-1.14)很容易地解决。
(2)成像芯片后动物死亡。 该过程的目的是在该动物造成最小的应力,和野生型基因型的动物具有> 90%的存活率,即使在芯片12上一个小时的固定化。由于某些基因型可能不太有弹性的芯片的压力,首先检查野生型动物(例如, 广S)生存的固定化技术。一)最常见的原因为杀伤力幼虫的不正确定位( 见图2G-H)。如果角质层,头或气管的部分并不完全在室内,那么他们可以在固定化过程中被损坏,并且幼虫过大的芯片(> 4mm)的是不太可能生存。 b)一个不太常见的原因杀伤力是利用压力太大或加载芯片时真空。当适当地定位在芯片上,由真空产生的压力,是很好的耐受性。然而过大的压力,无论是从真空中或在一种定位动物的初始阶段可能是一个问题。这是最好的学习压力具有正确大小的野生型幼虫试验经验所需要的程度。 c)若过多卤烃油包括动物的气管动物可能具有潜在的长期生存问题。油中起着芯片几个重要的作用:它是用于建立真空的,在成像过程中的光学重要,它抵消了干燥的芯片。应避免然而过多的油。 (这也可以导致油中的管道和注射器,损害真空)。建议的协议大衣幼虫的油只是腹侧,则R转移到最终的盖玻片成像前通过在一个干净的盖玻片幼虫放置emoves多余的油。 D)光毒性,可从成像会话经历。正如任何实时成像的应用,它是理想的使用较短的曝光时间,低强度的激光,它是用高感光摄像头或探测器的最佳实现。尝试用UV光照射降到最低,包括汞光源产生广谱光。
其他问题和未来发展方向:
由于这种方法不使用麻醉剂,动物的心脏仍在跳动。这造成一些不可避免的流动性,从而影响成像在某些地方比别人多。这里的实施例表明腹神经索,节段性神经和体壁可以在不脱离心跳干扰容易地成像。在情况下,心跳会影响成像,常规动作有时可以与纠正在分析软件(例如,图像稳定器插件ImageJ的)。这个效果很好,当单个对象正在移动在快速的时间尺度(例如〜1微米/秒的快速轴突运输),或在一个非常缓慢的时间尺度(几分钟到几小时)。当对象(次)利息移动用范围的速度和方向的但是,也可以是难以纠正的心跳诱导的运动。
另一个问题是在光学微小变异性从动物到动物之间,或在相同的动物在芯片的多个成像会话。更深的感兴趣的对象是动物内,越大这种变化就越大。节段性神经和腹神经索通常是太深则动物在常规显微镜要成像范围内。然而,温和的压力在经历了幼虫芯片推动这些结构非常接近的角质层和盖玻片。这些结构从盖玻片的精确距离将有来自TR小的变化IAL审判。的变化为对象关闭角质层,如感觉神经元的细胞体,是以下。因此,重要的,特别是用于制备强度的测量,利用大量的动物和独立试验的帐户,以供在光学可变性。
虽然这里显示的例子都集中在过程神经元内,这种方法应该是经得起任何成像结构,可在显微镜物镜的聚焦深度内被带到动物。这包括角质层,体壁肌肉,和它们的NMJs。气管上的动物的腹侧面和潜在的消化道的部分可能也进行成像。该动物也可位于其背侧朝着盖玻片为结构短期成像背侧表面附近。深的动物中的能力的图像结构由所用的显微镜物镜的工作距离的限制。结构,如即时通讯aginal光盘是无法进入的高放大倍数( 如 40倍)的目标。
在此协议中描述的幼虫芯片为幼虫初3 龄期(范围从3.5-4毫米大小)而设计的。然而,许多有趣的问题需要成像在不同的幼虫阶段。更小的芯片,以容纳第二龄幼虫,或更大的芯片来容纳晚第三龄期可以用同样的原理可以容易地设计。 (补充图1包含了制造硅模具与改变腔尺寸易修改的DXF文件)。的可逆密封的简单原理甚至可以被应用到其他生物体如C。线虫或斑马鱼中,与主变体是腔室的尺寸。一个有用的未来发展方向是设计一个芯片,可以同时固定许多动物,用于筛选目的。然而,对于这种情况,设计将需要显著不同从目前的装置中,在需要独立地处理每个动物的定位动物在芯片中的问题。
为研究损伤反应在幼虫周围神经的神经挤压试验:
这里描述的幼虫节段性神经的神经挤压法是用于引入损伤果蝇周神经轴突的简单方法。这种方法的优点包括:1)它是简单的进行与在果蝇实验室(立体显微镜的CO 2源和镊子)中找到的标准工具;二)它可以为许多动物迅速进行,使神经索的生化分析损伤后可行14; c)在这种损伤的分子和细胞反应是高度重现14,15,28和可以用于发现,也是重要的在脊椎动物的神经元29,30流程。
替代方法,神经元损伤是focu山高功率激光,例如脉冲紫外或飞秒激光,通过激光显微17,31-33切断的轴突。幼虫芯片是用于定位所述动物为例如显微手术的理想方法。因为在试验之间光学,上面所讨论的微小差异然而,基于激光的方法,可以更加难以再现的幼虫,特别是在幼虫节段性神经。此外,基于激光的轴突损伤,需要更多的时间来定位每个动物,因此更难以(具有大量的动物)进行大规模。
故障排除:
从神经损伤最常遇到的技术问题是由内脏损害死亡。当进行粉碎,也不要挤压腹神经索,唾液腺,或肠是很重要的。同样重要的是不向穿刺角质层。最好是通过使所述钳子以45°角的角质层表面活性避免这些问题E( 见图3)。
镊子的质量有经粉碎和生存后的效果有很大的影响。我们建议Dumostar 5号镊子。保留其清晰度,镊子,必须小心处理,不能用于其他用途,并更换一次,他们变钝或弯曲。
动物的大小也能影响粉碎的有效性。小动物(小于3毫米的长度)是不太可能的损伤生存。与大型动物,(流浪的第三龄),这是比较难找到的神经和避免损坏较大唾液腺和肠道,并有少,研究损伤反应化蛹前的时间。神经压榨量在年初3 龄幼虫最有效地进行(这是〜3-4.5毫米,沿前后轴长)。
该动物被提出后,在食物来源可能影响实力粉碎后的角质层和生存。建议在饲养动物的食物从一个标准的酵母葡萄糖配方制成。
学习如何有效地做的美眉最好的方法是实践上的许多动物,先用实现生存的首要目标(而不是化蛹)粉碎后的24小时。初学者通常具有较低的生存率( 如 10%),但一旦技术被据悉,生存率可达到〜90%。
其他问题和未来发展方向:
粉碎试验提供了轴突近端的萌芽研究到损伤部位和轴突和突触末梢损伤部位的退行性变的有力方法。而变性的发生率不同神经类型而异,它们是高度重复性在给定的神经元类型,提供证明了损伤实验的可重复性。
与此相反,“再生”萌反应在近端轴突观察到的是更具挑战性的研究。在节段性神经轴突都广泛开展发芽接 近损伤部位(例如,参见图6和图3)。然而发芽的程度可以变化从神经元到神经元,并且是难以量化。类似度和可变性在萌芽可以单后在运动神经元神经节段用紫外脉冲染料激光引入更多的局灶性病变进行观察。我们解释了发芽的nondiscriminate方向性是由于缺乏指导线索在节段性神经。与此相对,通过激光接近它们的细胞体损伤感觉神经元的轴突发生在相同的方向上失去的轴突34新轴突生长。在动物中的该区域的轴突有可能接触到的再生轴突的指导更具体的位置信息。神经节段内的环境是不太可能有太大resemblan行政长官最初他们在胚胎期间,指导驾驶的轴突,因此预计不会有信息引导轴突再生的环境。
使用节段性神经挤压试验研究再生另一个限制是,受伤的感觉和运动神经元轴突仍然有显著的距离动物经受前盖(0.25-1毫米),以达到他们的目标,并在有限的时间框架(<3天)化蛹。最近的一项研究确定了prothoraciotropic激素受体 的三倍,3 龄幼虫期35的持续时间的遗传操作。该操作将延长时限为研究神经元的恢复和退化损伤后显著,到9,而不是3天。这可能是足够长的时间以观察新的事件,如受伤的轴突与突触后的目标的重新连接时,尤其是当损伤诱导靠近突触的结局。
披露声明
作者宣称没有竞争的财务权益。
致谢
这项工作是由美国国家科学基金会(批准号IOS-0842701,以CAC)和美国国立卫生研究院(R00MH080599通过,R21 NS062313到NC和NS069844到CAC)的支持。我们要感谢詹姆斯·舒特,艾米丽啥的,雷妮张庭的技术支持,以及布卢明顿库存中心飞线。所有的芯片是捏造的劳瑞加工设施在密歇根大学。
材料
| Name | Company | Catalog Number | Comments |
| 0.5 mm Polyethylene tubing | Fisher Scientific | 14-170-11B | Polyethylene tubing, I.D. = 0.023 in O.D. = 0.038 in |
| 1 mm Polyurethane tubing | Fisher Scientific | BB521-63 | Polyurethane tubing, I.D. = 0.063 in O.D. = 0.125 in |
| Barb to barb connector | Bio Rad | 732-8300 | 0.8 mm barb to barb connector |
| 3-way Stopcock valve | Bio Rad | 732-8104 | Screw on valve for the syringe |
| Syringe (20 ml) | Fisher Scientific | 14-817-33 | Screw on 20 ml syringe for generating vacuum |
| Dispensing needles, 23 G (0.4 mm I.D., 0.6 mm O.D.) | McMaster-Carr | 75165A684 | Needle for outlet connection |
| Dispensing needles, 21 G, (0.6 mm I.D., 0.8 mm O.D.) | McMaster-Carr | 75165A679 | Needle for outlet connection |
| Halocarbon oil | Sigma | H8898 | Halocarbon oil 700 |
| Dumostar Number 5 Forceps | Roboz | RS-498 | For nerve crush |
| PDMS Kit (Base and curing agent) | Ellsworth | 184 SIL ELAST KIT 0.5KG | Dow Corning Sylgard 184 Silicone Encapsulant 0.5 kg Kit Clear |
| Glass Coverslips | Fisher Scientific | 12-544-C | 24 mm x 40 mm (thickness according to recommendation for your microscope objective) |
| Disposable Plastic Cup (9 oz) | |||
| Plastic coffee stirrer stick | |||
| Razor Blade | |||
| Grape juice agar plates | See http://cshprotocols.cshlp.org/content/2007/4/pdb.rec10925 for recipe |
参考文献
- Pilling, A. D., Horiuchi, D., Lively, C. M., Saxton, W. M. Kinesin-1 and Dynein are the primary motors for fast transport of mitochondria in Drosophila motor axons. Mol. Biol. Cell. 17, 2057-2068 (2006).
- Gunawardena, S., et al. Disruption of axonal transport by loss of huntingtin or expression of pathogenic polyQ proteins in Drosophila. Neuron. 40, 25-40 (2003).
- Miller, K. E., et al. Direct observation demonstrates that Liprin-alpha is required for trafficking of synaptic vesicles. Curr. Biol. 15, 684-689 (2005).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
- Fuger, P., Behrends, L. B., Mertel, S., Sigrist, S. J., Rasse, T. M. Live imaging of synapse development and measuring protein dynamics using two-color fluorescence recovery after photo-bleaching at Drosophila synapses. Nat. Protoc. 2, 3285-3298 (2007).
- Schmid, A., et al. Activity-dependent site-specific changes of glutamate receptor composition in vivo. Nat. Neurosci. 11, 659-666 (2008).
- Fuentes-Medel, Y., et al. Glia and muscle sculpt neuromuscular arbors by engulfing destabilized synaptic boutons and shed presynaptic debris. PLoS Biol. 7, (2009).
- Andlauer, T. F., Sigrist, S. J. . Building an imaging chamber for in vivo imaging of Drosophila larvae. , 476-480 (2012).
- Sandstrom, D. J. Isoflurane reduces excitability of Drosophila larval motoneurons by activating a hyperpolarizing leak conductance. Anesthesiology. 108, 434-446 (2008).
- Sandstrom, D. J. Isoflurane depresses glutamate release by reducing neuronal excitability at the Drosophila neuromuscular junction. J. Physiol. 558, 489-502 (2004).
- Mondal, S., Ahlawat, S., Rau, K., Venkataraman, V., Koushika, S. P. Imaging in vivo neuronal transport in genetic model organisms using microfluidic devices. Traffic. 12, 372-385 (2011).
- Ghannad-Rezaie, M., Wang, X., Mishra, B., Collins, C., Chronis, N. Microfluidic chips for in vivo imaging of cellular responses to neural injury in Drosophila larvae. PloS one. 7, (2012).
- Schmid, A., Sigrist, S. J. Analysis of neuromuscular junctions: histology and in vivo imaging. Methods Mol. Biol. 420, 239-251 (2008).
- Xiong, X., et al. Protein turnover of the Wallenda/DLK kinase regulates a retrograde response to axonal injury. J Cell Biol. 191, 211-223 (2010).
- Xiong, X., Collins, C. A. A conditioning lesion protects axons from degeneration via the Wallenda/DLK MAP kinase signaling cascade. J. Neurosci. 32, 610-615 (2012).
- Byrne, A. B., Edwards, T. J., Hammarlund, M. In vivo Laser Axotomy in C. elegans. J. Vis. Exp. (51), (2011).
- Williams, W., Nix, P., Bastiani, M. Constructing a Low-budget Laser Axotomy System to Study Axon Regeneration in C. elegans. J. Vis. Exp. (57), (2011).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875-881 (2009).
- Chudakov, D. M., Lukyanov, S., Lukyanov, K. A. Tracking intracellular protein movements using photoswitchable fluorescent proteins PS-CFP2. 2, 2024-2032 (2007).
- Gurskaya, N. G., et al. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nat. Biotechnol. 24, 461-465 (2006).
- Rao, S., Lang, C., Levitan, E. S., Deitcher, D. L. Visualization of neuropeptide expression, transport, and exocytosis in Drosophila melanogaster. J. Neurobiol. 49, 159-172 (2001).
- Fujioka, M., et al. Even-skipped, acting as a repressor, regulates axonal projections in Drosophila. Development. 130, 5385-5400 (2003).
- Rietdorf, J., Steitz, A., Heidelberg, E. Linear unmixing macro for ImageJ. European Advanced Light Microscopy Network. , (2004).
- Koon, A. C., et al. Autoregulatory and paracrine control of synaptic and behavioral plasticity by octopaminergic signaling. Nat. Neurosci. 14, 190-199 (2011).
- Yarali, A., Gerber, B. A Neurogenetic Dissociation between Punishment-, Reward-, and Relief-Learning in Drosophila. Front. Behav. Neurosci. 4, (2010).
- Kuo, C. T., Jan, L. Y., Jan, Y. N. Dendrite-specific remodeling of Drosophila sensory neurons requires matrix metalloproteases, ubiquitin-proteasome, and ecdysone signaling. Proc. Natl. Acad. Sci. U.S.A. 102, 15230-15235 (2005).
- Mondal, S., Ahlawat, S., Koushika, S. P. Simple Microfluidic Devices for in vivo Imaging of C. elegans, Drosophila. J. Vis. Exp. (67), (2012).
- Xiong, X., et al. The highwire ubiquitin ligase promotes axonal degeneration by tuning levels of nmnat protein. PLoS Biol. 10, (2012).
- Shin, J. E., et al. Dual leucine zipper kinase is required for retrograde injury signaling and axonal regeneration. Neuron. 74, 1015-1022 (2012).
- Watkins, T. A., et al. DLK initiates a transcriptional program that couples apoptotic and regenerative responses to axonal injury. Proc. Natl. Acad. Sci. U.S.A. 110, 4039-4044 (2013).
- Hammarlund, M., Nix, P., Hauth, L., Jorgensen, E. M., Bastiani, M. Axon regeneration requires a conserved MAP kinase pathway. Science. 323, 802-806 (2009).
- Guo, S. X., et al. Femtosecond laser nanoaxotomy lab-on-a-chip for in vivo nerve regeneration studies. Nat. Methods. 5, 531-533 (2008).
- O'Brien, G. S., Rieger, S., Martin, S. M., Cavanaugh, A. M., Portera-Cailliau, C., Sagasti, A. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J. Vis. Exp. (24), (2009).
- Stone, M. C., Nguyen, M. M., Tao, J., Allender, D. L., Rolls, M. M. Global up-regulation of microtubule dynamics and polarity reversal during regeneration of an axon from a dendrite. Mol. Biol. Cell. 21, 767-777 (2010).
- Miller, D. L., Ballard, S. L., Ganetzky, B. Analysis of synaptic growth and function in Drosophila with an extended larval stage. J. Neurosci. 32, 13776-13786 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。