需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
该
摘要
剖切开凡士林差距的方法来获得电压依赖性离子通道的离子和门控电流的表达在非洲爪蟾卵母细胞具有高分辨率的快速通道动力学低噪音录音。有轻微的修改,电压钳荧光可以被耦合到所述剖切开的卵母细胞的协议。
摘要
剖切开的卵母细胞凡士林间隙(COVG)电压钳技术允许对异源的离子通道在卵母细胞的电生理和动力学特性分析。从开封设置录音是解决低幅度门控电流,快速离子电流的激活和失活时特别有用。通过双电极电压钳(TEVC)技术的主要好处包括提高夹紧的速度,提高了信号 - 噪声比,并以调制胞内和细胞外环境的能力。
在这里,我们采用人类心脏钠通道(HNA V 1.5),表达在非洲爪蟾卵母细胞,以展示开封的设置和协议,以及所需要的加电压钳位荧光能力的修改。
快速激活离子通道,如海航V 1.5的属性,不能完全接近室温解决使用TEVC,在whic卵母细胞的膜h的全部内容被夹紧,使电压控制困难。然而,在剖切开的技术中,在细胞膜中的一小部分的隔离允许为需要同时防止用膜片钳技术相关联的信道破落准确地记录快速动力学的快速装夹。
与COVG技术中,离子通道的动力学和电生理学特性相结合可以通过使用电压钳荧光,其中蛋白质运动经由的细胞外施加荧光团,插入基因编码荧光蛋白的,或者非天然氨基酸掺入半胱氨酸缀跟踪可以进一步测定入息1的区域。这个额外的数据产生关于该蛋白质的电压依赖性的构象重排通过改变周围的荧光分子的微环境动力学信息。
引言
专门的电压钳位技术允许离子流在控制膜电位的记录。广泛使用双电极电压钳(TEVC)和膜片钳技术提供许多离子通道的特性可靠的电生理信息。然而,这两种方法都有缺点,防止收购可靠的数据进行快速电压门控钠离子通道等快速激活通道,膜如爪蟾卵母细胞。该Bezanilla和史蒂芬妮因而实验室开发的剖切开凡士林隙电压钳技术(COVG)的卵母细胞2。该技术已被广泛应用于录音,的Na +,K +和Ca 2 +通道3-8。
在COVG记录,异源蛋白表达的卵母细胞的膜被分成三个区域。离子电流数据从卵母细胞作为的顶部区域记录浴周围的顶部区域被钳位到一个命令的潜力,这可以容易地和迅速地改变。中间区域防泄漏电流通过被钳位到电位相同的顶部区域9。底部区域是卵母细胞的开口(切开的)通过使用皂苷溶液或套管发生。化学或膜中的底部区域手册开口允许内部潜力,这被钳位到地的控制权,并呈现与下部腔室的溶液中的细胞内是连续的。灌注液进入下部腔室可以调节内部环境的属性,而在顶室溶液交换改变的外部环境。 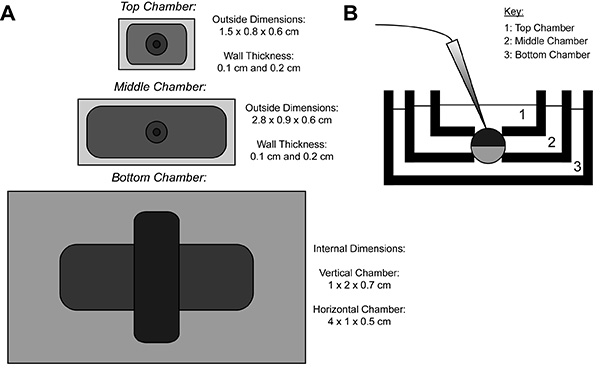
图1。卵母细胞剖切开的电压钳巴斯安装图(A)顶部往下看彼此分开了三次澡的。各室的COVG尺寸显示在图中。 ( 二)在测试位置的浴场设置的侧视图。 点击这里查看大图 。
该COVG技术的优点包括低电流噪声(1 nA在3千赫),外部媒体的离子组成,以调节内部媒体,快速的时间分辨率(衰变20-100微秒的时间常数的能力控制瞬态的能力),以及稳定的录音数小时9。的缺点是,它需要专门的设备,并且更难以进行对比2电极电压钳(TEVC)10。
而COVG方法需要高度专业化的设备和复杂的程序要素,它可以允许用于收购有价值的能电生理数据。这个数据,如门控电流,具有快速动力学和尾电流4,可以记录一些不与其他电压钳位协议,包括通道破败的相关问题。轻微的修改,COVG设置可以允许使用温度控制器和电压钳位荧光(VCF)的。列入COVG组件中的电压钳荧光元素可以通过赋予监察蛋白质构象的变化,同时记录电流11-13的能力,增强数据输出。
研究方案
1。最初的设备设置
- 放置在振动隔离系统( 例如一个空气表)的阶段和在微电极操纵器与周围的法拉第笼,以防止电气和机械噪声。
- 焊接6银/氯化银颗粒为24 AWG电线六英寸长。对于这些长度中的一个(也可以连接到P1),拼接在第二导线,以形成一个“Y”。对每根线的两端焊金BNC端子,它包含与放大器。
- 连接焊接到24 AWG电线的浴室/卫队探头(P1,P2,CC,GS1,GS2和)五个银/氯化银颗粒。连接的“I”的Ag / AgCl沉淀到“I”的探头和所述第二金属丝脱落P1到V2的探头。
- 根据在设备手册中的指示放大器连接到数据采集单元。
- 将环氧温度控制器热敏电阻。通过在金属scaffol一个洞线程块热敏电阻D直接上面的加热/冷却元件的中心。放置和环氧浴热敏电阻在钻孔中的温度传导底腔体非常接近但不接触的溶液的孔。
2。卵母细胞和前期准备
- 要记录一个异源表达的渠道,如海航V 1.5,合成的mRNA(从hSCN5a派生),并执行协议4前约4-5天注射到非洲爪蟾卵母细胞。对于hSCN5a,在19℃下培养4-5天之后得到表达高峰参阅理查兹和Dempski 14和Cohen 等人 15对卵母细胞的详细说明,mRNA的制备方法,以及卵母细胞注射。
- 协议开始前4氯的氯化银线和氯化银颗粒。要做到这一点,将电线的一端与球团成漂白至少20分钟,只要的O / N。一旦粒料已经被氯化物版,使用粘合剂将它们粘贴到歧管。
注意:驱动电流通过导线也可以用氯化物电线粒料。这种技术将增加由氯化的速度,但也需要更多的设备。见技术Chloriding银线作进一步说明16。
3。琼脂桥准备
- 通过加热的硼硅酸盐毛细管的一端,在培养基中的火焰使至少6琼脂桥。确保在毛细管的端部是在蓝色火焰的顶端部。让的情况下损坏原稿额外的桥梁。
- 一旦毛细管已经升温,用钳子使在管内以90°角弯曲。要弯曲的目标是具有平滑的曲率,而不是突然的角落,或者它可能显著降低玻璃,这使得填充更困难,并增加了电桥的电阻的内径。
- 拨打第二个90°弯头在相同的方向25毫米向下毛细管从所述第一弯曲部使用相同的步骤。
注意:桥的确切长度并不重要,只要桥大小是一致的,但最终的长度应该是合适的,因为他们将被用于在钻机。记住,电桥电阻正比于其长度,并应尽量减少。 - 一旦毛细管已经冷却,用金刚石尖玻璃切割器修剪的“腿”的桥到大约5毫米。
- 插入铂丝的长度分成三个“电流供应”桥的毛细管通过减少在琼脂17电阻来提高性能。切掉多余的铂线,使得没有导线管外露出。
注意:由于铂金的成本高,检索和重用来自破碎桥梁任何电线。 - 推铂丝进一步进入毛细管用细尖工具如微量吨IP使得线为1mm比在毛细管两端的玻璃短。
- 赚100毫升1M NMDG缓冲1.2克HEPES的。使用pH计和添加MES水合物粉末,直至pH为7.4的实现(〜10克)。一旦pH值为7.4已经达到,移开电极。预留40毫升溶液,以保持作为一个存储解决方案。
- 添加颗粒状琼脂产生2-3%的琼脂混合。搅拌均匀并加热至琼脂溶液溶解并清除。不要过度加热或煮沸的溶液,因为它会变得过分粘稠并填充所述桥将是困难的。
- 将琼脂溶液到一个新的烧杯中,添加一个小的搅拌棒。继续加热,并以中等速度搅拌。
- 加毛细管桥一次一个朝上的腿。随着时间的推移桥将充满琼脂。可替换地,通过连接到一个小的移液管尖的注射器推琼脂溶液填充桥。
- 一旦没有气泡在BRI当选总监,检索从琼脂溶液中的桥梁和放置桥梁在纸巾上干燥。残留气泡任何桥梁被搅拌用钳子,方便泡退出。
注:结算琼脂泡沫可以通过浸泡桥梁,放入沸水中完全去除。一旦琼脂被去除,使用真空线,以去除残留的水。网桥可以被重复用于琼脂治疗。 - 从桥梁干燥时取出多余的琼脂。加60ml水到40毫升储备溶液,然后将桥的存储解决方案。
4。开封钻机准备
- 打开水源的温度控制器,然后将电源开关置于温度控制器。等到浴温度达到规定的温度(19°C)。
- 从硼硅毛细管用微电极拉马拉微电极的0.2-0.5MΩ电阻。
注:降低点子ETTE性提高装夹速度。然而,较低的电阻移液器更容易损坏的卵母细胞。可以通过实验来确定每个应用的最佳移液管的电阻值。 - 通过混合0.125克干皂素用50ml内部溶液的制备皂角苷溶液。这将导致0.25%的溶液。颠倒轻轻混匀。
- 在解剖显微镜下可以使用少量的凡士林围绕孔的边缘上的中间腔和上腔室的底侧具有非常细长的物体的顶侧。
注:凡士林的“甜甜圈”将有助于保持卵母细胞中发生过孔,并在密封的形成帮助。然而,过多的凡士林将捕获的气泡并防止溶液到达卵母细胞表面。 - 加的3M KCl溶液成保持的Ag / AgCl粒料歧管槽,使得没有从槽溢出,但粒料和桥臂两端科夫红色。清理多余的氯化钾液滴,以防止插槽之间不必要的电连接。
- 加入外部解决低收入和中等浴室。
- 将琼脂桥到在氯化银沉淀歧管槽,使每个桥一条腿是在每个插槽。桥的另一条腿稍后将被放置到各自的腔室(P1,P2,CC顶部; GS1,GS2中间(后卫);余底部)。确保铂丝桥是在GS2,P2和我插槽。
注意:确保桥插入到腔室浴之前,用蒸馏水洗涤并完全干燥。 - 打开数据采集系统和PC上。启动录音软件。
5。开封程序
- 没有安装的卵母细胞的顶部和中间腔室的卵母细胞。滑动顶室偏离中心,以便在两个腔室中的孔不重叠。填写所有室与外部解决方案,并把所有的电极在各自室。
注:前室安装腔时,不要推一路下滑。确保一个非常小的差距仍然是两个腔室之间。偏离中心的安排增加了腔室系统的阻力,以更好地模拟一个细胞的存在。这个过程被称为“平衡的桥梁”,弥补了可能产生的琼脂网桥之间的不均匀性偏移电位。- 关闭外部命令和两个夹子。检查当前的读数上的放大器。调整用小螺丝刀在P上的浴/守护头级零电流背面偏移。
- 切换浴/后卫开关放大器积极调整GS偏移,以获得零电流。
- “主动”与“被动”之间的重复,直到双方都相当接近于零(<100 nA的)。
- 移除顶室,并用移液管泵的卵母细胞转移到中间浴室中。确保oocy特被定位在在浴中的中心孔中。
注:在准备一个卵母细胞为VCF,将标记的细胞进入腔与动物极(暗面)朝上。细胞定向不要紧,如果VCF没有被执行。 - 使用吸气创建卵母细胞和浴面之间的密封拆下底部浴多余的外部解决方案。
- 放置在顶部浴室在卵母细胞,以便在腔室中的孔的中心在卵母细胞上。用拇指和中指,直到它被紧紧地压在卵母细胞,从而通过该孔的膜,只有一小部分露出于上部浴慢慢地施加压力下放置在腔室中。
注:卵母细胞可从顶部腔室中的压力作用下发生膨胀。过度用力不适用顶端室,因为这将导致卵母细胞破裂。镊子尖端放置在顶室的对角可以作为一种替代手指APPLY向下的压力。 - 添加外部溶液的顶部和底部浴直至它们几乎已满。
- 将游离腿琼脂桥到每个浴的, 如图2(桥接位置)看到的外部溶液。确保每座桥被搁在了正确的洗澡位置。 (Ⅰ弥合底部浴,GS1和GS2在中间浴桥梁,P1,P2,并在上部浴CC桥)。切换浴/后卫开关放大器为主动。
注意:确保有桥,它们的孔中,该记录室之间无3米氯化钾连接。此外,请确保桥梁塑造,使它们上面录音室解决方案提出。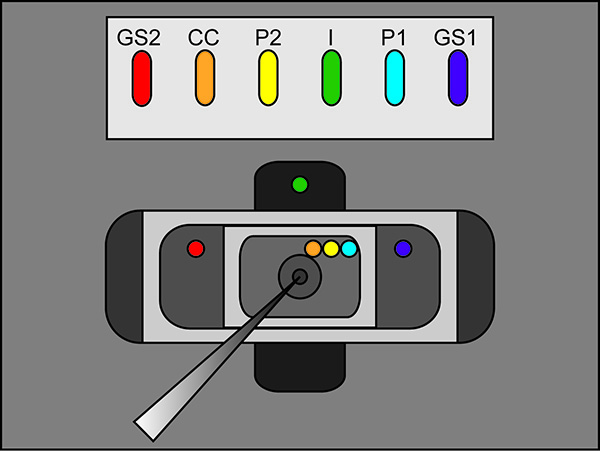
图2。琼脂桥的自由端的琼脂桥安装位置示意图。放置位置在各个浴场。 点击这里查看大图 。 - 开始测试协议中的录音软件。如果在申请一个100 mV的脉冲大于100 nA的(对应于0.3MΩ同浴/后卫被动),那么增加的浴罩的密封性脉冲显示两个峰之间的水平段垂直位移。请参阅图3为一个理想的测试脉冲的一个例子。
注:测试协议发出一个电压脉冲,以查看是否在浴罩是足够紧凑,并且所有组件都已正确组装。可替换地,可以使用放大器的测试功能。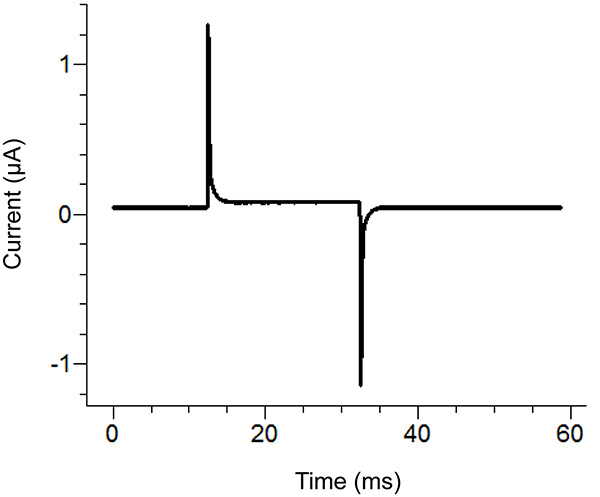
图3。从录音软件理想的测试脉冲的脉冲测试应该类似于取决于应用的协议后,上面的脉搏。保持电流(中心基线)应接近于零。 点击这里查看大图 。 - 删除外部解决方案在底部洗澡并更换皂素的解决方案。要小心,以避免产生气泡,同时增加了皂素。为了确保最大的更换,采用吸在底部槽的相对端,同时加入该溶液中。
- 后的皂苷溶液已被添加,观察的重复测试脉冲。如果测试协议的峰值减少或消失,那么这是一个迹象,表明有位于卵母细胞下方的泡沫。在这种情况下,完全除去皂苷溶液,然后更换它。
注:通透通常在30秒内用新鲜的皂素完整的解决方案。该解决方案可能难以到达的小区是否有气泡被困或者,如果滤泡层保持在一个难消化的卵母细胞。卵母细胞被透化(打开)时的电压尖峰的斜率减小(增大的衰减时间常数)。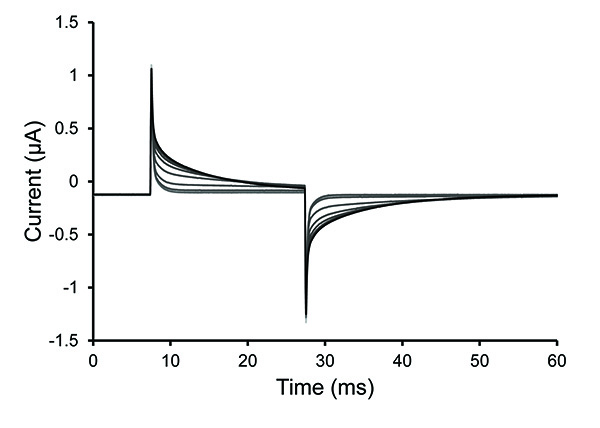
图4。测试脉冲轨迹在卵母细胞的透化。从测试脉冲协议指定的痕迹后0.25%的皂角苷溶液引入底部卵腔中。衰变看到的痕迹的时间常数的增加表明增加卵母细胞通透性。 点击这里查看大图 。 - 一旦细胞透,取出皂素的解决方案,并填写浴内部的解决方案。停止测试协议。
注:即使皂素允许访问由透膜单元的内部,下部浴和卵母细胞通过扩散的细胞质之间的离子浓度的平衡是一个非常缓慢的过程。这个过程可能需要几十分钟的时间根据条件( 图5)。 - 检查在浴任何高水平的溶液中结晶和氯化钾的歧管的孔之间,因为这些可能会导致短路和异常行为。
- 使用修改过的注射器注入3米氯化钾成微电极。轻弹微电极数次用一个手指同时用其他手指支撑。
注意:此步骤是必需的微电极内移除任何残留的空气气泡。 - 通过将灯丝到打开微电极末端安装氯化钾填充电极上的微操作机器人手臂。推微电极的一端插入灯丝支架,并确保电极不松动。拧紧电极紧固件。
注:马柯确保该导线具有均匀的AgCl涂层为正常工作电极。 - 摆动手臂到了卵母细胞浴位置,旋紧紧固螺丝,以防止进一步的手臂运动。
- 使用操纵旋钮,走在电极下入浴缸。确保没有测试脉冲应用和膜测试功能没有在这一点上激活。
注意:在电极尖端插入到液体中,V1-V2的电压钳将读取的正电压。一次电极尖端插入到液体上的电压钳位在电压表应该改变的值接近零。对于VCF录音,电极需要接近细胞在一个相当小的角度,以留有余地的目标。刺穿的细胞与偏离中心电极,靠近隔离膜贴剂的边缘还有助于避免物镜与电极碰撞。 - 停走电极下来。设置电极偏移量电位为零,按V1按钮,然后降低V1的电压为零通过调节V1的偏移量。此外,执行相同的调整V2。该电位差V1-V2应该阅读000毫伏。
- 切换回V1和转Z测试在测量电极电阻。该值会逐渐下降,接近实际的阻力。旨在为0.2-0.5MΩ的电阻值。
- 继续走在电极下来,对卵母细胞中的顶浴缸可见的补丁。一旦微电极是非常接近的卵母细胞,观察V1-V2读数看时,电极进入卵母细胞,当微电极进入细胞的V1-V2的电压将变成负值。
注意:在这一点上显示的值是在细胞的膜电位和将受所表示的信道和所使用的解决方案。插入微电极太多会破坏细胞膜。 - 打开在数据收集协议录音软件。
- 翻盖上的电压钳位钳位开关和调整,通过调整位于“我”探头旋钮以匹配命令( 例如 -100毫伏)的潜力。
- 翻盖上的电容和电阻补偿开关。
- 翻转“测试”,在电压钳的“命令”区域打开。用示波器直观的信号。调整信号调理段厘米补偿旋钮,以减少对示波器的电容瞬态。不要峰过度补偿的地方会出现额外的反向峰或峰值开始开发一个S形弯曲,这可以引入神器进入录制的位置。
- 一旦该电容已经手动减小到令人满意的水平,关闭检测开关。
- 开始进行数据记录协议中的录音软件。
6。净化
- 当记录有蜜蜂Ñ完成,关闭上的电压钳位所有的各种开关,包括夹具和浴缸/卫开关。
- 使用镊子从各个浴场取出琼脂桥梁。
- 卸下顶部浴,吸从所有浴室所有的解决方案和卵母细胞。
- 用奶瓶的去离子水冲洗所有浴场,然后吸出浴场用真空。重复此步骤3 - 5倍。
- 擦拭结晶氯化钾断桥梁,并将桥梁的存储解决方案。桥可以用于许多周,只要他们正确地存储被重用。
- 从歧管油井吸出KCl溶液冲洗歧管,用去离子水多次。
- 关掉所有的各种设备,包括温度控制和记录软件。
7。除了电压钳位荧光法
- 按照第1步到第6在以前发表的朱庇特的协议共16项xamining膜蛋白构象动力学原位与定点荧光标记: 点击此处查看页面。
- 执行第4节中的步骤,通过使用VCF显微镜设置为4X焦点上述COVG协议5.22。
注:VCF录音要求比需要COVG测量较大的卵母细胞浴室。 (的定制VCF腔室的尺寸被设在物料清单)。这一较大的VCF室必须能够同时容纳物镜,微电极,以及琼脂桥。此外,动物极(卵母细胞的暗侧)需要被朝上的室,用于低背景VCF录音。 - 使用水浸渍40X物镜使卵母细胞的顶部成为焦点。
注:从4X切换到40X客观需要特定的GE开封组件认真地ometry以免降低40倍物镜时碰到电极,桥梁,或室。此外,由于在顶级控卫的增加量,确保从顶部后卫的浴卷不与中间护罩连接时的40倍目标是在地方设置。 - 集中于周围的露出的卵母细胞表面的周边的环,以使卵母细胞的最顶部略高于焦点的平面。
注意:调节在xy平面内可能是必要的,使得视场主要是填充有膜,而不是该室。 XY翻译是最容易在翻译阶段所完成显微镜的位置。 - 移动过滤器立方体插入光路和从目镜切换到检测器(二极管)的光路中。
- 打开VCF光源。
- 关闭顶灯,光纤光照明,以及其它光源。
注:在理想情况下,VCF录音应该在一个完全黑暗的房间中进行。 - 运行一个荧光协议的录音软件。
结果
图4显示了在卵母细胞作为皂苷溶液的渗透性的变化施加到卵母细胞的底部部分, 图5展示了胞内溶液交 换的速率由扩散以下皂苷透化。 20-40分钟必须来一个稳态2,18。
从记录协议生成图6A表演的痕迹。图中示出了离子电流响应于所述电压协议(插图)(P/-8漏减之后)。图中的每个轨迹代表了不同的外加电压。与?...
讨论
剖切开的卵母细胞凡士林隙电压钳技术,可以进行数据的快速高分辨率,低噪音,增加控制权的内部解决方案和外部解决方案组成,并记录稳定在相对 长的协议19。这些优势设置这项技术除了标准的双电极电压钳和膜片钳技术。虽然专门的设备是必要的,该协议是比较困难的,一旦系统进行了优化,非常少的问题发生。这使得钠(HNA V 1.5)和其它快速激活信道可重复的记录。...
披露声明
作者什么都没有透露。
致谢
华盛顿大学圣路易斯分校心脏分子工程实验室的所有成员。一个伯勒斯欢迎基金事业奖在科学界面 - 1010299(JS的)。
材料
| Name | Company | Catalog Number | Comments |
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
参考文献
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. . Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , (2006).
- Cha, A., Zerangue, N., Kavanaugh, M., Bezanilla, F., Susan, G. A. . Methods in enzymology. 296, 566-578 (1998).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. 3rd edn. , (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R., Roberts, G. . Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. , (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。