需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
木质素下调
摘要
双链RNA干扰(dsRNAi)技术以下调玉米肉桂酰辅酶A还原酶(ZmCCR1)基因为低植物木质素含量。木质素下调从细胞壁是由微观分析和可视化的Klason法进行定量。在半纤维素和结晶纤维素组成的变化进行了分析。
摘要
为了便于使用木质纤维素生物质作为替代生物能源资源,在生物转化过程中,前处理工序是必要的,开放的植物细胞壁的结构,增加了细胞壁碳水化合物的可访问性。木质素,多酚材料存在于许多细胞壁类型,被称为是一个障碍显著酶连接。减少木质素的含量为不与植物的结构完整性和防御系统干扰电平可能是一个有价值的步骤,以减少生物乙醇生产的成本。在这项研究中,我们已经通过基因的双链RNA干扰技术下调1的木质素生物合成相关的基因,肉桂酰基-CoA还原酶(ZmCCR1)。使用粒子轰击法ZmCCR1_RNAi构建体已整合到玉米基因组中。转基因玉米植物正常生长相比于野生型对照植物在无与生物生长或防御机制terfering,除在转基因植物叶片中肋,壳显示棕颜色的,和茎。微观分析,与组织学检测相结合,发现叶厚壁纤维变薄,但其他主要血管系统部件的结构和尺寸没有改变。在转基因玉米中的木素含量降低了7-8.7%,结晶纤维素含量响应于木质素还原性增大,半纤维素保持不变。的分析可以表明碳流可能已被移离木质素生物合成的纤维素生物合成。本文界定了用于下调通过RNAi技术在玉米中的木素含量的方法,并在细胞壁组成分析用于验证的修改对细胞壁结构的影响。
引言
生物燃料由木质纤维素生物质生产是由于其大量存在于美国1非常可取的,并在农业和林业废弃物可持续收获的情况下,不直接用于食品和动物饲料的生产耕地竞争的能力。然而,与玉米粒,这是目前在美国产生生物燃料的主要来源,木质纤维素材料是显著更加复杂和难以打破。除了长链碳水化合物,纤维素和半纤维素,其是糖的主要来源的木质纤维素原料的发酵过程中,多种类型的植物细胞壁也含有木质素,苯丙聚合物,可提供强度,抵御病原体的攻击,和疏水性细胞壁。而必需的植物的生长和存活,木质素也提出了显著障碍的纤维素和hemicellu的成功的酶转化失去可溶性糖。具有高木质素含量的材料一般为生物燃料(通过生物转化途径),且由于对加工性能和产品质量的负面影响的纸浆和造纸工业不太理想的材料。因此,植物材料的木质素减少在不与作物的结构强度和防御系统干扰电平的遗传操作可能是对双方的木质纤维素生物燃料和纸浆和造纸工业的生产成本的降低非常重要的。
在玉米( 玉蜀黍 ),木质素共价交联通过阿魏酸和diferulate桥2的初级细胞壁半纤维素。木质素半纤维素复合物通过氢键结合到纤维素微纤维,形成了复杂的矩阵赋予完整性和强度的次生细胞壁。植物细胞壁的机械强度在很大程度上是由利的类型确定gnin亚基3-5。在以前的研究中,改变木质素亚基的比例显示在酶解6-11没有明显的趋势。然而,减少的木质素含量通常显示在转换12,13的改进,并且可以是键,由水解酶包括endocellulases,纤维二糖水解,和β-葡糖苷酶14增加植物材料的可消化性。
基因工程来调节转录物的表达水平已被广泛实行,以提高作物的性状。先进的技术,包括反义15和共抑制16的技术,能够有效地下调靶基因。完整的基因敲除也被用用发夹结构17编码内含子剪接的RNA基因结构来实现。此外,双链RNA干扰(dsRNAi)技术, 即一个强大和有效的基因表达媒体器的工作原理是针对两种转录本的降解或翻译抑制,提供了一种有效的手段,引导广泛的对靶mRNA 18抑制效果。基因沉默技术显示一些局限性。这些技术不能精确地调节转录水平,并可能导致对其他同源基因沉默意想不到的效果。
在该方法中,我们采用的粒子轰击进行的dsRNAi构造成玉米基因组中。迄今为止,植物种类繁多已成功利用粒子轰击, 农杆菌介导的转化,电穿孔,显微注射和方法转化。在玉米中的遗传转化,粒子轰击方法是有利的,对所有的其它方法,因为它是最有效的。粒子轰击是不依赖于细菌,所以该方法是游离的生物因素如基因,物种基因的大小或igin,或植物的基因型。物理转基因传送系统,使高分子量DNA和多个基因在高转化效率19被引入到植物基因组中,并在某些情况下进入叶绿体。在叶中肋的血管系统中的木质素还原可以通过扫描电子显微镜(SEM)进行可视化是有益的用于检查的样品的形貌和组成。
在玉米植株,两个肉桂酰辅酶A还原酶(ZmCCR1:X98083和ZmCCR2:Y15069)基因被发现在玉米基因组中20。肉桂酰基-CoA还原酶可催化羟基肉桂酰-CoA酯转化成肉桂醛。我们选择了ZmCCR1基因下调这种酶是因为基因的表达在所有的组织木质化。在523个核苷酸的ZmCCR1基因的3'末端被选为一个dsRNAi构造,因为序列似乎是而相对于ZmCCR2的更加多样化。因此,dsRNAi结构会正是只绑定到ZmCCR1,避免脱靶沉默21。甲ZmCCR1_RNAi构建体设计到细胞质表达系统ImpactVector1.1-标签(Ⅳ1.1)包含绿色组织特异性启动子,核酮糖1,5 -二磷酸羧化酶加氧酶(Rubisco)。
研究的dsRNAi构造上的转基因植物的影响,木质素含量进行定量。的Klason(酸不溶性)木质素测量已知相比,其溶解一些木质素22的酸性洗涤木质素的定量方法,以更准确。因此,Klason木质素测定转基因玉米秸秆。这个过程包括两个步骤的酸水解,转换聚合碳水化合物转化为可溶性单糖23。水解的生物量,然后分馏成酸可溶性和不溶性MATERIALS和酸不溶木质素是根据以前的研究23,24测量。理想情况下,木质素分析应包括在水解之前步骤中,为了除去可影响结果可溶性材料,木质素残渣占存在于所述残基的任何灰分的后燃烧水解萃取,用水和乙醇。没有这些步骤,样品的木质素含量可以人为地抬高。完整的方法,这里介绍的,但是我们的实验中,我们无法因体积小的材料可用于测试执行这两个步骤
其他两个细胞壁成分,纤维素和半纤维素中的木质素下调的转基因玉米系进行了分析。它已经报道,已下调或者他们的苯丙氨酸解氨酶(PAL)25,4 -香豆酸的转基因植物:辅酶A连接酶(4CL)26,或肉桂一lcohol脱氢酶(CAD)27显示增加在其它细胞壁结构组分。如在我们的研究中的第一步骤,结晶纤维素是使用Updegraff方法28测定。最初被设计用于测定纤维素的大量纤维素分解细菌和真菌的这种方法。简言之,将磨碎的玉米库存均与Updegraff试剂(:硝酸:乙酸的水)处理,以除去半纤维素,木质素和xylosans。结晶纤维素,通过加入H 2 SO 4完全水解成经由Saeman水解葡萄糖。结晶纤维素,然后用比色蒽酮法测定29。核实,如果半纤维素含量发生了变化,从磨碎的茎的提取物的单糖用三氟乙酸水解,用醛醇乙酸酯法衍生化,然后用气相色谱(GC)30进行分析。的详细程序结晶CELlulose含量和基质多糖成分分析是在福斯特等人(2010)31。
在这里,我们描述了用于木质素的程序下调通过RNAi技术,粒子轰击转化和木质素分析玉米木质纤维素生物质解构加速成可发酵糖生物燃料的玉米。
研究方案
1。dsRNAi构造用于下调ZmCCR1的制备
- 设计基因特异性引物,包括必要的限制性酶切位点用于制作dsRNAi构建以敲除的ZmCCR1基因。两个引物组被设计以扩增ZmCCR1 cDNA的片段2段:一个523 bp的片段从核苷酸748到1271,和一个285 bp的片段从核苷酸986至1271的ZmCCR1的cDNA是从亚利桑那州基因组研究所(AGI)提供。更多细节在图1中描述。
- 通过从ZmCCR1 cDNA模板使用引物ZmCCR1_748F_BglII(5'-AGATCTACATCCTCAAGTACCTGGAC-3')和ZmCCR1_1271R_NcoI(5'-CCATGGTTTACACAGCAGGGGAAGGT-3')聚合酶链反应(PCR)扩增的大片段。使用引物ZmCCR1_986F_BglII(5'-AGATCTGGAAGCAGCCGTACAAGTTC-3')和一个ZmCCR1_1271R_SacI(5R放大较小的片段(285 bp)的17;-GAGCTCTTTACACAGCAGGGGAAGGT-3')。
- 单独结扎片段到pGEM-T简易按照制造商的说明进行操作。
- 从个人转化进行小量制备质粒DNA的提取,每个都包含pGEM-T中构造使用商业小量制备质粒试剂盒。
- 既消化了的pGEM-T :: ZmCCR1(523 bp)和ImpactVector(四)-1.1(细胞质表达载体)与两个BglⅡ和NcoI位 。
- 结扎大消化凝胶纯化ZmCCR1片段(523 bp)的进入消化凝胶纯化IV-1.1。
- 消化的pGEM-T :: ZmCCR1(285 bp)和IV-1.1 :: ZmCCR1(523个基点),既BglII和SacI位 ,以便插入小片段插入的IV-1.1 :: ZmCCR1(523个基点)。
- 结扎小消化凝胶纯化ZmCCR1片段(285 bp)的进入消化凝胶纯化IV-1.1 :: ZmCCR1(523个基点)。
- 这两个克隆523个基点和285个基点fragmenTS到IV-1.1,使ZmCCR1的RNAi构建体,其中有一个285bp的反向重复序列与在反向重复片段的中间一个238 bp的间隔区(参见图1)。
- 转让本建设成为大肠埃希氏菌(大肠杆菌),增长他们并执行南部-准备大小的质粒DNA的提取,以获得足够的质粒DNA的玉米遗传转化。
2,玉米遗传转化
- 钨粒子的制备
- 放置60毫克钨珠(M10)在1.5ml管中,振荡混合2分钟洗涤用1毫升70%乙醇中。孵育10分钟,在23℃下再离心在18,894×g离心2分钟,弃去上清液。
- 用1ml 100%乙醇洗涤3次,离心2分钟,弃上清。加入1毫升无菌50%的甘油,使该微粒浓度为60毫克/毫升。
- 用于轰击制备的DNA
- PL王牌50微升的钨珠(3毫克)制备在50%甘油至1.5 ml管中。加IV-1.1的5微升(1微克):: ZmCCR1的RNAi质粒DNA,50微升的2.5M的CaCl 2,和20微升0.1M的亚精胺。短暂涡旋每次加入上述试剂之间。
- 涡流的钨珠-DNA混合物短暂离心18,894×g离心30秒。倒掉上清,悬浮颗粒在140微升70%乙醇。除去液体并丢弃。加入140微升的100%乙醇。除去液体并丢弃。
- 加入48微升的100%乙醇。立即使用或储存在冰长达4小时前轰击。
- 轰击
- 放置一个3-5厘米直径的Hi-II胚玉米愈伤组织(爱荷华州立大学的玉米转化中心提供),在100毫米含N6OSM媒体32(如osmotium)的轰炸至少4小时之前培养皿中间。
- PreparE依据制造商的说明33 PSD-1000/He颗粒递送装置。
- 消毒腔室壁,用70%的乙醇。装入无菌的650磅爆破片到无菌护帽。传播5-6微升M10-DNA溶液到大载体,干燥简要的表面上。负荷大载体和停止屏幕变成微推出装配。
- 将推出微组装和玉米愈伤组织在室内从停止屏(L2 = 6厘米)和关门选定距离。加速中的27磅对一个金属丝网的真空度。
- 按下开火按钮,直到破裂盘破裂和氦压力表下降到零。松开开火按钮。
- 孵育轰击的愈伤组织在含有N6OSM(渗透压培养基)32为16小时,在黑暗中在27℃的培养皿中打破愈伤组织成约十几块,并转移到N6E(愈伤组织诱导培养基),在培养皿中32和孵化5天我n个暗在27℃。
- 选择
- 后N6E 5天,转移愈伤组织到N6S培养基(选择媒体)32。在继代选择培养基愈伤组织所有,每30天为8-12周,而不会干扰愈伤组织结构。
- 约8-10周后,白快速增长的行业会生长出的非增殖和部分坏死母亲愈伤组织。切除白快速增长的组织,并将它们传代至新鲜选择培养基(N6S)32,继续按上述程序进行孵化。
- 再生
- 转让白色和快速增长的胚性愈伤组织到再生培养基32和上述孵育1周。切换再生胚性愈伤组织,以期为16小时光照和8小时黑暗中,在25-27℃下
- 转移再生芽上生根在玻璃试管介质32 3-4周后,继续按上述程序进行孵育。大幅r之后OOT发展出现后,下水龙头仔细冲洗根部,然后移植苗4“盆带土。盖上塑料包装袋的盆,以保持湿润。术后第2天做小孔的塑料袋。经过5-6天取出塑料袋。继续上述的孵育另一个5-6天。
- 温室
- 转移苗成18“花盆土足额夏天的阳光下或温室光维护。最初再生的植物称为T 0,而第一批种子属于对T 1代。
3,组织学分析
- 修正了玉米叶片中肋在5毫升10%中性缓冲福尔马林。
- 工艺和真空渗透与石蜡的使用组织处理的组织处理。
- 使用HistoCentre三站嵌入嵌入石蜡组织。
- 从边缘去除多余的石蜡一次阵营KS冷却。
- 在4-5微米与用切片机切片机部分样品。
- 放在显微镜载玻片和干燥在56℃培养箱中培养2-24小时部分。确保部分完全遵守的幻灯片。
- 二甲苯5分钟在23°C。两个转变Deparaffinize节
- 水合物的100%乙醇2分钟两个变化和95%乙醇2分钟在23°C。两个转变滑过
- 冲洗部分在流动的自来水2分钟。
- 染色用0.05%甲苯胺蓝O对于1-2分钟,用双蒸2 O简要冲洗
- 放置盖玻片上有浸油和可视化的样品与光学显微镜。
- 扫描电子显微镜(SEM)
- 固定剖玉米叶中肋在4%戊二醛和0.1M磷酸钠缓冲液(pH 7.4)中在4℃下1-2小时。
- 简要地冲洗在缓冲器中的样本,脱水他们在一个乙醇系列(25%,50%,75%和95%),用于在各灰度和100%乙醇中10分钟,3次10-15分钟。
- 干燥脱水剖玉米叶中肋中使用液体二氧化碳作为过渡性流体的临界点干燥器。
- 采用高真空碳标签安装在铝存根干燥的样品中
- 涂层的玉米叶中肋安装在铝存根与金(约20纳米厚)在一个溅射镀膜机,用氩气吹扫气体。
- 检查在JEOL JSM-6400V(六硼化镧电子发射器),扫描电子显微镜对涂层的样品。
- 数字图像进行使用分析Pro软件(3.2版本)合照。
4,Klason木质素测量
- 穆勒通过2毫米筛的样品。
- 使用水分测定仪,以测定各样品的水分含量,并记录该值。
- 称出〜1.5克各样品并记录质量。 ËXTRACT利用水对在第一提取,随后用乙醇通过使用任意一种自动化溶剂萃取器(萃取每3个周期,〜每循环14分钟)或索氏装置(每萃取8小时)第二抽取的样品。 (注:此步骤去除提取物,可在酸水解缩合和干扰准确测量木质素,增加了明显的Klason木质素含量。)
- 干燥提取的样品在45℃过夜,然后让他们在干燥器中冷却,并再次称重。
- 设置一个孵化到30°C。测量0.3克每个干,抽取样品放入螺丝顶高压管(每个样品一式三份建议)并记录重量,精确到0.1毫克。加72%的H 2 3毫升SO 4到各压力管。
- 使用玻璃或聚四氟乙烯搅拌棒混合样本。离开搅拌棒在管内,直到水加入下列孵化。
- 将小瓶在孵化器本身吨至30℃和150rpm下进行60分钟。 1小时后加84毫升的去离子水稀释的酸浓度至4%,并用搅拌棒混合。要小心,不要让大量的样品在水线以上的小瓶的侧面。
- 紧紧密封瓶塞上的所有小瓶并将其放置在一个金属架或大烧杯。高压釜在121℃下用液体消毒周期为1个小时。让他们打开之前,冷却至室温。
- 预灰在炉中在575℃下过滤坩埚中进行至少4小时。让坩埚放入干燥器中冷却,至少一个小时。
- 真空过滤从每个管中的溶液通过一个单独的坩埚中,使用橡胶连接器,以确保坩埚。使用去离子水冲洗从管任何剩余的颗粒。
- 擦干残留的木质素在105℃为最低4小时的。记录干燥坩埚和残留物的重量。
- 如果使用的是575℃,预火样品在本生灯,直到没有烟雾或灰,然后在炉内放置24小时,或者如果使用一个可编程的炉子,不预灰和使用下面的程序:
- 从室温升温至105℃并保持12分钟。
- 斜至250℃以10℃/分钟,保持30分钟。
- 加速到575°C在20°C /分钟,并保持至少180分钟。
- 从炉中取出坩埚,并在干燥器中冷却。称量坩埚和灰分。
- 计算使用下面的公式的酸不溶性残余物:
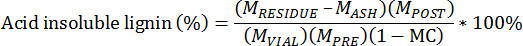
M PRE =质谱萃取前生物量的
M POST =质量后提取生物质的
M VIAL =质量中提取的生物质的加入小瓶
M 渣油 =质量的坩埚和木质素渣油UE
M 灰 =质量坩埚和灰
MC =水分萃取前的生物量,总重量为基准的内容
5,碳水化合物分析
- 执行细胞壁碳水化合物分析的基础上,福斯特等人 (2010)的协议31。总之,准备从冷冻干燥的植物原料醇不溶物。然后水解该材料用三氟乙酸和相匹配的溶解的单糖衍生物以它们相应的醛糖醇乙酸酯。通过连接到四极质谱仪,气相色谱(GC)分析这些挥发性衍生物。
结果
我们已经证明通过RNAi技术在玉米植株的木质素含量降低。粒子轰击转化方法取得了30%左右trnasformation效率。 ZmCCR1的基因沉默在T0-T2世代中观察到的一致。木质素降低转基因同样成长为野生型的玉米植株,除了在叶片中肋,壳,茎和显示棕色着色。组织学分析表明,该突变体品系表现出显著减少在玉米叶中肋18的厚壁组织纤维细胞壁厚度。尽管细胞壁厚度的减小,其它主要血管系统?...
讨论
微生物纤维素酶对植物细胞壁多糖的可访问性在很大程度上取决于其所用酚醛聚合物23相关联的程度。从木质纤维素生物质的转化率为可发酵的糖是负沉积在植物secondadry细胞壁木质素含量相关。这种相关性是归因于木质素的物理性质如疏水性24,化学不均一性,以及没有定期水解intermonomeric连杆25。
在这项研究中,一个dsRNAi技术诱发不同程度的遗传靶?...
披露声明
没有利益冲突的声明。
致谢
显微成像是通过美国密歇根州立大学中心高级显微镜的服务进行。玉米愈伤组织爱荷华州立大学的玉米转化中心购买。笔者想感谢密歇根州立大学植物研究实验室的杰夫·韦瑟他对碳水化合物分析技术援助。这项研究是由慷慨密歇根州的玉米营销计划(CMPM)及财团的植物生物技术研究(CPBR)资助。
材料
| Name | Company | Catalog Number | Comments |
| N6OSM (Osmotic medium) | Made in-house | ||
| N6E (Callus induction) | Made in-house | ||
| N6S media (Selection media) | Made in-house | ||
| Regeneration medium | Made in-house | ||
| Rooting medium | Made in-house | ||
| 10% Neutral buffered formalin (1 L) | Made in-house | ||
| Bio-Rad PSD-1000/He Particle Delivery device | Hercules, CA, United States | ||
| Zeiss PASCAL confocal laser scanning microscope | Carl Zeiss, Jena, Germany | For brightfield microscopy, the images were recorded using a Zeiss (Jena, Germany) PASCAL confocal laser scanning microscope with a 488 nm excitation mirror, a 560 nm emission filter, and a 505-530 nm emission filter. Image analysis was performed using Laser scanning microscope PASCAL LSM version 3.0 SP3 software. | |
| Excelsior ES Tissue Processor | Thermo Scientific, Pittsburgh, PA, United States | ||
| HistoCentre III Embedding Station | Thermo Scientific, Pittsburgh, PA, United States | ||
| Microtome Model Reichert 2030 | Reichert, Depew, NY, United States | ||
| Emscope Sputter Coater model SC 500 | Ashford, Kent, England | ||
| JEOL JSM-6400V Scanning Electron Microscope | JEOL Ltd., Tokyo, Japan | ||
| Fitzpatrick JT-6 Homoloid mill | Continental Process Systems, Inc., Westmont, IL | ||
| MA35 Moisture Analyzer | Sartorius | ||
| Critical point dryer, Balzers CPD | Leica Microsysstems Inc, Buffalo Grove, IL, United States | ||
| Screw-top high pressure tubes | Ace Glass, Vineland, NJ | #8648-27 | |
| Screw-top high pressure tube plugs | Ace Glass, Vineland, NJ | #5845-47 |
参考文献
- Ralph, J., Grabber, J. H., Hatfield, R. D. Lignin-ferulate cross-links in grasses - Active incorporation of ferulate polysaccharide esters into ryegrass lignins. Carbohydrate research. , 275-178 (1995).
- Park, S. -. H. . Expediting cellulosic biofuels agenda: Production of high value-low volume co-products and lignin down-regulation of bioenergy crops [Ph.D. thesis]. , (2011).
- Boerjan, W., Ralph, J., Baucher, M. Lignin biosynthesis. Annual review of plant biology. 54, 519-546 (2003).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. Journal of the Royal Society, Interface / the Royal Society. 9, 2749-2766 (2012).
- Dien, B. S., et al. Enhancing alfalfa conversion efficiencies for sugar recovery and ethanol production by altering lignin composition. Bioresource technology. , 102-6486 (2011).
- Fu, C. X., et al. Downregulation of Cinnamyl Alcohol Dehydrogenase (CAD) Leads to Improved Saccharification Efficiency in Switchgrass. Bioenerg Res. 4, 153-164 (2011).
- Grabber, J. H., Ralph, J., Hatfield, R. D., Quideau, S. p-hydroxyphenyl, guaiacyl, and syringyl lignins have similar inhibitory effects on wall degradability. Journal of agricultural and food chemistry. 45, 2530-2532 (1997).
- Li, X., et al. Lignin monomer composition affects Arabidopsis cell-wall degradability after liquid hot water pretreatment. Biotechnology for biofuels. 3, (2010).
- Mansfield, S. D., Kang, K. Y., Chapple, C. Designed for deconstruction--poplar trees altered in cell wall lignification improve the efficacy of bioethanol production. The New phytologist. 194, 91-101 (2012).
- Studer, M. H., et al. Lignin content in natural Populus variants affects sugar release. Proceedings of the National Academy of Sciences of the United States of America. 108, 6300-6305 (2011).
- Chen, F., Dixon, R. A. Lignin modification improves fermentable sugar yields for biofuel production. Nature. 25, 759-761 (2007).
- Ziebell, A., et al. Increase in 4-coumaryl alcohol units during lignification in alfalfa (Medicago sativa) alters the extractability and molecular weight of lignin. The Journal of biological chemistry. 285, 38961-38968 (2010).
- Park, S. -. H., et al. The quest for alternatives to microbial cellulase mix production: corn stover-produced heterologous multi-cellulases readily deconstruct lignocellulosic biomass into fermentable sugars. Journal of Chemical Technolog., and Biotechnology. 86, 633-641 (2011).
- Mol, J. N., et al. Regulation of plant gene expression by antisense RNA. FEBS letters. 268, 427-430 (1990).
- Adamo, A., et al. Transgene-mediated cosuppression and RNA interference enhance germ-line apoptosis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 109, 3440-3445 (2012).
- Smith, N. A., et al. Total silencing by intron-spliced hairpin RNAs. Nature. 407, 319-320 (2000).
- Park, S. -. H., et al. Downregulation of Maize Cinnamoyl-Coenzyme A Reductase via RNA Interference Technology Causes Brown Midrib and Improves Ammonia Fiber Expansion-Pretreated Conversion into Fermentable Sugars for Biofuels. Crop Sci. 52, 2687-2701 (2012).
- Altpeter, F., et al. Particle bombardment and the genetic enhancement of crops: myths and realities. Mol Breeding. 15, 305-327 (2005).
- Pichon, M., Courbou, I., Beckert, M., Boudet, A. M., Grima-Pettenati, J. Cloning and characterization of two maize cDNAs encoding cinnamoyl-CoA reductase (CCR) and differential expression of the corresponding genes. Plant molecular biology. 38, 671-676 (1998).
- Mansoor, S., Amin, I., Hussain, M., Zafar, Y., Briddon, R. W. Engineering novel traits in plants through RNA interference. Trends in plant science. 11, 559-565 (2006).
- Hatfield, R. D., Jung, H. -. J. G., Ralph, J., Buxton, D. R., Weimer, P. J. A comparison of the insoluble residues produced by the Klason lignin and acid detergent lignin procedures. J Sci Food Agr. 65, 51-58 (1994).
- Sluiter, J. B., Ruiz, R. O., Scarlata, C. J., Sluiter, A. D., Templeton, D. W. Compositional analysis of lignocellulosic feedstocks. 1. Review and description of methods. Journal of agricultural and food chemistry. 58, 9043-9053 (2010).
- Sluiter, A., Hames, B., Ruiz, R., Scarlata, C., Sluiter, J., Templeton, D., Crocker, D. Determination of structural carbohydrates and lignin in biomass. Laboratory Analytic Procedure. , (2008).
- Bate, N. J., et al. Quantitative Relationship between Phenylalanine Ammonia-Lyase Levels and Phenylpropanoid Accumulation in Transgenic Tobacco Identifies a Rate-Determining Step in Natural Product Synthesis. Proceedings of the National Academy of Sciences of the United States of America. 91, 7608-7612 (1994).
- Hu, W. J., et al. Repression of lignin biosynthesis promotes cellulose accumulation and growth in transgenic trees. Nature. 17, 808-812 (1999).
- Lapierre, C., et al. Signatures of cinnamyl alcohol dehydrogenase deficiency in poplar lignins. Phytochemistry. 65, 313-321 (2004).
- Updegraff, D. M. Semimicro determination of cellulose in biological materials. Anal Biochem. 32, 420-424 (1969).
- Yemm, E. W., Willis, A. J. The estimation of carbohydrates in plant extracts by anthrone. The Biochemical journal. 57, 508-514 (1954).
- Filomena, A. P., Cherie, W., Geoffrey, B. F., Antony, B. Determining the polysaccharide composition of plant cell walls. Nature. 7, 1590-1607 (2012).
- Foster, C. E., Martin, T. M., Pauly, M. Comprehensive Compositional Analysis of Plant Cell Walls (Lignocellulosic biomass) Part II: Carbohydrates. J. Vis. Exp. (e1837), (2010).
- Department of Agronomy, Iowa State University. Particle bombardment of Hi II immature zygotic embryos and recovery of transgenic maize plants. , (2005).
- Cano-Delgado, A., Penfield, S., Smith, C., Catley, M., Bevan, M. Reduced cellulose synthesis invokes lignification and defense responses in Arabidopsis thaliana. The Plant journal : for cell and molecular biology. 34, 351-362 (2003).
- Boudet, A. M., Kajita, S., Grima-Pettenati, J., Goffner, D. Lignins and lignocellulosics: a better control of synthesis for new and improved uses. Trends in plant science. 8, 576-581 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。