Method Article
磁性镊子的扭曲和扭矩的测量
摘要
磁镊子,一个强大的单分子操纵技术,可以适用于扭曲的直接测量(使用一种称为自由轨磁镊子配置)和扭矩中的生物大分子(使用被称为磁转矩镊子的结构)。指引进行这种测量,给出了包括应用DNA和相关的核蛋白丝的研究。
摘要
单分子技术使得有可能研究在溶液中个体的生物分子的实时行为。这些技术包括所谓的力谱方法,如原子力显微镜,光镊,拉伸流动和磁性镊子。在这些方法中,磁镊已经由他们来施加扭矩,同时保持一个恒定的拉伸力的能力,证明自己。这里,它示出了如何这样的“传统的”磁镊子实验结构可以通过其外地配置一个简单的修改,以减少横向电场的幅度,适应于测量捻在生物分子的程度。由此产生的配置被称为自由地轨道磁性镊子。此外,它示出了如何在现场配置的进一步修饰可以产生一个横向场与幅值的&#之间的中间8220;常规的“磁镊子和自由轨道磁镊子,这使得它可以直接测量存储在生物分子上的扭矩。这种配置被称为磁转矩镊子。在详细介绍了如何传统的磁镊成可自由旋转的磁性镊子和磁力矩镊子的转换可以实现影随行解释,并演示了如何使用这些技术。这些适应维护传统的磁性镊子的所有优点,同时大大扩展了这个强大的工具的通用性。
引言
近年来,单分子技术已经证明了其广泛的适用性中的processive马达蛋白和其它酶的研究,得到洞察其动力学和底层的机械力。在力量光谱的背景下,重要的贡献已经由原子力显微镜流动拉伸,以及光学和磁镊。光学和磁镊(MT)已经明显成功地将分子操纵与高空间和时间分辨率方面很大的灵活性。在这里,我们专注于MT,它可以同时拉伸力和力矩适用于表面和超顺磁珠1-3之间拴生物分子。
磁镊子(MT, 图1a)是已被用于监测核酸的二者的机械性能,以及其与蛋白质相互作用的一个非常通用的单分子技术。 MT有很多实力秒,其中包括整体简洁性和鲁棒性实验实施,扭矩浅显的应用,自然运行和恒力模式4简单的校准,扩展并行测量5,6,和缺乏样品加热和光损伤。相对于其他单分子方法,MT提供了一种方法来执行力依赖于测量势力低至≈10 FN和有直截了当控制超螺旋的程度的能力。而微管已经主要被用作实验工具,调查涉及核酸7,8生物学过程,他们还发现应用中的蛋白质9-13或电池10,14-17的机械性能的研究。许多有用的参考资料,可描述如何构建和运行一个MT 4,18-20。
Howev呃常规MT不直接跟踪旋转运动,并且,尽管它们适用的扭矩,也不用直接测量扭矩。此外,它们限制了核酸连接臂的自由转动。在这里,我们提出磁铁镊子的两个扩展。第一,称为自由地绕磁镊子(FOMT, 图1b)21,使平衡角的波动和变化在拴系的核酸分子的扭曲的测量,而不约束围绕该系绳轴的旋转运动。第二,称为磁力矩镊子(MTT, 图1c),其有权申请和直接测量两个力和力矩,以单一生物分子22-27的能力。
在下面的协议,我们假设读者已经在他/她的性格一个'传统'MT仪器。我们建议读者在讨论关于如何构建和运行一个MT设置,以及参考conside必须考虑的磁珠,磁铁和跟踪例程的选择口粮。此外,第1和第2议定书文本描述如何我们通常准备和孵育在MT使用的DNA样本,以及一个可以在单个DNA在传统的MT来进行初步测量。该议定书文本的第3和图4说明了如何在MT仪器可以很容易地适应并用于名华和MTT测量。
研究方案
1制备的DNA样品和孵化
- 准备被连接到双工端(通常采用≈600 bp的DNA PCR片段),这些功能化的多生物素和地高辛组,分别为18 DNA结构。开始,一个DNA系绳长度> 1微米, 例如 ,一个7.9千碱基对应〜2.7微米的拉伸长度为这里采用,被推荐用于易用性;特别是,利用DNA长度是类似于或高于所述胎圈半径短是有问题的,由于在MTT和名华附件几何形状。请参阅讨论有关如何DNA的长度会影响响应时间在角域的描述。
- 装配流动池对单分子实验。为流动池,可以使用两片玻璃显微镜盖玻片由双层封口膜垫片隔开。顶显微镜的盖玻片应该有两个孔流体入口和出口的单元格。可以很方便地用喷砂来钻孔。底部的盖玻片上涂有硝酸纤维素(0.1%重量/体积的乙酸异戊酯)。将封口膜垫片底部幻灯片的硝化棉包覆侧,用干净的玻片顶部关闭顶部。
- 密封所述流动池。使用物理镊子,将组装的流动细胞上的加热板设定为80〜100℃下进行约1分钟。注意流通池密封良好,该封口膜不会关闭关闭该连接在和插座,且玻片完全一致的孔。
注:为了确保良好的密封,它是用一个大的棉签推荐行程出的封口膜气泡。流动池可以被安装在磁镊子仪器。 - 准备缓冲区。准备TE圈养缓冲液(10mM的Tris-HCl,pH值8.0,1mM的乙二胺四乙酸(EDTA)和200 mM氯化钠)。可替换地,可以使用PBS缓冲液(137 mM氯化钠,2.7 mM的氯化钾,10mM磷酸缓冲液,pH 7.4),补充瓦特第i个100微克/毫升BSA,0.1%吐温和5mM叠氮化钠(PBS +)作为束缚缓冲区。冲洗2-3细胞体积的TE缓冲液圈养进入流通池。
- 孵育0.5或1.5微米的半径的非磁性的乳胶珠中为〜30分钟的流动池。这些珠将在磁镊子测量,允许一个最小化漂移的目的和样品架( 即流动池)之间的效果作为参考珠。通过用TE缓冲液圈养2-3细胞体积冲洗冲洗出独立的非磁性珠。
- 通过温育与100μg/ ml的抗洋地黄毒苷的PBS中为至少1小时官能流动池的底表面(优选更长;孵育可过夜进行),以提供用于DNA附着。冲洗用的TE缓冲液圈养2-3细胞体积。最后孵育流动池用2毫克/毫升牛血清白蛋白(BSA)的TE缓冲圈养30分钟进行表面钝化。
- 采取的等分试样2毫升链亲和素包被的超顺铭扬珠(见讨论材料和表),并稀释用10ml TE缓冲液圈养。使用磁粉集中,重悬在10毫升的TE缓冲液圈养用10ml TE缓冲液圈养洗两次。附上约1毫升的DNA分子(约1毫微克)的这些珠孵育于TE缓冲圈养30分钟。
- 通过添加90毫升TE缓冲圈养稀释的DNA拴超顺磁珠10倍的溶液。最后,将溶液注入流动池并孵育约1小时,以允许DNA附着到抗地高辛包被的表面上。用TE缓冲液圈养彻底清洗流通池。该DNA连接臂构建体的温育后,用实验缓冲液冲洗广泛(这可以是TE圈养缓冲器),以除去所有非附着珠。
- 用于测量雇用的角跟踪协议,它需要附着在磁珠上基准标记珠 23(见讨论),培育流通池用的TE缓冲液圈养珠标记1000倍稀释股票至少30分钟,冲洗彻底的缓冲区。
2,在常规的磁性镊子对单个DNA分子的测量
- 使用传统的MT(见讨论)与相应字段的配置( 图1a)和两个平移和磁铁位置的旋转控制,搜索在流通池中旋转受限的DNA分子。在拉动≥1 PN力量(参考文献4,19,20,28,29关于力校准磁镊子),拴珠可以很容易地从珠中的焦点粘在底部滑动表面由他们不同的高度区分。是否一个DNA分子被旋转约束可以通过引入20-30轮流进行评估磁铁在≈0.25 PN的力S:在这里,系绳长度应为0.4-0.5微米的下降。
注意:要运行磁镊子实验中,图象处理被用于确定在x,y和z的DNA -拴系的珠子的位置。自定义的LabVIEW软件,为此可从应要求作者。- 验证珠子连接由一个单一的DNA系绳。这可以通过在正极和负极匝数为> 1的PN( 图2a)的力量比较的行为来完成。在这股力量的制度,多个系绳的DNA的存在将导致在引入后,正面和负面的转弯延伸约对称的减少,而单个DNA系绳将产生一个非对称的回应。
- 搜索相应的固定孔玻璃珠粘在底表面在感兴趣的系绳,可以作为参考珠的附近。
- 校准T的长度他的DNA,L。流动池表面的位置可以通过将接触系留珠与表面来确定( 例如 ,由60〜轮流低于0.2 PN力旋转磁铁)。的系留式磁珠的相对于该表面的垂直位置的测量然后报告上升的绝对值。
注意:为尽量减少漂移的后续影响,建议进行升相对的测量基准珠固定到表面的位置。 - 记录一个旋转曲线(该DNA扩展作为匝数的函数, 即测量)为≈0.25 PN( 图2a)的拉伸力。
- 确定的圈数在该扩展是最大,因为此相对应的状态在其中DNA分子是扭转放松。要做到这一点,与抛物线或高斯函数来确定中心positi适合本地的旋转曲线是很有用的上。定义这个点为“零转弯”。
注意:用于此目的的自定义编写的例程可从应要求作者。
- 确定的圈数在该扩展是最大,因为此相对应的状态在其中DNA分子是扭转放松。要做到这一点,与抛物线或高斯函数来确定中心positi适合本地的旋转曲线是很有用的上。定义这个点为“零转弯”。
- 对于一系列〜20磁铁的位置,决定了扭转,轻松分子的平均延伸( 即 “零转弯”,见步骤2.4.1)从z痕迹。
- 在步骤2.5各测量点,精确地确定从在 x或y的位置20,28,29中的波动的拉伸力,或者,设置在胎圈的磁化是众所周知的,使用局部磁场梯度4的知识。绘制的拉伸力与在力-伸展率曲线的平均延伸的结果( 图2b)。
- 配合所产生的力-延伸数据使用多项式逼近布夏等 30蠕虫状链方程。
- 如果准备以后FOMT测量,缓慢旋转的磁铁,而在录音(X,Y)的磁珠的短途旅行。
注意:得到的环状空间中的常规MT配置的半径越小,越紧密的DNA分子拴接近于“南极”的磁珠。当一个切换到FOMT配置,例如一个DNA分子会密切拴在“赤道”磁珠的,它使旋转角的可靠跟踪从(X,Y)的位置(见讨论)。
扭曲的DNA 3,测量使用的自由轨道磁性镊子
- 通过一个用于FOMT( 图1b)的圆筒形磁体手动替换正方形磁体的以往的磁镊子。此操作应以这样的方式所选择的DNA连接臂保持在视野内来进行。
- 这可以通过简单地拧下完成磁铁头部持有磁体的常规镊子配置和被磁铁头部持有的圆筒形磁铁,FOMT替换它来完成,在不到1分钟。
- 磁珠由一个单一的dsDNA系绳拴在(X,Y)的偏移就相对于所述圆筒形磁体( 图1b,图3a)的轴线系绳的位置强烈地依赖。记录的(X,Y)偏移,以便确定特征波动模式中的相应位置( 图3a, 讨论)。
- 执行中的磁体名华的粗对准。这可以通过使用(X,Y)平移台移动的圆筒形磁体的流动池上面来实现。如果(x,y)的偏移遵循的弧形,圆柱形磁铁没有正确对齐和需要移动在适当的方向( 图3b)。
- 粗对准可以在15分钟内完成对铭扬珠7.9 kbp的系绳的情况下,和完成时的(X,Y)偏移的结果,在观察圆周运动( 图3b,中心)的测定。
注:粗定位通常是足够的观察结合到单一的DNA拴在名华配置由蛋白质而引起的变化,扭转21,31(代表结果, 图5),尽管随行的二维直方图可能没有它的计数绝对均匀地沿着圆形环( 图3c)分布。
- 粗对准可以在15分钟内完成对铭扬珠7.9 kbp的系绳的情况下,和完成时的(X,Y)偏移的结果,在观察圆周运动( 图3b,中心)的测定。
- 如果需要进一步的实验中,名华进行精细定位。这可以通过使用高分辨率微米螺丝或高分辨率自动阶段来移动磁体或流动池,以百分之实现呃圆柱形磁铁到胎圈到内〜10微米。在精对准阶段,磁铁仔细定位,使得在圆环形的波动几乎是均匀的,对应的情况下的能量势垒,以完整的旋转,由于磁铁为k(B T)( 图4)。
注:一个MATLAB脚本在绘制直方图或热谱图的波动, 如图4可从应要求作者。
注:精细定位可以在45分钟内完成对铭扬珠7.9 KBP系绳的情况下,并在较小的珠子和系绳较短时间周期减少雇用(见讨论)。
注:精对准,通常需要进行裸或蛋白包被的DNA的扭转刚度的测量(代表结果, 图4)。 - 如果需要进行分析,校准的名华力。此,可以进行我呐以类似于MT,使用任一胎圈的2>(其中,尖括号表示的时间平均值)中所示的附带视频和Lipfert 等[21]详细,或者,设置在胎圈的径向磁化的波动非常知的,使用本地磁场梯度21的知识。
4,DNA扭矩的使用磁力矩测量镊子
- 手动替换是由一个圆筒形磁体加上一个侧面(永久)磁铁的MTT( 图1c)用于FOMT的圆筒形磁体。此操作应以这样的方式所选择的DNA连接臂保持在视野内来进行。
- 最简单的方法来实现这一目标是手动添加的侧磁铁在其适当的位置,它可以在1分钟内完成。没有进一步的调整是必要的。
注意:一个替代的侧磁铁是利用的电磁铁32。
- 最简单的方法来实现这一目标是手动添加的侧磁铁在其适当的位置,它可以在1分钟内完成。没有进一步的调整是必要的。
- 如果需要进行分析,校准类似的方式将力向MT,使用任一胎圈的x或y的波动,或者提供在胎圈的磁化是众所周知的,使用局部磁场梯度21的知识。
- 跟踪角速度波动使用无论是基于基准的跟踪协议,或23所示,影随行,根据监测(X,Y)的位置(见讨论)的角跟踪协议的时间θ(t)的函数。在前者的情况下,记录珠的完整图像作为时间用于随后的图像处理的功能。在后一种情况下,它足以在该步骤中,记录在胎圈的(X,Y)的波动。
注意:MATLAB脚本从珠作为时间的基准为基础的协议跟踪功能的全面图像确定θ(t)是根据要求从作者演示。- 正如在讨论中所述,基于监测(X,Y)的位置,也是可取的记录时间轨迹,其中磁铁慢(通常在0.1赫兹)几圈旋转角跟踪协议。这将允许一个精确地转换笛卡尔坐标(x,y)变换为极坐标(r,θ)的使用讨论的方程3-5。
注意:MATLAB脚本的基础上监测(X,Y)的位置可从应要求作者角跟踪脚本。
注意:测量时间主要取决于所要求的转矩的分辨率。详细参数给出Lipfert 等[24]。对于铭扬珠和8 kbp的DNA的系绳,测量为30-100秒,应足以得到在1〜PN·20nm范围内的扭矩的分辨率。
- 正如在讨论中所述,基于监测(X,Y)的位置,也是可取的记录时间轨迹,其中磁铁慢(通常在0.1赫兹)几圈旋转角跟踪协议。这将允许一个精确地转换笛卡尔坐标(x,y)变换为极坐标(r,θ)的使用讨论的方程3-5。
- 确定扭转陷阱,从日刚度角波动电子用方差(σθ2,以弧度为单位):
K表θ= K(B T)/σθ2(1)
注:在MTT法实现典型的旋转陷阱刚度是在10-1000 PN·纳米/弧度,比传统的磁镊较低的范围内。 - 此外,记录珠的z位置,并以此来确定系绳长度 l(参见步骤2.4-2.7)。
- 旋转N匝并重新录制θ(t)和L(T)。
注意:MTT的还原旋转阱刚度相比MT使得它适合的单分子扭矩测量,但意味着能够施加的最大扭矩减小。这意味着,MTT可能无法抗衡引起的快速旋转高阻力扭矩。因此必须要注意不要超过最大速度;吨ypically旋转速率接近0.1赫兹。 - 确定在核酸系绳积累的扭矩N匝使用后:
Γ= -钾θ<θ北 - θ0>(2)
其中<...>表示平均和θ0,θN的角度为零匝(对应于扭转宽松系绳,参见步骤2.3和N匝 ,分别。 - 重复,以充分确定一个单一的测量运行一个分子的转矩响应(代表结果, 图6)步骤4.5和4.6需要。
结果
从MT( 图1a)代表性的结果示于图2。图2a示出了用于一个7.9 kb的DNA在F取= 0.25,0.5和2.0 PN旋转延伸曲线。单个DNA旋转的响应应该在最低的力(0.25 PN)是对称的,用该DNA作为减小的正或负plectonemic超螺旋的形成而产生的扩展名。这种反应的定性知识是有用的,当开始寻找一个旋转约束的DNA系绳(步骤2.1)。注意,该系绳的额外检查是必需的,以确认它由一个单一的DNA分子:在这里,一个单独的DNA在力超过0.5 PN对于旋转非对称响应,有助于从多个的DNA(步骤2.1.1)区分开来。一旦这个已经证实,其中一个返回到0.25 PN旋转反应,以确定磁体的确切数目轮流在其中的单个DNA我š扭转宽松,其中一个需要力-延伸曲线,这应该类似于图2 B。对于这个特殊的测量,一个合适的数据到蠕虫状链模型(实线)产生了一个拟合外形长度L C = 2.71微米和弯曲持效期长L P = 45纳米。对于双链DNA,持续长度的拟合值应在范围40-55纳米,这取决于缓冲液条件33,拟合轮廓的长度应该接近(通常在10%以内)向预期的DNA构建体的值,该值用于在测量时,使用下面的关系微升DNA = 0.34纳米/沸点·碱基对的数目。
图3示出的程序和对应的结果在名华( 图1b)。记录在步骤3.2的初始(X,Y)的偏差可以被比作波动作为函数澳的整体视图f中图3a,其显示了可用于指导在名华保持的磁铁和DNA拴珠之间随后的相对位移一个“旋涡”的图案中所示的横向磁铁的位置。当随后的粗对准完成后,磁珠的(X,Y)的波动描绘出一圆形轨迹,如也由黑色迹图3b所示。在这一点上,从绕z轴的磁铁的转矩减小到如此地步,热波动足以胎圈绕其连接点。所得到的圆环形(圆拟合以红色显示)的半径R的圆表示的DNA的附着点和胎圈的中心( 图1b)之间的径向距离。 如图3c所示 ,但是,在图3b中的数据的直方图显示,粗对准并不能保证均匀覆盖沿着环形,所有可能的位置。即使热波动足以探索圆上的所有旋转角度,仍然存在一个小的能量势垒(热能量K(B T)的顺序)以自由旋转。
当精细对准是在该名华(步骤3.4),该仪器可用于测定DNA的( 图4)的扭转模量。首先,将样品的精细对准是用来获取圆周运动( 图4a),其二维直方图现在应( 图4b)示出均匀的覆盖。角波动(从转换的(X,Y)的位置而获得,见下文)的相应时间跟踪Q(t)的显示没有周期性对应于360˚( 图4c),并揭示了相应的数圈,大型游览( 图4D)。隐含的能源格局谐波是在一个范围> 1,000˚( 图4e)。波动的标准偏差σθ= 223°时,对应于k的角阱刚度θ= K(B T)/σθ2 = 0.27 PN·纳米/弧度,从而使有效的扭转持续长度的估计值的DNA等于C = L C /σθ2〜76纳米(L C = 1,150纳米的这种测量所使用的3.4千碱基的DNA)在测量的力。
的名华如何能够被用于测量通过蛋白31的结合诱导成拴系的DNA分子中的扭曲的变化的例子,34是如图5所示,在这里,我们监测RAD51蛋白加倍的结合链DNA; RAD51都是已知的加长和放松DNA作为其形成核蛋白丝31。后冲洗RAD51进入流动池,我们观察到胎边经受在名华( 图5a)一个螺旋形的轨迹。如上所述,通过转换的(X,Y)的运动迹线作为时间到q(t)的函数,我们可以合作地积是RAD51对DNA的连接臂长度和退绕其程度的影响( 图5b,三) 。
一种替代的方法来测定DNA的扭转特性是MTT( 图1c,图6)。在图6a中的示意性示出了测量的原理:过卷后(或底卷绕)由N的DNA连接臂转动时,该DNA施加一个复原扭矩,导致在平衡的角位置的偏移从θ0至θn中珠上。在MTT磁场的横向分量相比,MT,这有利于这样的角位移的测量,同时仍允许胎圈转动( 图1)减小。施加N = 45之后测量的角位移的幅度变为7.9 kbp的DNA示于图6b。 MTT法测量协议,将所得的扭矩与DNA的旋转曲线的结果的完整序列示于图6c-F。这里,角坐标的标准偏差( 图6c)和平均(图6d)的测量结果被示为过压和底卷绕的函数,与标准偏差成反比的角度阱刚度(等式1)。两者合计,这些量允许一个构造转矩与DNA的旋转曲线( 图6F),其应该显示的线性响应区域为中心的约0变为一个第二两个平台在该转矩饱和,在正和负旋转,分别。这样的扭矩与旋转曲线补充了一个扩展与旋转曲线( 图6e)的信息,从而量化伴随DNA的屈曲和变性的转换。
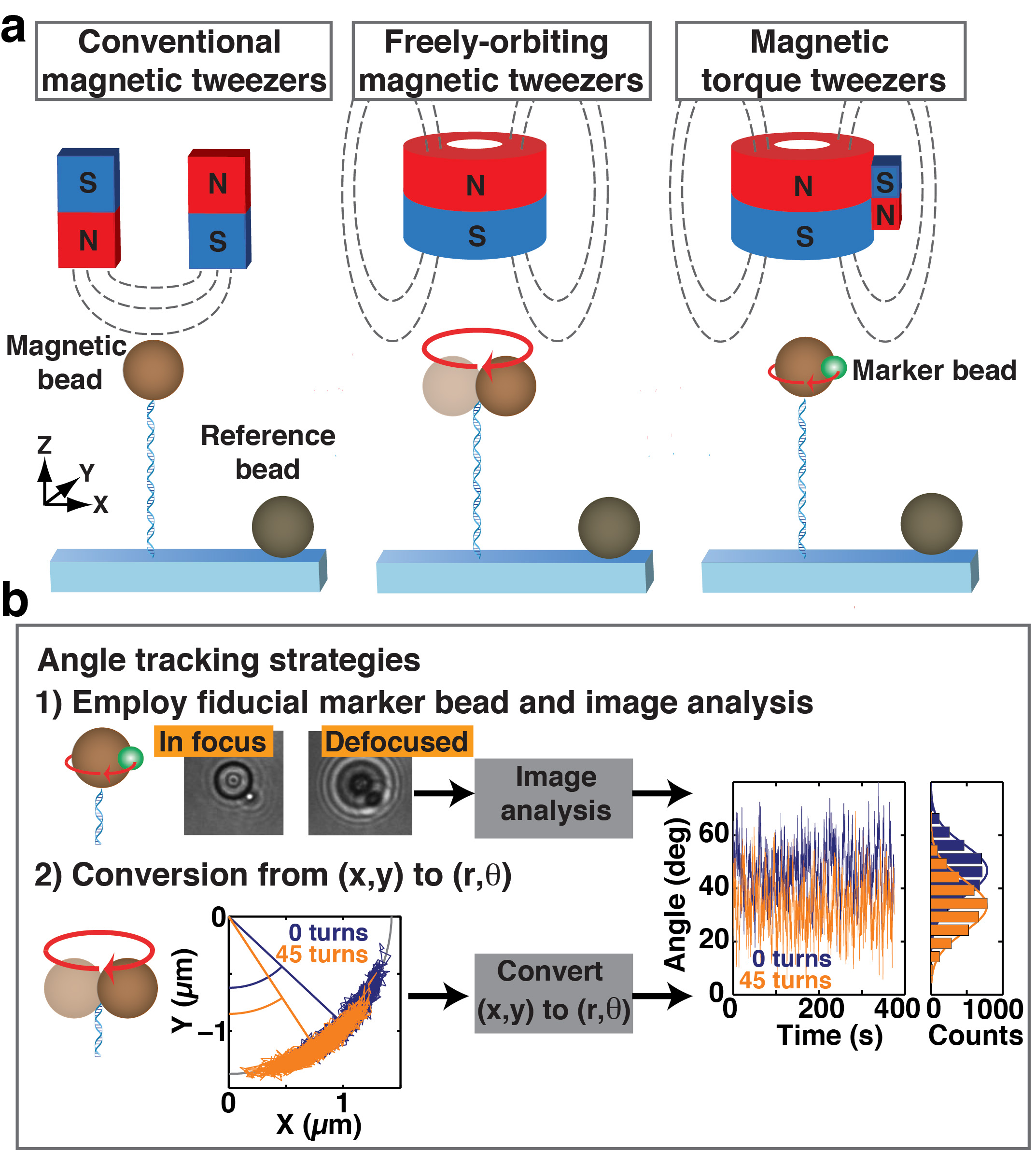
图1常规磁镊子的原理图(吨),可自由回转磁镊子(FOMT),磁转矩镊子(MTT),以及用于跟踪转角两种策略。 (a)在磁镊子的所有三个实施方案中,磁珠被官能化的大分子拴在流动池表面, 如示意性地示出的双链DNA分子。参考珠附着到流动池表面和跟踪的DRIFT校。所有三个MT的调校采用磁铁施加一个向上的拉伸力在磁珠上,因此,DNA的系绳。在常规的MT,一对磁铁,施加一磁场,该磁场被定向横向相对于连接臂轴,紧紧地限制在胎圈的旋转围绕所述DNA连接臂轴。在名华,圆筒形磁铁提供一个磁场,该磁场沿系绳方向取向。当系绳是相一致的圆柱状的磁铁的中心,任何剩余的横向字段被最小化,从而允许关于该系绳轴以MTT自由转动,一个侧磁体被加入到用于在名华,以提供圆柱形状的磁铁一个小的横向场(降低的幅度相比吨)。这个小的横向场使扭矩的应用,以及作为其测量(B)两种策略来测量关于该DNA连接臂轴磁珠的旋转角度被示出。 1):标记珠(格力n)的附着在磁珠(棕色)给出了一个非对称的图像,使角跟踪通过想象分析。一个1.4微米的半径磁珠用0.5微米的半径基准标记的两个CCD图像示,在聚焦和失焦。 2):当DNA是拴到磁珠的位置处远离所述胎圈的南极,胎圈的中心波动沿着弧形,其中心限定的角位置。任何一个策略可以被用来跟踪的旋转角度,并监测位移的角度位置作为系绳扭转应变(右侧曲线),从而使单分子扭矩测量。

图2的DNA校准测量在传统的MT(a)就在F = 0所取的7.9 kb的DNA旋转延伸曲线0.25,0.5,和2.0 PN。下旋转到单双链DNA系绳的正和负匝的非对称响应,可作为该连接臂连接的一个方便的测试。一个7.9 kb的DNA(B)力-伸展率曲线,具有一个配合到一起虫像链模型(实线),产生一个拟合外形长度L C = 2.71微米和弯曲持效期长L P = 45纳米。所有测量均在PBS缓冲液中进行。
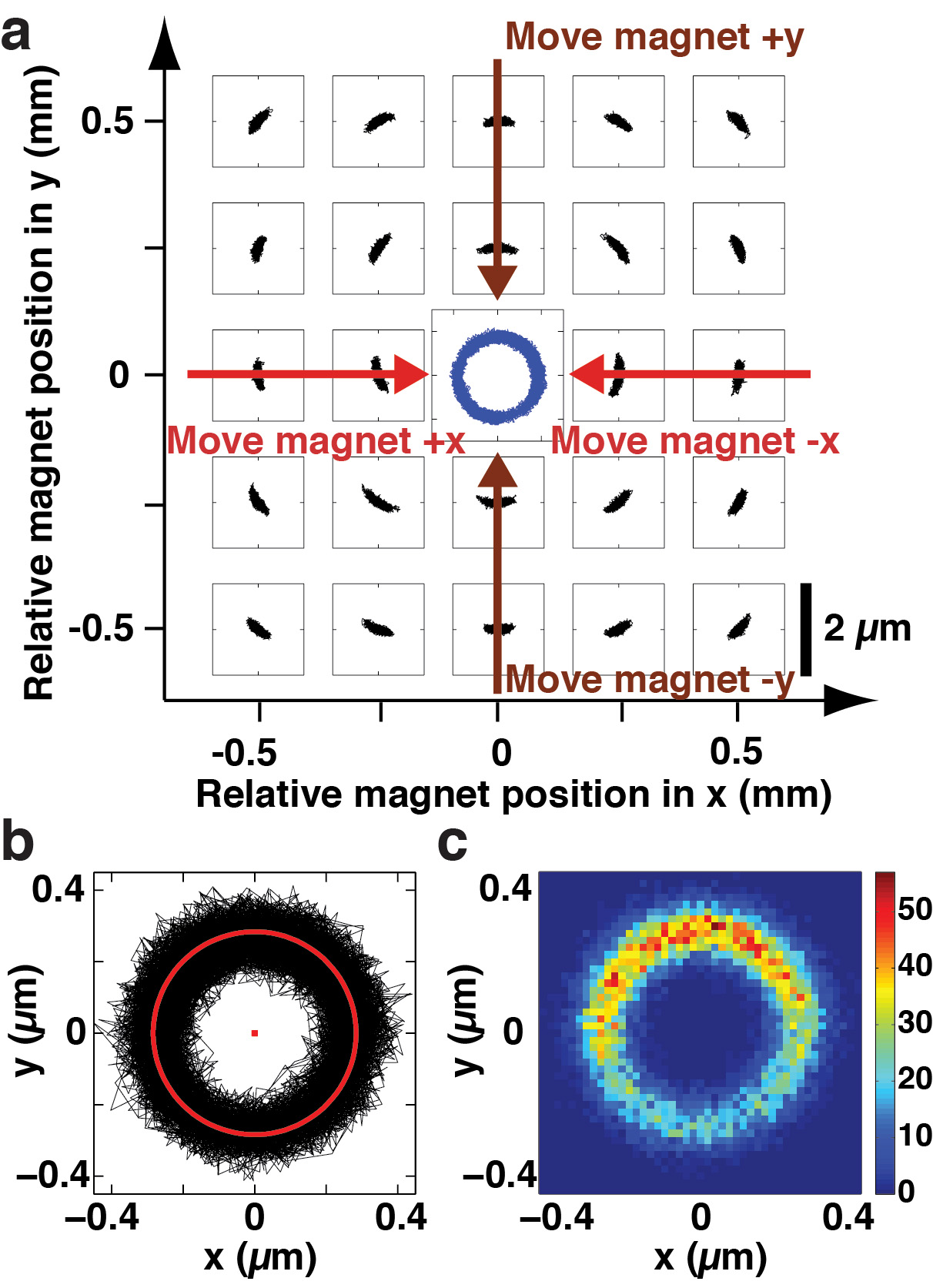
图3。对齐的名华。 (一)(X,Y)作为磁铁位置的函数的名华持有DNA拴珠的波动。圆筒形磁铁的位置进行扫描时为3毫米穿过流动池表面上的恒定高度在步骤250微米的x和 y和标示于外的情节轴。在每个(X,Y)的磁铁的位置,相同的DNA拴珠的波动被记录和被绘制在小的坐标系(在右下角的比例尺条适用于所有子坐标系统)。磁珠的(X,Y)与磁铁的位置类似一个气旋或涡流波动模式的系统的变型是显而易见的。这个“涡流”的图案,可用于引导所述磁体的位移(或可替代地,系绳,同时保持磁铁固定)在x和y(由大箭头所示)来实现对准。当粗定位完成后,磁珠的(X,Y)的波动描绘出一个圆形轨迹(蓝色线在情节的中心)。此跟踪是在对准围绕中心较小的步骤磁铁,并列作说明在这个情节之后记录在另一项实验中,(B)(X,Y)的波动在T举办的DNA拴珠他的磁铁(黑色曲线)的成功的粗定位后,名华。波动躺在一个圆形的环比和热波动足以探索角圆上的所有旋转。一个安装的圆圈显示为红色。(三)直方图对应于(B)中的数据,显示出粗对准不保证沿环形,所有可能的位置的均匀覆盖。即使热波动足以探索圆上的所有旋转角度,仍然存在的能量势垒(对热能量K(B T)的顺序)以自由旋转。
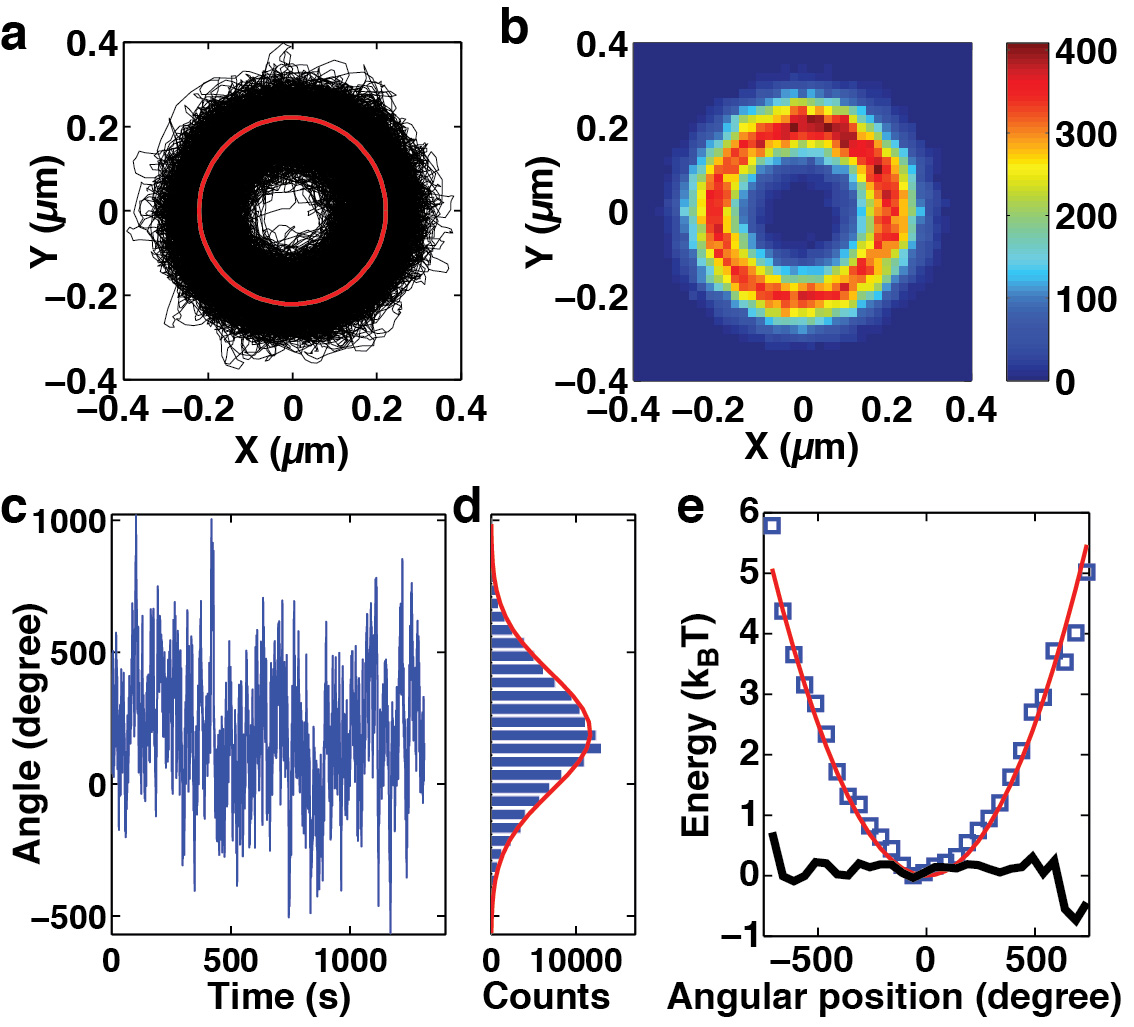
图4:使用名华的DNA扭转刚度的测量。(X,Y)的轨迹(a)和直方图(b)的DNA的特提斯在名华的相对磁绳位置进行精细定位后那些ered珠的波动。在这种情况下,直方图显示圆上的位置基本上是均匀的覆盖。(三)从旋转的(X,Y)的位置。(四)旋转波动的直方图确定的珠的波动。红线是高斯拟合与σθ= 223°。(五)能源格局由(c)该旋转波动密度及(d)暗示。的能量景观的旋转波动和隐含的谐波近似(其中kθ= K(B T)/σθ2 = 0.27 pN-nm/rad)之间的差比热能量K(B T)超过几圈小得多。数据偏移的清晰度,使得θ0 = 0。的宽度的波动,可用于测定DNA的扭转刚度,见正文。该测定是在PBS缓冲液中的1〜PN的拉伸力。数据是改编自Lipfert 等[21]。

图5。RAD51蛋白与DNA的结合使用FOMT测定。 (一)RAD51蛋白装配到一个拴7.9 kbp的双链DNA在3.5 PN监控。在(X,Y,Z)的第200秒的装配过程中由磁性珠(直径1.0毫米)执行弹道所示,随着时间的颜色编码的从蓝色到红色(b)该双链DNA的延伸推导从胎圈的轨迹(a)中作为时间的函数(c)约推导出的双链DNA连接臂轴的旋转角的z分量从X中,胎圈的轨迹(a)中作为时间的函数的y分量。
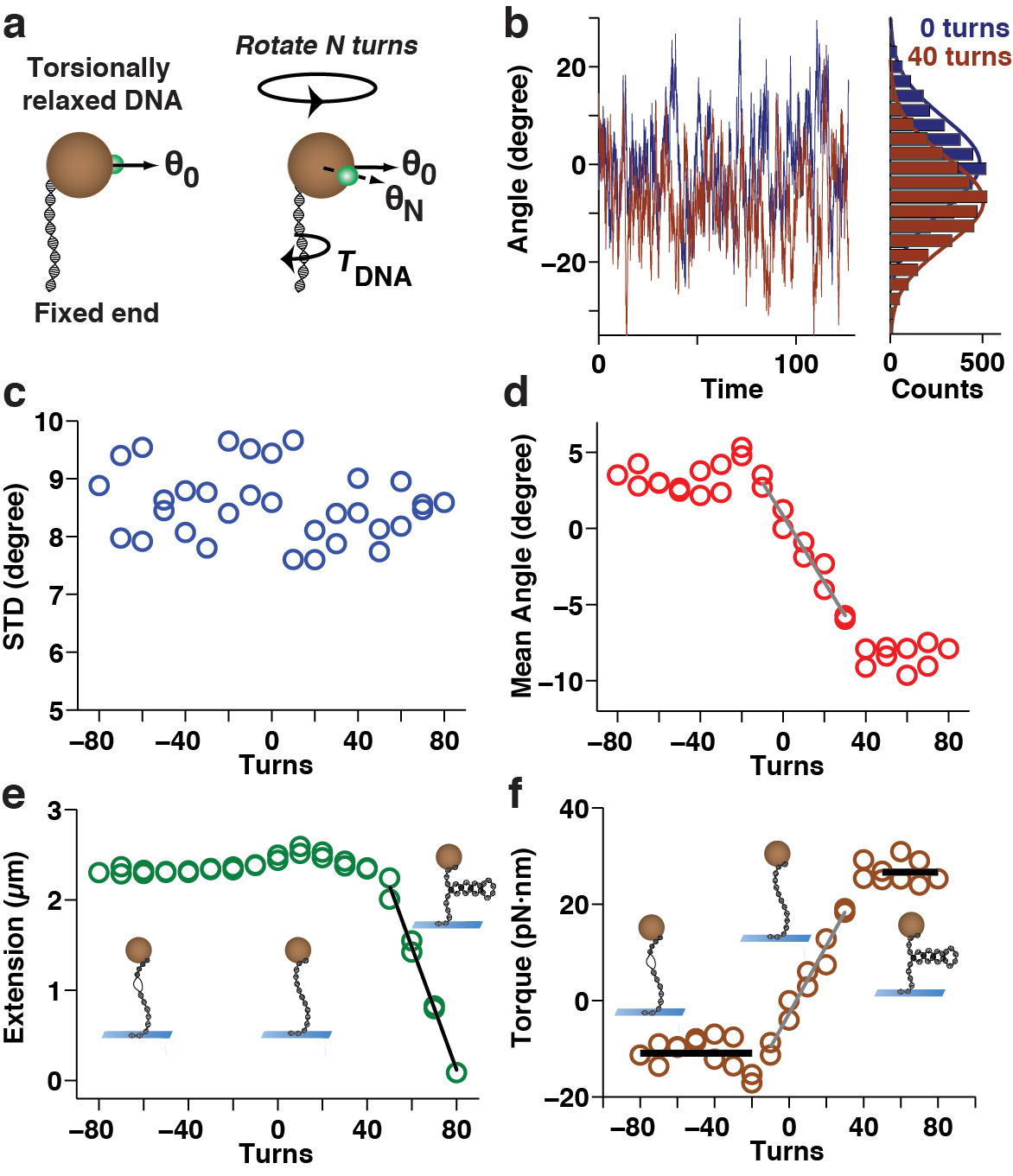
图6。扭矩测量上的MTT单个DNA系绳(一)示意图示出了转矩测量的原理。后过度(或不足)绕组由N的DNA连接臂转动时,施加的DNA,导致在平衡角度位置的转变,从θ0至θn中珠上的复原扭矩。的使用角度的痕迹(b)将实例来测量转矩:前(蓝色),并引入40匝(暗红色)后拴在扭转宽松7.9 kbp的DNA分子的珠的角度波动(参考)扭矩在PBS缓冲液中的7.9 kbp的DNA分子上的一个ST保持测量使用基准标记珠基于角跟踪协议的干呕〜3 PN力。角速度的波动,如图(b)记为施加匝数的函数。(c)该角波动的标准偏差作为施加匝的函数。波动的宽度近似为常数,这表明恒定角速度陷硬度(D)中的平均旋转角的移应用于匝的函数。在过压和底卷绕的平均角的系统的变化是明显的(e)本同时监测DNA连接臂延伸而适用匝的函数(f)在从(d)中所示的平均角度所确定的DNA的连接臂所施加的扭矩,见正文。过并围绕零底卷绕匝数产生了一个线性扭矩与原来的DNA的连接臂(装灰斜坡离子(d)和(f)项),可以用来确定有效扭转持续长度的响应(〜77纳米的这组数据)。进一步过卷导致屈曲和形成plectonemic超螺旋(在插图示意性地示出),对应于(在〜26 PN·nm的黑线,正转中(F))的扭矩高原和系绳延伸与数的线性减少圈(黑色坡(e)条)。开卷超出线性状态引起的DNA到局部熔化(在左边的插图示出),带标记的扭矩高原等于熔化转矩(黑线,负匝(f)中于-11〜PN·纳米)。
讨论
当运行使用MTT或名华实验,需要一些选择,作出关于珠,磁铁,跟踪协议等作出最好的选择将取决于感兴趣的实验。下面,我们描述的权衡,伴随着不同的选择,这应有助于选择一个特定的实验。接下来,我们描述伴随的MTT和名华实验路线和运行的几个关键步骤。最后,我们讨论的MTT和名华的意义就现有的方法,以及未来的应用。
注意事项在此之前的MTT和名华实验开始
任何实验都需要一个人选择使用一种类型的磁珠。一个可以多种市售streptavidin包被的超顺磁性珠, 如 0.25微米半径珠,0.5微米半径珠,或1.4微米半径珠(秒之间选择ee值的材料表)。较大的珠将具有增加的磁矩相比小珠(大致比例为体积),因此它们的使用将促进更高力量的应用程序(在我们的工具来实现典型的力量, 见表1)。当使用标记珠角跟踪需要,我们通常用1.4微米的半径,并使用0.5微米半径的非磁性生物素化微珠作为标记珠(参见相应的附件协议第1.9段)。使用更小的珠子特别推荐的名华,作为珠旋转τ的特征时间尺度C等于系统的拖过其弹簧常数γ/ Kθ的比例;重要的是,相关的角度测量的时间尺度为尺度R〜3 圈 , 即与半径的三次方(旋转阻力系数见表2的特征时间尺度为几个名华珠的DNA组合和MTT法测量)。中的最大的力的减少伴随的可应用可以通过使用圆筒形磁铁27的翻转堆叠来解决。尽管如此,在FOMT测量它有时可能需要达到的最佳的时间分辨率和最大施加的力之间的妥协。
此外,实验需要的磁体配置的选择。在传统的磁镊子结构( 图1a),我们通常使用对5×5×毫米立方体磁铁在垂直方向与磁铁4之间的0.5或1毫米的间隙。当磁体被沿x(y)轴间隔开,这会产生一个磁场,该磁场主要是沿着x(y)轴定向。为FOMT实验,一个圆筒形磁体被选择在其中心的磁场主要是针对沿z轴方向 ( 图1b)。在实践中,我们使用了一叠三个这样的圆筒形磁体,每一个直径为6毫米和2毫米的直径的中心孔,为6毫米的总厚度。当更高的拉力是理想的,其中底磁铁层叠具有相反磁化了“翻转栈”磁铁的配置是优选的。实现了MTT配置( 图1c)中 ,我们添加一个额外的磁铁对FOMT配置,典型地具有4毫米直径7mm的高度实心圆柱体的主磁铁层叠体的侧面。要查看我们的仪器达到的最大力量是如何依赖于磁体结构, 见表1。
的MTT和名华实验对齐
由于磁珠有一个(约)均匀功能化表面(通常为链霉),并因为这两个官能n的附件ucleic酸系绳和标记珠粒的情况下(标记基于珠子的角度跟踪采用)发生时通过在溶液中简单孵育,1不控制,其中所述连接臂和/或标记珠附着在磁珠。磁珠有一个优选的磁化轴趋向于沿外磁场方向排列。如果表示其中优选的磁化轴相交胎边的表面为北极和南极的点,然后,其中所述DNA-系绳附接靠近赤道珠将描绘出的圆形环状空间,其半径接近或稍比大珠半径的名华;与此相反,那些附着接近南极珠会有波动,在一个圆形的环空中的名华半径很小,可以排除使用拟合方程3-5圈。我们注意到,通过简单的球形的几何形状,在赤道附近附着的概率比附件恰好在两极大得多;因此,第二个白EADS将拴,使得(X,Y)的基于角跟踪可以成功地进行。
类似的说法持有的标记珠附件为基准基于标记的角跟踪。标记珠被用来创建磁珠,使角跟踪的图像中的不对称。如果标记珠的珠( 即直接在顶部或底部)的北极或南极正好连接,生成的图像仍然是旋转对称和角跟踪协议失败。然而,由相同的球面几何参数为一个标记珠直接连接在两极之一的机会相对较小;我们发现,在实践中大多数标记珠给予足够的不对称性,使角跟踪。最后,我们注意到,在传统的磁镊子的磁场方向是在(X,Y)平面内;因此,胎圈的优选磁化轴将在第对齐E(X,Y)平面和南北两极,如上述定义,将要在珠两侧,不太可能在名华或MTT法,那里的极点在顶部和底部的情况。
在FOMT实验中,一个关键的步骤是在圆筒形磁体,使得所述径向磁场可忽略不计在接近胎圈的对准。此对齐是在一个时间执行用于单个珠子。判断在名华珠议案是否均匀分布在一个圆形的环,测量时间应超过20·τÇ。为τC等于〜45秒,8 kbp的DNA和0.5mm的半径珠,测量时间为〜900秒,以对准的最后阶段。为了进行比较,使用1.9千碱基的DNA和0.25 mm的半径珠减少τÇ20倍至〜2秒( 参见表2)。
关键步骤和注意事项跟踪在FOMT和MTT实验
跟踪圈的平面内波动, 即它的(X,Y)位置,我们使用的,通过用珠显示的强度分布的互相关分析在随后的时间间隔35,36。这可以进行以子像素分辨率来为几纳米20的精度。以跟踪在 Z磁珠的运动,我们通常使用的方法首先通过高斯和炸肉饼设计,其中物镜的焦平面(OFP)被准确地转移在垂直方向上,而成像附着在核酸20中的胎圈的衍射环。在这种方式中,校准轮廓产生关联珠的衍射图案,以在胎圈和OFP 19之间的距离。当这个校准轮廓被插值,在胎圈的垂直位移也可以测量具有高达几毫微米20的精度。我们建议读者参考描述更精确的跟踪算法37,38以及它们的应用程序到并行的多个珠子5,6,37跟踪的其他引用。
当采用了棱角分明的跟踪,依靠的(X,Y)的位置为角坐标的转换,我们建议进行如下操作。从时间轨迹中珠描绘出一个圆形的环,用(X I,Y I)位置(其中索引i表示后续计量点),以适应圆心(X 0,Y 0),半径为r 圆 ( 图2a)通过最小化:
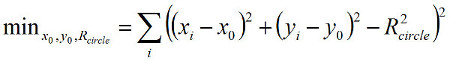 (3)
(3)
其中求和是对所有数据点。菲比后纳克X 0,Y 0,且R 圆 ,确定在使用时间跟踪每个数据点的极坐标(R I,θI):
 (4)
(4)
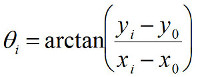 (5)
(5)
需要注意的是应该照顾到“解包”的角度θ,即增加±相位跳变π(如适用)。为配合和转换,从(X,Y)至(r,θ)坐标的自定义编写的代码可从应要求作者。在名华,时间跟踪,其中所述胎圈描绘出一个环形,可以通过实现粗对准(参见步骤3.3)和记录道的热波动来获得。在MTT法,热fluctuations都不足以描绘出圆形环;相反,使用由几圈旋转的时间轨迹,其中磁铁慢(通常在0.1赫兹)利用方程3-5,以适应循环。
我们注意到,对于MTT法,它选择合适的角跟踪方法,通过角跟踪标记( 图1c,图1d,图3a)或通过的(X,Y)的位置为角坐标的转换,即是很重要的( 图1d,图2b)。而通常的角跟踪从(X,Y)的位置和使用的标记珠的精度相媲美,它认识到,串扰发生在(X,Y)和角珠的波动之间,如描述是很重要的扬森等人 32:因此,从(X,Y)的位置角跟踪是唯一有效的规定,在(x中的布朗波动,y)的贡献可以忽略不计的不确定性中的角坐标,它的正确使用(X,Y)的跟踪可以通过调整侧磁铁的位置都需要旋转陷阱刚度的调整。通常情况下,使用更高的陷阱刚度需要使用标记珠的使用角度跟踪。使用标记珠粒需要额外的附着步骤,这可能会减少可用的连接臂的数量(参见步骤1.9的附件协议)。当使用标记基于珠子的跟踪,它选择磁珠其中有一个标记珠附着在赤道附近以获得最佳效果是重要的。
该名华和MTT意义的方法相比,以现有的方法和应用
在上文中,我们已经展示了如何可以,从传统的MT起,轻松修改磁铁配置,仪器转换成MTT法或名华。这个简单的米odification,这可能伴随着引入时使用的角跟踪标记是期望的角跟踪的,是这两种配置的直接优点,因为它允许用户施加扭矩,扭矩测量,或测量捻取决于实验在眼前。正如引言中所述,无论是名华和MTT受益很多MT的现有优势,特别是其简单,用MTT法还特别受益于平行测量5,能力6(这些都不是在名华那样容易实现给定的系绳的取向相对于所述圆筒形磁体的中心的要求)。值得注意的是,MTT和名华并不需要与其他技术,特别是纳米颗粒的制备22,39,40,复杂的光学设计41,或引入额外珠内栓(脱氧核糖核酸)分子42的对比。这种Ø热敏技术仍然可以提供其他优点,例如,更高的时间分辨率27 43,44。既名华和MTT应该发现在基因组中处理的研究未来的应用,如在DNA分子马达的行为都受与具有本地捻和扭矩的后果。其他应用程序可以在DNA纳米技术27新兴领域或活跃在生物处理7,45旋转电机的更广泛的领域中找到。
| M270(R 珠 = 1.4微米) | 铭扬(R 珠 = 0.5微米) | Ademtech(R 珠 = 0.25微米) | |
| 常规MT(双立方5×5×5毫米3磁铁1毫米的间隙,垂直排列) | 70 PN | 8 PN | 1.6 PN |
| 名华或MTT *(堆栈的三个圆柱形磁铁,直径6毫米,直径为2毫米的间隙) | 9 PN | 1 PN | 0.2 PN |
| 名华或MTT *(堆栈的三个圆柱形磁铁,直径6毫米,直径1毫米的间隙) | 18 PN | 2 PN | 0.4 PN |
| 名华或MTT *(三个圆柱形磁铁与最后一个堆栈翻转,直径1毫米的间隙) | 〜50 PN | 9 PN | 1.8 PN |
*在MTT细长的磁铁的存在对拉伸力的影响可以忽略
表1。最大的力量通常实现为不同的磁铁配置和珠类型。
| ř 珠 = 1.4微米 | ř 珠 = 0.5微米 | ř 珠 =0.25微米 | |
| 摩擦系数* | 120 PN·纳米·秒 | 5.5 PN·纳米·秒 | 0.7 PN·纳米·秒 |
| 特征时间尺度:名华,10千碱基的DNA ** | 1200秒 | 55秒 | 7秒 |
| 特征时间尺度:名华,1千碱基的DNA | 120秒 | 5.5秒 | 0.7秒 |
| 特征时间尺度:MTT法,K Q = 100 PN·纳米/弧度 | 1.2秒 | 0.06秒 | 0.007秒 |
| 特征时间尺度:MTT法,K Q = 1000 PN·纳米/弧度 | 0.12秒 | 0.006秒= 6毫秒 | 0.0007 S = 0.7毫秒 |
*关于通过“赤道”一轴摩擦系数为旋转( 即 图1b所示的情况),由14给出·磷·H·遥控珠 3,其中h是缓冲的粘度。
*在名华,旋转阱刚度由该DNA的扭转刚度,K Q中给出,脱氧核糖核酸 = C·K(B T)/ L,C,其中C是有效的扭转持续长度,假定为80纳米此处(这是一个中间力量政权,F〜1 PN)和L C的特点是DNA,每个碱基对0.34纳米的轮廓长度。
表2。摩擦系数和特征时间尺度的名华和MTT。
披露声明
与此相关的工作的一个专利已提交下参考PCT/NL2011/050446。
致谢
这项工作是由代尔夫特理工大学,荷兰科学研究组织(NWO),该基金会为基础研究物质,以及由欧洲科学基金会的支持。
材料
| Name | Company | Catalog Number | Comments |
| Sandblaster | Great Lake Orthodontics | 190-070 Microetcher II | |
| Nitrocellulose | Life Technologies | LC2001 | |
| Magnetic particle concentrator | Life Technologies | 12002D | |
| Non-magnetic latex beads (0.5 μm radius) | Polysciences | 17010 | |
| Non-magnetic latex beads (1.5 μm radius) | Sanbio | PV05N/2179 | |
| Antidigoxigenin | Roche | 11 214 667 001 | |
| Streptavidin-coated superparamagnetic beads (0.25 μm radius) | Ademtech | 3150 | |
| Streptavidin-coated superparamagnetic beads (0.5 μm radius, “MyOne”) | Life Technologies | 650.01 | |
| Streptavidin-coated superparamagnetic beads (1.4 μm radius, “M270”) | Life Technologies | 653.05 | |
| Biotin-coated latex beads (0.5 μm radius) | Life Technologies | F-8768 | |
| Cubic magnets for conventional tweezers | Supermagnete | W-05-N50-G | |
| Cylindrical magnet for MTT and FOMT | Supermagnete | R-06-02-02G | |
| Side magnet for MTT | Supermagnete | S-04-07-N | |
| Linear stage | Physik Instrumente | M-126.PD | |
| Rotary stage | Physik Instrumente | C-150 | |
| High-resolution automated sample stage | Physik Instrumente | P-733.2D | |
| Software for coding analysis routines | The Mathworks | MATLAB | custom-written routines are available from the authors |
参考文献
- Strick, T. R., Allemand, J. F., Bensimon, D., Bensimon, A., Croquette, V. The elasticity of a single supercoiled DNA molecule. Science. 271, 1835-1837 (1996).
- Bustamante, C., Bryant, Z., Smith, S. B. Ten years of tension: single-molecule DNA mechanics. Nature. 421, 423-427 (2003).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nature methods. 5, 491-505 (2008).
- Lipfert, J., Hao, X., Dekker, N. H. Quantitative modeling and optimization of magnetic tweezers. Biophysical journal. 96, 5040-5049 (2009).
- Ribeck, N., Saleh, O. A. Multiplexed single-molecule measurements with magnetic tweezers. The Review of scientific instruments. 79, (2008).
- De Vlaminck, I., et al. Highly parallel magnetic tweezers by targeted DNA tethering. Nano letters. 11, 5489-5493 (2011).
- Koster, D. A., Crut, A., Shuman, S., Bjornsti, M. A., Dekker, N. H. Cellular strategies for regulating DNA supercoiling: a single-molecule perspective. Cell. 142, 519-530 (2010).
- Dulin, D., Lipfert, J., Moolman, M. C., Dekker, N. H. Studying genomic processes at the single-molecule level: introducing the tools and applications. Nature reviews. Genetics. 14, 9-22 (2013).
- Ajjan, R., et al. Common variation in the C-terminal region of the fibrinogen beta-chain: effects on fibrin structure, fibrinolysis and clot rigidity. Blood. 111, 643-650 (2008).
- Mierke, C. T., et al. Mechano-coupling and regulation of contractility by the vinculin tail domain. Biophysical journal. 94, 661-670 (2008).
- Shang, H., Lee, G. U. Magnetic tweezers measurement of the bond lifetime-force behavior of the IgG-protein A specific molecular interaction. Journal of the American Chemical Society. 129, 6640-6646 (2007).
- Shang, H. K. P., et al. The application of magnetic force differentiation for the measurement of the affinity of peptide libraries. J Magn Magn Mater. 293, 382-388 (2005).
- Lee, G. U., Metzger, S., Natesan, M., Yanavich, C., Dufrene, Y. F. Implementation of force differentiation in the immunoassay. Analytical biochemistry. 287, 261-271 (2000).
- Smith, A. S., Sengupta, K., Goennenwein, S., Seifert, U., Sackmann, E. Force-induced growth of adhesion domains is controlled by receptor mobility. Proceedings of the National Academy of Sciences of the United States of America. 105, 6906-6911 (2008).
- Kanger, J. S., Subramaniam, V., van Driel, R. Intracellular manipulation of chromatin using magnetic nanoparticles. Chromosome research : an international journal on the molecular, supramolecular and evolutionary aspects of chromosome biology. 16, 511-522 (2008).
- Tanase, M., Biais, N., Sheetz, M. Magnetic tweezers in cell biology. Methods in cell biology. 83, 473-493 (2007).
- Bausch, A. R., Moller, W., Sackmann, E. Measurement of local viscoelasticity and forces in living cells by magnetic tweezers. Biophysical journal. 76, 573-579 (1999).
- Lipfert, J., Koster, D. A., Vilfan, I. D., Hage, S., Dekker, N. H. Single-molecule magnetic tweezers studies of type IB topoisomerases. Methods Mol Biol. 582, 71-89 (2009).
- Vilfan, I. D., Lipfert, J., Koster, D. A., Lemay, S. G., Dekker, N. H., Hinterdorder, P., van Oijen, A. . Handbook of Single-Molecule Biophysics. , (2009).
- Gosse, C., Croquette, V. Magnetic tweezers: micromanipulation and force measurement at the molecular level. Biophysical journal. 82, 3314-3329 (2002).
- Lipfert, J., Wiggin, M., Kerssemakers, J. W., Pedaci, F., Dekker, N. H. Freely orbiting magnetic tweezers to directly monitor changes in the twist of nucleic acids. Nature communications. 2, 439 (2011).
- Celedon, A., et al. Magnetic tweezers measurement of single molecule torque. Nano letters. 9, 1720-1725 (2009).
- Lipfert, J., Kerssemakers, J. J., Rojer, M., Dekker, N. H. A method to track rotational motion for use in single-molecule biophysics. The Review of scientific instruments. 82, (2011).
- Lipfert, J., Kerssemakers, J. W., Jager, T., Dekker, N. H. Magnetic torque tweezers: measuring torsional stiffness in DNA and RecA-DNA filaments. Nature. 7, 977-980 (2010).
- Mosconi, F., Allemand, J. F., Bensimon, D., Croquette, V. Measurement of the torque on a single stretched and twisted DNA using magnetic tweezers. Physical review letters. , 102 (2009).
- Mosconi, F., Allemand, J. F., Croquette, V. Soft magnetic tweezers: A proof of principle. Review of Scientific Instruments. 82 (12), (2011).
- Kauert, D. J., Kurth, T., Liedl, T., Seidel, R. Direct mechanical measurements reveal the material properties of three-dimensional DNA origami. Nano letters. 11, 5558-5563 (2011).
- Velthuis, A., Kerssemakers, J. W. J., Lipfert, J., Dekker, N. H. Quantitative Guidelines for Force Calibration through Spectral Analysis of Magnetic Tweezers Data. Biophysical journal. 99, 1292-1302 (2010).
- Lansdorp, B. M., Saleh, O. A. Power spectrum and Allan variance methods for calibrating single-molecule video-tracking instruments. The Review of scientific instruments. 83, (2012).
- Bouchiat, C., et al. Estimating the persistence length of a worm-like chain molecule from force-extension measurements. Biophysical journal. 76, 409-413 (1999).
- Lee, M., Lipfert, J., Sanchez, H., Wyman, C., Dekker, N. H. Structural and torsional properties of the RAD51-dsDNA nucleoprotein filament. Nucleic acids research. 41, (2013).
- Janssen, X. J., et al. Electromagnetic torque tweezers: a versatile approach for measurement of single-molecule twist and torque. Nano letters. 12, 3634-3639 (2012).
- Baumann, C. G., Smith, S. B., Bloomfield, V. A., Bustamante, C. Ionic effects on the elasticity of single DNA molecules. Proc Natl Acad Sci U S A. 94, 6185-6190 (1997).
- Lipfert, J., Wiggin, M., Kerssemakers, J. W., Pedaci, F., Dekker, N. H. Freely orbiting magnetic tweezers to directly monitor changes in the twist of nucleic acids. Nat Commun. 2, 439 (2011).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophys. J. 81, 2378-2388 (2001).
- Gelles, J., Schnapp, B. J., Sheetz, M. P. Tracking kinesin-driven movements with nanometre-scale precision. Nature. 331, 450-453 (1988).
- Loenhout, M. T., Kerssemakers, J. W., De Vlaminck, I., Dekker, C. Non-bias-limited tracking of spherical particles, enabling nanometer resolution at low magnification. Biophysical journal. 102, 2362-2371 (2012).
- Kim, K., Saleh, O. A. A high-resolution magnetic tweezer for single-molecule measurements. Nucleic acids research. 37, 136 (2009).
- Deufel, C., Forth, S., Simmons, C. R., Dejgosha, S., Wang, M. D. Nanofabricated quartz cylinders for angular trapping: DNA supercoiling torque detection. Nature methods. 4, 223-225 (2007).
- Huang, Z., Pedaci, F., van Oene, M., Wiggin, M. J., Dekker, N. H. Electron beam fabrication of birefringent microcylinders. ACS nano. 5, 1418-1427 (2011).
- La Porta, A., Wang, M. D. Optical torque wrench: angular trapping, rotation, and torque detection of quartz microparticles. Physical review letters. 92, (2004).
- Gore, J., et al. DNA overwinds when stretched. Nature. 442, 836-839 (2006).
- Bryant, Z., Oberstrass, F. C., Basu, A. Recent developments in single-molecule DNA mechanics. Curr Opin Struct Biol. 22, 304-312 (2012).
- Oberstrass, F. C., Fernandes, L. E., Bryant, Z. Torque measurements reveal sequence-specific cooperative transitions in supercoiled DNA. Proceedings of the National Academy of Sciences of the United States of America. 109, 6106-6111 (2012).
- Forth, S., Sheinin, M. Y., Inman, J., Wang, M. D. Torque measurement at the single-molecule level. Annu Rev Biophys. 42, 583-604 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。