Method Article
平地板的空气解禁平台:一种新方法与显微镜或电对清醒结合行为自由移动鼠害
摘要
此方法创建一个有形的,熟悉的环境,为鼠标导航,并在显微成像或单细胞电生理记录,这需要动物的头牢固地固定探索。
摘要
人们普遍认为使用全身麻醉,可破坏的从一个活生生的动物的大脑得到电或微观数据的相关性。此外,长时间的恢复从麻醉限制在纵向研究重复记录/成像发作的频率。因此,新方法,将允许非麻醉做人老鼠稳定的录音有望提前细胞和认知神经科学领域。现有的解决方案的范围从单纯的物理约束,以更复杂的方法,如用计算机生成的虚拟现实结合使用线性和球形跑步机。在这里,一个新颖的方法描述了一个头固定鼠标可以围绕一个空气提升移动居住笼移动,并探讨无压力条件下的环境。这种方法使研究人员能够与同时进行行为测试( 例如 ,学习,习惯或新物体识别)双光子显微成像和/或膜片钳记录,都组合在一个单独的实验。此视频文章介绍了利用清醒动物头部固定器(手机居住笼)中,展示了动物习惯的过程,并体现了许多的方法的可能应用。
引言
在神经科学的一个令人兴奋的新趋势,是发展的实验方法对分子和细胞探测神经元网络在清醒的大脑,行为啮齿类动物。这种办法有希望摆脱对背后的运动功能,感觉运动整合,知觉,学习,记忆,以及损伤的进展,神经退行性疾病和遗传性疾病的神经生理过程的新光源。此外,从清醒动物的大脑记录有希望的新的治疗药物和治疗方法的发展。
人们越来越认识到,麻醉,这在神经生理学实验中被普遍使用,可以影响大脑功能的基本机制,可能导致实验结果的错误解释。因此,广泛使用的麻醉剂氯胺酮迅速增加形成新的树突棘和突触增强功能1;另一个常用的anesthetIC在异氟醚麻醉的手术水平完全抑制在成年动物2新生大鼠和块主轴突发振荡自发皮质活动。目前的方法只有有限数量的由双光子显微成像或膜片钳记录装置能够在非麻醉小鼠的实验。这些方法可以分为可自由移动和头固定制剂。
一个可自由移动的动物制备的独特的吸引力在于,它允许自然行为的评估,包括在导航期间整个身体的运动。一个办法,像一个自由移动啮齿动物的大脑中是附加一个小型头戴式显微镜或纤维镜3-5。然而,小型化的设备往往具有比较客观的基于双光子显微镜有限的光学性能,并且不能用全细胞膜片钳记录6很容易地结合。
鄂西用于头部固定清醒啮齿动物蛰解决方案主要依赖于任何物理约束7,8或培养的动物表现出自愿头枕9。另一种流行的做法是让动物的肢体放置它, 如球形跑步机10移动;这种方法往往是结合计算机生成的虚拟现实。头部固定小鼠的电生理实验已大多采用细胞外记录,并用于研究心血管功能11的中枢调节,麻醉对神经元活动12特效,在脑干13与信息处理14听觉反应。开拓细胞内/全细胞记录中清醒做人动物在2000年代进行的,并侧重于与感知和运动15-20神经活动。大约在同一时间,在清醒小鼠的第一个显微成像研究,酒馆已发表 ,其中双光子显微镜在物理上抑制大鼠7的感觉皮层和上球面跑步机21上运行的小鼠使用。
随后在体内的显微和电生理学研究表明,一个头部固定制剂可以成功地结合了基于前肢运动,气味识别,搅打和舔8,22-25行为范式。放置在球面跑步机的小鼠可以被训练来浏览由计算机10,26生成的虚拟视觉环境。胞内/细胞外记录表明,在头固定动物导航这样的虚拟环境中,活化海马位置细胞的可检测27。在一个虚拟的视觉环境,老鼠显示,主动运动27在局部场电位和θ相岁差正常运动相关的theta的节奏。最近,在空间和时间activit在虚拟环境中的28个工作存储器决策任务期间记录的神经元群体Y图案光学小鼠。
尽管已经启用了突破性的研究,球形跑步机设计有几个固有的局限性。首先,将动物需要移动的旋转空气抬起球,这不会带来任何有形的障碍,如墙壁或障碍物的无限表面。此限制仅适用于部分由计算机生成的"虚拟现实"的补偿,因为视觉输入可以说是事倍功半的小鼠和大鼠相比,触觉感官的输入( 例如 ,晶须触摸或舔),这些物种的自然依赖上。其次,相当曲率球表面的可能是不舒服,用来走在平坦的地板在笼子里的实验鼠。终于,球的绝对直径(至少为200毫米的小鼠和300毫米大鼠)已使该球形的垂直尺寸跑步机设备比较大。这使得它很难球形跑步机结合的大多数市售的显微镜设置,并且经常需要建立围绕跑步机新的设置通过定做显微镜的帧的装置。
在这里,一个新颖的方法描述了一个头固定鼠标可以围绕一个空气提升移动居住笼,具有一个平坦的地板和墙壁有形的移动,并探讨无压力条件下的物理环境。本文演示鼠标的培训和头部固定的程序,并提供了其中双光子显微镜,内在的光学成像和膜片钳记录在清醒做人小鼠的大脑进行有代表性的例子。
研究方案
所有这里介绍的程序是根据对动物护理(在动物实验(62/2006)芬兰法)局部指引进行。动物许可证(ESAVI/2857/04.10.03/2012)由地方当局(ELÄINKOELAUTAKUNTA-ELLA)获得。成年小鼠(年龄1-3个月,体重20〜40克)放在组笼屋在赫尔辛基大学的认证的动物设施和提供食物和水随意 。
1,颅植入窗
颅窗口是根据公布的协议29-31稍加修改植入,如下面简要描述:
- 开始颅窗口植入前消毒的仪器。在手术过程中保持无菌状态,以减少术后并发症的风险。
- 30分钟的手术和24小时后的手术前给药止痛剂(酮洛芬,2.5毫克/千克)。一个使用氯胺酮(80毫克/千克)和赛拉嗪(10毫克/千克)的混合物中esthetize的小鼠腹膜内注射。定期监测麻醉用爪子捏的深度。使用加热垫保持动物的体温在37.0℃。以减少手术引起的炎症和脑水肿,通过皮下注射施用地塞米松(2毫克/千克)。
- 敷眼部润滑剂,以保护眼睛免受越来越干燥。刮胡子鼠标的头部和清洁剃光区域。采用切开手术剪刀和镊子沿线从颈背至前额皮肤。除去附着在头骨的任何结缔组织。
- 慢慢地,小心地钻小井上使用高速手术电钻左额骨。拧一个小闪电(见材料)嵌进好。执行螺杆的不超过一个和一个半完整圈。
注意:要避免那些位于正上方的浅表皮层血管的区域。这些VES中断的SEL可导致大量出血。 - 要执行开颅手术,在右顶骨钻一个圆形窗口(3-3.5毫米直径)。滴一滴皮质缓冲液(125 mM氯化钠,5mM的氯化钾,10mM葡萄糖,10mM的HEPES,2mM的氯化钙 ,和2mM MgSO 4干燥蒸馏水H 2 O的补充有青霉素100单位/ ml链霉素和100微克/毫升),并小心地取出位于圆形窗口内骨骼的一部分。
注意:要表达的荧光蛋白在细胞中的特定亚群,在这一点上在程序执行颅内注射腺相关病毒(AAV)载体或其他病毒载体。 - 对颅窗口位置的圆形玻璃盖玻片(#1.5厚码)。附加盖玻片与聚丙烯胶的头骨。放置一个金属支架上的盖玻片的顶部,并与牙科用粘固剂与聚丙烯胶的混合物固定。
注:上述程序是为颅窗优化在光学成像的实验中使用。准备一个"倒"颅适合电生理实验窗口,使用不同的程序。首先,胶金属持有人的头骨。持有人的开口内钻出一个圆形的窗口,体现在视频中。可替换地,使一个较小的开颅手术(小于0.5毫米的直径),在感兴趣的区域,以防止或尽量减少大脑运动32。刷新皮质缓冲或将硅氧烷粘合剂对颅窗口的下降,然后用圆形盖玻片关闭它。 - 完成操作后,将动物在笼子里温暖与方便食物和水。返回该动物群,房栊后,才恢复完全从麻醉中。在检测到疼痛的迹象,包括不愿动,不吃不喝,体重下降,流涎,毛发竖立或异常呼吸音重管理镇痛。
2。阿尼玛升搬运
- 拿鼠标从笼中,只是拿着它5-10分钟。冷静而处理的动物,避免生涩的动作和声音。
- 处理后,返回鼠标笼子里。
- 重复上述操作步骤2 - 3倍与处理情节之间不等间隔,以使鼠标舒适的实验者。
- 取一小软布,敷动物2-3倍不等的时间间隔。
- 动物应保持冷静,习惯了被包裹。如果鼠标是兴奋又紧张,重复处理和包装程序。
3,动物训练
- 在移动居住笼的习惯来处理和包装后,第二天完成启动动物的训练。
- 记录动物的日常之前和期间的训练重量。
注意:如果在训练过程中,动物失去超过其重量的10%,它应被排除吨他的实验。 - 调整,以匹配训练动物的大小,移动居住笼装置的头部固定臂的垂直位置。该装置的空气入口连接到标准实验室的加压空气出口(通常,无论是气体罐或空气泵,它提供足够高的压力和气流的速度, 即约5巴和300升/分钟)。
- 包裹动物的抹布。
- 插入金属支架,这是附着在动物的头,到头部固定手臂,牢牢拧紧螺丝固定。打开空气流动,并确保空气流是最佳的空气抬起居住笼中自由漂浮。通过删除抹布释放的动物进入移动居住笼。
- 要习惯于动物噪音,提供一个经常接触到周围的声音(例如使用,无线电或录制的音乐和语音),在所有的培训课程,以及实验过程中。
- ð期间,球员第一堂训练课,保持室内光线上的第一个小时,然后关灯,直到训练课结束。
- 之后在移动居住笼2小时的培养,从头部固定释放动物,并将其与水和食物供应返回其笼中。将其放置至少2小时的休息条件下。
- 用70%的乙醇溶液每次训练后,清洁移动居住笼,并用自来水冲洗。泡了水的一次性纸巾以备下次使用前晾干移动居住笼。
- 进行连续训练2小时,与室内的灯光关闭,而动物被训练。
- 每天两次进行训练。
- 经过8到12个培训课程,使用在动物实验阶段长达2小时的时间。
注:在此期间,持续超过1-2小时长时间的培训课程,考虑提供鼠标瓦特第i个饮水,可手动或使用连接到移动居住笼架的移液管固定器递送。或者,可将水供给给随意使用的动物通过将粘性液滴水凝胶的直接在移动居住笼的壁上。
注:请记住,每天训练,以排除任何慢性应激的影响之前,要权衡动物。从实验中排除一个动物如果,在任何时间点,它展示了应激反应,如冷冻,发声,或应激诱导的腹泻。
4。应用
- 清醒鼠标双光子成像中移动的手机居住笼
- 组装移动居住笼。检查桥梁和头部固定手臂的位置。
- 包裹训练有素的动物在抹布。将动物在移动居住笼。夹紧金属支架在头部固定手臂。取出抹布。
- 使用清洁灰尘植入盖玻片一个70%的乙醇溶液并使其干燥。
- 将一滴封面类浸渍液中。最好是,使用粘性溶液,因为水会很快蒸发。
- 将移动设备的居住笼与显微镜下受过训练的动物(除非你有第二次,相同的设备,这是固定在显微镜的设置)。
- 无论是使用了一个定制的或配备了飞秒脉冲红外激光市售的激光扫描显微镜成像系统进行成像。
- 找到感兴趣使用荧光显微镜的宽视野模式的区域。使用长通滤波器,以评估脑血管和检查血管的模式后选择一个合适的目标区域。
- 到图像皮层血管,注入70000兆瓦德克萨斯红标记的葡聚糖(或其类似物)的1%溶液,要么到尾静脉而将动物固定于碎布,或眼窝而动物被定位在所述移动居住笼。调的双光子激光到860纳米,使用带通滤波器(590-650纳米),以收集所发射的光。使用515-560 nm发射滤波器来评估神经元形态或利用神经元活动的细节,例如,表达YFP或Ca 2 +的转基因小鼠-敏感的荧光蛋白GCaMP3在根据Thy1系启动子的神经元的亚群。
- 用于图像采集合适的软件。
- 成像后,通过拧松螺钉松开动物从头部固定臂。返回动物笼子,并允许它开始下一个成像会议之前休息至少2小时。
- 随后的重新映像存储感兴趣区域(ROI)每区域的坐标。图像相同的投资回报随着时间的推移,每一次以最大限度地提高图像的重叠调整坐标。
- 分析图像并使用适当的软件使三维重建是( 例如 ,ImageJ的,等等)。
- 在清醒小鼠的内在光学成像中移动的手机居住笼
- 组装的内在光学成像设置的图像采集摄像头下的移动居住笼。
- 包裹训练有素的动物在抹布。将动物在移动居住笼。金属支架夹到头部固定手臂。
- 用70%的乙醇溶液清洁灰尘植入的盖玻璃和晾干。
- 将甘油对植入玻璃的降低,且与一个8毫米的圆形盖玻片覆盖。
- 将一个机械手,相反对侧鼻毛空气喷吹管。
- 调整高速摄像机的位置和它专注于皮质血管。
- 使用不带相机滤镜绿光(过滤器546BP30)收购该船舶的地图。
- 重点深入皮层,约400微米以下的皮质表面。
- 以图像T他血氧水平依赖(BOLD)的光信号,将590LP过滤器在前面的摄像头和照亮皮质与红光(过滤器630BP30)。
- 调节皮质表面的照明,使得它是通过感兴趣区域均匀分布,从而避免过度曝光。调整照明亮度,使感兴趣区域落入相机的动态范围的70〜90%的区段内。
- 使用LongDaq图像采集软件采集来自摄像机的图像。
- 使用1图像采集频率为10赫兹( 即每秒1到10帧之间),与低频刺激(0.05赫兹)的实验。
- 关掉房间的灯,以防止与固有的光学信号的任何干扰。
- 允许至少30分钟的小鼠适应移动居住笼。
- 图像中的6分情节无刺激的基线活性。
- 录制诱发çortical活动,刺激触须在10秒ON/10秒关闭模式(0.05赫兹刺激)具有高频率(25赫兹)的空气喷了6分钟的总时间的列车。
- 图像采集后,从头部固定手臂松开鼠标,它返回到它的笼子。
- 不使用附加的数据滤波的频率,因为刺激的响应的振幅趋向于相对高的清醒动物,从而产生优异的信噪比。
- 转换所获得的图像为*。TIF一堆文件集和使用, 如进一步分析它们,开源斐济软件(ImageJ的)。利用图像计算器工具触须刺激过程中获得的帧减去基线自发活动。或者,在使用适当的软件在频域滤波器的数据。
- 清醒鼠标膜片钳记录中移动的手机居住笼
- 组装移动居住笼。
- 包裹训练有素的动物在抹布。管理trimethoprime(5毫克/千克)和磺胺多辛(25毫克/千克),以防止细菌感染。将动物在移动居住笼。金属支架夹到头部固定手臂。
- 清洗和消毒用70%的乙醇溶液或0.5%氯己定二葡糖酸盐植入牙科水泥"封顶"和盖玻片,并允许它干。
- 慢慢地,小心地从金属支架上取下玻璃盖。
- 刷新皮质缓冲辅以青霉素,链霉素和清理碎片颅窗用无菌止血棉球。
- 放置在接地电极插入皮层缓冲区。
- 将电探头在显微操作。
- 从硼硅玻璃制造吸管,瞄准尖端电阻范围从6.5到8.5MΩ。与细胞内液填补了补丁吸管。补丁吸管溶液的组成是以下(以mM计):8的KCl,111 K-葡糖酸盐,0.5的CaCl 2,2的NaOH,10葡萄糖,10 HEPES,2的Mg-ATP和5 BAPTA,pH值用KOH调节至7.2。膜电位值必须为-12 mV的33计算出的液体接界电势进行修正。
- 针对使用立体坐标感兴趣区域,并迅速将电极转移到脑,同时保持在移液管尖强正压。 硬脑膜渗透和吸管定位后,测量端阻力和丢弃,显示增加了超过10%-15%的电阻,以提高后续步骤的成功率的电极。
- 减少正压一半,以避免周围脑组织肿胀。进一步的步骤类似于标准的"盲补丁"的协议。为了找到一个神经元的记录,降低针尖进入大脑中一个循序渐进的方式,直到神经元是在一个紧密proximit检测枪头的Y,通过电极阻抗的变化的特性时间序列所指示的。一个神经元的存在的关键指标是在几个连续的前进步骤移液器在电极电阻单调增加(通常,在三个2-μm的步骤增加了吸液管电阻的20%)。
- 以形成与目标神经元一gigaseal接触,施加负压的吸管和超极化。
- 为了建立全细胞构造应用的较大负压到小区的简要脉冲。由2-3微米收回电极,以保持良好的密封。
- 在期望的时间周期记录自发或诱发活性,达20-40分钟。
- 在记录之后,从大脑取出吸管。
- 刷新皮质缓冲或将硅氧烷粘合剂对颅窗口的下降,然后粘上一个圆玻璃盖玻片上的金属支架的顶部。
- 松开阿尼姆人的头部固定臂松开螺丝。返回动物笼子,至少一天一次拍摄之前。
- 与分析, 例如 ,在FitMaster软件的数据。
- 习惯 - dishabituation嗅觉测试清醒鼠标移动围绕移动居住笼
- 附加一个干净的棉片(2 x 2厘米),使用双面胶带浸在自来水中至所述移动居住笼的壁的内侧。通过放置在墙上的外侧的颜色标记,以使棉片位于"目标区"的中间划分移动居住笼壁分为四个区。修复动物中headholder臂壁段相反的朝向的"目标"区,并使其适应移动居住笼30分钟。
- 取另一块干净的棉和几滴1%香草提取物的润湿它。更换干净的棉布上移动居住笼壁与一个携带vanilLA气味。呈现气味5分钟。在气味列报期间跟踪移动居住笼的运动。通过测量动物花费面临的"目标"区就移动居住笼运动的总时间累计时间估计感兴趣的气味水平。
- 使用香草的气味,重复5分钟应用会话三次,用5分钟闭会期间间隔。使用一块新鲜的"香草"棉花在每一个会话。
- 最后,第五十五届会议期间提出的动物与社会显著的气味。湿润干净的棉片用几滴尿液(得到的前一天从相反性别的动物),并把它在5分钟的目标区域的中间。
- 在围绕移动居住笼清醒鼠标移动新颖的气味识别
- 通过将颜色标记在移动居住笼壁的外侧划分壁成四个区域。 ATTACH两个干净的棉片(2 x 2厘米)浸渍在自来水中的壁的内侧面中的区域彼此相对(指定为目标区域1和目标区域2)的中间。修复动物中headholder臂朝向一个墙段的目标区以外,并使其适应移动居住笼30分钟。
- 更换两个棉片与新鲜的:代替棉片的1%香草提取物湿到目标区域1和另一个湿用自来水对目标区2记录的移动居住笼运动期间的气味10分钟的视频介绍会。计算出的气味出席作为该动物花费面对目标区域1中的时间的百分比相对于累积时间花费面对区域1和2。
- 一个10分钟的时间间隔后,将另一对喷头的居住笼墙后面10分钟内。将"香草"棉花目标区1和棉签,用1%的香蕉ê湿XTRACT在目标区2。制作的移动居住笼运动的视频录制。计算出的偏好新颖气味随着时间的动物花费面壁段与新颖的气味(目标区域2)相对于面对区域1和2的累积时间的百分比。
结果
这里提出的方法用于显微成像或单细胞电生理记录在清醒,头部固定但以其他方式自由移动和行为的小鼠。动物可以在一个真正的(而不是虚拟的)的,有形的和熟悉的环境中,两个维度移动,同时动物的头骨被牢固地固定到头部的固定臂。 Habituating小鼠的空气解除移动居住笼由4-6天每日两次2小时培训课程( 图1)。受过训练的动物就可以立即在实验中使用。一个典型的研究包括许多的间隔为间隔从数小时至数天或数周成像会议或膜片钳记录会话。重要的是,光学和电生理记录可以同时使用认知或行为的刺激和读数进行,在一个单一的实验。
以评估的机械稳定性鼠的头固定在所述移动居住笼,收集标记的皮质树突表达YFP的荧光标记的葡聚糖和皮层血管的图像序列,而在实验动物中导航的移动居住笼( 图2)。大脑中动物的运动的最大位移没有通常超过1-1.5微米。这些位移发生在水平方向上,很少导致成像平面的一个可检测的移位,使运动伪影的不必要的任何校正。稳定的头部固定在移动居住笼允许单个树突棘中清醒动物具有相同的可靠性在麻醉小鼠的定量。树突棘密度,形态及营业额可以在与间隔从数小时至数天或数周进行多个会话成像纵向研究进行监控。
在米的可用性i)于Thy1系 - GCaMP3转基因小鼠双光子显微镜和野生型小鼠II)内在的光信号成像:obile居住笼的功能性光学成像是在用两种方法清醒小鼠的体感皮层测试。在2/3层,其中包含许多荧光标记的神经元的细胞体,以及它们的树突和轴突( 图3)进行钙离子成像。的荧光-时间从感兴趣(投资回报)的选定区域的曲线示于图3中 ,在此期间在移动居住笼鼠标的活性导航演示自发神经元活性(测量为短暂增加,GCaMP3荧光)。基于内在信号光学成像允许映射的功能域的空间分布。 图4说明了血氧水平波浪式的变化(反映区域神经元激活)沿躯体感觉皮层的响应到v传播ibrissa刺激以0.05赫兹的频率。
为了测试的膜片钳记录与移动居住笼可行性,我们用2-3月龄C57BL/6J小鼠。 2/3层的神经元在躯体感觉皮层,记录到的全部单元配置使用电流钳模式。膜片钳记录中清醒小鼠脑头固定在移动居住笼基本上类似于盲膜片钳脑切片。约50%的尝试导致成功gigaseal形成,其中超过70%取得了稳定的全细胞配置记录。失去gigaseal接触,由于细胞的机械位移的任何事件,观察图5说明了典型的10分钟长的电流钳记录与小鼠的活动状态(运行)的情节和被动(静止)状态相关的60秒片段。

图1。清醒小鼠的头部固定在移动居住笼的方法。空气,解除移动居住笼的设计和典型实验时间轴的一般概念。 二)图插图一)概述。前habituating鼠标来处理和包装,随后是8每日两次训练两周颅窗口的植入研究开始。典型的研究包括许多的间隔为间隔从数小时至数天或数周成像会议或膜片钳记录会话。光学和电生理测量可以用在单一实验中认知或行为的刺激和读数并行完成。 请点击此处查看该图的放大版本。
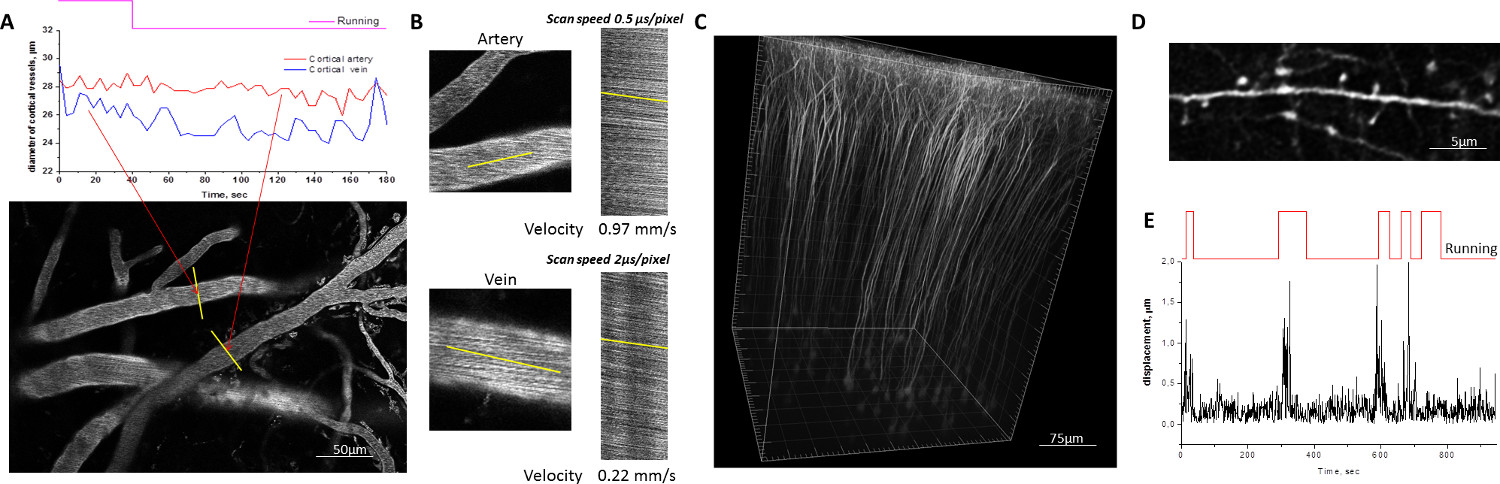
图2例对清醒小鼠围绕移动居住笼移动的双光子显微成像。 A,B)皮质血管,标有70 kDa的德克萨斯红标记的葡聚糖。个别血管段的直径通过绘制随时间期间小鼠的静止和运行(A)的期间穿过血管腔引出的配线的轮廓测量。在动脉和静脉血液流动的速率是由行扫描测量沿绘制平行于容器壁(B)的C,D)的精细神经元形态可视化的转基因小鼠的大脑中表达YFP中的亚群中的细节的线下Thy1系启动子的神经元。三维重建在小鼠的体感皮层(C)锥体神经元。树突状B的图像牧场在清醒,行为小鼠习得足够稳定的个人树突棘形态(D)引起的小鼠大脑运动运动。 五)量化量化。振幅较大的位移关联与鼠标的磨合期。 请点击这里查看这个数字的放大版本。
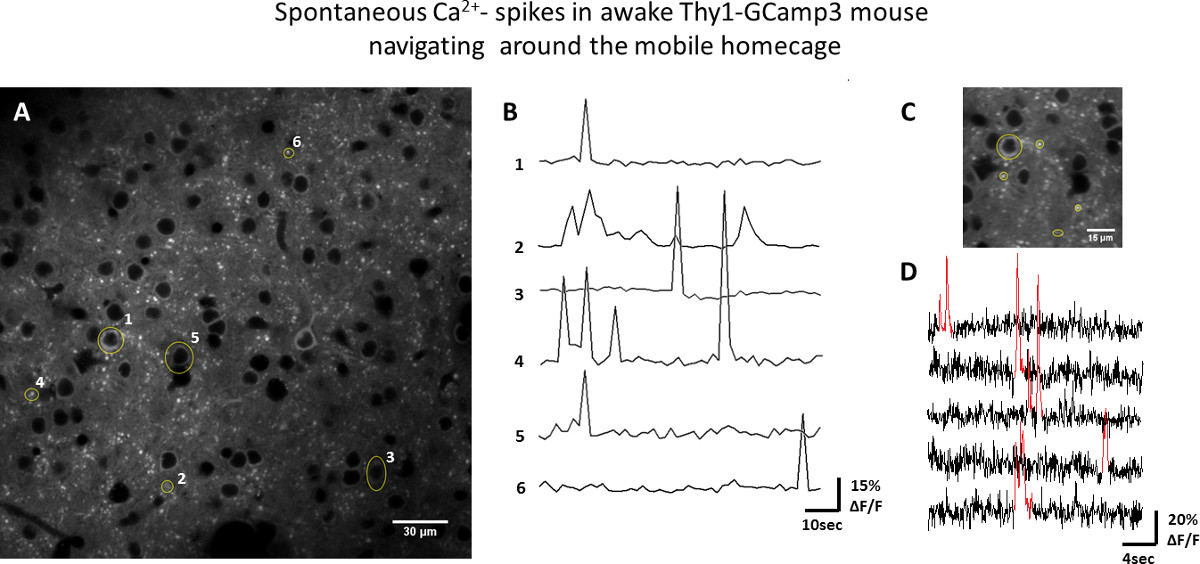
图3例在清醒Thy1系- GCaMP3鼠标移动围绕移动居住笼神经元群的活动。 A)双光子皮质层II / III神经元的形象。投资回报,例如神经元胞体,树突和轴突显示为黄色B)从A中所示的ROI的GCaMP3荧光ΔF/ F曲线(时间s从黄色的ROI以C eries记录在1.5秒/帧)。C)放大的区域成像在65毫秒/帧D)荧光对时间作图,显示了短暂增加(红色)在GCaMP3荧光相对应的动作潜在诱导的Ca 2 +内流的情节。 请点击此处查看该图的放大版本。
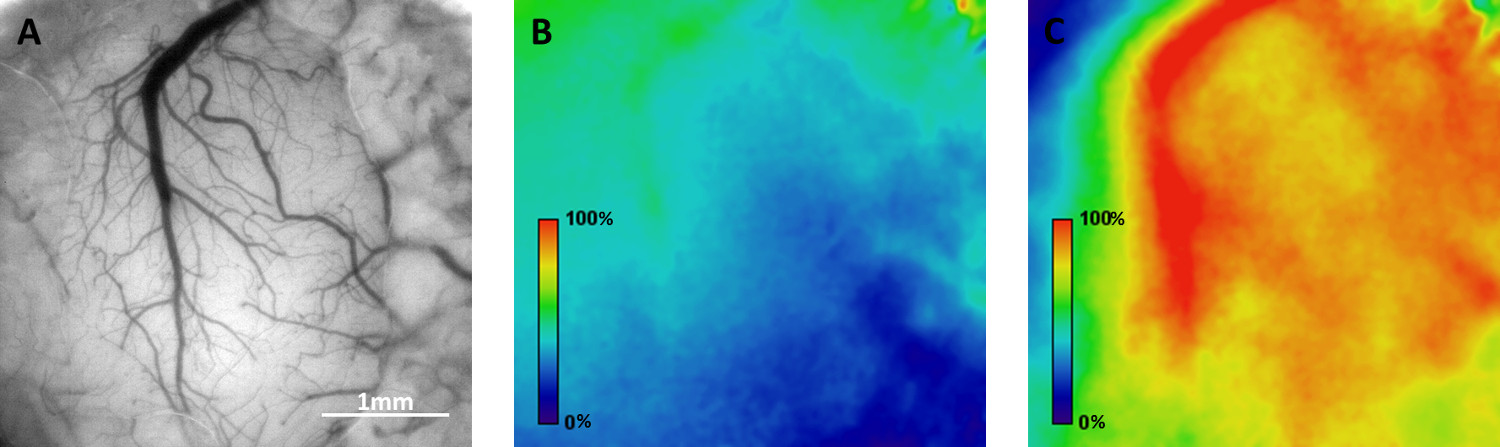
图4例经影像学的内在的光信号的方式映射的功能反应在清醒小鼠皮层的空间分布。的浅表血管,通过颅窗口A)明场视图B)幅度在移动豪基线活动地图在6分钟一集的神经元活动沿着躯体感觉皮层响应触须刺激在0.05 Hz的频率传播的。C)震级地图mecage。 请点击此处查看该图的放大版本。
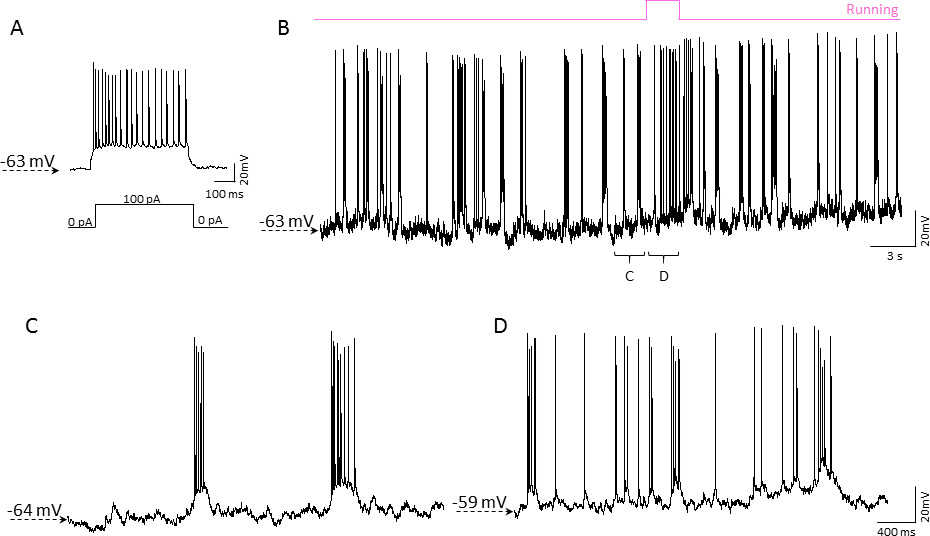
图5实施例的全细胞膜片钳记录中清醒小鼠围绕移动居住笼移动的皮层。 A)电流钳记录从小鼠皮层2/3层神经元。 0.5秒,100 pA的电流注入(轨迹如下图所示),结果在一阵动作电位。细胞呈尖峰频率适应特性的锥体神经元B)连续电流钳记录从相同的神经元与鼠标的自发活动(粉红色轨迹如上图所示)相关。的2/3层神经元的过程中鼠标的休息(C)和运行(D)期间代表自发活动。 请点击此处查看该图的放大版本。
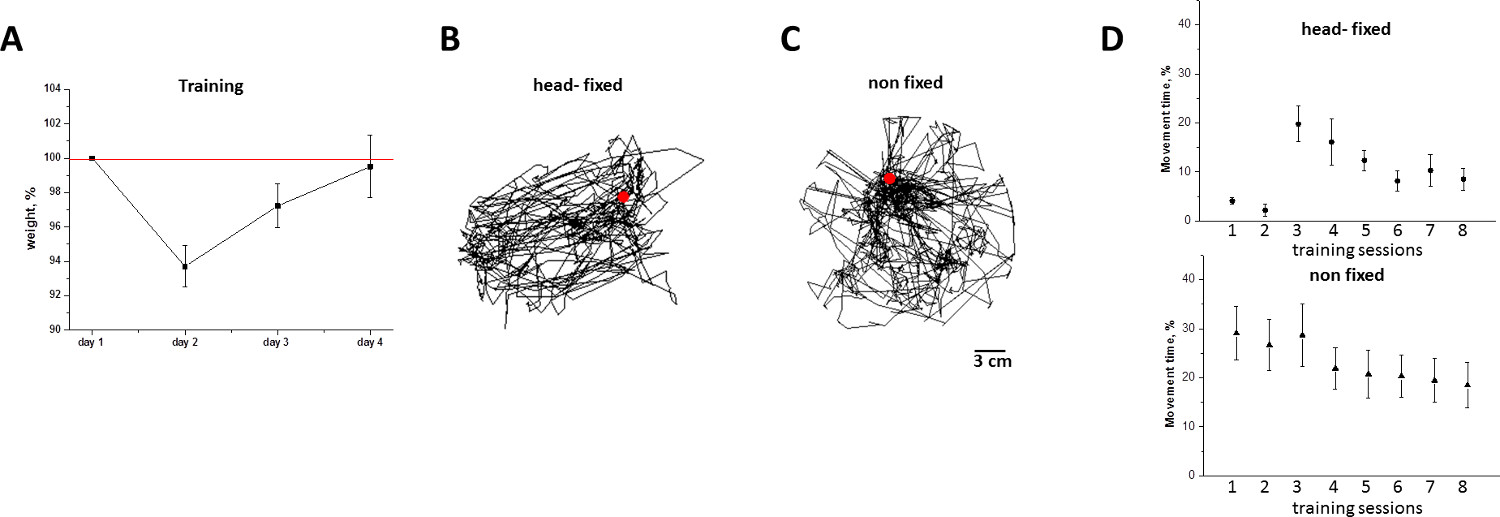
图6。动物体重减轻和head-fixed/non-fixed小鼠的自发活动期间,在移动居住笼训练。 A)动物体重(平均值±SD,%)培训课程之前。请注意,减肥是由7-8 次训练课鼠标的运动水平相对于移动居住笼的B)轨迹完全逆转,这是从移动居住笼的追踪移动中8 次培训课程的非头固定在鼠标第八次培训班的头固定(圆D)持续时间)探索圆笼。 三)履带的运动和推断在培训1-4 天时非固定(三角形)小鼠运动(平均值±SD,%)。需要注意的是,在第4天,头部固定小鼠显示既不结冰(如第1天),也没有过多的自发活动。 请点击此处查看该图的放大版本。
讨论
为了更好地理解大脑生理和病理的研究,必须对各种制剂复杂性水平下进行,采用最合适的技术,为每个制剂。目前,多种神经科学方法论(从全身fMRI来子细胞器STED显微镜)被容易地应用到麻醉的动物,而在清醒和行为的动物实验都代表一个显著方法论的挑战。
在这里,一个新颖的方法描述了一个实验动物,尽管是头牢牢固定,可围绕一个空气提升移动居住笼移动,并探讨无压力条件下其有形的环境。头部固定行为动物制备这里提出提供了许多重要的优点。首先,用该方法得到的电或成像数据是打折扣的既不是由麻醉也不由约束引起的应力。定位鼠标到手机之家笼子是快速,不需要麻醉的动物甚至短暂。第二,空气抬起居住笼确保所需要的量化变化的精细的神经元的形态,并在清醒动物记录单细胞电生理活动的机械稳定性。最后,移动居住笼的设计相比,球形跑步机更紧凑,因而允许一个标准的直立显微镜对清醒鼠的大脑双光子成像或膜片钳记录下定位所述移动居住笼。
坚定的头部固定在移动居住笼需要一个特别设计的四翼金属支架植入术,圆开口的中心光或电访问底层的大脑区域。这些金属支架是将胶水,牙科用粘固剂和小螺栓拧入头骨的骨结合的方法连接到头骨。这种手术是基于大量的以前的开发公开的方法,并发现产生稳定和可再现的颅窗制备。 在体内电生理实验,一个月亮形的窗口34,具有体积小开颅手术(小于0.5毫米)32,和一个钻玻璃覆盖的准备35已动用。在此,"倒"颅窗口被植入与任何一个大(直径3.5毫米),或小的(小于0.5毫米直径)开颅手术。尽量减少大脑运动是稳定的单细胞记录的关键,这就是为什么它是最好进行小规模开颅手术的电生理实验。经颅窗口用于光学成像实验的注入,动物被允许恢复至少2或3周,在该期间内的第一窗口暂时失去其透明性和重新获得它(具有50-70%的产率,这取决于的小鼠品系的遗传背景)。颅窗口和稳定性的透明度附着在头骨的牙齿水泥"帽"性可以通过在动物处理一个普通双目显微镜和物理检验方法进行验证。在2-3周恢复期结束时,那些显示出在该牙科用粘固剂的剩余运行后炎症或机械损坏迹象的动物应该被排除在实验和终止。
用于启动训练的小鼠的最佳年龄为2-4个月(相当于体重20-40克)。在较年轻的动物中,牙科用粘固剂"帽"到头骨的锚定是不可靠的,这可能会降低其韧性到由头部固定小鼠的运动中移动居住笼施加的机械应力。虽然雄性和雌性小鼠出现同样愿意在移动居住笼中导航,有实现的颅窗更好百分比恢复雌性小鼠其透明性(数据未示出)的倾向。因此,为了吨o确保两性平衡组合中选择的成像动物的世代中,约30%的雄性小鼠植入颅窗推荐。社会交往是众所周知的改善动物的福利和减少压力,因此是可取的窝运作和培训,并行和保存在一起,组笼屋。
而相比之下,公布了球形跑步制备13的程序,利用该移动居住笼的方法不需要麻醉的小鼠在头固定的时刻。这种差异是很重要的,因为它允许以排除任何残余的影响,即使是短暂的和"光"麻醉情节是可能对不久后获得的生理测量。事实上,即使在头部固定在麻醉下进行,实际的实验,一个简短的等待期13日后开始,缺一不可的研究排除短暂的麻醉情节的实验数据可以长期持久的影响。其他研究也依赖于禁水的动物头部固定的系统的习惯和使用水作为奖励激励动物保持不动36的手段。然而,奖励为基础的头部固定方法限制适用行为测试的选择,更重要的,占据了行之有效的刺激奖励协会之一。相比之下,鼠标习惯的方法来固定头部移动居住笼不需要禁水和随后的奖励。
补充流动居住笼与水输送系统被推荐用于长期实验。动物训练课程和实验这里给出白天做了,它对应于生理上的被动周期被保持在标准的12小时光照时间表(LI这些小鼠(上午8时至下午6时)光线直接照射在早上6点关闭,并在下午6点)。由于水的摄入量直接与鼠标的活动相关联,在被动的时期小鼠不需要输水如果一个培训/影像/记录会话的持续时间不超过2小时。除了培训课程的时间和持续时间,需要解决所需habituating动物移动居住笼会议的最佳数量的问题。为此目的,两个标准被用来评价应激诱导的头部固定程序:i)重量损失,以及ii)自发活动水平。 如图6,减肥达到培养第2天6%的平均水平,并且通过训练天4( 图6A)完全逆转。始终与动态权衡,头部固定动物的自发活动水平被抑制在训练的第一天,但由稳定训练4天( 图6D)。基于这些测量,我们sugges吨的移动居住笼鼠标训练周期的持续时间最少为4天,如在此协议中所述。
使用空气抬起,平地板移动居住笼中允许的头部固定小鼠的培训范式加入复杂的任务(感觉,知觉和认知)。在本研究中的行为测试两个协议都。这两个协议利用气味线索,并可以在小鼠皮层纵向成像/录音相结合。虽然移动居住笼由非吸收性材料制成,人们仍然需要考虑到设备和测试气味(次)的气味之间的可能的干扰。可与一个行为实验的视觉/触觉提示干扰的另一个因素是壁和嵌入件,这是不无缝和可能,因此,由该动物被认为是一个里程碑之间的交界处。但值得注意的是这里,为了在这种集成减少动物的痛苦rventions作为气味呈棉花到移动居住笼壁的位置时,实验者应练习尽可能快地执行这些措施和避免长时间处理的碳笼。新颖的气味/对象演示的替代策略是可以想象的, 例如 ,放置水凝胶为基础的溶液滴或对象(如食物芯片)安装到连接到碳笼壁的高度与动物的头定位兼容的内表面小的货架上。
移动居住笼允许头固定动物进行了广泛的二维运动包括水平运动,仰卧起坐,梳洗,搅打,舔,鼻子戳,熟练的前爪的动作,和墙壁感人的前肢与所示,本研究中。使用移动居住笼和这里介绍的协议,研究人员可以研究感觉神经系统,同时通过刺激条件控制的高水平s和行为读奏。此外,可调节,空间导航和决策任务期间进行认知能力的清醒小鼠的研究。
这种方法有几个实际的限制。首先,需要有一个显著量的加压空气以实现居住笼升降功率和执行持久的实验。其次,在目前实施移动居住笼只有18厘米直径,因此提供了相较于虚拟现实,其中一个复杂的实验环境,可以设计没有任何空间的限制相对小而简单的空间。第三,在晶须刺激和这里介绍的奖励基础实验,设备使用限制的可能性墙接触的鼠标。除了外部视觉或感官刺激渠道(如眼定向光源投影机)的需要相比,设计更符合人体工程学和紧凑的设备已在球形跑步机实验中被使用的多屏幕或圆顶投影解决方案。
总之,使用头部固定小鼠在空中移动抬起移动居住笼的极大的方便,结合的细胞,分子和行为的在单一实验中观察和操纵水平的研究。这里示出的具体应用包括双光子显微成像,固有光信号成像和膜片钳记录在非麻醉做人小鼠。据预计,这种做法将在实验打开新的视野上清醒,行为鼠标并作为两个药物开发和脑功能的基础研究的有用工具。
披露声明
作者什么都没有透露。
致谢
作者感谢艾罗Castren教授为他的手稿宝贵意见。这项工作是由芬兰科学院,中央补助芬兰的国际流动性,神经科学和芬兰研究生院(脑和心博士)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Tweezers, Stainless Steel, 115 mm | XYtronic | XY-2A-SA | |
| Animal trimmer, shaving machine | Aesculap | Isis GT420 | |
| Binocular Microscope | Zeiss | Stemi 2000 | |
| Biological Temperature Controller with stainless steel heating pad | Supertech | TMP-5b | |
| Blunt microsurgical blade | BD | REF 374769 | |
| Borosilicate tube with filament | Sutter Instruments | BF120-69-10 | For patch pipette production |
| Camera | Foscam | FI8903W | Night visibility |
| Carprofen | Pfizer | Rimadyl vet | |
| Dental cement | DrguDent, Dentsply | REF 640 200 271 | |
| Dexamethasone | FaunaPharma | Rapidexon vet | |
| Disposable drills | Meisinger | HP 310104001001008 | |
| Dulbeco’s PBS 10x | Sigma | D1408 | |
| Dumont #5 forceps, 110 mm | FST | 91150-20 | |
| Eyes-lubricant | Novartis | Viscotears | For eyes protection during operation and as viscose solution for immersion |
| Foredom drill control | Foredom | FM3545 | |
| Foredom micro motor handpiece | Foredom | MH-145 | |
| Four-winged metal holder | Neurotar | ||
| Head Holder for Mice | Narishige | SG-4N | Assembled on stereotaxic instrument |
| Hemostasis Collagen Sponge | Avitene, Ultrafoam BARD | Ref 1050050 | |
| Imaris | Bitplane | ||
| Ketamine | Intervet | Ketaminol vet | |
| Kwik-Sil | WPI | ||
| Mai Tai DeepSee laser | Spectra-Physics | ||
| Micro dressing forceps, 105 mm | Aesculap | BD302R | |
| Microelectrode puller | Narishige | PC-10H | Vertical puller for glass pipette production |
| Micromanipulator | Sensapex | ||
| Mini bolt | Centrostyle | Ref. 00343 s/steel M1.0x4.5 | |
| Mobile Homecage | Neurotar | ||
| Multiphoton Laser Scanning Microscope | Olympus | FV1000MPE | |
| Nonwoven swabs, 5 x 5 | Molnlycke Health Care | Mesoft | Surgical tampons |
| Polyacrylic glue | Henkel | Loctite 401 | |
| Round glass coverslip | Electron Microscopy Sciences | 1.5 thickness | |
| Small animal stereotaxic instrument | David Kopf Instruments | 900 | |
| Student iris scissors, straight 11.5 cm | FST | 91460-11 | |
| Xylazine | Bayer Health Care | Rompun vet |
参考文献
- Li, N., et al. mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists. Science. 329, 959-964 (2010).
- Sitdikova, G., et al. Isoflurane suppresses early cortical activity. Annals of Clinical and Translational Neurology. 1 (1), 15-26 (2013).
- Helmchen, F., Fee, M. S., Tank, D. W., Denk, W. A miniature head-mounted two-photon microscope. high-resolution brain imaging in freely moving animals. Neuron. 31, 903-912 (2001).
- Piyawattanametha, W., et al. In vivo brain imaging using a portable 2.9 g two-photon microscope based on a microelectromechanical systems scanning mirror. Optics letters. 34, 2309-2311 (2009).
- Sawinski, J., Wallace, D. J., Greenberg, D. S., Grossmann, S., Denk, W., Kerr, J. N. D. Visually evoked activity in cortical cells imaged in freely moving animals. Proceedings of the National Academy of Sciences of the United States of America. 106, 19557-19562 (2009).
- Fee, M. S. Active stabilization of electrodes for intracellular recording in awake behaving animals. Neuron. 27, 461-468 (2000).
- Greenberg, D., Houweling, A., Kerr, J. Population imaging of ongoing neuronal activity in the visual cortex of awake rats. Nat Neurosci. 11 (7), 749-751 (2008).
- Fujiwara-Tsukamoto, Y., et al. Reinforcing operandum: rapid and reliable learning of skilled forelimb movements by head-fixed rodents. Journal of Neurophysiology. 108, 1781-1792 (2012).
- Scott, B. B., Brody, C. D., Tank, D. W. Cellular Resolution Functional Imaging in Behaving Rats Using Voluntary Head Restraint. Neuron. 80, 371-384 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nat Neurosci. 13, 1433-1440 (2010).
- Parry, T. J., McElligott, J. G. A method for restraining awake rats using head immobilization. Physiolog & behavior. 53 (5), 1011-1015 (1993).
- Brecht, M., Schneider, M., Sakmann, B., Margrie, T. W. Whisker movements evoked by stimulation of single pyramidal cells in rat motor cortex. Nature. 427 (6976), 704-710 (2004).
- Van Looij, M. A. J., Liem, S. -. S., van der Burg, H., van der Wees, J., De Zeeuw, C. I., van Zanten, B. G. A. Impact of conventional anesthesia on auditory brainstem responses in mice. Hearing research. 193, 75-82 (2004).
- Hentschke, H., Schwarz, C., Antkowiak, B. Neocortex is the major target of sedative concentrations of volatile anaesthetics: strong depression of firing rates and increase of GABAA receptor-mediated inhibition. The European journal of neuroscience. 21, 93-102 (2005).
- Margrie, T. W., Brecht, M., Sakmann, B. In vivo, low-resistance, whole-cell recordings from neurons in the anaesthetized and awake mammalian brain. Pflugers Archiv: European journal of physiology. 444, 491-498 (2002).
- Crochet, S., Petersen, C. C. H. Correlating whisker behavior with membrane potential in barrel cortex of awake mice. Nat Neurosci. 9, 608-610 (2006).
- Houweling, A. R., Brecht, M. Behavioural report of single neuron stimulation in somatosensory cortex. Nature. 451, 65-68 (2008).
- Poulet, J. F. A., Petersen, C. C. H. Internal brain state regulates membrane potential synchrony in barrel cortex of behaving mice. Nature. 454, 881-885 (2008).
- Bryant, J. L., Roy, S., Heck, D. H. A technique for stereotaxic recordings of neuronal activity in awake, head-restrained mice. Journal of neuroscience methods. 178, 75-79 (2009).
- De Kock, C. P. J., Sakmann, B. Spiking in primary somatosensory cortex during natural whisking in awake head-restrained rats is cell-type specific. Proceedings of the National Academy of Sciences of the United States of America. 106, 16446-16450 (2009).
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large-scale neural activity with cellular resolution in awake, mobile mice. Neuron. 56, 43-57 (2007).
- Hentschke, H., Haiss, F., Schwarz, C. Central signals rapidly switch tactile processing in rat barrel cortex during whisker movements. Cerebral cortex. 16, 1142-1156 (2006).
- Stüttgen, M. C., Rüter, J., Schwarz, C. Two psychophysical channels of whisker deflection in rats align with two neuronal classes of primary afferents. J. neuroscience. 26, 7933-7941 (2006).
- Connor, D. H., Peron, S. P., Huber, D., Svoboda, K. Neural activity in barrel cortex underlying vibrissa-based object localization in mice. Neuron. 67, 1048-1061 (2010).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extend arteriole capacity. Proceedings of the National Academy of Sciences of the United States of America. 108 (20), 8473-8478 (2011).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461, 941-946 (2009).
- Chen, G., King, J. A., Burgess, N., O’Keefe, J. How vision and movement combine in the hippocampal place code. Proceedings of the National Academy of Sciences of the United States of America. 110 (1), 378-383 (2013).
- Harvey, C. D., Coen, P., Tank, D. W. Choice-specific sequences in parietal cortex during a virtual-navigation decision task. Nature. 484 (7392), 62-68 (2012).
- Holtmaat, A., et al. Long-term , high-resolution imaging in the mouse neocortex through a chronic cranial window. Nat Protoc. 4 (8), 19-22 (2009).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. J. Vis. Exp. (12), (2008).
- Portera-Cailliau, C., Trachtenberg, J. T., de Paola, V., Svoboda, K., Wilbrecht, L., Holtmaat, A. Imaging Neocortical Neurons through a Chronic Cranial Window. Cold Spring Harbor Protocols. 2012, (2012).
- Garaschuk, O., Milos, R. -. I., Konnerth, A. Targeted bulk-loading of fluorescent indicators for two-photon brain imaging in vivo. Nat Protoc. 1 (1), 380-386 (2006).
- Barry, P. H. JPCalc, a software package for calculating liquid junction potential corrections in patch-clamp, intracellular, epithelial and bilayer measurements and for correcting junction potential measurements. Journal of neuroscience methods. 51 (1), 107-116 (1994).
- Golshani, P., Gonçalves, J. T., Khoshkhoo, S., Mostany, R., Smirnakis, S., Portera-Cailliau, C. Internally mediated developmental desynchronization of neocortical network activity. The Journal of neuroscience. 29 (35), 10890-10899 (2009).
- Polack, P. -. O., Friedman, J., Golshani, P. Cellular mechanisms of brain state-dependent gain modulation in visual cortex. Nat Neurosci. 16 (9), 1331-1339 (2013).
- Schwarz, C., et al. The head-fixed behaving rat--procedures and pitfalls. Somatosensor., & motor research. 27, 131-148 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。