需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
小龙虾的游泳足系统:实用指南为神经线及电机模式外记录的解剖
摘要
Here we describe the dissection of the crayfish abdominal nerve cord. We also demonstrate an electrophysiological technique to record fictive locomotion from swimmeret motor neurons.
摘要
在这里,我们证明小龙虾腹部神经索的解剖。该制剂包含的最后两个胸神经节(T4,T5)和腹腔神经节的链(A1到A6)。这种链节包括中枢神经系统(CNS),其驱动所述腹肢(游泳足)的协调运动的部分:游泳足系统。它是已知的,在小龙虾每个游泳足由它自己的独立模式生成内核生成节奏交替活动1-3从动超过五十年。运动神经元支配每个游泳足的肌肉组织包括两个解剖学和功能上不同的人群4。一个是负责对游泳足的缩回(动力行程,PS)。其他驱动游泳足的前伸(回击,RS)。所述游泳足系统的运动神经元都能够自发产生假想马达模式,这是相同的记录在体内图案1。
本报告的目的是介绍一个有趣和方便的模型系统研究的节奏生成网络和协调学生的实践课程,实验室独立的微电路。所提供的协议包括一步一步的说明小龙虾的腹神经索的解剖,神经节钉扎的孤立链,desheathing的神经节,并从隔离神经系统记录游泳足虚构的运动模式细胞外。
此外,我们还可以监视从树突细胞内记录的游泳足的神经元的活性。在这里,我们还简要介绍这些技术,并提供了一些例子。此外,游泳足神经元的形态,可以使用各种染色技术进行评估。在这里,我们提供的细胞内(通过离子电渗疗法)染料填充神经元和游泳足运动神经元的池的回填的例子。在我们的实验室我们使用这种制剂来研究微电路之间假想运动,感觉反馈对CNS的活性的效果,和协调的基本功能在细胞水平上。
引言
小龙虾的游泳足发球局中姿态控制功能,并有节奏地敲打当动物往前游,通风的洞穴或女性充气鸡蛋5,6,信号小龙虾, 螯leniusculus的游泳足,是成对出现的,从第二到第五腹段,用一肢上腹部7的每一侧。对中枢神经系统产生自身的节律马达图案驱动在完整的动物,以及在分离的神经索制备的游泳足运动。当没有感官反馈或降序输入本公司生产的节奏马达模式被称为假想运动1,2,在游泳足系统该电动机模式中不从在完整动物测得的游泳足的活性的任何参数不同。
每个游泳足的运动是通过将位于和限制为一个c-微电路驱动orresponding hemiganglion 1 - 3在每个微电路是有规律生成内核包括五个确定非扣球的interneurons。它们可以在功能特征为两种动力冲程抑制剂(IPS)或回击抑制剂(IRS)8。这些IPS和IRS的interneurons不是内生的振荡器,而他们的交流活动是由交互抑制9驱动。由于这些的interneurons直接抑制游泳足运动神经元,交替的PS-RS机芯生成10。运动然而,这不仅需要活动的产生,同时也协调不同的独立微电路。在游泳足系统,这种协调是通过协调微电路可确保四肢活跃在正确的时间建立。此微电路由三个识别神经元中的每个段11-15构建的。
该协议规定,日Ë首次一步一步夹层导向分离神经节(T4至A6, 图1)的链。我们展示了如何针隔离腹部神经索和desheathe每节。在这种孤立的神经系统的准备,负责游泳足的运动神经元是准备在电生理及形态学实验。此协议的第二部分展示了游泳足运动模式的主要特点。这包括了一步一步的指导,细胞外记录的游泳足的运动神经元的活动。 RS运动神经元的轴突通过神经N1的前支伸出,而PS的运动神经元的轴突通过同一神经的后支( 图1)突出4。因此它们的活性可以从这些分支具有差分针电极进行记录。

图1:隔离从胸神经节4(T 4),以腹神经节6(A6)和它 T4 的示意图神经系统:胸神经节4; T5:胸神经节5; A1,A2 ...... A6腹神经节1,腹神经节2 ...腹神经节6; N1:神经N1; N2:神经N2; N3:神经N3; PS:电源冲程; RS:返回行程。定向缩写: A =前; P =后路。
这解剖程序和电技术展示是方便本科生和可能的生理补充学生实践课程。神经节的分离链已被用在大量的实验以研究神经系统的功能,协调性,或游泳足微电路6的调制以及在运动16,17适应性行为的神经元控制,小龙虾游泳足系统因此提供了一个巨大的量有趣的教学或T下雨,所有开始与小龙虾和假想马达图案的细胞外记录的腹神经索的解剖机会。
Access restricted. Please log in or start a trial to view this content.
研究方案
这解剖过程是按照22欧洲共同体理事会指令次 2010年9月(2010年/ 63 / EU)。
1.准备
- 小龙虾获得男女≥8厘米大小的, 螯leniusculus(德纳)。确保动物是至关重要的,腹部和四肢腹部都完好无损。
- 小心检查甲壳而这个角质层又粗又硬。前和postmolt动物具有柔软甲壳和不适合的实验,因为在蜕皮过程中的许多参数改变( 例如,减少在运动活性)。
- 组装解剖过程中使用的所有工具和材料,钉扎和神经索的desheathing 图2中示出并在所提供的补充剂列出。

图2: 材料和工具用于清扫,牵制和神经索的desheathing。
(1)大水桶装满冰块; (2)小龙虾盐水; (3)盐水分配器; (4)解剖显微镜; (5)夹层菜; (6)强大的剪刀; (7)镊子(8)弹簧剪刀; (9)培养皿内衬明确SYLGARD; (10)固定销; (11)冷灯源。
2.总解剖
- 麻醉动物在冰上15 - 20分钟。进行总夹层的第一部分在水槽附近的实验室工作台上,因为它包括一个放血步骤和试样需要定期用小龙虾盐水在手术过程中漂洗。
- 保持动物腹侧和使用强大的剪刀在靠近胸部( 图3-1)他们的基地削减双方的爪子。拆下左,右尾肢( 图3-2)。
- 将动物腹侧的解剖盘内衬黑色SYLGARD。的Eleva德头胸部通过在尾节( 图4A)下插入冰和引脚腹部。
- 填充生理盐水饮水机用〜60毫升冷冻小龙虾生理盐水。灌注小龙虾通过爪孔( 图4B)冷盐水。多余的盐水将通过削减在腹足流掉。覆盖小龙虾与放血过程中的冰
- 斩首动物用单个横向切割只是后侧到使用强剪刀( 图5A)的动物的眼睛。删除所有腿走路附近的基地关节, 如图5B所示。
- 隔离与来自头胸部的其余部分的最后胸段腹部。通过插入剪刀的尖端插入所述第二行走腿的开口和切削到相对侧使在第二行走腿的水平(胸段3)的第一切口。 ( 图6A-1)。
- 扩展这个首次降息双方通过吨他头胸部( 图6A-2)。
- 翻转动物开放做出一些内脏可见。推突出消化腺( 图6B-3)在试样的前部,并使用镊子从腹腔取出生殖器官。
- 除去头胸部( 图6C)的前部。用横向切割以除去甲壳的横向部件,覆盖鳃,对剩余的胸部( 图6D-4)的两侧。取出鳃和冲洗用冷盐水标本。
- 通过胸骨板的整个长度继续进行切割夹层, 如图6E-5表示。使这个在削减和pleuron游泳足( 图6E红色标记)之间的最大横向位置。继续与同一切对方。冲洗用冷盐水的样品。
- 根据dissectio进行清扫剩余ñ显微镜。放置小龙虾的腹部腹侧在解剖盘内衬黑色SYLGARD和填充小龙虾生理盐水,使其覆盖所述样品。
注:以下步骤(2.12-4.8)包含适用于右手实验者的方向指示。在下面的步骤(2.12-6.8)它用冷盐水代替小龙虾盐水在规则的间隔,每次20-30分钟,以保持对神经系统的健康是非常重要的。 - 修复与昆虫针试样后方的尾节,并在前方的背甲的遗体。放置试样,以使尾节点的左侧和平行于该表的边缘。
- 使用左手粗钳抓住通过行走的腿开口( 图7A)和拉标本开( 图7B白色箭头)。识别大型两背侧屈肌股线( 图7B-1和C-1),并切断其腹如图7B基础。
- 识别胸骨动脉( 图7C-2),一个从背侧(心脏),以腹侧,在第 4胸椎节段。该动脉位于右侧的神经索( 图7C-3)上面,它的神经线下的项目之前,形成腹动脉。
- 横切胸骨动脉。这表现在图7C中 ,首先解除动脉,用剪刀的一个叶片,并且仅切割时的腹侧位于神经索是可见的。
- 前方固定背屈肌(向右侧)。这应该在最大伸展位置来完成与引脚,因此他们不会挡住视野和标本仍然捉襟见肘。当背肌肉股被固定( 图8-1)中,第一腹神经节,A1和A2,与相 关的神经N1,N2和N3是可见的( 图8)。
- 使用镊子在左手抓住规范imen在一个开口步行腿。纵观以下步骤剥离轻轻拉,以保持标本打开。
- 横切的神经N3从神经线最远的位置。 ( 图8-3)。
- 切开屈肌肌肉接近腹表皮内突, 如图8-4所示 。请注意不要损伤神经线或神经N2。
- 重复步骤2.18和2.19的神经N3,其余腹腔神经节A2到A5的屈肌肌肉。
- 在最后的腹神经节,A6,切背屈肌,从腹侧表皮内突和试样应在图9的样子,如图所示。
- 切开胸骨板后,以A6( 图9-1)的神经,保持腹部的一部分( 图9-2)。丢弃背侧部与屈肌肌肉( 图9-3)。通过行走的腿的开口与销前方固定胸骨板,并且向后到A6。
3.精细解剖
- 将样品与前部引导离开并朝向表'边缘的后部,在显微镜下。
- 使用镊子, 如图10A除去cephalothoracic胸骨的最前部分。
注:胸神经节和相关的神经得到部分弥补了腿部肌肉和cephalothoracic燕。所述cephalothoracic腹板形成骨架分隔行走腿的侧向位于空腔彼此并从中间腔,其中腹神经索驻留。 - 切, 如图10B所示的剩余外骨骼结构-1和B2之间的肌肉。使用镊子抓住并提起腹神经索( 图10C)的前端。
注:神经线将在此过程中被损坏,以便避免拿起NERVË线多次。 - 切胸神经横向同时抬起神经索(图10C-3)。保持这些神经在适当的长度牵制。除去神经节,将其拾起用钳子的链挤压部,通过切除所有的组织前到T4( 图10C-4)。
- 将样品与前部的左侧和集中在A1中。切A1的神经N1和N2在合适的长度(最大1厘米)对于钉扎出来。
- 着眼于A2和识别神经N1,N2和该段的N3( 图11)。腹神经节A2-A5的神经N1驻留2胸骨表皮infoldings之间在各段( 图11A-1)和被覆盖的肌肉。做一个切沿胸骨后表皮内折。开始在腹部的侧缘,并继续朝向中线, 如图11A。
- 如果目标N1仍然是海湾红色与组织, 如图11B(红色箭头),切断跨肌束,但此时前两者胸骨表皮infoldings和神经N1( 图11B-2)。
- 切断神经N1作为远侧越好( 图11C-3)。神经N1为完全可见,前部和后部支可识别( 图11C)。
- 继续向健侧神经N1和第一切开肌肉沿胸骨后表皮内折,从内侧,靠近神经节( 图11D)。如果神经仍然覆盖由组织,切横跨肌束,但此时前两者胸骨表皮infoldings和神经N1,类似于图11B-2。切断神经N1作为远端越好。
- 切断该神经节的神经N2到合适的长度(约0.5厘米)对钉扎。
- 重复步骤3.7-3.11为A3-A5的神经。
- 切仪神经节A6的VES的远侧尽可能( 图12A)。使用镊子抢A6多个神经,解除这一节,并开始从胸骨板隔离神经节链。
- 同时抬起神经线,这表现在图12B(白色箭头),轻轻在前面的方向拉。作为个别神经节被提升,取出腹侧动脉可附着到神经索( 图12C)的腹侧。继续这个(轻轻)拉切序列,直到神经索是完全隔离的。
- 神经节的分离链转移至培养皿内衬清晰SYLGARD和填充小龙虾的盐水( 图12D)。
4.管脚的神经索到培养皿
注:使用小针切不锈钢线材(见补充)引脚神经线。触摸只能用产钳结束神经,不SQUEEZe本连接词或神经节。
- 针神经节在一条直线上的链条,同时施加轻柔舒展。
- 安排在培养皿背侧的神经索朝上( 图13中黑线)。神经节的腹侧可以标识通过其凸;背侧是平坦的。针胸神经向两侧。继续与A6的神经,沿其纵向轴线伸展的神经索。
- 引脚输出A1的神经,在90°角相对于神经索一个。
- 着手A2和引脚神经N2在35-45°相对于神经索( 图1A)的角度。
- 钉扎这表现在图14中之前分离的神经N1在其前部和后部的分支,使用两对细镊子的拾起带有一对钳子的前部,并与其他的神经N1的后支。小心挑选只有最前端S中的神经分支。现在拉他们仔细分开。
- 针神经N1的前支在90°角相对于神经索( 图1A)一个。脚前N1分支和神经之间的N2 N1神经的后支。
- 重复步骤4.4-4.6为神经节A3-A5的神经。而行了吧神经索牵拉它在纵向和横向方向。
5. Desheathing神经节
- 将制剂以这样的方式即实验者的手总是搁在一个稳定的平面,以避免振荡。为了desheath神经节从下面照亮的神经线。
- 专注于任何腹神经节A1到A5。用细弹簧剪刀,使通过节套一小横向切割,后到神经节的神经N2和N3( 图15A红色箭头)。
- 使用非常˚F拿起节护套INE镊子和横向切割穿过上述联结套管,如在图15A-1表示。小心不要挤压或剪切的神经索用剪刀。
- 仍持有和解除神经节护套用钳子继续削减它沿神经节( 图15B-2,-3)的横向边界。移除护套。可替代地将其固定到联结的两侧,使得它被固定,但在神经索未挤压的方法。
- 所有腹节A1至A5重复步骤5.2-5.4。
- Desheathe胸神经节和以类似的方式在神经节的A6。为了desheathe A6开始前的神经节,并继续在后方向。针A6的神经节护套神经节的链的后端。
6.外记录,从运动神经元
- 组装用于显示我外记录所有的工具和材料Q 图16B和上市的补充。在记录设置的概况示于图16A。启动在该实验中( 图16C)使用的所有电子设备,从而使放大器可以预热至少30分钟记录之前。打开电脑并启动录音软件。
- 放置神经节上的显微镜表的链和从下方照亮。插入记录电极插入SYLGARD接近目标神经,并在附近的位置上的参考电极,但横向于神经节( 图17A和B)。周围弯曲的记录电极( 图17C)的目标神经。
- 伸展的神经咯,以确保电极与神经之间的接触,并将其管脚到侧(F igure 17D)。固定用橡皮泥电极电缆连接到显微镜表,所以它们留在所需的位置。
- 使用注射器填充有凡士林和一个20号针头(具有圆形的尖端)( 图17E-3)以分离从浴液目标神经。第一dAb一些凡士林在记录电极周围的SYLGARD。其结果是一层凡士林覆盖在记录电极( 图17E-4)的附近的SYLGARD。小心不要直接轻拍到神经和避免气泡在这一层。
- 密封用凡士林来自各方面的记录电极至盐水( 图17F)的表面水平。
- 重复此过程为所有目标神经的活动进行监测。
- 开始录制。使用连续或间隙自由获取模式和为5 kHz的取样速率。设置外放大器下列参数;争取到1000(放大信号1000次,照顾到包括在收购软件设置这个参数放大)的300赫兹(低胸)到2000赫兹(高切)达带通滤波器的范围。
Access restricted. Please log in or start a trial to view this content.
结果
与从RS和PS,1神经节的运动神经元的同时外记录,这些运动神经元池的交替活性,可以监测( 图18)中,表示假想运动图案。
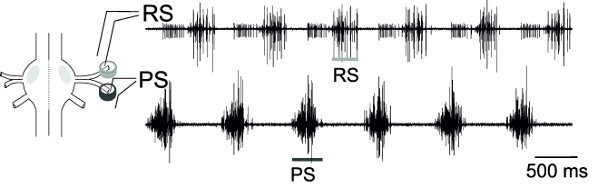
图18:示意图1节和差分引脚电极的放置 RS运动神经元的细胞外记录(上部曲线)和PS运动神经元(下迹线)。
同侧PS 2〜PS 5运动神经元?...
Access restricted. Please log in or start a trial to view this content.
讨论
小龙虾的解剖和它们的腹神经节以前已经描述5,18,19,20和建议之前夹层熟悉它们,以避免的重要神经切割。
关键是要保持的制备在温度低于23℃,以防止分离的神经索的降解。这可以容易地通过更换浴液每20-30分钟用冷小龙虾盐水来实现。在这些情况下,可用于电生理实验长达12小时神经节的链。
有时候,游泳足运动神经元处于非活动状态...
Access restricted. Please log in or start a trial to view this content.
披露声明
The authors declare that they have no competing financial interests.
致谢
我们感谢乔斯Burgert帮助有一些数字。我们感谢英戈SELBACH(和组"Edelkrebsprojekt北威州"),为他的努力提供实验室与实验动物。我们感谢安娜·C·施奈德校对书稿的第一个版本。这项研究是由埃米诺特DFG授予SM 206 / 3-1和科隆大学女教师启动资助。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 4-channel extracellular amplifier: MA 102 | Amplifier | Elektroniklabor, Zoologie, Universität zu Köln, Germany | |
| air-table | Technical Manufacturing Corporation (TMC) a unit of AMETEK Ultra Precision Technologies, Peabody, MA, USA | 63-534 | |
| Axon Digidata 1440A | Digitizer | Axon Instruments, Molecular Devices Design, Union City, CA | DD1440A |
| big bucket | |||
| Clampex & Clampfit | pClamp 10, recording and analysis software | Molecular Devices Design, Union City, CA | pClamps 10 Standard |
| cold lamp source | with flexible light guide (fiber optic bundle) | Euromex microscopes holland, Arnhem, BD | LE.5211 & LE.5235 |
| computer and monitor | equipped with recording software | ||
| container and pipette for liquid waste | |||
| crayfish saline | contains (in mM): 5.4 KCl, 2.6 MgCl2, 13.5 CaCl2, and 195 NaCl, buffered with 10mM Tris base and 4.7mM maleic acid; aerated for 3 hours. Adjust at pH of 7.4. | ||
| dextran, Texas Red (3000MW, lysine fixable) | fluorescent dye, lysine fixable | Life Technologies GmbH, Darmstadt, Germany | D3328 |
| dissection dish | (l x w x h) 15x7x5 cm; linned with black silicone | ||
| faraday cage | |||
| fixing pins | |||
| forceps (biology, Dumont #5) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11252-20 |
| forceps (biology, Dumont #55) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11255-20 |
| forceps (electronic, Dumont #5) | Forceps: Standard, tip 0.1 x 0.06 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11251-20 |
| intracellular electrode | Borosilicate glass capillaries (outer/inner diameter: 1mm/0.5mm), with filament | Sutter Instruments, Novato, CA | BF100-50-10 |
| Leica S8 Apo StereoZoom | Dissection Microscope Zoom 1x - 8x | Leica, Germany | 10446298 |
| microscope table | |||
| mirror | to illuminate preparation from below | ||
| modeling clay | |||
| Olympus SZ61 | Dissection Microscope Zoom 0.67x - 4.5x | Olympus, Germany | |
| petri dish | 94 x 16 mm; lined with clear silicone | Greiner bio-one, Germany | 633180 |
| ring scissors | ThoughCut, cutting edge: sharp/blunt, straight: 13cm | Fine Science Tools (FST), Germany | 14054-13 |
| spring scissors or alternative: Vannas spring scissors | cutting edge: 8 mm, tip diameter: 0.2mm, straight: 10cm or cutting edge 2.5 mm, tip diameter 0.075 mm, straight: 8cm | Fine Science Tools (FST), Germany | 15024-10 or 15000-08 |
| student Vannas spring scissors or alternative: Moria Spring Scissors | cutting edge: 5mm, tip diameter: 0.35mm, straight: 9cm or cutting edge: 5mm, tip diameter 0,1 mm, straight: 8 cm | Fine Science Tools (FST), Germany | 91500-09 or 15396-00 |
| sylgard | 184 Silicone Elastomer Base and Curing Agent; for black sylgard add activated carbon | Dow Corning, Midland, MI, USA | |
| syringe filled with petroleum jelly and equipped with a 20 gauche needle with rounded tip |
参考文献
- Hughes, G. M., Wiersma, C. A. G. The Co-Ordination of Swimmeret Movements in the Crayfish, Procambarus-Clarkii (Girard). J Exp Biol. 37 (4), 657-670 (1960).
- Mulloney, B., Smarandache, C. Fifty Years of CPGs: Two Neuroethological Papers that Shaped the Course of Neuroscience. Front Behav Neurosci. 4, 45(2010).
- Murchison, D., Chrachri, A., Mulloney, B. A Separate Local Pattern-Generating Circuit Controls the Movements of Each Swimmeret in Crayfish. J Neurophys. 70 (6), 2620-2631 (1993).
- Mulloney, B., Hall, W. M. Functional organization of crayfish abdominal ganglia. III. Swimmeret motor neurons. J Comp Neurol. 419 (2), 233-243 (2000).
- Davis, W. J. Lobster Righting Responses and Their Neural Control. Proc R Soc Ser B-Bio. 170 (1021), 435-456 (1968).
- Mulloney, B., Smarandache-Wellmann, C. Neurobiology of the crustacean swimmeret system. Prog Neurobiol. 96 (2), 242-267 (2012).
- Huxley, T. H. The crayfish: An introduction to the study of zoology. , MIT Press. Cambridge, MA. (1980).
- Smarandache-Wellmann, C., Weller, C., Wright, T. M., Mulloney, B. Five types of nonspiking interneurons in local pattern-generating circuits of the crayfish swimmeret system. J Neurophys. 110 (2), 344-357 (2013).
- Skinner, F. K., Mulloney, B. Intersegmental coordination of limb movements during locomotion: mathematical models predict circuits that drive swimmeret beating. J Neurosci. 18 (10), 3831-3842 (1998).
- Mulloney, B. During fictive locomotion, graded synaptic currents drive bursts of impulses in swimmeret motor neurons. J Neurosci. 23 (13), 5953-5962 (2003).
- Smarandache-Wellmann, C., Grätsch, S. Mechanisms of coordination in distributed neural circuits: Encoding coordinating information. J Neurosci. 34 (16), 5627-5639 (2014).
- Mulloney, B., Hall, W. M. Local commissural interneurons integrate information from intersegmental coordinating interneurons. J Comp Neurol. 466 (3), 366-376 (2003).
- Mulloney, B., Harness, P. I., Hall, W. M. Bursts of information: Coordinating interneurons encode multiple parameters of a periodic motor pattern. J Neurophys. 95 (2), 850-861 (2006).
- Smarandache, C., Hall, W. M., Mulloney, B. Coordination of Rhythmic Motor Activity by Gradients of Synaptic Strength in a Neural Circuit That Couples Modular Neural Oscillators. J Neurosci. 29 (29), 9351-9360 (2009).
- Smarandache-Wellmann, C., Weller, C., Mulloney, B. Mechanisms of Coordination in Distributed Neural Circuits: Decoding and Integration of Coordinating Information. J Neurosci. 34 (3), 793-803 (2014).
- Chrachri, A., Neil, D., Mulloney, B. State-Dependent Responses of 2 Motor Systems in the Crayfish, Pacifastacus leniusculus. J Comp Physiol A. 175 (3), 371-380 (1994).
- Chrachri, A., Neil, D. M. Interaction and Synchronization between 2 Abdominal Motor Systems in Crayfish. J Neurophys. 69 (5), 1373-1383 (1993).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) II. Synaptic Neuropils. J Comp Neurol. 234 (2), 182-191 (1985).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) I. Tracts in the Ganglionic Core. J Comp Neurol. 234 (2), 168-181 (1985).
- Mulloney, B., Tschuluun, N., Hall, W. M. Architectonics of crayfish ganglia. Microsc Res Techniq. 60 (3), 253-265 (2003).
- Braun, G., Mulloney, B. Cholinergic modulation of the swimmeret motor system in crayfish. J Neurophys. 70 (6), 2391-2398 (1993).
- Davis, W. J. Motoneuron Morphology and Synaptic Contacts - Determination by Intracellular Dye Injection. Science. 168 (3937), 1358-1360 (1970).
- Altman, J. S., Tyrer, N. M. Filling Selected Neurons with Cobalt through Cut Axons. Neuroanatomical Techniques. Strausfeld, N. J., Miller, T. A. , Springer. New York, NY. 373-402 (1980).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。