Method Article
准备,成像和定量的细菌表面运动性测定
摘要
Swarming motility is influenced by physical and environmental factors. We describe a two-phase protocol and guidelines to circumvent the challenges commonly associated with swarm assay preparation and data collection. A macroscopic imaging technique is employed to obtain detailed information on swarm behavior that is not provided by current analysis techniques.
摘要
细菌表面蠕动,如蜂拥,使用板测定法使得需要特定的琼脂的浓度,有时纳入特定营养素在生长培养基中通常检测在实验室。这样明确的培养基和表面生长条件的制备用于提供的有利条件,允许不仅细菌生长,但细菌过度薄液膜内的这些表面中的协调运动。群板等表面活力板试验的重复性可以是一个重大的挑战。尤其是对于更"温带游动"表现出只在0.4%琼脂范围-0.8%(重量/体积),在协议或实验室环境可以极大地影响群的测定结果小的改动蠕动。 "润湿性",或水含量以这些板试验中液 - 固 - 气界面,通常要控制的关键变量。在评估蜂拥另外一个挑战是如何量化Ø任何两个(或更多个)的实验之间bserved差异。下面我们详细介绍一款多功能两阶段协议的准备和图像群检测。我们有指引,规避通常与群试验介质制备并从这些实验数据的定量相关的挑战。我们具体地用细菌表达荧光或生物发光基因记者如绿 色荧光蛋白(GFP),萤光素酶(LUX操纵子),或细胞的污渍,使时间推移光学成像显示我们的方法。我们进一步证明我们的方法来跟踪在同一实验的竞争蜂拥物种的能力。
引言
许多细菌对移动使用自推进各种手段表面。一些蠕动表型可以在实验室中使用受与半固体平板测定组合物相关联的液体环境板测定法进行研究。有用的表面运动板测定法的子集进一步包括一个气相 - 典型的室内空气。因此,任何特定的表面运动检测的结果,需要小心控制的三相界面的:当地环境的固体表面,液体的环境中,和气体环境的特性。
在这样的三相测定中最常用的研究运动模式被称为蜂拥。蜂拥蠕动是通过在表面1薄液体膜推进通过鞭毛的细菌细胞的协调组运动。它通常是研究在使用含有0.4%-0.8%的半固体板测定(重量/体积)的实验室琼脂1。数组人类病原体利用这个动力的行为去探索和殖民人类宿主。例如, 奇异变形杆菌采用蜂拥蠕动拉升尿道,达到和殖民膀胱和肾脏2。蜂拥蠕动通常被认为是前体的步骤,以形成生物膜,发病机制在许多人类病原体3的首要原因。
蜂拥表型是细菌物种之间多种多样;实验成功和再现强烈依赖于因素,例如营养组合物,琼脂型和组合物,杀菌协议( 例如 ,高压灭菌),半固体介质固化,和环境湿度( 例如 ,季节变化),等等3-5。表面动力响应的变化强调了这些研究和显著影响,媒体和环境能发挥所遇到的挑战。对于一些蜂拥物种,如假单胞菌属 ,蜂拥MOTility可以发生在各种介质组合物中,虽然观察到的表型和伴随群膨胀率会相差很大3。结合这些因素,可以使表面蠕动的研究极具挑战性。实验室内的季节性变化可以影响这三个阶段试验:检测功能可以在潮湿的空气夏天更好,更糟糕的冬季的干燥空气。在这里,我们提出的一般准则进行表面蠕动板研究时,以规避一些最显着的挑战。
对于一些表面蠕动的研究,具体的表型的发展是极大的兴趣。大多数,但不是所有的,已发表 的研究以检查P的蜂拥假单胞菌显示卷须或分形从中心接种3-9辐射的形成。 P.之间的差异假单胞菌菌株已被记录5,8,但大部分的存在或不存在卷须可以归因于specifiC介质和协议用于这些群活力板试验。在这里,我们包括如何促进卷须形成群为P.细节铜绿假单胞菌 。由于P.铜绿假单胞菌只是众多蜂拥的细菌之一,我们还包括了我们的方法来检查枯草芽孢杆菌的蜂拥和滑翔粘细菌的细节。像P.铜绿假单胞菌 ,对B.目前的研究芽孢杆菌和M.球菌跨越主题为研究人员组成的数组正在辨别孢子,运动,应激反应和过渡行为1,10的各个方面。有必要进行量化,这些细胞中的特定行为(多个)的图案和动力学蜂拥基。
表面动力数据采集,分析和解释很麻烦和定性。我们已经开发出一种协议细菌群的详细的宏观分析,提供除了一窝蜂区形态和sIZE( 例如 ,直径),关于群膨胀率与细菌或生物制品的密度分布7定量的动态信息。此外,这种方法可以充分利用可用的荧光蛋白,发光,和染料,以获得细菌的相互作用8的全面视图,以及追踪生物制品的合成( 例如 , 铜绿假单胞菌鼠李糖脂7,8)一个群内。
研究方案
1.群试验培养基制备和接种4,5,7,8,11
- 媒体准备
注意:下面描述的介质组合物是适用于第绿脓杆菌卷须形成的研究。请参阅表1介质规格为P.铜绿假单胞菌,B.枯草芽孢杆菌 ,和M.球菌表面蠕动检测。- 通过用磁力搅拌棒搅拌下混合200毫升FAB-减去的(NH 4)2 SO 4群介质(材料表),将0.9g诺布尔琼脂和0.2克酪蛋白氨基酸( 表1)。用小体积(100-300毫升),以改善实验之间的一致性。
- 高压釜用22分钟,121.1℃的温度下曝光,和快速的通气选项的曝光时间200毫升琼脂/介质混合物。高压釜的设置将允许适当的消毒和琼脂融化,但以防琼脂焦糖。
注:高贵琼脂很容易出现焦糖化;细菌的活力被改变的焦糖琼脂。 - 该消毒周期已经完成后,立即关闭媒体瓶的帽上,以防止水的损失蒸发。但是,请注意紧封盖可引起"真空密封"在瓶状的效果。
- 冷却介质至50℃,在室温(RT)下搅拌的同时,加2毫升无菌1.2M的葡萄糖。或者,将媒体在60℃培养箱或水浴中待用(最多15个小时后),并按照指示。为了防止气泡在媒体上形成的,用磁力搅拌棒调匀;气泡琼脂将防止甚至蜂拥的表面上。
注:对于其他测定法,在此步骤,可以不进行高压灭菌,如附加的营养素或染料,根据需要热敏感部件添加( 例如 ,在加入每100毫升8微升英杰SYTO 63染料熔化的琼脂至图像分枝球菌所示在Representati已经结果,下同)。另外,一些染料的可能影响基线蜂拥行为,这应该对非染料控制进行检查。 - 在实验室罩,等分7.5毫升每直径60毫米的聚苯乙烯培养皿无菌介质并保持在一个单一的层中的板(未堆叠)。对于更大蜂拥表面,等分试样将25ml每100毫米直径的培养皿的介质。它以补偶数水平面上的菜是很重要的。用一个靶心,以检查是否表面平整。
注:对于P.假单胞菌测定法,使用每板的特定介质体积将改进的一致性和可重复性。对于B.芽孢杆菌和M.球菌测定,用手倾倒产生的结果堪比比容等分。
- 极板硫化
- 对于小板(60 MM),使熔化的琼脂培养基固化(均设置为半固体和干多余的液体)中发现的罩( 即没有盖)30分钟。较大板(100毫米)需要更长的固化时间(见讨论)。
注意:可替换地,一些测定法可能需要板以固化置于工作台顶部过夜(20-24小时)覆盖( 即 ,上盖)在一个单一的层( 表1)。蜂拥是既过剩和不足的水分敏感。湿度,气流和温度的任何给定实验室可能需要变化到板固化促进你细菌最佳蜂拥。 - 接种板后立即干燥的时期已经过去。不要存放板继续使用。
- 通过点样试验板用0.50%10微升混合物(体积/体积)希金斯防水黑色墨汁和细菌接种11执行"墨扩散试验"。如果油墨/接种物混合物扩散容易( 即不保留液滴形式)的媒体的表面上,该媒体将需要更多的时间来变干。
注:对于那些对湿度特别敏感物种(如P.铜绿假单胞菌 ),执行快速"墨蔓延测试"11,以确定这些板块都干够了。
- 通过点样试验板用0.50%10微升混合物(体积/体积)希金斯防水黑色墨汁和细菌接种11执行"墨扩散试验"。如果油墨/接种物混合物扩散容易( 即不保留液滴形式)的媒体的表面上,该媒体将需要更多的时间来变干。
- 对于小板(60 MM),使熔化的琼脂培养基固化(均设置为半固体和干多余的液体)中发现的罩( 即没有盖)30分钟。较大板(100毫米)需要更长的固化时间(见讨论)。
- 群试验接种
- 接种6毫升肉汤培养基( 见表1的详细信息)与来自新鲜(<5天,如果放置在室温下老)LB培养基(LB)平板培养一个孤立的殖民地。孵育肉汤培养过夜(≤18小时),在30℃或37℃的水平摇动(240转)。
- 通过发现与1-5微升过夜肉汤培养物,或通过"拨"接种群板用无菌齿琼脂接或导线接种针。
注意:我们优选后一种方法,因为它降低飞溅的接种物的可能性,并防止增加额外的水分,所述群表面积。
- 群孵化试验
- 对于一般的检测,孵化群检测板在30℃C或37℃(或甚至42℃下枯草杆菌 ; 表1) -这是特定细菌。孵育期间倒置平板,使多余的水分凝结在盖,而不是琼脂。
注:温度会影响表型和动力学。对于P.铜绿假单胞菌群,在37℃,导致更快的增长和扩张群比潜伏期在30°C;然而,这些群的形态往往不同于与该温度变化。 - 对于时间推移成像,孵化群板,在转移到成像站( 见表1详情)之前适当的温度。
注意:此预成像孵育允许群开始他们的发展和被移动到一个新的环境,这可能会或可能不会是最佳的蜂拥运动之前成为确立。
- 对于一般的检测,孵化群检测板在30℃C或37℃(或甚至42℃下枯草杆菌 ; 表1) -这是特定细菌。孵育期间倒置平板,使多余的水分凝结在盖,而不是琼脂。
表面运动性测定7,8 2.宏观成像
- 对于时间推移成像,预成像潜伏期地点群测定板上的清晰成像板商业体内成像站内之后。图像多达六个,直径60毫米或4,直径100毫米的板的时间。由于相机从成像平面之下拍摄图像,颠倒使得光学路径没有被阻挡8所述板。可替代地,孵育在30℃或37℃( 表1)在实验的持续时间,并取出板,以从培养箱中在设定的时间间隔成像。
- 地方的培养皿的盖子直立板块对应持有的接种媒体之上。填补了培养皿的盖子与水,以防止过度干燥成像过程中,并使用另一个明显的托盘,保持整个实验过程中的湿度将整个设置。
- 使用分子成像(MI)的软件12,执行使用即时测定(S)在室温下老化在表2中描述的设置。对于时间推移成像,设置了必要的步骤和规格的协议。
3.数据处理与解释7,8
- 图像处理
- 使用MI软件批量导出图像为16位TIFF文件:文件>导出或导出多个>选择文件(S)的出口和出口的位置。
- 使用ImageJ的打开一个图像或导入延时系列:
- 打开一个图像:文件>打开
- 进口时间推移图像序列:文件>导入序列,然后选择"类别名称数值"。
- 对于较大的延时文件,选择"导入序列"窗口"使用虚拟栈",以导出图像叠加到适当的类别( 如 GFP,RFP 等 )。
- 如果需要,改变图像从16位文件到8位文件:图像>类型> 8位
注:有些ImageJ的工具需要8位图像。 - 确定是否需要亮度信号的图像或时间推移序列反转。广场上的一个亮点图像( 如荧光标记的增长)的光标,并注意从工具栏中ImageJ的信号强度"值"。然后,将光标放在盘区外的暗斑,并注意信号强度。如果为暗斑的信号强度比强度为亮点越大,图像信号的强度需要被反转(按照子步骤1-2所示)。
- 反转强度信号:编辑>反转
- 反转查找表:图像>查找表>反转LUT
- 减去背景:流程>减去背景,并使用"滚动球的半径"用像素半径是半个图像尺寸(之一例如 ,1000像素为2,000×2000 Pixel图像)。
- 人为色彩图像或延时序列:图像>查找表,然后从列表中选择相应的颜色。
- 电影具有两个或更多个通道,合并和平衡的颜色之前保存作为电影(图像处理中,步骤8)。要合并在一起的图像,在开放ImageJ的所有图像栈,然后选择图像>颜色>合并通道,每个堆栈分配给一个颜色通道。
- 节省时间推移顺序为AVI或QuickTime电影:文件>另存为,然后选择所需的格式和规范。
- 数据分析
- 收购细菌表面增长区,以量化膨胀率
- 在ImageJ的打开图像(S)
- 为了计算该板在象素的直径,画出穿过测定板的中心的线与来自"直线"工具,并测量它的长度:分析>测量
- 在ImageJ的默认测量单位是圆周率XEL。通过将测定板的直径( 例如 ,60到60毫米板)通过在前面步骤中获得的象素长度得到的换算因子。
- 从像素更改计量单位,以毫米:图像>属性
- 改变"单位长度"到"毫米",和"像素宽度","像素高度"和"体素深度",以在先前的步骤中计算出的换算因子。选择"全球"框保持在多个图像这种转换的因素。
注意:如果ImageJ的关闭并重新打开,或视图像的场被改变( 即 ,一个图像被放大时多于另一个),转换系数必须重新计算。替代地,执行所有的分析在像素,然后转换为毫米。
- 改变"单位长度"到"毫米",和"像素宽度","像素高度"和"体素深度",以在先前的步骤中计算出的换算因子。选择"全球"框保持在多个图像这种转换的因素。
- 对于每一帧,跟踪和使用"手绘选择"工具,在工具栏中跟踪OU测量群区域使用群的TLINE并测量面积:分析>测量。这将产生一个测量记录可以保存,以便进一步分析在Microsoft Excel或类似的程序:文件>另存为
- 收购细菌表面生长强度量化表面增长率
- 一旦背景减去(图像处理中,步骤5),使用该序列的最后一帧,以确定群(数据分析,步骤1)的最大面积。
- 从工具栏使用"椭圆"选择工具画一个框周围的细菌表面生长。
- 将意味着使用在框中像素的强度测量:分析>设置测量,然后选择"平均灰度值"。
- 以获得强度测量信号在时间推移序列中的每个帧,而该序列的第一帧上转到:分析>措施。这将产生一个测量记录可以保存为进一步分析弥crosoft Excel或类似的程序:文件>另存为
- 替代在上一节(数据分析,步骤2)。使用ImageJ的宏插件安装和运行宏表面生长强度测量的脚本。
- 设置一个自动测量的脚本来分析多个帧同步:插件>新建>宏,并粘贴提供的脚本(下同)入禁区,并保存为ImageJ的宏文本文件:文件>保存,并保存到下"的ImageJ的应用程序文件夹宏"。
numberOfFrames = N
对于(i = 0; I 运行("办法");
运行("下一个片[>]');
}
注意:在这里,变量"N"是用于帧的未定义数量。 - 编辑中的宏插件每个实验的"numberOfFrames",以反映之前运行脚本的帧的图像序列中的数目。用途:插件>宏>编辑,并输入序列中帧的正确数量和保存(文件>保存)。
- 按照子步骤1-3中的数据分析,第2步,并同时在序列的第一帧上运行宏插件:插件>宏>运行。这将产生一个测量记录可以保存,以便进一步分析在Microsoft Excel或类似的程序:文件>另存为
- 设置一个自动测量的脚本来分析多个帧同步:插件>新建>宏,并粘贴提供的脚本(下同)入禁区,并保存为ImageJ的宏文本文件:文件>保存,并保存到下"的ImageJ的应用程序文件夹宏"。
- 收购细菌表面增长区,以量化膨胀率
结果
变化板的准备也极大地影响蜂拥蠕动。浇注融化的琼脂培养基后固化或干燥时间的影响的薄液体膜存在于表面的蠕动的测定和细菌运动性随着时间的推移。变化的营养组合物也影响蜂拥几个细菌。 图1A示出根据印度油墨的铺展和枯草芽孢杆菌的初始接种物的铺展干燥时间的短期效应11。 图1B示出的干燥时间和图1C示出的效果的硫酸铵[(NH 4)2 SO 4]的影响在随后的卷须发展由蜂拥P.铜绿假单胞菌 5。
量化的数据可以从表面蠕动使用多个成像策略端点图像来获得的。 图2示出了代表性的表面生长的结果 P。铜绿假单胞菌蜂拥及其相关的GFP荧光图像; B.枯草蜂拥和其相关联的生物发光图像;和粘细菌表面生长和SYTO的相关的红色荧光图像64染色的细胞。
扩大数据采集不仅仅是检查和终点结果成像允许的动态行为(S)的表面生长的细菌的研究。 图3 7显示P.的例子假单胞菌蜂拥(摄像的GFP表达细胞),并从这些图像数据的-The量化也被显示,以显示P的膨胀率及其相关的鼠李糖脂的生产(使用尼罗红脂质染色摄像) 假单胞菌蜂拥。 视频1示出的时间推移B的使用勒克斯 -expressing菌株发光杆菌蜂拥成像。 视频2 8示出的时间推移P的铜绿假单胞菌 (绿色表达GFP)和沙门鼠伤寒沙门氏菌(红色表达勒克斯 )在竞争群分析。
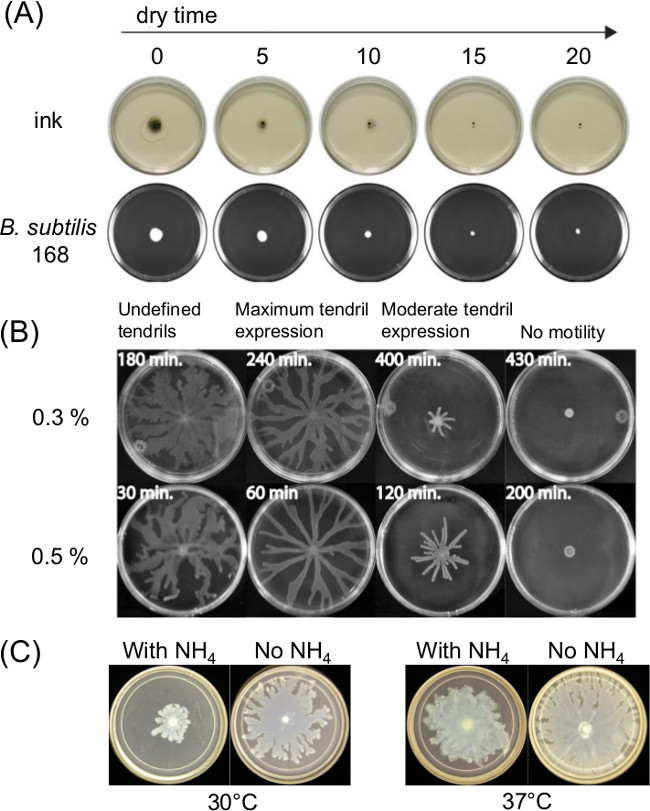
图1:对影响测定结果的影响(A) 的琼脂干燥时间在琼脂表面水分和接种物为B.扩频因子在表面蠕动测定制备实施例 杆菌 (参考文献8),(B)的琼脂的干燥时间上P.铜绿蜂拥和(C)存在或不存在硫酸对P.铵(从参考文献5经许可转载) 铜绿蜂拥和卷须形成。
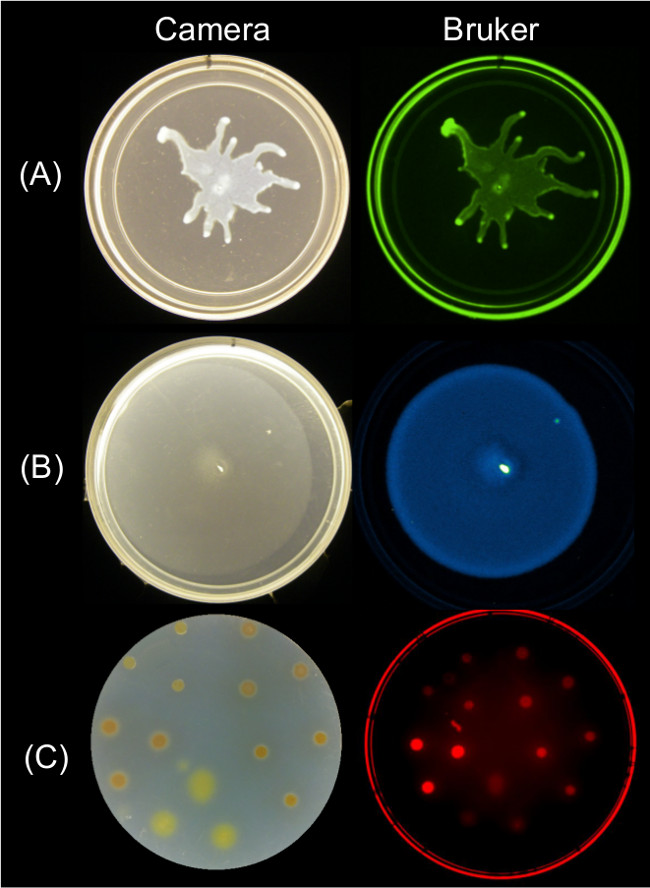
图2:Alternati已经对使用Bruker成像站。边由照相机(左)侧图像和布鲁克图像(右)示出(A) 的 第细菌成像表面生长和运动的方法铜绿假单胞菌表达GFP-成像使用绿色荧光设置,(B)B.枯草表达勒克斯记者生物发光成像使用发光的设置,以及(C)M.沾上SYTO 球菌用红色荧光II设置64成像。 见表2设置细节。
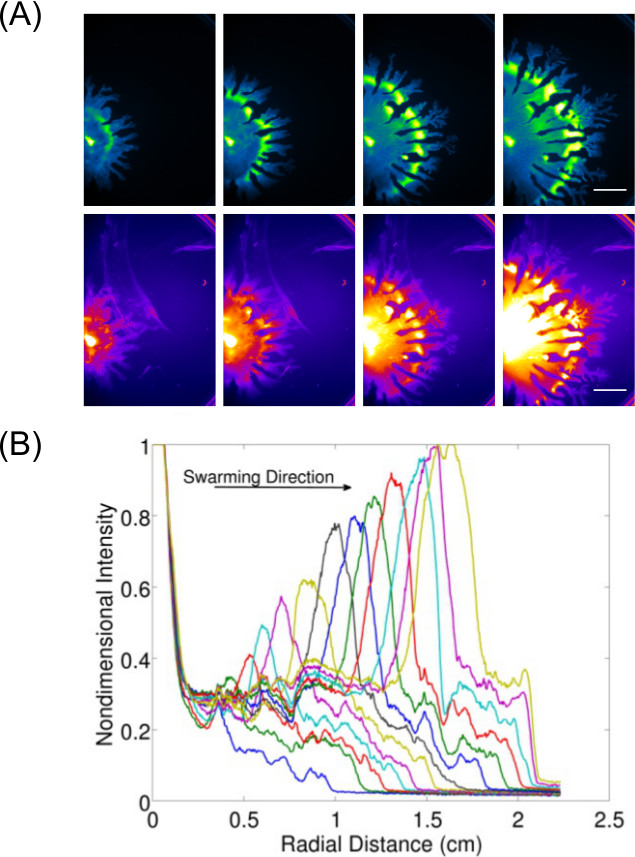
图3:表面运动检测的定性和定量分析 ( 一 )时间推移细胞密度分布的分析,鼠李糖脂生产(尼罗红脂染色使用红色荧光成像我的设置;比例尺扩张速度从P的细胞密度分布的图像的长度为15 mm),和(B)的定量铜绿假单胞菌群。 (转载自编号6的许可。)
视频1。一个B.时间推移成像枯草群。B. 枯草芽孢杆菌表达勒克斯和使用发光的设置进行拍摄。 见表2设置细节。
视频2。种间竞争的可视化按时间推移成像。P.的成群铜绿假单胞菌 (绿;表达GFP,并使用绿色荧光的设置进行拍摄)和S.沙门鼠伤寒沙门氏菌(红色; EXPRES唱勒克斯和使用发光设置)记录。 见表2设置细节。 (转载自编号7的许可。)
| 铜绿假单胞菌 | 铜绿假单胞菌卷须形成研究 | 枯草芽孢杆菌 | M.球菌 | |
| 隔夜肉汤培养基 | FAB加30毫米的葡萄糖 | FAB加30毫米的葡萄糖 | 磅 | CTT |
| 隔夜肉汤培养孵化温度 | 37℃ | 37℃ | 37℃ | 30小时在30℃下 |
| 群媒体 | FAB | FAB负(NH 4)2 SO 4的 | 2%(重量/体积)的LB | CTT |
| 群媒体:附加组件 | 12 mM的葡萄糖 | 10%(重量/体积)的CAA,12毫葡萄糖一 | N / A | SYTO®64 |
| 琼脂类型 | 琼脂,高贵 | 琼脂,高贵 | 颗粒状琼脂 | 琼脂,高贵Affymetrix公司 |
| 琼脂浓度(重量/体积) | 0.45% | 0.45% | 0.60% | 1.50% |
| 群板尺寸 | 60毫米 | 60毫米 | 100毫米 | 150毫米 |
| 每盘介质卷 | 7.5毫升 | 7.5毫升 | 手浇 | 手浇 |
| 群媒体设置/干燥的方法 | 油烟机;板破获 | 油烟机;板破获 | 台式;板覆盖 | 台式;板覆盖 |
| 群媒体设置/干燥时间 | 30分钟 | 30分钟 | 隔夜(20 -24小时) | 隔夜(20 -24小时) |
| 群试验孵化温度 | 30或37℃ | 30℃ | 37℃ | 30℃ |
| 孵育时间推移成像 | 30℃至少4小时 | 30℃至少4小时 | 37℃2小时 | RT下12小时 |
| 定时捕获长度 | 24小时 | 24小时 | 10小时 | 66小时 |
| 定时设置 | 1帧/ 10分钟 | 1帧/ 10分钟 | 1帧/ 6分钟 | 1帧/ 10分钟 |
| 高压灭菌后添加。 | ||||
表1:规格表面运动性实验的准备工作包括表面动力试验制剂规格为P.铜绿假单胞菌,B.枯草芽孢杆菌 ,和M.球菌 。
| 信号 | 绿色荧光 | 红色荧光我 | 红色荧光II | 发光 |
| 蛋白质或染料 | 绿色荧光蛋白(GFP) | mCherry蛋白或尼罗红染色鼠李糖脂 | SYTO®64 | 从勒克斯操纵子的荧光素酶 |
| 激发波长(nm) | 480±10 | 540±10 | 590±10 | 离 |
| 发射波长(nm) | 535±17.5 | 600±17.5 | 670±17.5 | 没有过滤器 |
| 曝光时间(秒) | 三十 | 60 | 60 | 240 |
| F-停止 | 4 | 4 | 2.5 | 1.1 |
| FOV(毫米) | 190 | 190 | 140 | 120 |
| 焦平面(毫米) | 27.5 | 27.5 | 12.2 | 4 |
| 分级(像素) | 无 | 2×2 | 无 | 8×8的 |
表2:成像规范布鲁克成像站的规格为红色和绿色的荧光,和细菌表面生长发光成像。
讨论
实现可再现蜂拥在实验室可以是具有挑战性的,因为群的测定是于环境因素,如湿度和可用养分高度敏感。一个表面运动板测定法的最重要的方面是湿气在琼脂表面。在接种前,群媒体必须有足够的干燥,防止细菌细胞来自全国各地的表面液体游泳,但不能这么干,以抑制蜂拥蠕动5。孵化应在足够潮湿的环境:太少水分可导致在测定中干燥出来孵育期间,而过多的水分可导致人工或人为的表面扩散。除非湿度控制的孵化器在手,孵化器和实验室湿度相差很大。因此,一个附加的储水器,加湿器,或除湿培养箱内可能需要防止过度干燥或过量湿气的积累,同时保持relat香港专业教育学院附近湿度80%。保持这种理想的湿度可能具有挑战性,如果季节湿度变化显著。如果是这样的情况下,该群测定方案将需要一些调整以考虑季节变化湿度。我们已发现,修改群介质干燥时间调整为季节性湿度变化最简单的方法。恒定的湿度监测,内外孵化器外,值得推荐。此外,建议的研究人员进行校准和验证他们的乐器,孵化器,秤等中的温度,体积小的错误或媒体组分的量可以影响这些测定的可重复性。
还应当指出的是,在测定中使用的板的类型和尺寸可以影响板的水分,并且因此蜂拥。密闭板不泄掉多余的水分,从而鼓励游泳运动。相比之下,开放式面板允许过多的水分逃逸。培养皿提供了一个理想的环境,因为它通风口关闭足够的多余水分,以防止液体积聚,但保留足够的水分,以防止介质干燥。这种方法详细介绍了表面动力试验协议,允许高品质的影像。为了保持琼脂清晰的成像直径60mm的培养皿充满7.5毫升琼脂培养基中。如果不需要详述成像,体积达到20ml也能提供可重复的结果。
而蜂拥蠕动可在琼脂浓度的宽阵列来实现,需要蜂拥琼脂的最佳范围取决于物种。总体而言,较高的琼脂浓度则抑制蜂拥蠕动,因此所需的时间,以产生一个图像就绪群增加。P.假单胞菌群通常在琼脂浓度之间0.4-0.7%1,但我们发现,最优蜂拥发生在窄得多的范围(0.4-0.5%)。其它如B.芽孢杆菌和S.肠一大群在0.6%琼脂和副溶血性弧菌在1.5%琼脂10。所需的琼脂浓度也由琼脂的类型和品牌来确定。纯度较高的琼脂,像贵族琼脂,大力提升蜂拥在P.假单胞菌和优于造粒琼脂13,14。然而,琼脂的这些纯化的版本也更容易出现在高压釜灭菌周期焦糖;取决于仪器,缩短/改性灭菌序列(至可能改变排气循环,以防止长时间的热接触),可能需要使用诺布尔琼脂制备群介质。
媒体组成也起着观察群的表型3的作用。P.铜绿假单胞菌蜂拥动力的研究通常执行使用最小的营养介质。我们优选FAB培养基4,8-( 材料数据表),但其他媒体,如M9,LB或轻微变化到这些公共媒体已成功9,15,16使用。卷须形成在补充有葡萄糖作为碳源和酪蛋白氨基酸(CAA)。FAB基本培养基最好地实现,但没有附加的氮源( 例如 ,(NH 4)2 SO 4)6,13-。如果卷须形成或形态不研究的主要焦点,然后FAB最小培养基( 材料表; 表1)缺乏CAA的建议,使得特定碳源和/或另外的营养物的影响可以进行详细的研究。其它物种,如B.枯草芽孢杆菌 (这里介绍),是通用游动,能够在蜂拥LB和颗粒状琼脂。这些品种蜂拥而上容易,只需要〜10小时,开发出全群。这种快速蜂拥速率使得继群潜在的困难的进展,但我们的协议使得这种跟踪非常可行的。执行群延时成像能力提供了一个substanTiAl基缓解群数据采集,尤其是从这样的狂热游动。
我们引入了强大的,全面的,两阶段协议和准则,旨在提高执行力和细菌表面蠕动研究的可重复性,并主要强调的方面的重要研究鞭毛介导的蜂拥。这个群试验协议细节的媒体组成和操作面蠕动板的重要方面,为内部和之间的研究小组更大的一致性和可重复性。这将改善不同的研究研究之间比较的基础。此外,所提出的方法和协议提供手段,使上蜂拥和表面蠕动研究较少受环境变化通过使研究人员知道,这样的因素会影响他们的工作,并提供可能的解决方案( 例如 ,在琼脂的小变化是如何影响蜂拥4,5- )。此外,该协议提供量化蜂拥宏观方面,提供了一个机会来衡量的细菌表面生长的许多属性这在以前是无法量化的。
我们还没有检查所有表面活动细菌在这个协议的发展。因此,它预期的协议的修改将需要在这里没有呈现物种。该协议的效率是由所采用的设备和材料的固有界限的限制。例如,与温度相关的研究是不可能的,因为尚未与布鲁克成像站中,由于温度控制不是设备的一个特征。此外,使用染料(如尼罗红染色鼠李糖脂)可具有的动能和浓度限制8。这种技术强烈依赖于处理和数字图象数据;数据分析的改进的自动化( 例如 ,使用附加的宏中的ImageJ脚本函数)将减少分析所需的时间和扩展数据的有效性。最后,由于所述成像协议的鲁棒性,未来的应用程序的目标应该是扩大该技术,研究较不均匀的生长表面是更相关的受环境和致病的细菌定植的表面。
披露声明
这篇文章出版费用由布鲁克公司被部分赞助。
致谢
(;以MA和JDS R01GM100470和1R01GM095959-01A1)和来自印第安纳州的临床与转化科学研究所的核心设施补助(由美国国立卫生研究院资助#UL1 TR000006部分资金,由美国国立卫生研究院提供的这项工作的部分支持JDS)。
材料
| Name | Company | Catalog Number | Comments |
| Reagentsa | |||
| FAB Minimal Media: | Prepare every ~4 weeks. Top to 1 L with nanopure H2O. | ||
| (NH4)2SO4 | Sigma | A4418 | 2 g. Not used in P. aeruginosa tendril formation studies. |
| Na2HPO4 x 7H2O | Sigma-Aldrich | S9390 | 9 g |
| KH2PO4 | Sigma | P5655 | 3 g |
| NaCl | BDH | BDH8014 | 3 g |
| MgCl2 x 6H2O solution (198 g/L) | Fisher Scientific | M33 | 1 ml |
| CaCl2 x 2H2O solution (14 g/L) | Fisher Scientific | C79 | 1 ml |
| Trace metal solution (see below) | n/a | n/a | 1 ml |
| Trace Metal Solution: | Top to 1 L with nanopure H2O. Maintain in a glass bottle, stirring and covered with foil. | ||
| CaSO4 x 2H2O | Sigma-Aldrich | 255548 | 200 mg |
| MnSO4 x H2O | Sigma-Aldrich | M7634 | 20 mg |
| CuSO4 x 5H2O | Fisher Scientific | C493 | 20 mg |
| ZnSO4 x 7H2O | Sigma-Aldrich | Z4750 | 20 mg |
| CoSO4 x 7H2O | Sigma-Aldrich | C6768 | 10 mg |
| NaMoO4 x 2H2O | Sigma | S6646 | 10 mg |
| H3BO3 | Fisher Scientific | A74 | 5 mg |
| FeSO4 x 7H2O | Sigma-Aldrich | F7002 | 200 mg |
| CTT Media: | Prepare as needed. Top to 100 ml with nanopure H2O. | ||
| Tris-HCl, 1 M solution (adjust to pH 8.0) | Amresco | 0234 | 1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 8.0 and filter sterilize (0.2 μm pore). |
| K2HPO4, 1 M solution (adjust to pH 7.6) | Sigma-Aldrich | P3786 | 0.1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 7.6 and filter sterilize (0.2 μm pore). |
| MgSO4 solution | Fisher Scientific | M65 | 0.8 ml. Prepare a 1 M stock solution in nano pure H2O. Filter sterilize (0.2 μm pore). |
| Casitone | BD Diagnostics | 225930 | 1 g |
| Additional Reagents: | |||
| LB Broth, Lennox | BD Diagnostics | 240230 | 2% (wt/vol) |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | 30 mM for overnight broth cultures; 12 mM for swarm media. Prepare a 1.2 M filter sterilized stock solution in nano pure H2O. Add to media after autoclaving. |
| Casamino acids (CAA) | Amresco | J851 | 0.10% (wt/vol). Recommended for P. aeruginosa tendril formation studies. Add to media prior to autoclaving. |
| Agar, Noble | Sigma-Aldrich | A5431 | 0.45% (wt/vol). Preferred Noble agar for P. aeruginosa surface motility studies. Add to media prior to autoclaving. |
| Agar, Noble | Affymetrix | 10907 | 1.50% (wt/vol). Used in M. xanthus surface motility studies. Not recommended for P. aeruginosa motility studies. Add to media prior to autoclaving. |
| Agar, Granulated | Fisher Scientific | BP1423 | 0.60% (wt/vol) |
| Higgins Waterproof Black India Ink | Higgins | HIG44201 | 0.50% (vol/vol). Mix ink with inoculum to test swarm media surface moisture. |
| SYTO® 64 Red Fluorescent Nucleic Acid Stain | Invitrogen | S-11346 | Use 4 μl (for P. aeruginosa) or 8 μl (for M. xanthus) of SYTO® 64 per 100 ml of molten agar (added after autoclaving). |
| Relevant Materials and Equipment | |||
| Petri dish, sterile, 150 mm x 15 mm (Dia. x H) | VWR | 25384-326 | |
| Petri dish, sterile, 100 mm x 15 mm (Dia. x H) | VWR | 25384-342 | |
| Petri dish, sterile, 60 mm x 15 mm (Dia. x H) | VWR | 25384-092 | |
| In-Vivo Xtream | Bruker | Use for the macroscopic imaging of surface motility studies. http://www.bruker.com/products/preclinical-imaging/opticalx-ray-imaging/in-vivo-xtreme/overview.html | |
| Bruker MI software | Bruker | http://www.bruker.com/fileadmin/user_upload/8-PDF-Docs/PreclinicalImaging/Brochures/MI-software-brochure.pdf | |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| aSee MSDS of reagents for handeling and disposal information. | |||
参考文献
- Kearns, D. B. A field guide to bacterial swarming motility. Nature Reviews: Microbiology. 8 (9), 634-644 (2010).
- Burall, L. S., et al. et al.Proteus mirabilis. genes that contribute to pathogenesis of urinary tract infection: Identification of 25 signature-tagged mutants attenuated at least 100-fold. Infection and Immunity. 72 (5), 2922-2938 (2004).
- Shrout, J. D., et al. The impact of quorum sensing and swarming motility on Pseudomonas aeruginosa. biofilm formation is nutritionally conditional. Mol Microbiol. 62 (5), 1264-1277 (2006).
- Kamatkar, N. G., Shrout, J. D. Surface hardness impairment of quorum sensing and swarming for Pseudomonas aeruginosa. PLoS One. 6 (6), e20888 (2011).
- Tremblay, J., Déziel, E. Improving the reproducibility of Pseudomonas aeruginosa. swarming motility assays. Journal of Basic Microbiology. 48 (6), 509-515 (2008).
- Caiazza, N. C., Shanks, R. M., O'Toole, G. A. Rhamnolipids modulate swarming motility patterns of Pseudomonas aeruginosa. Journal of Bacteriology. 187 (21), 7351-7361 (2005).
- Du, H., et al. High density waves of the bacterium Pseudomonas aeruginosa. in propagating swarms result in efficient colonization of surfaces. Biophysical Journal. 103 (3), 601-609 (2012).
- Morris, J. D., et al. Imaging and analysis of Pseudomonas aeruginosa. swarming and rhamnolipid production. Appl Environ Microbiol. 77 (23), 8310-8317 (2011).
- Tremblay, J., Richardson, A. P., Lépine, F., Déziel, E. Self-produced extracellular stimuli modulate the Pseudomonas aeruginosa. swarming motility behaviour. Environmental Microbiology. 9 (10), 2622-2630 (2007).
- Partridge, J. D., Harshey, R. M. Swarming: flexible roaming plans. J Bacteriol. 195 (5), 909-918 (2013).
- Patrick, J. E., Kearns, D. B. Laboratory strains of Bacillus subtilis .do not exhibit swarming motility. Journal of Bacteriology. 191 (22), 7129-7133 (2009).
- . . Molecular Imaging. , (2014).
- Harshey, R. M., Matsuyama, T. Dimorphic transition in Escherichia coli. and Salmonella typhimurium.: surface-induced differentiation into hyperflagellate swarmer cells. Proceedings of the National Academy of Sciences, USA. 91 (18), 8631-8635 (1994).
- Rashid, M. H., Kornberg, A. Inorganic polyphosphate is needed for swimming, swarming, and twitching motilities of Pseudomonas aeruginosa. Proc Nat Acad Sci U.S.A.. 97 (9), 4885-4890 (2000).
- Caiazza, N. C., Merritt, J. H., Brothers, K. M., O'Toole, G. A. Inverse regulation of biofilm formation and swarming motility by Pseudomonas aeruginosa. PA14. Journal of Bacteriology. 189 (9), 3603-3612 (2007).
- Kuchma, S. L., et al. Cyclic-di-GMP-mediated repression of swarming motility by Pseudomonas aeruginosa.: the pilY1. gene and its impact on surface-associated behaviors. J Bacteriol. 192 (12), 2950-2964 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。