需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
通过电场诱导释放和测量(EFIRM)检测外体生物标志物
Erratum Notice
摘要
Exosomes are microvesicular structures found within biofluids that potentially carry important disease discriminatory biomarkers. Here, a novel method is used to specifically extract exosomes and rapidly test the exosomal cargo for both RNA/protein targets following the disruption of exosomes using non-uniform electric cyclic square waves.
摘要
外来体是起到间通讯中介的作用,小泡结构。这是研究的外来体的内部货物以确定它们是否携带疾病的生物标志物的歧视性的兴趣。用于执行外来体分析,有必要开发用于提取和分析来自靶生物流体的外来体,而不会损坏内部内容的方法。
电场诱导释放,并测量(EFIRM)是用于具体提取外来体从生物流体,卸载他们的货物,并测试其内部的RNA /蛋白质含量的方法。使用抗人类CD63特定抗体的磁性微粒,外来体被首先从生物流体中沉淀。以下提取,低压电环状方波(CSW)被施加到破坏泡囊膜而引起的货物装卸。外来体的含量杂交固定在电极表面,用于QUA的DNA引物或抗体的ntification分子内容。
该EFIRM方法是有利的提取外来体和卸载货物中的分析,而无需裂解缓冲液。该方法是能够执行RNA和蛋白质生物标志物的目标的特异性检测,在外来体中。 EFIRM提取具体地说明在其表面上的标记的外来体,而不是基于大小的技术。
透射电子显微镜(TEM)和测定表明该方法对于外来体捕获和分析的功能。该EFIRM方法用于外来体注射人肺癌细胞H640 9小鼠的分析,以测试它们的外来体信息对11只小鼠接受盐水对照(转染以表达外来体标记人类CD63-GFP的细胞系)。外体生物标志物水平升高(参照基因GAPDH和蛋白质表面标志CD63人-GFP)被发现的H640小鼠注射血清和唾液样本。此外,贝VA和血清样品证明具有线性关系(r = 0.79)。这些结果暗示对唾液外来体的生物标志物用于检测远端疾病的可行性。
引言
切体研究是调查的一个新兴领域,它检查携带RNA 1,DNA 2和3的蛋白脂类货物微泡。以前的调查外来体生物学已经导致鉴定外来体的生物流体诸如血液4,尿5,母乳6和唾液7。研究表明,外来体发挥不同细胞途径的作用,远程沉思的体8的不同系统之间的通信。的作用,因为外来体在细胞间通讯玩,假定它们可以打包与疾病状态相关的生物分子靶(蛋白质,RNA和DNA)。 体外 3和动物模型9的研究显示为证实这一假设。在调查的生物标志物发现外来体的内容,有必要制定从生物液体选择性切体隔离的方法,诱导expulsi货物从外来体,和切体生物分子的定量。在这项工作中的程度,外来体将被定义为具有直径为约70-100纳米,具有表面标记CD63的结构。
研究人员通常先净化外来体由超速10,然后经过加工裂解液袋使用外体内容。裂解缓冲液的方法的使用需要的孵育时间范围从数分钟到数小时。这个过程可能会潜在危害的外来体货,导致样品降解。例如,通过裂解缓冲液释放到周围的细胞外环境唾液外来体RNA具有的半衰期小于1分钟,使得外来体RNA后裂解的测定缓冲一个特别困难的任务不添加稳定化试剂11。添加各种试剂溶解和稳定的配合作用可以引入该复杂化剂和干扰ANALYSIS的外来体内容。另一种做法可以是用于快速卸外来体内容并安全地保存货物为表征很有帮助。
在这项工作中,我们提出了一个非均匀电场的用法的外来体内容的释放。电场已被公知的携带极化和破坏形成细胞膜脂双层的能力。我们的实验工作探索不均匀环状方波(CSW)的用法用于破坏外来体的微泡结构和释放运载的货物。这种方法在几百毫伏范围内使用电压,这意味着大多数生物分子不会中断。我们表明,环状方波的使用能够致动的唾液mRNA的外来体内容释放进入周围环境中的流体。此释放的外来体内容无缝地与可用于量化生物标志物表达水平的电极系统集成12,13,该提出的方法允许快速,灵敏,和裂解缓冲液不含外来体含量分析。

图EFIRM工作流1.概述。该EFIRM方法大致分为三个主要阶段所必需的纯化和分析外来体。
这个CSW基于外来体内容释放和分析方法被用在与CD63的特异性磁微珠为外来体隔离结合使用。这些CD63亲和力磁珠允许从唾液样品(和其他生物流体)的外来体的选择性分离。在温育和提取使用磁化珠的外来体,珠粒被迁移到的CSW基于内容发布和实验分析部的电化学传感器系统。 图1给出了工作的概述流动EFIRM方法。
研究方案
1.基于磁珠的外来体提取
- 吸管5微升链霉亲和涂层的磁性体微粒的充分混合的溶液加入495微升磷酸盐缓冲盐水(PBS)缓冲液中离心管,以重悬珠子。用磁力架洗,重悬珠用500μlPBS中的3倍。机架是磁体上的壳体单元,可容纳的样品的离心管的侧阵列。
- 对于每一个洗,先让管子坐在架1分钟,然后用枪头小心地取出上清缓存,而不会干扰珠。
- 放置在常规机架管子而不磁铁在侧。添加500微升PBS入管,并使用移液管以混合溶液和珠在一起。然后把管背面磁性机架上再次从溶液中分离磁珠。
- 通过磁化和再悬浮在PBS中执行此清除缓冲区总共三次。此进行磁性粒子的初始洗涤。
- 重悬珠子到490微升的PBS缓冲液中,与管放置在磁性支架的非磁化部。吸管5微升生物素化的小鼠抗人CD63抗体以1.0mg / ml储备浓度成珠的混合物。使用吸移管以混合珠和抗体在溶液中。
- 将离心管与珠和生物素标记抗体的混合物样品上肩。设置的旋转器参数为往复旋转样品旋转器,在90°倾斜5秒,并在5℃振动1秒。旋转样品珠混合物在管的这些参数在室温30分钟。
- 结合后,除去未结合的抗体。
- 以下旋转在室温30分钟后,将管背磁架中5分钟。
- 通过使用微量吸管除去液相执行珠粒洗涤三次并清洗用500μ;升PBS的。三重洗涤后,悬浮于机架的非磁化部分在490微升酪蛋白的PBS和地点的珠子。
- 外来体提取使用抗体包被的珠子。
- 标记每个管有针对性的样品ID。吸取血清或唾液的10微升样品放入离心管中。使用吸管吹打几次以混合样品和磁性珠粒。
- 放置与旋转器样品和抗人CD63抗体的珠子的管子和旋转2小时,在室温。如在步骤1.2中所述使用相同的旋转器的参数。
- 以下的2个小时的样品旋转的,由磁化分离珠从溶液中去除液体相用微量吸管,并在500微升的Tris-HCl缓冲液重悬珠子进行三重洗涤。所得珠粒现在结合到外来体,并准备对电场释放和测量。
2.电场感应发布了次外体含量的测定
- 电极的初始与预涂底漆GADPH
- 适用于塑料以及一个电极阵列,以防止交叉污染的个别电极。对于这个实验,使用16传感器电极阵列与每个单元的电极由一个工作,计数器,和参考制成的裸金电极的阵列中。
- 吹打库存试剂与超纯蒸馏水的管制备股票混合物100nM的DNA探针,0.3M KCl和10mM的吡咯。涡旋调匀。
注:在本研究中,所选择的DNA探针对应于GAPDH基因的参考,这是公知的外来体中存在。所使用的探针序列是:5'-生物素 - AGGTCCACCACTGACACGTTG-3'。上所有的电极使用此混合物。 - 吸管上各金电极的表面60微升单体-DNA探针混合物。检查电极,以确保有工作角的足够的覆盖范围ounter,和参考电极由液体混合物。
- Electropolymerize单体探针混合物通过施加环状方波(CSW)电场分布到电极表面,以创建在电极表面上的导电聚合物层。该电场由申请350 mV的9秒,并立即切换到950毫伏1秒。应用此环状方波剖面向电极对10个循环,共100秒施加的电场的。
- 冲洗传感器表面3次,用蒸馏水和干氮气以从电极表面除去液体。确保液体从电极适当除去。
- 切体卸货
- 负载5微升1μM的一个探测器探测到495微升珠外来体复合物的混合物,并使用移液管混合。
注:检测探针是偶联于荧光素分子在3'末端的DNA引物序列。该探测器概率用于此留学e序列对应于外来体中找到的GAPDH的mRNA。荧光素缀合的检测探针的序列是:5'-GCAGTGGGGACACGGAAGGCC荧光素-3'。 - 吸管上与下一个磁体阵列金电极表面60微升探针和珠子的外来体复合物的混合物。这种磁体阵列由排列以对应于所述传感器的工作电极162.54毫米直径的钕磁铁。 图2A示出的放置在磁铁和珠外来体溶液。
- 一旦样品在电极表面上加载,应用20个周期的CSW电场与9秒,在-300毫伏和1秒,200毫伏(200秒计)。被释放的外来体的货物将杂交到引物的电极的表面上。如果外来体的表面标记是调查对象,跳过实验的这一部分。 图2B示出了这个过程。
- 洗掉由三重漂洗电极表面用蒸馏水在电极表面上的未结合的分析物。干燥氮气的电极。
- 负载5微升1μM的一个探测器探测到495微升珠外来体复合物的混合物,并使用移液管混合。
- 记者抗体和读出
- 加入60微升150单位/ ml的抗荧光素抗体缀合到辣根过氧化物酶(在1 HRP:1,000稀释度)稀释于酪蛋白/ PBS中。
- 使用电场驱动的缀合复合物的抗荧光素HRP到探针三明治。申请-200毫伏为1秒和500毫伏,1秒,5个循环到电极表面上。 图2A示出了用于两个蛋白质和核酸的系统的捕获和检测探针复合物。
- 使用蒸馏水和干氮气三重洗涤传感器表面。
- 继洗掉未结合的多余的抗荧光素抗体的,加入60微升的3,3',5,5'-四甲基联苯胺(TMB)底物。装载在该基板上,以使用多通道移液管的每个传感器的表面上。
- 通过测量电极的电流在-200毫伏为60秒,使用能够16路同时测量的电化学电位执行当前的安培读数。 图2C是在读出期间电流分布的一个例子。
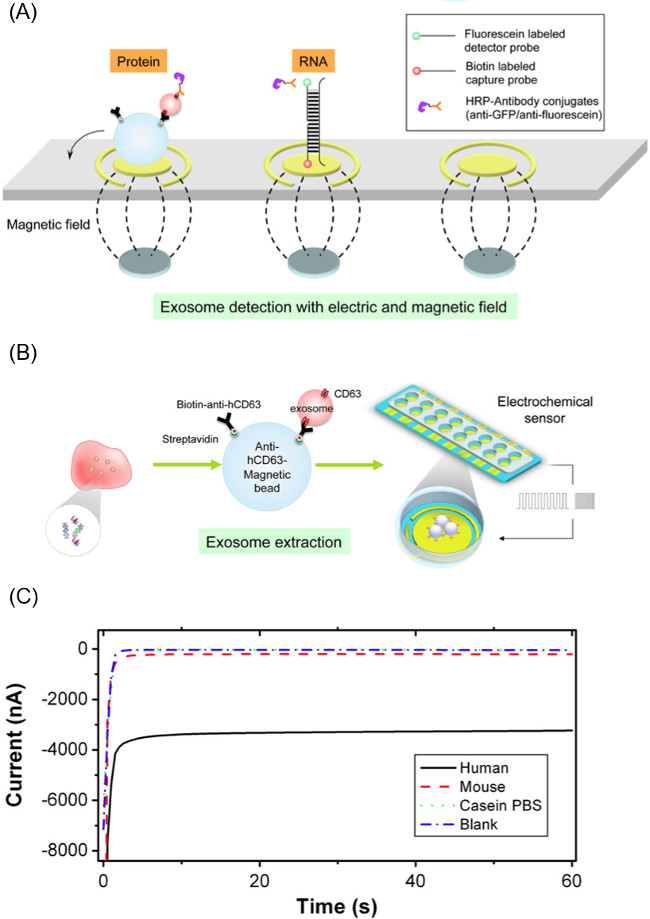
图2.组件EFIRM方法。(A)中提取使用抗人类CD63包被的磁性微粒生物流体外来体,然后使用施加到颗粒外来体复合物的循环方波卸货物外来体的方法。电极的生物传感器的(B)的计划用于从释放外来体检测的RNA / DNA /蛋白质的目标。 (C)的距离EFIRM方法论,安培读出的代表性的例子,其中较大的电流幅度将对应吨Ø更高水平的生物分子。这个数字是从威等14 请点击此处查看该图的放大版本。
结果
珠用TEM的外来体捕获验证
以下通过使用透射电子显微镜(TEM)图像提取协议使用抗人类CD63磁性珠从唾液外来体的分离进行了验证。 TEM显示磁珠与70-100纳米颗粒直接相邻( 见图3A和3B),与外来体的已知轮廓相一致。观察为磁珠唾液那些没有缀合到它们的抗人CD63抗体先前( 见图3C和3D)无70-100纳米颗粒。
讨论
其结果表明,抗 - 人CD63包被的磁性纳米颗粒能够特异性捕获具有的尺寸范围为70-100纳米的小颗粒。这个捕获粒子是与外来体的先前观察到的轮廓相一致。此外,低电压的CSW以下,颗粒的捕获的使用被示为从胎圈表面除去它们,并导致DNA降解型材类似于传统的裂解缓冲液基础的方法对货物的释放。此数据表明,外来体货物释放的工作流可以通过一个环状的方波的外来体的脂质膜的破坏的应用被简化...
披露声明
王守业是RNAmeTRIX公司是一家分子诊断公司的创始人之一。 PeriRx LLC分许可有关的RNAmeTRIX分子诊断知识产权。王守业是一个顾问PeriRx。
致谢
这项工作是由国家研究资源中心和国家中心推进转化科学,国家卫生研究院,通过格兰特UL1TR000124(至FW)的支持;费利克斯和米尔德里德业明德教授和巴恩斯家庭基金(以DTWW),国家研究所美国国立卫生研究院的牙科及颅面研究下奖号码T90DE022734(以MT)。内容完全是作者的责任,并不一定代表美国国立卫生研究院的官方意见。
材料
| Name | Company | Catalog Number | Comments |
| Helios 16-Channel Reader System with Chip Interface | Genefluidics, USA | RS-1000-16 | |
| 16x Sensor Chip, Bare Gold, pack of 5 chips | Genefluidics, USA | SC1000-16X-B | |
| Biotinylated anti-human CD63 Antibody | Ancell, USA | 215-030 | |
| Dynabeads MyOne Streptavidin T1 | Invitrogen, USA | 65601 | |
| Neodynium Magnetics (1/10" dia. x 1/32" thick) | K&J Magnetics, USA | DH101 | |
| Ultrapure Distilled Water | Life Technologies, USA | 10977-023 | |
| Mettler Toldeo 3 M KCl Solution | Fisher Scientific, USA | 1911512 | |
| Pyrrole | Sigma-Aldrich, USA | W338605-100g | |
| Anti-Fluorescein-POD, Fab fragments | Roche, Germany | 11426346910 | |
| 3,3′,5,5′-tetramethylbenzidine substrate (TMB/H2O2, low activity) | Neogen, Usa | 330175 | |
| Phosphate Buffered Saline Solution | Life Technologies, USA | 10010023 | |
| Casein/PBS | Fisher Scientific, USA | 37532 |
参考文献
- Rabinowits, G., Gerçel-Taylor, C., Day, J. M., Taylor, D. D., Kloecker, G. H. Exosomal MicroRNA: A Diagnostic Marker for Lung Cancer. Clinical Lung Cancer. 10 (1), 42-46 (2009).
- Thakur, B. K., et al. Double-stranded DNA in exosomes: a novel biomarker in cancer detection. Cell Research. 24 (6), 766-769 (2014).
- Lau, C. S., Wong, D. T. W. Breast Cancer Exosome-like Microvesicles and Salivary Gland Cells Interplay Alters Salivary Gland Cell-Derived Exosome-like Microvesicles In. Vitro. PLoS ONE. 7 (3), e33037 (2012).
- Bala, S., et al. Circulating microRNAs in exosomes indicate hepatocyte injury and inflammation in alcoholic, drug-induced, and inflammatory liver diseases. Hepatolog. 56 (5), 1946-1957 (2012).
- Dear, J. W., Street, J. M., Bailey, M. A. Urinary exosomes: A reservoir for biomarker discovery and potential mediators of intrarenal signalling. Proteomics. 13 (10-11), 1572-1580 (2013).
- Lässer, C., et al. Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages. Journal of Translational Medicine. 9 (1), 9 (2011).
- Palanisamy, V., et al. Nanostructural and Transcriptomic Analyses of Human Saliva Derived Exosomes. PLoS ONE. 5 (1), e8577 (2010).
- Camussi, G., et al. Exosomes/microvesicles as a mechanism of cell-to-cell communication. Kidney International. 78 (9), 838-848 (2010).
- Lau, C., et al. Role of pancreatic cancer-derived exosomes in salivary biomarker development. The Journal of Biological Chemistry. 288 (37), 26888-26897 (2013).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and Characterization of Exosomes from Cell Culture Supernatants and Biological Fluids. Current Protocols in Cell Biology. 3 (22), (2001).
- Park, N. J., Li, Y., Yu, T., Brinkman, B. M. N., Wong, D. T. Characterization of RNA in Saliva. Clinical Chemistry. 52 (6), 988-994 (2006).
- Wei, F., et al. Bio/Abiotic Interface Constructed from Nanoscale DNA Dendrimer and Conducting Polymer for Ultrasensitive Biomolecular Diagnosis. Small. 5 (15), 1784-1790 (2009).
- Wei, F., et al. Electrochemical Sensor for Multiplex Biomarkers Detection. Clinical Cancer Research. 15 (13), 4446-4452 (2009).
- Wei, F., Yang, J., Wong, D. T. W. Detection of exosomal biomarker by electric field-induced release and measurement (EFIRM). Biosensors and Bioelectronics. 44, 115-121 (2013).
Erratum
Formal Correction: Errata: Detection of Exosomal Biomarker by Electric Field-induced Release and Measurement (EFIRM)
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for Detection of Exosomal Biomarker by Electric Field-induced Release and Measurement (EFIRM). The disclosures were updated.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。