Method Article
的自然杀伤细胞免疫突触上的玻璃支承平面脂双层超分辨率成像
摘要
We describe here a combination of the glass-supported lipid bilayer technique of forming immunological synapses with the super-resolution imaging technique of stimulated emission depletion (STED) microscopy. The goal of this protocol is to provide users with the instructions necessary to successfully carry out these two techniques.
摘要
The glass-supported planar lipid bilayer system has been utilized in a variety of disciplines. One of the most useful applications of this technique has been in the study of immunological synapse formation, due to the ability of the glass-supported planar lipid bilayers to mimic the surface of a target cell while forming a horizontal interface. The recent advances in super-resolution imaging have further allowed scientists to better view the fine details of synapse structure. In this study, one of these advanced techniques, stimulated emission depletion (STED), is utilized to study the structure of natural killer (NK) cell synapses on the supported lipid bilayer. Provided herein is an easy-to-follow protocol detailing: how to prepare raw synthetic phospholipids for use in synthesizing glass-supported bilayers; how to determine how densely protein of a given concentration occupies the bilayer's attachment sites; how to construct a supported lipid bilayer containing antibodies against NK cell activating receptor CD16; and finally, how to image human NK cells on this bilayer using STED super-resolution microscopy, with a focus on distribution of perforin positive lytic granules and filamentous actin at NK synapses. Thus, combining the glass-supported planar lipid bilayer system with STED technique, we demonstrate the feasibility and application of this combined technique, as well as intracellular structures at NK immunological synapse with super-resolution.
引言
免疫突触(IS)位于在对细胞的活化和功能1临界结。它是由抗原呈递细胞介导的免疫是进行主平台。突触形成的最早微观研究利用了细胞-细胞共轭系统2。这种方法的主要限制是,大部分的结合物将被视为"轮廓",因为它是,因而限制了突触结构本身的观察者的图。 1999年,达斯汀实验室利用玻璃支持的脂质双层(SLB)技术3,已被早先由麦康纳实验室4,5率先解决了这一限制。这种方法布置有利于在玻璃支承平面脂表面,在其中蛋白质可附连性和自由在两个维度移动的抗原呈递细胞(APC)的。使用这种方法,达斯汀和他的同事们能够直接达到窥探吨他突触使用高分辨率荧光显微镜,并在第一时间拿到了"脸对脸"看IS的结构。
与使用SLB系统,与该IS可以可视化的细节已经被限制仅由当前的成像技术6-8的局限性。使用标准的照明技术,最小分辨率( 即,两个不同的对象之间的最小距离,其中它们可以区分)已<的瑞利准则9的基础上,为200nm。此限制阻碍了非常细的,分子尺度结构构成突触的摄像,并且直到超分辨率成像技术10-12的发展,这些结构的可视化只限于用电子显微镜固定细胞成像。
与多种超分辨率技术,诸如SIM卡,最近问世(结构照明显微镜),PALM(光敏定位显微镜),STORM(随机情形光学显微重建)和STED 10-12,调查人员现在能够研究这些突触结构在前所未有的细节,这反过来又提供了IS日益明确的认识。 STED显微镜的优点13之前已被描述。在这里,我们描述了超分辨率成像STED显微镜装有新开发的660纳米激光耗竭。相对于传统的592纳米的耗尽激光器,660nm的激光可以进行更广泛的选择的荧光染料(参见http://nanobiophotonics.mpibpc.mpg.de/old/dyes/),尤其是这些红色荧光团。
其他出版物所描述的抗体包被的载玻片13,14的NK细胞突触的STED成像。在这里,SLB系统结合了超分辨率显微镜STED研究NK细胞的突触。这种技术的优点是通过抗体的是一个流体镶嵌,其中嵌入的表面蛋白可以在一个平面二维表面(xy面)自由移动涂覆的滑动。这更加忠实地模仿目标小区的有机和移动表面,从而更好地概括一个生理学相关免疫突触的形成。
该协议的目的是通过组合SLB系统和超分辨率STED显微镜,以提供最终用户与NK细胞如何图象免疫突触的详细描述。它将提供必要的步骤,最终用户:制备脂质体,构建蛋白质包埋双层,确定对脂质双层的蛋白质浓度,并使用STED显微镜获得超分辨率图像。这些技术不限于免疫学领域,并且可以在各种学科中被广义地使用。
研究方案
1.准备脂质体
- 计算的氯仿悬浮原液的1,2-二油酰基-sn-甘油-3-磷酸胆碱(DOPC)和1,2-二油酰-sn-甘油-3-磷酸乙醇胺的N-帽生物素的量(生物素 - PE)的在所希望的最终浓度,使稀的股票。为了使最终浓度为400μMDOPC和80微米生物素 - 磷脂的PE在每次10毫升,通过将629微升10毫克/毫升DOPC和88微升10毫克/毫升生物素 - 聚乙烯成单独的玻璃层析管开始。
注:通过清洗溶液(1升95%乙醇至120毫升水中含有60g氢氧化钾,KOH),而转移DOPC和生物素 - 聚乙烯的氯仿悬浮原液清洗玻璃汉密尔顿注射器和玻璃层析管是很重要的。 - 干燥用氩气中的化学罩的流的氯仿。由密封封口膜层析管。
- 若使新干燥的脂质体,以在高真空中lyophiliz呃O / N,以消除任何残余的氯仿。在当天完成,干燥60-90分钟。
- 而冻干机运行,准备一些稀释液。对于这个协议,准备25毫升由25毫米的Tris,pH值8.0; 150毫米氯化钠;和2%(重量)的正辛基β-D-吡喃葡糖苷(OG)洗涤剂。混合头两个成分先在一起,然后加入干燥的OG粉末之前置换氧气与氩气。制备后,过滤该OG溶液用0.2微米的醋酸纤维素膜,并储存在4℃。
- 此外,准备两个螺旋盖瓶的1升的tris-盐水缓冲剂在相同浓度下,但不OG。放置在各底部的蒸馏水清洗磁力搅拌棒。准备的Tris-生理盐水缓冲液的增加6升。从所有的瓶用氩气除去氧,并放置于4℃为好。
- 冷冻干燥后,溶解在tris-盐水OG缓冲干血脂,使每一个4毫米的解决方案。下面的例子卷,加入2毫升的DOPC管,和0.2毫升的生物素 - 聚乙烯管。
- 混合生物素PE脂质与DOPC脂质在一起。这改善了SLB的流动性,作为生物素偶联可以损害磷酸盐头组的流动性。为了使80微米生物素 - 聚乙烯的终浓度,混合0.2毫升4mM的生物素 - 聚乙烯和1ml的4毫DOPC。然后加入8.8毫升的的Tris-OG生理盐水缓冲液。
- 为400微米DOPC的终浓度,简单地混合的4mM的DOPC1毫升用9ml的tris-盐水OG。
- 填用冰水的超声波仪。把含有在超声波仪的中心的稀释磷脂通过使用工具夹钳玻璃管。超声处理的稀释磷脂10分钟,直到溶液变得清晰。
注:加入冰块放入超声波仪水浴,以保持温度低,因为超声处理会产生热量。 - 在管中填充用氩气置换,在液体上方的空气中的氧气,并用封口膜密封它们。
2.透析脂质体
- 切的干透析管的两个部分(分子量截止:12-14,000,直径:6.4毫米),适当的长度(在本例中,有40厘米),每一个磷脂稀释,从辊。
- 通过允许它们在200毫升的蒸馏水浸泡在玻璃烧杯中,持续2分钟再水合管路部分。
- 在高设置微波这5分钟,或至少直到水来煮沸。
- 打结在各管的一个端部和冲洗出的内部用的tris-盐水-OG缓冲器几毫升。此后,精心挤出尽可能多的这种洗涤缓冲尽可能的最小化缓冲液内残留的量。
- 在层流罩,用小的透析管闭合添加稀释磷脂到每个管中,并夹的开口端,以排除所有的空气。完整的空气排除,需要小体积样品的牺牲夹紧下面的&#8220;水行"。
- 沉浸在预先制备的瓶的tris-盐水缓冲剂中的样品,而不OG。重新密封并置于前置换中的氧气瓶用氩气下搅拌O / N在4℃。
- 传输管成新瓶的tris-盐水缓冲剂而不OG每隔12小时至少3次。
- 不久去除脂类透析之前,准备一些小管放入其中填充每个氩气置换氧气分装油脂。
- 36小时后,将透析瓶进入层流罩,并从瓶子取出透析管。有一个板凳尿布或烧杯手头收集湿径流。
- 切透析管夹子以上,然后取出夹子和经由吸管透析脂质溶液仔细转移到1ml等分在预先准备好的试管充满氩气在冰上。
- 分装的水性脂质体溶液,可使用氩气流再次置换氧气我n分别管。
- 存储脂质体在4℃。不要冷冻。
在脂质双层3.测定抗体密度
- 制备系列稀释生物素化的,荧光标记的抗体,50μl的体积为每个稀释,以下列浓度:为0nM(空白),10纳米,50纳米,100纳米和500纳米。 (以下简称"样品系列")。
- 加入1微升的二氧化硅珠粒到6个孔96孔V形底板。一定要摇移液珠之前好,因为他们往往定居。
注:如果已经下令干的珠子,而不是暂停,按照制造商的说明稀释。 - 在1生物素磷脂:1的比例,这些珠子,加入2微升的混合DOPC。做到这一点的每口井。
- 脉冲在板上的涡流混合器以中等强度为每10秒的3倍,以鼓励与珠子和磷脂相互作用。
- 加入150微升5%的中科院EIN到每个孔中。吹打向上和向下三次拌匀。
- 让在酪蛋白溶液的板孵育10分钟,然后冲洗出来。洗,以及填充每个以250微升用HEPES总体积缓冲的盐水(HBS)含1%人血清白蛋白(HSA)。离心在1000×g离心2分钟。吸取出来并丢弃前200微升上清液,并总共3次洗涤循环重复两次。
- 加入50微升链霉在333纳克/毫升的浓度。脉冲的板再次3×10秒,并让它坐在振荡器上15分钟。洗3次,如步骤6以除去未结合的链霉。
- 添加50微升从先前准备的稀释系列的荧光标记的生物素化的抗体(参见步骤3.1),以每孔,并更换该板在摇动20-30分钟。洗3次,如步骤6以除去未结合的抗体。
- 最后一次洗涤后,重悬珠子在100μlHBS / 1%人血清白蛋白,然后转移到在FACS管中。两次重复这确保有效地去除所有珠子从井,总共300微升,并做为每个孔中。
- 把所得的管子的流式细胞仪。这是时间去阅读它们。
- 添加从标志着从荧光强度的校准(FIC)珠盒"B"的瓶子1滴(以下简称"标准系列"),以在FACS管中,并稀释用300μlHBS / 1%人血清白蛋白。
- 阅读该管,但不记录数据,只是还没有。现在,只需确保空白珠正确归零。作的直方图示出在相应的信道测得的珠的荧光,然后转移激励激光器的电压下降,直到峰值是在所述直方图的最左侧。
- 取出管,并添加1滴每个其它4管中的系列(标记为1到4)的同一个管中。现在,再次将管在机器,并记录所得到的数据,它应该显示为5个不同的峰。
- 阅读来自样品系列每一个人管。
- 使用FACS分析软件,绘制的栅极横跨在标准系列直方图每个峰的整个宽度在半最大点。这是一个门的每个峰。做同样的每个样品。注意MFI(平均荧光强度),用于每个门。
- 在适当的地方使用电子表格程序输入测量MFI值。也被输入的MESF值(等效可溶性荧光染料的分子)的每个瓶子中的标准系列(荧光分子涂覆每个胎圈的平均数量)。这个信息可以通过以下的塑料的方向摇晃管排在被发现。
- 使用电子表格将绘制的MFI上日MESF值,产生的荧光团的数量和所测量的强度之间的线性关系。
- 使用'蛋白质&标签"的模块中的微体积分光光度计,以确定染料的亲的比率蛋白中的标记的抗体。
- 输入样本的蛋白质的标记效率,涂有脂质珠的平均直径,和为每个条目的MFI值。电子表格将自动使用公式从在步骤3.16中产生的线图来计算MESF值对于每个蛋白质稀释和样品蛋白质的各浓度的接种密度。
4.分离和培养人类NK细胞
- 等分15毫升外周血或血沉棕黄层到50毫升锥形管中。稀释该血液用含有1%FBS的以1比PBS中:1。
- 添加13毫升菲轻轻到管与10ml的血清吸液管的底部。
- 离心该管20分钟,在1200×g离心与加速器和所述脱离或在其最低的设置。
- 离心后,使用血清吸管采集外周血单个核细胞(PBMC)浮白色混浊中间层,WHICH应该坐下和澄清的黄色上层和更加混浊苍白色的下层,这两者都坐在上面的红血细胞(红细胞)最下层之间的交叉点。注意不要收集任何红细胞收集的外周血单个核细胞。
- 将收集的PBMC在一个新的50ml锥形管中,并稀释至容量的PBS含有1%FBS中。离心一次,这次与制动和油门上最大,5分钟,在300×g下。
- 弃去上清并将细胞重新悬浮在含有1%FBS的10毫升PBS中。
- 计数细胞,而离心再次在相同的设置步骤4.6。
- 弃去上清液一次以上,并且重悬细胞在R10培养基以10百万细胞/ ml的密度。
- 需要30万个细胞中5ml的聚苯乙烯管中,并使用磁力分离试剂盒分离的NK细胞,按照制造商的说明进行操作。下面的隔离,细胞计数多一个重悬在500,0密度00个细胞/ ml在R10中的完全培养基(88%RPMI,10%FBS,1%HEPES,1%丙酮酸钠),补充有IL-2(100U / ml)中。培养在37℃在CO 2培养箱中,并每周2-3次更换培养基。
5.装配玻璃平面支持脂质双层
- 3在烧杯中:通过混合30%的过氧化氢与硫酸以1:1的比率制备100ml食人鱼溶液。
注意:始终贯彻与有毒药剂如硫酸工作正确指定的化学通风柜。 - 入该溶液中,浸泡2矩形#1.5盖玻片在食人鱼溶液20-30分钟。
注:重要的是通过食人鱼溶液清洗盖玻片。 - 而盖玻片正在清理,采取1管事先准备好的400μMDOPC脂质和1管事先准备好的80μM生物素-PE脂质。运输他们对冰氩储罐。
- 置换氧气在一个新的微量离心管中与氩气,然后添加在一起DOPC和生物素 - 聚乙烯在1:1的比例。具体量将根据实验的需要而变化,但应该是在每个最小2微升。置换氧气的混合物管再次用氩气,并且单个试剂管,以及,在返回后到冰箱之前。
- 当他们完成清洗,彻底用蒸馏水冲洗盖玻片。设置盖玻片出空气干燥几分钟。
- 收回1.5微升步骤5.4准备的脂质体混合物和分装在一个单一的降入腔滑的车道室之一。每泳道使用2滴是典型的,但不是必要的。
- 快速有效地将干盖玻片上的水滴。确保液滴充分地间隔开,以便它们不合并一旦盖玻片放置。此外,确保液滴保持圆形且良好定义的,而不接触腔室壁的边缘。用力按下在之间并围绕每个车道,以确保盖玻片和幻灯片之间的防水密封。
- 用记号笔标记滴的位置
- 通过加入100μl水溶液5%酪蛋白的通过腔室阻挡双层。尝试以确保有在流动室中无气泡。
- 注入100μl的链霉的浓度的333纳克/毫升到每个泳道。孵育在室温10-15分钟。此后,通过运行3毫升HBS / 1%人血清白蛋白通过每个车道以除去过量的链霉洗净。
- 加入100微升生物素化的荧光标记的抗CD16的诸如的Alexa Fluor 568在预先确定为最有效的在黑暗部分3孵育20-30分钟的蛋白浓度。通过每个通道运行3毫升HBS / 1%HSA再次清洗。
- 为了结合任何过量的链霉亲和因此消除ST的非特异性结合的可能性流100微升的D-生物素的浓度25nM的通过腔室reptavidin到细胞中。
- 计数NK细胞,重悬在在HBS / 1%HSA 500000 / ml的浓度。
- 而停转的细胞,与另一3毫升每通道的HBS / 1%的HSA洗涤D-生物素从室的。
- 检查在SLB配体由荧光恢复的迁移率上的全内反射荧光(TIRF)或共焦显微镜光漂白(FRAP)加入NK细胞之前后。
- 一旦细胞已完成纺丝和已再悬浮在所需的浓度,添加100μl到每个泳道。
- 放置在一个37℃5%CO 2培养箱腔室30-60分钟。
- 在此之后的潜伏期,固定细胞,用4%多聚甲醛在室温下10-20分钟。通过运行3mL的PBS通过每个车道以除去多聚甲醛清洗。
- 加入400微升封闭缓冲液(5%正常驴血清和0.2%Tritron X-100的PBS中)。在室温下孵育30分钟。
- 染色F-actin和穿孔按广告丁200微升稀释的荧光标记的鬼笔环肽(1单位/ ml标记的鬼笔环肽)和荧光标记的抗穿孔单抗(500纳克/毫升的抗穿孔单抗)。在室温下孵育1小时。
- 通过运行3毫升PBS清洗。该腔室是准备用于成像。
6.成像的NK突触的脂质双分子层使用STED的
- 打开所有必要的硬件模块。
- 启动图像分析软件。同时启用共振扫描和STED模块。做出这些选择后,等待大约3-5分钟的软件启动。
- 点击" 配置 "选项卡上,在屏幕的顶部。
- 选择" 激光配置 ",然后打开白光和STED 592 nm激光。
- 选择100×物镜 ,并对准激发激光束与592纳米的激光耗竭。
- 选择" 激光配置 "模块,关闭592枯竭激光,并打开660纳米激光枯竭。
- 在舞台上放置滑动,在镜头上。使用白色灯和目镜带来结合在划分双层区域成为焦点的单元格。
- 返回到" 采集 "选项卡,直接将" 配置 "选项卡的右侧。
- 点击" 切换到白光 "选项卡,然后打开该模块,并激发激光线拖动到合适的波长。
- 从可用的列表中选择所需的检测,然后将检测范围涵盖波长适当的范围内。
注意:千万不要把检测范围直接激发光束下。 - 在左侧点击"Seqential"键" 获取 "的工具栏,弹出在左侧栏底部的顺序扫描的对话。这使用户能够添加多个序列,各用不同的激发束为不同的颜色。点击"之间帧",然后设置激励频率,检测器,并为每个额外的颜色检测范围如步骤6.9和6.10。
- 一旦所有的设置都进行了优化,点击"开始",开始采集过程。
- 申请使用设计用于STED反卷积,如先前13描述的设置的自由去卷积软件(惠更斯)。
结果
图1显示了对脂质双层的抗体密度的结果。其原理是利用标准珠使MESF与MFI的通过流式细胞仪(A)的标准曲线。样品系列的MFI是使用标准曲线转化为MESF。在脂双层的抗体密度是线性相关的抗体浓度(B)。 图 NK突触2示出了三色STED图像上玻璃支撑平面脂双层。在脂双层的抗CD16抗体的积累,触发F-肌动蛋白的形成和偏振,并通过F-肌动蛋白网状在免疫突触中NK细胞的焦点面板穿孔的渗透。使用这种组合方式,人们可以清晰地观察到荧光的SLB,这直接反映了CD16对NK细胞集群内标记的抗CD16的微簇。相比于常规的共焦图象,CD16 CENTRA的结构l集群更容易因耗尽周围的荧光看出端倪,在STED图像。此外,肌动蛋白细胞骨架的超微结构看出与显著提高分辨率。与以前的观察16,17,穿孔阳性裂解颗粒被认为定位在低F-肌动蛋白密度的STED形象,一个关键的细节,大多是输在共聚焦图像的区域。
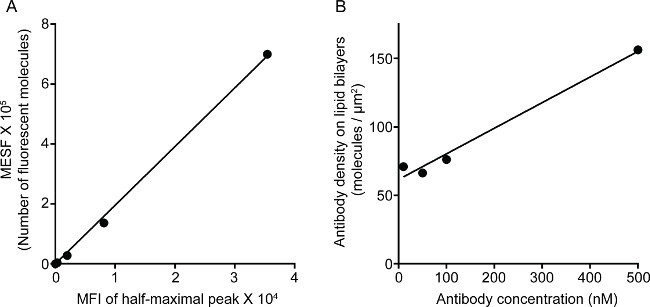
图1.密度对脂质双层3G8抗体。(A)的 MESF和MFI为标准系列之间的线性相关性。(B)的蛋白质的密度和浓度为样品蛋白质稀释系列的线性相关性,显示出每荧光标记蛋白单体的数量单位面积作为增加的浓度的脂质包衣SI的功能安洁莉卡珠。
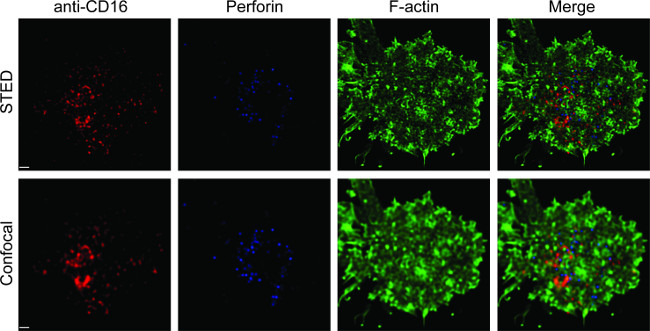
NK突触对 平面脂双层图2. STED成像。原发性NK细胞刺激的SLB含有生物素化的荧光标记的抗CD16(红),固定,透化,然后染色用鬼笔环肽(蓝色)和抗F肌动蛋白(绿色)。个别电池首先在正常共焦成像的设置,然后STED设置。共聚焦和STED图像用惠更斯软件解卷积。比例尺,1微米。 点击此处查看该图的放大版本。
讨论
目前的研究的新颖之处在于,它结合了SLB技术与STED研究NK细胞的突触。以前的研究已经拍摄到的脂质双层与TIRF研究T细胞突触形成8和信号分子贩卖上质膜6。其他人使用抗体包被的载玻片13,14描述的NK细胞突触STED成像。本文中进一步描述的混合方法,通过成像NK细胞突触具有增强清晰度的脂质双分子层表面赋予了超分辨率成像,建立在这些努力其中APC的更好的模型动态表面。
虽然SLBs的是人工膜缺乏骨架,脂筏,和其他的配体实际的靶细胞或装甲运兵车占有,这种技术可以概括重要的功能,如移动性和配体的方向。这使得SLB系统,作为在解剖吨的还原方法个别受体和配体的他的贡献形成了IS和IS的动态。 SLBs中的最重要的特点是,研究人员可以将这种技术具有高分辨率成像方法,如激光共聚焦和TIRF显微镜。 STED显微镜的推出进一步增加了这种优势,提供了前所未有的见解IS研究及其临床应用。
这个系统的一个潜在的批评是,所述的SLB没有充分模仿的APC的复杂表面,从而潜在地非生理解剖特征引起在所得突触。虽然这是事实,表面分子上的SLB有限剧目不完全概括的APC的不均匀填充面,这个限制也可以是有利的,因为它允许调查,以确定个别的受体和配体相互作用对突触形成的影响。
牛逼这里是在过程中的几个关键步骤。其中最关键的是脂质体的该氧化经过不断利用氩气置换中的氧气管和溶液,可以防止诸如在步骤1.10,2.6和2.11。脂质的氧化会导致降低脂质的流动性,从而妨碍表面蛋白的自由移动,并参与突触结构的能力。同样地,它也是重要的通过冻干(步骤1.2),以除去所有氯仿中的脂质体中。在脂双层的蛋白质浓度的测定,它是重要的,以第一分散硅珠粒成均匀的悬浮液不含簇。如果需要的话,珠超声处理可以应用。在组装的SLB,在早期步骤(5.1-5.8),其中所述盖玻片清洗,滴被放置,和盖玻片固定是非常重要的。在上述任何一个错误会需要开始实验了(从第5节的开头)。出于这个原因,它是很好的做法,更清洁盖玻片比将需要节省时间在发生事故的。
与该系统工作时,非群集是最常见的问题。如果,在最后步骤中可视化的细胞时,1未能找到任何荧光突触,有可以采取几个步骤。另一个污渍的同源细胞表面受体可以被添加到腔室,以验证该细胞还没有形成与双层的突触,而细胞可粘附的非特异性的玻璃盖玻片或双层表面,突触-涉及表面蛋白应显示为不同的簇,在小区双层界面的平面中,而未接合表面蛋白应该出现弥漫染色周围的小区的周边。应该方法失败,应检查通过流式细胞仪的细胞,以确保特定的标记1是希望研究中表达足够丰富细胞表面上。某些表面prote项是已知的下调超过长期在体内培养。
虽然该协议的细节具体如何可视化NK细胞突触形成,所述SLB系统可用于研究任何免疫细胞简单地由主配体的在步骤5.11的取代可以想象突触形成。多个配体,也可以同时加入。一也不必使用链霉抗生物素系统,为双层内附着的表面蛋白。镍NTA:组氨酸相互作用也是可行的。但是,由于高强度的链霉亲和特异性:生物素相互作用,我们的实验室喜欢这个系统。一个也可以变化,在步骤5.13中加入到双层从规定的密度细胞的浓度,以及在随后的孵育期,以观察突触在成熟的不同阶段的持续时间。这甚至可以现场完成,虽然这当然不包括可视化细胞内海峡的可能性uctures(除非它们已经标有一个稠合的荧光标记;我们的实验室使用几个这样的改变的细胞系)。由于高程度的定制可能在这个协议中,可以使用基本的SLB技术中,随着STED成像,以解决在免疫学,细胞生物学,生物化学和问题的十分广泛的多样性,包括基本的脂质动力学15,突触形成16,细胞内信号17,和肿瘤细胞转移18。
披露声明
The authors have nothing to disclose.
致谢
We thank Emily Mace and Malini Mukherjee for imaging and deconvolution analysis. Work in the Liu laboratory was supported in part by the Baylor-UTHouston Center for AIDS Research Core Support Grant number AI36211 from the National Institute of Allergy and Infectious Diseases, the Caroline Wiess Law Fund for Research in Molecular Medicine, Texas Children’s Hospital Pediatric Pilot Research Fund, and the Lymphoma SPORE Developmental Research Program from Baylor College of Medicine and the Methodist Research Institute.
材料
| Name | Company | Catalog Number | Comments |
| 18:1 (Δ9-Cis) PC (DOPC) 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti | 850375C | Liposome preparation |
| 18:1 Biotinyl Cap PE 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl) (sodium salt) | Avanti | 870273C | Liposome preparation |
| Argon gas, compressed | Airgas | UN1006 | Liposome preparation |
| A lyophilizer | Labconco | Freezone 7740020 | Liposome preparation |
| Lyophilizer tubes | Labconco | 7540200 | Liposome preparation |
| Chromatography Columns | Santa Cruz | sc-205558 | Liposome preparation |
| 1 M Tris pH 8.0 | Ambion | AM9856 | Liposome preparation |
| 5 M NaCl | Ambion | AM9759 | Liposome preparation |
| Octyl-β-D-glucopyranoside | Sigma-Aldrich | O1008 | Liposome preparation |
| Dialysis tubing | Spectrum Labs | 132676 | Liposome preparation |
| 96-well V-bottom polystyrene plate (untreated) | Corning | 3896 | antibody density determination |
| Non-functionalized silica beads | Bangs Laboratories | SS06N | antibody density determination |
| FACS tubes | Fisher Scientific | 14-959-2A | antibody density determination |
| QuantumTM MESF beads | Bangs Laboratories | Variable | antibody density determination |
| Casein | Sigma-Aldrich | C0875 | Lipid bilayer preparation |
| HEPES buffered saline + 1% HSA | Homemade | Lipid bilayer preparation | |
| Streptavidin | Life technologies | 434301 | Lipid bilayer preparation |
| Fluorescently-labeled biotinylated protein | Homemade | Lipid bilayer preparation | |
| ibidi Sticky-Slide VI 0.4 | ibidi | 80608 | Lipid bilayer preparation |
| 25x75 mm glass coverslip | ibidi | 10812 | Lipid bilayer preparation |
| Hydrogen peroxide (30%) | Fisher Scientic | BP2633 | Lipid bilayer preparation |
| Sulfuric acid | Sigma-Aldrich | 258105 | Lipid bilayer preparation |
| D-Biotin | Invitrogen | B20656 | Lipid bilayer preparation |
| Lens paper | VWR | 54826-001 | For imaging |
| Type F Immersion Oil | Leica | 11 513 859 | For imaging |
| A Leica TCS STED microscope | Leica | For imaging |
参考文献
- Dustin, M. L., Long, E. O. Cytotoxic immunological synapses. Immunol. Rev. 235 (1), 24-34 (2010).
- Monks, C. R., Freiberg, B. A. K. u. p. f. e. r. H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Hafeman, D. G., von Tscharner, V., McConnell, H. M. Specific antibody-dependent interactions between macrophages and lipid haptens in planar lipid monolayers. Proc Natl Acad Sci USA. 78 (7), 4552-4556 (1981).
- Tscharner, V., McConnell, H. M. Physical properties of lipid monolayers on alkylated planar glass surfaces. Biophys J. 36 (2), 421-427 (1981).
- Crites, T. J., Chen, L., Varma, R. A TIRF microscopy technique for real-time, simultaneous imaging of the TCR and its associated signaling proteins. J. Vis. Exp. , (2012).
- Prins, K. C., Vasiliver-Shamis, G., Cammer, M., Depoil, D., Dustin, M. L., Hioe, C. E. Imaging of HIV-1 envelope-induced virological synapse and signaling on synthetic lipid bilayers. J. Vis. Exp. , (2012).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. , (2008).
- Michalet, X., Weiss, S. Using photon statistics to boost microscopy resolution. Proc. Natl. Acad. Sci. U. S. A. 103 (13), 4797-4798 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu. Rev. Biochem. 78, 993-1016 (2009).
- Lippincott-Schwartz, J., Manley, S. Putting super-resolution fluorescence microscopy to work. Nat. Methods. 6 (1), 21-23 (2009).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J. Vis. Exp. , (2014).
- Rak, G. D., Mace, E. M., Banerjee, P. P., Svitkina, T., Orange, J. S. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Leutenegger, M., Ringemann, C., Lasser, T., Hell, S. W., Eggeling, C. Fluorescence correlation spectroscopy with a total internal reflection fluorescence STED microscope (TIRF-STED-FCS). Opt Express. 20 (5), 5243-5263 (2012).
- Liu, D., Bryceson, Y. T., Meckel, T., Vasiliver-Shamis, G., Dustin, M. L., Long, E. O. Integrin-dependent organization and bidirectional vesicular traffic at cytotoxic immune synapses. Immunity. 31 (1), 99-109 (2009).
- Liu, D., Peterson, M. E., Long, E. O. The adaptor protein Crk controls activation and inhibition of natural killer cells. Immunity. 36 (4), 600-611 (2012).
- Wu, J. C., et al. Antibody conjugated supported lipid bilayer for capturing and purification of viable tumor cells in blood for subsequent cell culture. Biomaterials. 34 (21), 5191-5199 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。