Method Article
表面增强拉曼光谱检测生物分子利用EBL装配纳米衬底
摘要
We describe the fabrication and characterization of nano-biological systems interfacing nanostructured substrates with immobilized proteins and aptamers. The relevant experimental steps involving lithographic fabrication of nanostructured substrates, bio-functionalization, and surface-enhanced Raman spectroscopy (SERS) characterization, are reported. SERS detection of surface-immobilized proteins, and probing of protein-ligand and aptamer-ligand binding is demonstrated.
摘要
制造和结合纳米生物系统接口的金属纳米结构在固体载体上固定化生物分子的表征报道。有关实验步骤的整个序列进行了说明,涉及使用电子束平版印刷,在基片上的生物分子的固定化的纳米结构基片的制造中,和它们的表征利用表面增强拉曼光谱(SERS)。三种不同的纳米生物系统的设计中采用,包括蛋白A,葡萄糖结合蛋白,和多巴胺结合的DNA适体。在后两种情况下,各自的配体,D-葡萄糖和多巴胺的结合,也包括在内。三种生物分子被固定在纳米结构化基底通过不同的方法,并且SERS成像的结果报告。 SERS的能力来检测振动模式从表面固定的蛋白,以及捕获的蛋白 - 配体的ð适体 - 配体结合的表现。结果还示出了纳米结构的表面几何形状,生物分子固定化的策略,该分子和存在的配位体上获取的SERS光谱结合的或不存在的拉曼活性的影响。
引言
能力开发和表征缀合物的纳米生物系统接口固体纳米结构和生物聚合物成为在下一代生物传感和生物技术的致动1,2-进一步发展越来越重要。这涉及到多学科研究在多个研究领域,如相关的固态成分(微或纳米的电极,纳米工程涂料,纳米线,或纳米颗粒)2,3,4的制造;表面上的生物分子,以创建所需生物共轭物5,6,7的固定;和监控纳米生物接口1。在大多数情况下,最佳的制造,生物官能化,和表征方法的选择是强互相关连。显然,纳米制造技术的选择将通过该系统的固态成分的需求来驱动,是在很大程度上依赖于该检测方法,该方法在涂RN是由所涉及的生物聚合物的性质和监测接口的目的来确定。
出了各种各样的用于表征生物共轭系统1,3,表面增强拉曼光谱(SERS)技术已成为一个非常有前途的方法,化学和生物物种的表面上8,9,10,11-的检测。 SERS通过表面固定的生物分子( 图1),允许对应于分子振动的独特的签名捕获采用单色光的非弹性散射。这种能力在不同的分子中区分而不涉及标签,复杂的化学,或耗时的步骤,使SERS生物检测的一个潜在的非常有效的方法。 SERS的另一个重要优点是它的高灵敏度。本地化的表面等离子体光与贵金属纳米结构(SERS基质)的交互激发急剧增加的INT密度的拉曼散射由分析物,从而允许非常少量的分子的检测,从单层下至单分子限制8,9,10,11-。最后,大多数的生物分子所需要的水溶液是稳定的。因为水往往具有有限的拉曼活动,从水样的背景信号最小9。 SERS的应用已经显示出在过去十年10的指数增长。然而,SERS的许多讨论的挑战是,拉曼散射的电磁场增强关键取决于大小,形状,并且其中电浆波被诱导11,12,13间距的金属纳米结构。为了实现高效的和可再现的SERS测量,控制在衬底上的几何形状是需要在纳米级尺寸。
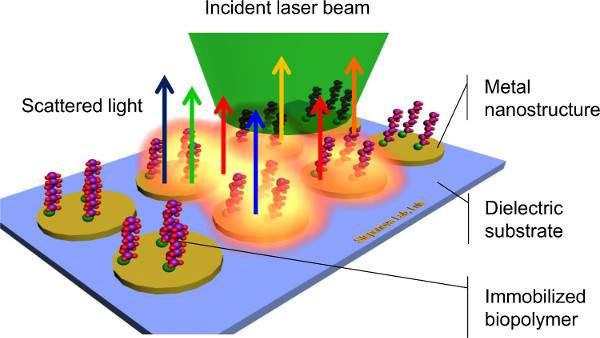
图1.钪血红素表面增强拉曼光谱的。
用来制造SERS衬底11,12,13的许多方法大致可以分为自下而上和自上而下的方法。第一种类型的方法使用自组装或定向化学合成,以产生纳米结构的各种处理。经常处理的例子包括单分散纳米粒子在固体支持11,12,13,热,溅射,或粗糙的金属片11,12的电化学沉积和各种化学合成方法13固定。虽然这样的技术往往是相对简单和便宜的,其中大部分是由缺乏控制以上所述结构的位置,和有限的样品到样品的再现性受到挑战。
相反,自上而下的光刻技术采用可操纵的仪器,如粒子束建立在表面所需的图案。其中最经常使用的纳米光刻法,电子束光刻(EBL),提供了极好的控制功能下降到低于10纳米,也有灵活性,以便在固体载体11,12不同的基板设计。在EBL,电子束聚焦下降到几纳米的直径扫描横跨电子敏感材料(抗蚀剂)使在曝光区域的化学变化的表面上的光点。对于正型抗蚀剂,如聚甲基丙烯酸甲酯(PMMA),电子束曝光的结果构成抗蚀剂的聚合物链的断裂,从而导致增加的溶解度在合适的溶剂(显影剂)。电子束光刻的方法包括抗蚀剂在衬底上的均匀层的旋转涂布;曝光在真空室用电子束靶抗蚀材料;和样品的发展以除去可溶性的区域。
金属纳米结构的下面的介电载体,如熔凝硅石,有B示EEN在SERS强度来显著增加由于电浆波定位相对于其他材料,例如硅14,15。然而EBL图案形成在介电基片,尤其是在纳米级,涉及到由于电荷在曝光期间积累显著挑战。以前,我们已经表明16,17,这些困难可通过将导电聚合物层之上的抗蚀剂来克服。 图2示出了总体制造工艺的示意性使用EBL曝光和显影后的金属沉积和剥离,以产生对熔融金属纳米结构二氧化硅支持。 请点击此处查看该图的放大版本。
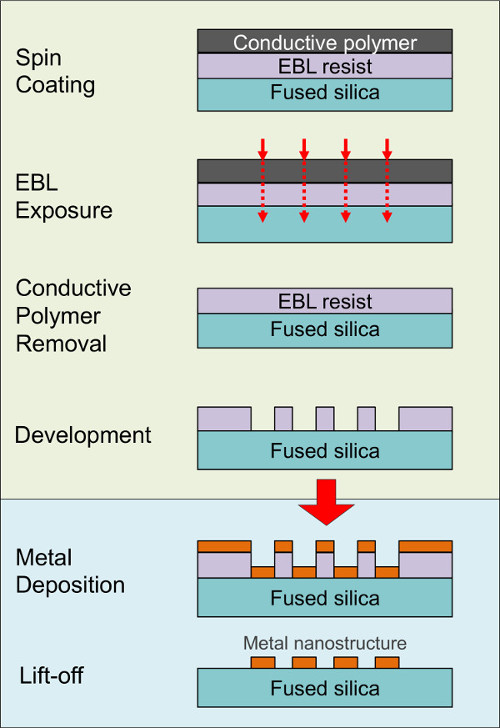
图E 2.计划lectron束光刻,金属沉积和剥离工艺用于制造在电介质基片16-19的金属纳米结构的步骤。在本文中,我们提出的,涉及的SERS衬底 制造由EBL,生物官能基片的处理步骤的全部序列,并收集的拉曼光谱的。三种设计中的最近的作品18,19探索被寻址(参见图3和4,和表1)。在设计1,重组蛋白A被固定在生物机能的Au纳米结构上的熔融二氧化硅(FS)的支撑件18,并且SERS检测的蛋白质被证实。在设计2,重组葡萄糖结合蛋白21,26,27具有和不具有配体(D-葡萄糖)是由组氨酸标记的手段在上镀镍的FS银纳米结构体之间的空间固定,和葡萄糖与蛋白的结合被检测。在设计3,巯基多巴胺结合DN一个适体19,23固定在金纳米结构的FS和多巴胺的固定化适配子的结合证明。包括从基板准备拉曼光谱采集,并代表不同的生物分子和固定化策略的所有相关实验步骤,这些例子都是各种各样的应用非常有用,从勘探研究询问纳米生物界面通过SERS到SERS的发展采用蛋白质或核酸适体-配体的识别方法结合的小分子生物传感器。 请点击此处查看该图的放大版本。
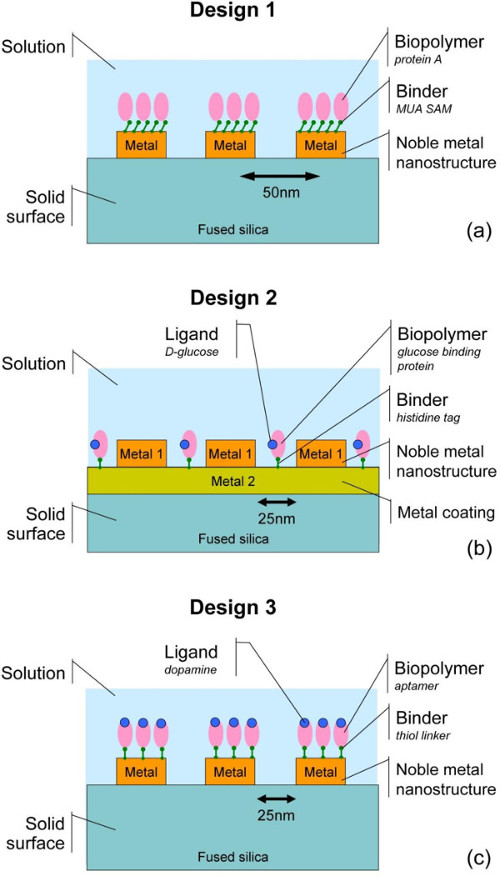
图三个具有代表性的设计方案3.使用不同的生物分子,immobiliza方法化,并且基板材料:(A)的蛋白质A固定在贵金属纳米点通过一个自组 装单层的11- mercaptodecanoic酸(SAM)(MUA)在DI水中官能; (B)的复合与D-葡萄糖固定贵金属纳米点之间的衬底表面上组氨酸标记的葡萄糖结合蛋白(GBP); (C)巯端完成与多巴胺(DBA)的多巴胺结合适体固定在贵金属纳米点。 见表1进一步的细节。在设计2面板(B)表示,如果没有相应的配体的样品也准备进行比较。 请点击此处查看该图的放大版本。
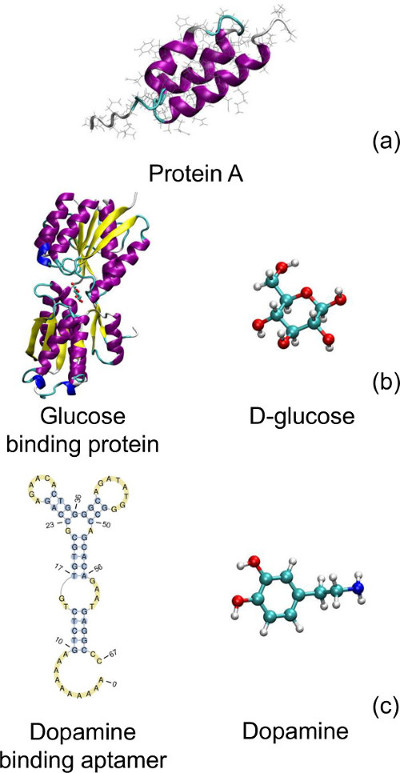
图4。生物分子在三种设计采用:(A)蛋白A; (B)中的葡萄糖结合蛋白和D-葡萄糖; (C)的多巴胺结合的DNA适体和多巴胺。该蛋白质的三级结构的(a)和(b)从蛋白质数据库,PDB ID 1BDD 20和2HPH 21,分别和绘制VMD为LINUXAMD64,版本1.9.1 22取。 (c)中的适体的二级结构是从序列23使用ValFold 24软件预测和绘制PseudoViewer 3.0 25。 G,A,T,和C对应鸟嘌呤,腺嘌呤,胸腺嘧啶和胞嘧啶碱基字母,分别请点击此处查看该图的放大版本。
| 设计1 | 设计2 | 设计3 | |
| 生物聚合物 | 蛋白A | 葡萄糖结合蛋白(GBP) | 多巴胺结合适体(DBA) |
| 粘结剂 | 11-巯基十一酸(MUA)的自组装单层(SAM) | 组氨酸标签 | 巯基交联剂 |
| 配体 | 无 | D-葡萄糖 | 多巴胺 |
| 解 | 去离子(DI)水 | 磷酸钾缓冲液 | 三(羟甲基)氨基甲烷(TRIS)和乙二胺四乙酸(EDTA)缓冲液;磷酸盐缓冲盐水(PBS) |
| 基板 | 金结构上的FS | 上镀镍的FS的Ag结构 | 金结构上的FS |
| 图案AREA | 4微米×10微米 | 4微米×8微米 | 4微米×10微米 |
| 模式 | 凹点,50纳米节距 | 银点,40纳米间距 | 凹六角形,200nm的间距 |
| 银六边形,200nm的间距 | 金非结构化垫 | ||
| 银非结构化垫 | |||
| EBL照射剂量 | 点: | 点:105μC/厘米2 | 六边形:180μC/厘米2 |
| 阵列I 120μC/厘米2 | 六边形:170μC/厘米2 | ||
| 阵列II 96μC/厘米2 | |||
| 排列三72μC/厘米2 | |||
| 激光激发波长 | 532纳米 | 532纳米 | 780纳米 |
表1.三种设计纳米生物系统。
研究方案
1.基板制备
- 使用半导体切割锯切割的石英玻璃(FS)的晶片1厘米×1 cm或更小的骰子。
- 在食人鱼的解决方案干净的样品(H 2 SO 4:H 2 O 2,3:1;注意:强氧化剂)28浴15分钟,然后用清水冲洗骰子在去离子水和干燥的氮气。
- 放置在热板上将样品面朝上,在180℃下进行15分钟。从热板中取出RT冷却后的样品。
- 对于外观设计1和3,继续执行步骤2。
- 对于设计2,放置在电子束蒸发室和涂层与Ni的10nm的层的样品。
2.制作纳米图案PMMA面罩采用电子束光刻(EBL)
- 旋涂聚甲基丙烯酸甲酯和抗蚀剂在衬底上的导电层。
- 使用晶圆微调用真空吸盘和地方样本分别在中心上的吸盘。地方1滴的聚甲基丙烯酸甲酯抗蚀上使用玻璃吸移管和旋转样品的中心以3,500rpm进行60秒与2秒斜坡时间。
- 烘烤衬底在180℃下进行3-5分钟。烘烤该基片之后,冷却样品至室温。
- 与基片冷却并返回到离心器卡盘,散布导电性高分子在基片上的下降。旋转该衬底40秒以3000rpm用2秒斜坡时间。烘烤的样品在80℃下1分钟。
- 根据标准程序16,17,18,29执行的EBL曝光。
- 用制造商的说明书,准备曝光的设计使用功能的剂量从表1用尽可能小的光束步长。
- 装载样品放入电子束光刻室。如果EBL系统不具有自动对焦,使用小刮离,其中模式是对被曝光并远离胎圈边缘为焦点ING。
- 用制造商的说明,执行所需的聚焦和散光矫正以及写场对准酌情揭露样本。要允许适当的曝光轮廓和最佳模式的质量,请使用30千电子伏电子束能量和7.5微米孔径的曝光。
- 除去导电性高分子与显影已曝光的样品。
- 制备用去离子(DI)水的烧杯中用于与显影剂混合物中除去的导电性聚合物和第二个烧杯(IPA:H 2 O,7:3),并搅拌5分钟,在RT。在第三个烧杯作为冲洗剂制备异丙醇(高纯度)。
- 使用镊子,将样品放入水中,持续3秒以除去所述导电性高分子膜,然后将样品放入显影剂并移动镊子慢慢上下持续20秒。紧接基片传送到异丙醇和冲洗10秒以上,然后用氮气干燥样品。
3.贵金属纳米结构的制备
- 加载样品倒置放入电子束蒸发器系统,以允许蒸发的金属被沉积在样品的前面。沉积10nm厚的Au层上的样本设计1和3,和一个10纳米厚的Ag层,用于设计2以大约0.1nm /秒的速率。
- 一个超声系统填充到与水的建议高度和填充用丙酮单独的烧杯中。放置一个样本正面向上烧杯的底部,并允许样品浸泡10分钟。保持烧杯中,将其放入水浴并允许丙酮的高度相匹配的水的高度,并打开超声系统上。让超声发生长达60秒。
- 使用相同的步骤,在步骤3.1详述的,由10纳米厚的金属薄膜上的FS(设计1和3)和Ni被覆的FS(设计2)SUBSTR沉积制备均匀的Au和Ag垫基板茨跳过步骤2。
4.生物功能化的衬底
- 准备设计1样本:
- 制备11- mercaptodecanoic酸(MUA)的乙醇在室温1mM溶液。声处理10分钟。
- 在MUA的48小时的溶液浸渍合适的纳米结构化基底。冲洗样品用乙醇三次,干燥5分钟,在室温。
- 制备的N-乙基-N'75毫溶液- (3-(二甲基氨基)丙基)碳二亚胺(EDC)在去离子水中。制备N-羟基琥珀酰亚胺(NHS)在去离子水中的15mM的溶液。
- 在金在基板上使用微量存款100微升NHS的,并立即在同一区域中添加100微升EDC的。孵育1分钟,以激活所述自组装单层的MUA的(SAM)。
- 放置蛋白的100微升滴在衬底的同一个区域中的溶液(47μM),并在5℃下放置24小时的样品储存在一个多隔室的Petrið十岁上下用1毫升去离子水在另一个隔室,并用一个密封的盖。
- 通过连续地搅拌该样品在分开的烧杯中,持续20秒在每个烧杯漂洗在DI水样品的3倍。不要让冲洗后或冲洗过程中的样品干燥。
- 继续执行步骤5。
- 准备设计2个样品:
- 准备葡萄糖结合蛋白(GBP)的磷酸钾缓冲液中的0.9毫摩尔溶液(K 2 HPO 4,25mM的,pH值7.5)。制备D-葡萄糖的缓冲液中的100mM的溶液。
- 混合30微升100mM D-葡萄糖溶液和30微升使用1ml塑料微型管容器和微量0.9毫英镑溶液。温育30分钟。
- 存20微升的配体的无GBP水溶液和每个上使用微量制备的基板上的配位体结合的GBP溶液。储存样品在5℃下放置24小时在一个培养皿的密封罩。
- 冲洗样品中的3倍在RT磷酸钾缓冲溶液中。
- 继续执行步骤5。
- 准备设计3个样本:
- 稀多巴胺结合适体(DBA)溶液到使用的TRIS EDTA缓冲液为7.4的最终pH为1μM的浓度。
- 通过测量多巴胺粉末在分析天平上,并有搅拌珠混合,在磷酸盐缓冲盐水(PBS)中5分钟,制备多巴胺溶液至5微米的浓度。
- 沉积在每个基片的表面上的DBA溶液的20微升丢弃,并让样品1小时,在室温坐用覆盖在陪替氏培养皿中。
- 漂洗所述样本中的磷酸钾缓冲液3次(K 2 HPO 4,25mM的,pH值7.5)。
- 将样品直立于洁净室等级的顶部擦拭干背侧,同时保持膜在基板的前侧。预留的样本作为对照。
- 将多巴胺溶液0的5微升滴氮对与所需的多巴胺浓度其余样品的PBS缓冲液溶液的现有滴的表面上。孵育样品10分钟。
- 将一滴在金垫表面的多巴胺解决方案,而适体。孵育10分钟。
- 冲洗样品中的磷酸钾缓冲液洗3次。
5.拉曼光谱
- 将每个样品中的防水室,以避免蒸发通过激光曝光。
- 填充塑料注射器具有化学惰性的高真空油脂,发生样品在载玻片上并分配的油脂包围样品几毫米而不触及样品。
- 放置在基板的顶部上的显微镜盖玻片并轻轻按下以形成密封,产生的基板和盖玻片之间的薄液界面不使缓冲器来与真空润滑脂接触。
- 使用光学拉曼显微镜系统,获得一个聚焦金属纳米图案化区域的表面上的不接通的激光进行采样。
- 执行拉曼采样18,19与2.4-3.1毫瓦之间的激光强度小于20秒的总的持续时间,以防止损坏的样品与10X放大率的一个目的。获得的拉曼光谱为从设计1,2和3使用的激发波长的样品,如表1所示。另外获得控制拉曼光谱的蛋白A,英镑,和D-葡萄糖,和多巴胺粉末采用玻片无金属溶液纳米结构作为支持用于比较。
结果
收集控制拉曼光谱的主要部件,包括游离的蛋白质在溶液中游离配位体在溶液或粉末形式的不使用含金属的基板,是很重要的,以使一适当的比较,以及用于解释的目的。 图5A呈现了典型的拉曼频谱在去离子水自由蛋白A上没有纳米结构基板用玻璃幻灯片。两个频带中的最高的拉曼强度,带在2931厘米-1和在1091厘米-1,对应于涉及CH和CS债券,分别振动。其它频带具有较低的拉曼强度如563厘米-1 1450 -1,1653厘米-1和2426厘米-1,可以归因于的振动模式18,32,33,34的叠加。控制拉曼光谱对配体游离GPB与三种不同浓度,0.3,0.9和1.3毫缓冲溶液,示于图5B。在T他图中,宽频带周围3400厘米-1对应于溶剂35中,而在带2935厘米-1表示涉及该蛋白质的CH键32,33。 图5C示出了高的波长的拉曼光谱为D-葡萄糖在振动1,6,100,200,和400毫:不同浓度的缓冲溶液中。当葡萄糖的浓度增加,CH键振动谱带出现在2890厘米-1和2960厘米-1。多巴胺在与两个532纳米和780纳米的激发波长获得的结晶形式的控制拉曼光谱示于图5D。大部分的拉曼光谱的来自苯环的弯曲和该分子19,36的CH键延伸。一些带中的约3000 -1仅在532纳米观察到,但尚未780nm的激发波长。
PLOAD / 52712 / 52712fig5.jpg"/>
蛋白A在DI水中图5.控制喇曼光谱获得在532nm的激发波长18(A)中 ;得到在532nm的激发波长(B)的配位体的无葡萄糖结合蛋白在缓冲溶液的拉曼光谱;得到在532nm的激发波长(C)的 D-葡萄糖中缓冲溶液的拉曼光谱;和在532纳米和780纳米的激发波长19(D)中获得的多巴胺粉末的光谱。所有的光谱是溶液的常规拉曼光谱(A,B,c)和粉末(D)在载玻片没有纳米结构的衬底。在(D),已完成使用通用原子和分子的电子结构系统(GAMESS)30和31 MacMolPlt软件作为其他19详细拉曼位移制度,以各种分子振动的分配。重印面板(a)在从18 AMERIC许可一个真空学会。 请点击此处查看该图的放大版本。
为了获得SERS光谱对于表面固定的生物分子,包括在熔融二氧化硅载体金属纳米结构基材如在步骤1-3中描述的制造。制成的基片的质量是利用扫描电子显微镜(SEM)进行监测。标准的SEM程序别处所述16,17,18,19和不包括在本协议中; 图6示出的Au和Ag纳米点和纳米六边形状结构板(镶板广告)的代表性SEM图像,以及非-structured金,银片(板E和F,分别)。下一步骤涉及生物材料上的纳米结构基材采用表1中所列的三种设计,并获得它们的SERS光谱的固定。邻的rDer维持期间拉曼成像水性环境中,每个样本被放置在其相应的溶液( 见表1),盖有一个薄的玻璃盖,并密封, 如图7。

图6.扫描电子显微镜(SEM)的作为SERS基质10纳米厚的Au和Ag纳米结构表面的图像:(A,B)纳米点的阵列; (C,D)的纳米阵列的六角形; (E,F)非结构化垫。基板用Au结构(左)采用FS支撑,而用Ag结构(右)基板使用10nm厚的Ni涂层上的FS。如别处16,17,18记载的图像获得。PG"目标="_空白">点击此处查看该图的放大版本。
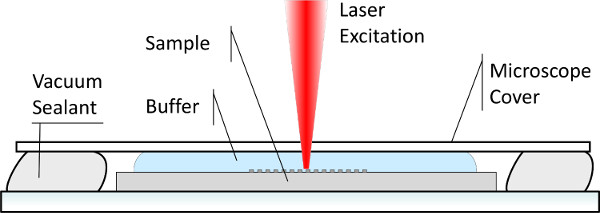
图防水室中溶液的生物官能化的样品的拉曼成像7.方案。
在设计1,重组蛋白A固定在由11-mercaptodecanoic酸(MUA)在去离子水中18一个自组 装单层官能基材。在该设计中,衬底包括凹点的三个阵列具有50纳米的间距和在熔融石英变间点的距离(参见图6A和图8)。蛋白质固定化的过程开始于一个的SAM的在基片上的形成。以获得共价的SAM和所述蛋白质之间的结合,自组装膜的羧酸基团被转化为胺反应性NHS-酯通过用氮的混合物乙基-N' - (3-(二甲基氨基)丙基)碳二亚胺(EDC)溶液并在去离子水中N-羟基琥珀酰亚胺(NHS)溶液。 A蛋白固定发生的NHS组位移蛋白37赖氨酸残基。成像样品设计1用蛋白A固定化在Au纳米结构的一个例子示于图9。图9A给出了样品,其包含的生物官能化的Au纳米点具有不同的间隙点三个阵列的光学显微镜图像(见还图3AA和图8),和图9B显示了这些阵列喇曼频谱映射。它可以看出,在最高拉曼强度被发现为阵列I其中间点间隙最窄,而较低的强度被用于第三阵列与最宽的间隙点获得。这可以通过由较高电FIE产生更强的等离子体耦合效应来解释在点之间的狭窄的空间LDS 18。 图9C示出了用于阵列I和II中获得的最强SERS光谱。该光谱显示出几条带(1630厘米-1,1964厘米-1,2280厘米-1,2577厘米-1,2916厘米-1)在接近自由蛋白A的溶液中的拉曼模式见图5A。可归因于各种键在蛋白质中发现的振动,这些频段既出现在两个固定的蛋白质类似的地点和在溶液中,或者被稍微偏移到稍高的波数固定时。相比之下,类似的纳米衬底的SERS谱没有蛋白MUA SAM功能化表现出完全不同的图案18,确认图9代表的表面固定的蛋白质A的SERS映射请点击这里查看更大的版本这个数字。

图金纳米点的三个数组对FS基板设计1 18 8,使用SEM图像。该阵列具有相同的50纳米间距和略有不同的点半径产生不同宽度的跨点的差距。这是通过将不同的EBL曝光剂量以产生PMMA掩模三个阵列来实现( 见表1)。较高的辐射剂量导致PMMA口罩更广泛的孔,允许金属化和升空后较大的凹点尺寸。转载来自18美国真空学会批准。 请点击此处查看该图的放大版本。
LES / ftp_upload / 52712 / 52712fig9.jpg"/>
衬底固定化蛋白A的设计1 18图9. SERS成像。(A)的样品的光学显微镜图像,由Au纳米点的三个阵列与石英玻璃基板50纳米节距和不同间点的间隙(也参见图6),生物官能化, 如图3A所示 。 (B)的样品的拉曼成像。 (C)SERS光谱从点阵列I和II。在面板(B)中 ,纵轴表示横跨基板的距离,横轴表示拉曼位移,和图例条表示拉曼强度。垂直虚线在板线(B)和(C)的代表游离蛋白A的溶液中,基准拉曼谱带(*)在面板(C)表示从阵列I中的拉曼光谱SERS谱带获得532 nm激发波长。转载来自18美国真空学会批准。 请点击此处查看该图的放大版本。
在设计2,重组葡萄糖结合蛋白(GBP)21复合与D-葡萄糖(配体)被固定在在磷酸钾缓冲液中的适当的基板。样品与固定的配体的无英镑用于比较还准备。在此设计中,葡萄糖结合蛋白附着由组氨酸标记,其结合良好,镍,但尚未到贵金属6的装置表面。由于在基片上包括镍涂覆的FS的Ag阵列纳米点,纳米六边形,和非结构化的Ag焊盘( 图6B,6D和6F分别),可以预计最固定化蛋白质分子将位于之间的间隙银纳米结构,其中镍涂层AVailable。拉曼光谱得到的用于固定化的葡萄糖和无葡萄糖结合的GBP示于图分别如图10A和10B所示 ,。所有这些光谱显示出宽频带在大约3300厘米-1,这对应于缓冲溶液35。具有非结构化的Ag垫获得的光谱仅包含该单一频带,并且不显示任何蛋白质振动模式,确认固定化蛋白质被发现,但在银的表面如预期。与此相反,光谱获得具有银纳米点和纳米六边形展览频带周围1550厘米-1和2900厘米-1阵列,它代表了被分析物32,33。具体地,宽频带周围1550厘米-1,被称为酰胺Ⅱ带,是归因于肽键的蛋白质33,34的振动。在考虑的情况下,该带代表自GBP的振动模式固定在Ag特征之间的Ni表面的叠加s和指示这些模式中的贵金属纳米结构的附近的SERS增强使用含有纳米点或纳米六边形基底时。该频带是非常弱的用于在不存在SERS增强( 图5B),以及不存在对Ag焊盘无镍表面可用于蛋白结合溶液中的蛋白,但它也明显为纳米基底与一些镍表面的蛋白质可访问绑定。然而,即使是对于本研究更重要的是其它,较窄的频带上大约2900厘米-1可以归因于CH键wibrations 32,33。葡萄糖-自由GBP的光谱显示在2933厘米-1与纳米点衬底,并在相似的波长与纳米六角形衬底( 图10A)的弱,但可见的带显带。从葡萄糖游离蛋白的情况下显着,葡萄糖结合的GBP的SERS光谱示于Figu重新10B展示对应的CH键振动制度,在2850厘米-1和2910厘米-1两个频段。该频带是公宣判纳米六边形基底葡萄糖结合的GBP的频谱,并且它们还可以在英镑对纳米点衬底频谱可以看出。在2850厘米频带-1是相当接近的2890厘米-1 1在从D-葡萄糖溶液中的控制拉曼光谱,因此,可以归结为葡萄糖结合到蛋白,而其它频带(在2910厘米-1)是归属于CH键既蛋白质和葡萄糖的振动。人们可以得出结论,从葡萄糖和无葡萄糖结合的基板固定的GBP SERS签名的这种差异是可观察到的在该区域中,与CH键蛋白质结合的葡萄糖的振动是可检测的采用所描述的设计。
10.jpg"/>
图10. SERS的配体免费(A),并在设计2固定在三个不同的衬底的光谱与780纳米的激发波长获得的配体结合(B)葡萄糖结合蛋白 。 光谱 请点击此处查看大图这个数字。
在设计图3中,定制的多巴胺结合适体(DBA)与巯基终止23被固定在基底在三(羟甲基)氨基甲烷(TRIS)乙二胺四乙酸(EDTA)缓冲液上,并且多巴胺然后结合至固定化的适体19。衬底为这种设计包含金的纳米六边形上的FS( 图6C)阵列。非结构化的Au焊盘( 图6E)也被用于控制目的。由于DNA在本质上是荧光灯38,780 nm激发waveleng个被用于设计3,以减少这个因素。在此设计中,识别元件(适体)没有拉曼活性在图11中考虑的拉曼位移的区域中,而多巴胺示出在该区域一个显著拉曼活性。由于从暴露于仅多巴胺而不固定适体样本信号表明没有所得多巴胺频带19中,观察到SERS频带,预计从适体结合的多巴胺始发图11上金的纳米结构之前和添加之后比较固定的适体的SERS光谱多巴胺。正如预期的,固定化的多巴胺游离适体不表现出拉曼频带。与此相反,许多明显的拉曼频带的被观察到多巴胺结合固定化的适体。大多数频带的图11中的位置是接近那些在结晶多巴胺,尽管在振幅的差异。
igure 11"SRC ="/文件/ ftp_upload / 52712 / 52712fig11.jpg"/>
图11. SERS的配体-自由(紫色线)和配体结合(蓝线)多巴胺结合适体在设计固定在Au纳米六边形基底3 19。红线表示多巴胺粉末的控制SERS光谱。 光谱 请点击此处查看该图的放大版本。
讨论
SERS是获得了认可,生物检测的一个非常强大的技术,提供了许多独特的优势。与分子振动之间的关系允许选择性地识别从SERS光谱的特定分析物的"指纹",而非常高的灵敏度,能够检测非常少量的分析物9,10,11,35的。此外,SERS是一种非破坏性的方法,这也是相对不敏感的水,并由此其非常适合用于探测生物材料在其自然的含水环境9。呈现的结果强调这些优点以及进一步展示的SERS的强烈潜力作为生物检测的一个非常灵活的无标记技术。在三种设计采用不同的基片固定的生物分子的单分子膜,拉曼模式已经被检测到,可以自信地归因于特定分析物。这些生物分子检测Òř各自的配体,已经被证明采用石英作为SERS基质的支撑平面表面,使得当前的电子和微流体设置兼容的设计,看好与新兴的生物电子架构接口生物材料与电子表面关系众多的应用和电化学设备2,3。重要的是,在2 3的设计SERS检测已被证明为小分子,如葡萄糖和多巴胺,采用分别在表面固定化蛋白和适体,单层的特异性结合,作为识别元素。
但是,有几个方面的应以实现一种有效的表面增强拉曼光谱的生物检测中的"芯片上"设定的照顾。首先,公知的挑战即是常见的大多数生物分子是其倾向降低,特别是当暴露于非天然条件如干燥ENVI境或强烈的激光。在整个协议中,我们强调始终保持浸没在适当的解决方案的生物官能化的样品在整个实验过程中,从准备的样品,以采集拉曼光谱的重要性。对于后者,定制防水室已被设计( 图7),以避免在激光照射的液体的蒸发。曝光和激光强度的持续时间如在该协议的步骤5.3中描述,以避免样品的损害也应受到限制。
的SERS检测的结果发现,以所用的基板,以及金属纳米结构的特别的相互分离特征的几何结构敏感。当它从图8和9所示,设计1样品的SERS强度强烈地依赖于对熔融二氧化硅的Au纳米点之间的间隙的宽度。金纳米点出三个阵列测试我n这个设计( 图8),最高的拉曼强度与阵列I,其具有凹的特征间的最窄的间隙,因此,它提供了更有效的电磁场增强来实现的。作为图9示出,需要间特征的分离在10-20纳米或更低的电平控制。用人EBL用于制造SERS衬底,如这里显示出,提供了一种有效的分辨率专门用于控制间隙特征的宽度。具有正色调抗蚀EBL例如PMMA,在PMMA的掩模孔的尺寸可以通过简单地改变曝光剂量进行改变。后剥离这导致不同尺寸的装配式金属点,并且这些点之间的间隙的宽度可被调谐为所希望的,通过选择合适的EBL曝光剂量18。
另一个挑战是为特定的生物检测应用程序SERS基质的几何形状的优化。虽然增强效果我ncreases与减少间特征间隙,生物分子的相对大的尺寸规定了如何窄的间隙可以是限制。这是显而易见的,从该结果设计2,其中固定化的方法是这样的蛋白有效地结合到只贵金属点之间的表面上,而不是在点本身( 见图3B)。当它从图10所示,对于非结构化的Ag焊盘的SERS光谱没有显示来自分析物的任何条带。虽然垫具有非常薄的岛屿间的差距纳米晶体结构( 见图6F),这些差距过于狭窄,以适应蛋白质分子。然而复杂性的另一个方面是加入时蛋白 - 配体的结合有被检测到。在图10中,表面增强拉曼光谱CH频带中从配体结合英镑光谱比在无配体1,其可以通过在英镑构象的变化来解释假想更加明显在D-葡萄糖2 7,27结合,产生更刚性的结构具有增加的拉曼活性。如果比较两个纳米结构衬底,从配位体的无蛋白质的CH带与所述纳米点基底所得SERS光谱强,而蛋白和葡萄糖CH频带从配体结合的蛋白质两者都更加显着的纳米六边形基板。两个因素都预期会导致这些差异,银之间的空间的可用性提供其中GBP可以结合到Ni和配体结合的配位体和游离蛋白的易感性拉曼的电磁增强散射中的"热点"之间的这些特征。一方面,所述纳米点图案,提供相对较大的间特征区,其中的Ni涂层是可用于蛋白质结合,这可以解释观察到的对Ag纳米点基底葡萄糖 - 自由GBP更明显的CH频带。另一方面,由于它们的非均匀STRUCTURE( 见图6D),银纳米六边形可能倾向于表现出更强的电磁增强在导致从纳米六边形基片上的葡萄糖结合的GBP更强CH振动谱带纳米六角形内银岛之间狭窄的间隙。这种相互作用的一些细节需要进一步的验证,并且SERS基材为复杂的分析物涉及大型蛋白质如英镑的优化仍然在流水线。
显然,SERS检测配体结合采用固定化的生物分子作为识别元件的当只有配位体是拉曼活性在所选择的区域中,而其他成分不容易。这是设计3,得到适体结合的多巴胺显SERS频带,其中( 图11)的情况下。所述适体 - 多巴胺对表现出优异的特异性和SERS光谱包括显带而没有任何显著背景信号。
标签费SERS技术未来的进步将涉及生物分子"SERS信号增强了广泛的不同的表面纳米结构设计,广泛的测试。直接写入电子束光刻的使用,以制造具有以上的大小,形状,及跨功能分离控制的一个极好的层次不同的纳米结构,并结合此处给出的样品制备的协议,将有利于比较的结果的和交叉验证获得的通过不同的研究小组。这将解决重复性的重大挑战时,SERS基质是捏造采用另一种"自下而上"的方法11,12,13,从而为更好地控制金属纳米结构的大小和位置对一个可靠的识别最优基板设计的各种各样的应用。这些技术的可扩展性可以随后通过EBL与互补的纳米光刻方法如纳米组合得到改善压印光刻19对未来大规模生产的纳米级设计而优化的采用可调EBL技术。
披露声明
The authors have nothing to disclose.
致谢
The authors would like to thank: David Wishart, Valentyna Semenchenko, Mark McDermott, Michael Woodside, and Albert Cao for their help in developing and preparing the protein conjugates as well as the DNA aptamer; T. M. Fahim Amin, Mosa Sharmin Aktar, and Trevor Olsen for their assistance in the sample preparation, Jonathan Mane for his assistance in generating images of the molecular structures; and the funding sources including the National Research Council of Canada – National Institute for Nanotechnology (NRC-NINT), Natural Sciences and Engineering Research Council of Canada (NSERC), and the University of Alberta for supporting the work.
材料
| Name | Company | Catalog Number | Comments |
| 11-Mercaptoundecanoic acid (MUA) |  Sigma Aldrich Sigma Aldrich | 450561 ALDRICH | Used for surface functionalization in Design 1 |
| Conductive polymer |  Mitsubishi Rayon Mitsubishi Rayon | aquaSAVE-57xs | A 70 nm thick layer is used as anti-charging coating for EBL exposures |
| D-glucose | Collaborator Lab. | Ligand in Design 2 | |
| Dopamine | Collaborator Lab. | Ligand in Design 3 | |
| Dopamine binding aptamer (DBA) |  Integrated DNA Technologies Inc. Integrated DNA Technologies Inc. | 5'- /Thiol Modifier C6 S-S/ AAAAAAAAAA GTCTCTGTGT GCGCCAGAGA ACACTGGGGC AGATATGGGC CAGCACAGAA TGAGGCCC-3' | Biopolymer in Design 3 |
| Fused silica wafers |  Mark Optics Mark Optics | ||
| Glucose binding protein (GBP) |  Collaborator Lab. Collaborator Lab. | PDB ID 2HPH | Biopolymer in Design 2 |
| High vacuum grease |  Dow Corning Dow Corning | Used to seal water-proof chamber | |
| Hydrogen Peroxide 30%, H2O2 | J.T. Baker | Used for pirahna solution | |
| N-ethyl-N'-(3-(dimethylamino) propyl) carbodiimide (EDC) |  Sigma Aldrich Sigma Aldrich | 03450 FLUKA | Used for immobilization of biopolymer in Design 1 |
| N-Hydroxysuccinimide (NHS) |  Sigma Aldrich Sigma Aldrich | 130672 ALDRICH | Used for immobilization of biopolymer in Design 1 |
| Potassium phosphate buffer | Collaborator Lab. | Buffer used in Raman sampling | |
| Phosphate buffered saline (PBS) | Collaborator Lab. | Solvent in Design 3 | |
| Polymethylmethacrylate (PMMA) 950 A2 |  MicroChem MicroChem | A 90 nm thick layer is used as EBL positive tone resist | |
| Recombinant protein A |  Protein Mods Inc Protein Mods Inc | PDB ID 1BDD | Biopolymer in Design 1 |
| Sulfuric acid 96%, H2SO4 | J.T. Baker | Used for pirahna solution | |
| Tris(hydroxymethyl)aminomethane (TRIS) and ethylenediaminetetraacetic acid (EDTA) buffer |  Sigma Aldrich Sigma Aldrich | T9285 SIGMA | Buffer in Design 3
|
| | |||
| Equipment | |||
| Name | Company | Catalog Number | Comments |
| Dicing saw | Diamond Touch Technology Inc. (17301 W Colfax Ave # 152, Golden, CO) | Used to cut FS wafer | |
| Electron beam evaporator |  Kurt J. Lesker Kurt J. Lesker | Used for Au and Ag evaporation | |
| Electron beam evaporator |  Johnsen Ultravac (JUV) Johnsen Ultravac (JUV) | JuV E-gun | Used for Ni evaporation |
| Microscope cover slips (25 mm) |  Fisher Scientific Fisher Scientific | 12-545-102 | Used in water-proof chamber |
| Microscope slides (3×1 in.) |  Fisher Scientific Fisher Scientific | Used in water-proof chamber | |
| Raith 150TWO EBL exposure system |  Raith Inc. Raith Inc. | Raith 150TWO system | Used for EBL exposures |
| Raman microscope |  Thermo Scientific Thermo Scientific | Nicolet Almega XR | Used for Raman spectroscopy |
| Sonicator system |  Branson Branson | Used for liftoff and solutions mixing | |
| Spinner |  Brewer Spinner and Hotplate Brewer Spinner and Hotplate | Cee 200X and Cee 1300X | Used to spin-coat PMMA and conductive polymer |
参考文献
- Sapsford, K. E., Tyner, K. M., Dair, B. J., Deschamps, J. R., Medlintz, I. L. Analyzing Nanomaterial Bioconjugates: A Review of Current and Emerging Purification and Characterization Techniques. Anal. Chem. 83, 4453-4488 (2011).
- Walcarius, A., Minteer, S. h. D., Wang, J., Yu, L., Merkoçi, A. Nanomaterials for Bio-Functionalized Electrodes: Recent Trends. J. Mater. Chem. B. 1, 4878-4908 (2013).
- Kim, J., et al. Applications, Techniques, and Microfluidic Interfacing for Nanoscale Biosensing. Microfluid. Nanofluid. 7, 149-167 (2009).
- Rassaei, L., Singh, P. S., Lemay, S. G. Lithography-Based Nanoelectrochemistry. Anal. Chem. 83, 3974-3980 (2011).
- Wong, L. S., Khan, F., Micklefield, J. Selective Covalent Protein Immobilization: Strategies and Applications. Chem. Rev. 109, 4025-4053 (2009).
- Ley, C., Holtmann, D., Mangold, K. -. M., Schrader, J. Immobilization of Histidine-Tagged Proteins on Electrodes. Colloids and Surfaces B: Biointerfaces. 88, 539-551 (2011).
- Kim, D., Herr, A. E. Protein Immobilization Techniques for Microfluidic Assays. Biomicrofluidics. 7, 041501 (2013).
- Anker, J. N., Hall, W. P., Lyandres, O., Shah, N. C., Xhao, J., Van Duyne, R. P. Biosensing with Plasmonic Nanosensors. Nature Materials. 7, 442-453 (2008).
- Bantz, K. C., et al. Recent Progress in SERS Biosensing. Phys.Chem. 13, 11551-11567 (2011).
- Sharma, B., Frontiera, R. R., Henry, A. -. I., Ringe, E., Van Duyne, R. P. SERS: Materials, Applications, and the Future. Mater. Today. 15, 16-25 (2012).
- Kleinman, S. L., Frontiera, R. R., Henry, A. -. I., Dieringer, J. A., Van Duyne, R. P. Creating, Characterizing, and Controlling Chemistry with SERS Hot Spots. Phys.Chem.Chem.Phys. 15, 21-36 (2013).
- Fan, M., Andrade, F. S., Brolo, A. G. A Review on the Fabrication of Substrates for Surface Enhanced Raman Spectroscopy and their Applications in Analytical Chemistry. Anal. Chim. Acta. 693, 7-25 (2011).
- Cao, Y., Li, D., Jiang, F., Yang, Y., Zh, H. Engineering Metal Nanostructure for SERS Application. J. Nanomater. 123812, 1-12 (2013).
- Glembocki, O., Rendell, R., Alexson, D., Prokes, S., Fu, A., Mastro, M. Dielectric-Substrate-Induced Surface-Enhanced Raman Scattering. Phys. Rev. B. 80, 085416 (2009).
- Merlen, A., et al. Surface Enhanced Spectroscopy with Gold Nanostructures on Silicon and Glass Substrates. Surf. Sci. 605, 1214-1218 (2011).
- Muhammad, M., Buswell, S. C., Dew, S. K., Stepanova, M. Nanopatterning of PMMA on Insulating Surfaces with Various Anticharging Schemes Using 30 keV Electron Beam Lithography. J. Vac. Sci. Technol. B. 29, 06F304 (2011).
- Peters, R., Fito, T., Gutierrez-Rivera, L., Dew, S. K., Stepanova, M. Study of Multilayer Systems in Electron Beam Lithography. J. Vac. Sci. Technol. B. 31, 06F407 (2013).
- Gutierrez-Rivera, L., Peters, R., Dew, S., Stepanova, M. Application of EBL Fabricated Nanostrucutred Substrates for SERS Detection of Protein A in Aqueous Solution. J. Vac. Sci. Technol.B. 31, (2013).
- Gutierrez-Rivera, L., Peters, R., Dew, S., Stepanova, M. Surface-Enhanced Raman Spectroscopy Detection of Protein-Ligand Binding Using D-glucose and Glucose Binding Protein on Nanostructured Plasmonic Substrates. , (2014).
- Peters, R. . Fabrication and Testing of Surface-Enhanced Raman Spectroscopy Substrates for the Detection of Biomolecules [MSc Thesis]. , (2014).
- Gouda, H., Torigoe, H., Saito, A., Sato, M., Arata, Y., Shimada, I. Three-Dmensional Solution Structure of the B Domain of Staphylococcal Protein A: Comparisons of the Solution and Crystal Structures. Biochemistry. 31, 9665-9672 (1992).
- Cuneo, M. J., Johnson, S. J., Beese, L. S., Hellinga, H. W. High Resolution Structure of E. Coli Glucose/Galactose Binding Protein Bound with Glucose. Research Collaboratory for Structural Bioinformatics (RCSB) Protein Data Bank. , (2009).
- Humphrey, W., Dalke, A., Schulten, K. VMD - Visual Molecular Dynamics. J. Molec. Graphics. 14, 33-38 (1996).
- Walsh, R., DeRosa, M. C. Retention of Function in the DNA Homolog of the RNA Dopamine Aptamer. Biochem. Biophys. Res. Comm. 388, 732-735 (2009).
- Akitomi, J., Kato, S., Yoshida, Y., Horii, K., Furuich, M., Waga, I. ValFold: Program for the Aptamer Truncation Process. Biomed. Inf. 7, 38-40 (2011).
- Han, K., Lee, Y., Kim, W. PseudoViewer: Automatic Visualization of RNA Pseudoknots. Bioinformatics. 18, S321-S327 (2002).
- Dwyer, M. A., Hellinga, H. W. Periplasmic Binding Proteins: a Versatile Superfamily for Protein Engineering. Curr. Opin. Struct. Biol. 14, 495-504 (2004).
- Benson, D. E., Conrad, D. W. Design of Bioelectronic Interfaces by Exploiting Hinge-Bending Motions in Proteins. Science. 293, 1641-1644 (2001).
- Bozic, S., Chorzempa, J. . Pirahna Cleaning. , (2011).
- Mohammad, M. A. Raith 150TWO SOP. , (2011).
- Schmidt, M. W., et al. General Atomic and Molecular Electronic Structure System. J. Comput. Chem. 14, 1347-1363 (1993).
- Bode, B. M., Gordon, M. S. MacMolPlt: a Graphical User Interface for GAMESS. J. of Mol. Graph. Mod. 16, 133-138 (1998).
- Bright, A., Devi, T. S. R., Gunasekaran, S. Spectroscopical Vibrational Band Assignment and Qualitative Analysis of Biomedical Compounds with Cardiovascular Activity. Int. J. Chem. Tech. Res. 2, 379-388 (2010).
- Bandekar, J. Amide Modes and Protein Conformation. Biochim. Biophys. Acta. 1120, 123-243 (1992).
- Barth, A., Zscherp, C. What Vibrations Tell About Proteins. Quarterly Reviews of Biophysics. 35, 369-340 (2002).
- Chrimes, A. F., Khoshmanesh, K. h., Stoddart, P. R. M. i. t. c. h. e. l. l. A., Kalantar-Zadeh, K. Microfluidics and Raman Microscopy: Current Applications and Future Challenges. Chem. Soc. Rev. 42, 5880-5906 (2013).
- Park, S. -. K., Lee, N. -. S., Lee, S. -. H. Vibrational Analysis of Dopamine Neutral Base based on Density Functional Force Field. Bull.-Korean Chem. Soc. 21, 959-968 (2000).
- Briand, E., Salmain, M., Compère, C., Pradier, C. M. Immobilization of Protein A on SAMs for the elaboration of immunosensors. Coll. Surf. B: Biointerfaces. 53, 215-224 (2006).
- Lakowicz, L. R., et al. Radiative decay engineering: 2. Effects of Silver Island Films on Fluorescence Intensity, Lifetimes, and Resonance Energy Transfer. Analytical biochemistry. 301, 261-277 (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。