需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
细胞周期进程的时间跟踪使用流式细胞仪,无需同步
摘要
这个协议描述了使用溴脱氧尿苷(BrdU)标记的摄取,以允许细胞是在S期在时间上的特定点的时间的跟踪。此外DNA染料和抗体标记的方便了S期细胞的命运在稍后时间详细分析。
摘要
This protocol describes a method to permit the tracking of cells through the cell cycle without requiring the cells to be synchronized. Achieving cell synchronization can be difficult for many cell systems. Standard practice is to block cell cycle progression at a specific stage and then release the accumulated cells producing a wave of cells progressing through the cycle in unison. However, some cell types find this block toxic resulting in abnormal cell cycling, or even mass death. Bromodeoxyuridine (BrdU) uptake can be used to track the cell cycle stage of individual cells. Cells incorporate this synthetic thymidine analog, while synthesizing new DNA during S phase. By providing BrdU for a brief period it is possible to mark a pool of cells that were in S phase while the BrdU was present. These cells can then be tracked through the remainder of the cell cycle and into the next round of replication, permitting the duration of the cell cycle phases to be determined without the need to induce a potentially toxic cell cycle block. It is also possible to determine and correlate the expression of both internal and external proteins during subsequent stages of the cell cycle. These can be used to further refine the assignment of cell cycle stage or assess effects on other cellular functions such as checkpoint activation or cell death.
引言
的细胞周期功能和发生在细胞的变化过程中的细胞周期进展的评估是基本理解生物学,特别是癌症生物学的许多方面。在发展为恶性肿瘤的治疗许多药物对细胞周期进程产生深远的影响,或通过细胞周期依赖性机制诱导细胞死亡。为了研究细胞周期动力学或细胞在细胞周期的特定阶段中,通常以同步的细胞。然而同步方法可以对细胞有害作用被研究,有可能混淆的结果。1在单细胞随时间的细胞周期进程的最新的使用荧光标记的蛋白质,是只存在于细胞周期的特定阶段的已批准的分析2,但是所述细胞进行研究需要被遗传操纵以表达这些标记的蛋白质,限制了其使用的地方这可以读取系统容易完成。
细胞周期包括两个活性阶段:合成(S)相,其中,DNA复制和有丝分裂(M),其中,细胞分裂发生。这些阶段由三个间隙相,G 0,G 1和G 2分开。 ģ0或静止,是其中细胞已离开循环的休止阶段中,G 1是其中细胞大小之前的DNA复制和G 2,其中的DNA复制的完成之间但细胞分裂前的细胞生长继续增加。通过细胞周期的进展是由多个检查站的控制。当环境条件不支持DNA合成和防止进入S期对G 1检查点被激活。内-S期检查点或延迟可以通过DNA损伤可能会导致复制叉停滞了被触发。期间克2-复制的DNA的保真度被确认,并且如果检测到损坏那G 2 检查点被激活允许细胞分裂DNA修复之前。有丝分裂期间的最后的检查点可确保染色单体已经在有丝分裂板被正确地对准,使得细胞分裂可顺利完成。这些检查点的3激活通常用于同步的细胞群。细胞周期关卡可以通过许多因素,但在肿瘤生物学中最常见的是检测DNA损伤激活。 DNA损伤响应由PI3激酶样激酶共济失调毛细血管扩张症和RAD3相关(ATR)发起和共济失调毛细血管扩张症突变(ATM),该激活下游效应激酶Chk1的和Chk2,分别3事件的范围激活的Chk1包括停滞复制叉,DNA的交联,和紫外线辐射的伤害而Chk2的是由双链断裂主要激活。
为研究对细胞周期i的长度的改变的条件下的效果的常用方法s到同步细胞在细胞周期的特定阶段。1这可以通过几种方法来实现。细胞可被物理分离基于尺寸,密度,侧向散射(粒度),以及细胞表面表达的标志。更实际,细胞可以通过化学手段进行同步。几剂,例如胸苷,羟基脲和阿糖胞苷可用于抑制DNA合成的细胞周期导致S期细胞继续循环的剂被除去后的累积的S期。细胞治疗诺考达唑,这防止形成有丝分裂纺锤体,逮捕与G 2 -或M相DNA含量。消除血清从培养基导致细胞于G1 0相位的累积。再加入内培养血清的营养素重新启动细胞的正常循环。然而,所有的这些同步方法干扰细胞的正常循环和生长,并且可以resul吨显著细胞死亡。
急性淋巴细胞白血病细胞的同步是特别具有挑战性的,并且这些细胞不适合于遗传操作。这里所描述的方法允许细胞周期动力学的评估和细胞在细胞周期的特定阶段没有传统同步或遗传修饰的研究。这种方法还可以用于其中,遗传修饰和传统的同步过程不容易实现其他类型的细胞是有用的。该方法是基于长期建立的使用溴脱氧尿苷(尿嘧啶)掺入,这对短期细胞的生长和增殖的影响非常小的。4成立的BrdU协议利用的BrdU的掺入在S期新合成的DNA 。这标志着永久细胞的BrdU曝光时已经处于S期。这部分人群可在稍后的时间点被染色的BrdU incorpor确定通货膨胀和由此充当可以遵循并评估在时间允许的对细胞周期转运药物作用的研究同步人口。 BrdU的需要前 抗体染色要曝光,通常是达到以下DNA酶或酸处理。6,7-使用流式细胞仪来检测掺入的BrdU使包括额外的标记。最重要的是利用染料来测量DNA含量,使该人在S期在研究开始时的细胞的细胞周期时相分布的评估。8另外附加的表面或细胞内的抗原,也可以研究。9,这些可能与细胞周期事件,如Ki67的或看似无关的细胞功能,如细胞凋亡的标记一样裂解的caspase-3。潜在的应用是由研究者的想象力的限制。
研究方案
这里所描述的协议使用的急性淋巴细胞白血病细胞系NALM6但可以适用于其他类型的细胞。
1.解决方案和试剂
- 完全RPMI
- 添加56毫升胎牛血清(FCS)和毫升的200mM 5.5 L-谷氨酰胺至500毫升瓶的RPMI-1640培养基。
- BrdU的库存解决方案
- 在Dulbecco氏磷酸盐缓冲盐水(DPBS)制备32.5毫BrdU的(10毫克/毫升)。
- 尿嘧啶完全RPMI
- 加入6.2微升的BrdU原液中加入10毫升完全RPMI中。
- DNA酶解决方案
- 制备1毫克DNA酶/ ml,在DPBS。
- 染色缓冲液
- 制备3%热灭活的FCS和0.09%叠氮化钠在DPBS中。
- 请参阅材料清单固定缓冲液,透化缓冲液和洗涤液的定义。
2.细胞
没有德:将细胞未培养大于6个月。这种方法是直接适用于与调整细胞密度和培养介质中的任何非粘附细胞系。使用的增长指数在实验开始细胞。
- 保持NALM6细胞在完全RPMI T-75培养瓶中。执行使用Ⅱ级生物安全柜无菌条件下的所有步骤。
- 保持NALM6细胞每毫升之间1-2×10 6细胞每周三次分裂的文化。
- 在5%的孵育在37℃ 的 CO 2在空气中。
细胞的BrdU 3.脉冲标记
小心:处理BrdU的小心,因为它是一个潜在的致突变和致畸。
- 离心细胞,在150×g离心5分钟。注意:传输细胞进入新鲜培养基提高了结果的重现性。
- 以2×10 6 C进行细胞计数和重悬的细胞在完全的RPMIELLS /毫升。
- 稀释细胞1 2用BrdU完全RPMI产生最终细胞的1×10 6个细胞/ ml的浓度。
- 在37℃,5%CO 2的45分钟,然后稀释细胞1在10与完全RPMI。离心细胞,在150×g离心5分钟,并小心地丢弃所有上清液。
- 重悬的细胞在完全的RPMI小体积(〜100微升),进行细胞计数,并调整到1×10 6个细胞/ ml。
- 吸管1毫升细胞向一个48孔平板的孔中。吸取1毫升DPBS到任何无人居住的井获得更多的可重复的结果。
- 在5%CO 2在37℃的空气中对希望的时间点,在这里1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17 ,18,19,20,21,22,23和24小时。注意:的时间长度将取决于实验设计的目的在于测量。
- 传送所有的细胞变成使用移液管FACS管。用1ml VOLU冲洗顺序以及的PBS MES至5 ml的最终总体积。
- 离心150 XG 5分钟,然后小心地取出所有的上清。细胞准备进行染色,执行该立即(第4节)。
4.细胞染色
注:如果需要的细胞表面染色固定之前执行它,以确保将细胞保持在4℃下贯穿。
- 重悬的细胞在100μl的染色缓冲液(用于可选表面染色,加入抗体的推荐量对表面抗原和温育30分钟,在4℃)。
- 加入1毫升的染色缓冲液中,离心5分钟,在150×g离心并弃去上清液。
注意:特定抗体,浓度,培养时间等,将取决于具体的实验目标而有所不同。 - 固定和透
- 重悬的细胞在100μl的固定缓冲液孵育15分钟,在室温下进行。
- 加入1毫升邻f。洗涤缓冲液,离心5分钟,在150×g离心并弃去上清液。
- 重悬的细胞在100μl的透化缓冲液孵育的细胞在冰上10分钟。
- 加入1毫升的洗涤缓冲液,离心5分钟,在150×g离心,并弃去上清液。
- 重悬的细胞在100微升每管固定缓冲孵育5分钟,在室温下进行。
- 加入1毫升的洗涤缓冲液,离心5分钟,在150×g离心,并弃去上清液。
注意:如果需要,该协议可以在这里暂停。固定细胞可稳定数天,在4℃,如果再悬浮于染色缓冲液中。取出染色缓冲以下,然后再继续离心。
- DNA酶处理
- 重悬的细胞在100μl的DNA酶溶液(30微克DNA酶/ 10 6个细胞),并孵育细胞1小时,在37℃。
- 加入1毫升的洗涤缓冲液,离心机在150×g离心5分钟并弃上清。
- 抗体染色
注意:染色比的BrdU其它胞内标记物可同时与BrdU的染色来进行。- 重要提示:准备补偿控制,包括未染色的细胞和细胞标记每个单独的荧光染料。理想情况下,使用相同的抗体用于补偿控制那些在实验管中使用。但是,如果这是不可行的,替代的抗体高度表达的抗原缀合到相同的荧光染料。
- 将细胞重悬于50微升的洗涤缓冲液,并添加1微升/ 10 6个细胞的BrdU抗体。注意:直接缀合抗体对其他特定细胞内抗原也可加入。
注:抗体对组蛋白H3磷酸化上Ser10可用于细胞在G2和M之间进行区分,组蛋白H3磷酸化在Ser10有丝分裂过程10的抗体的cdc2磷酸上Tyr15可用于检测细胞甲肝Ë致力于有丝分裂。11 - 孵育细胞20分钟,在室温下进行。
- 加入1毫升的洗涤缓冲液,离心细胞,在150×g离心5分钟并弃去上清。
- 对于细胞周期分析染色的DNA
- 松开颗粒和添加7-AAD溶液(0.25微克)的20微升。注意:关键是要使用的7-AAD /细胞的恒定量。
- 重悬在1ml染色缓冲液中的细胞。
5.收集流式细胞仪数据
注意:需要将依赖于所使用的荧光染料的数量和性质的机器。
- 收集以下参数:FSC-A,SSC-A,FSC-H(FSC-W能够被用来代替FSC-H)和7-AAD荧光上的线性标尺。收集对数尺度的APC渠道。收集所需的使用对数刻度的表面或内部的标签评估任何额外的通道。
- 执行COM补偿重叠在分析样品之前不同的荧光染料之间观察到的发射光谱信号。注意:大多数的流式细胞仪将自动执行此。
- 收集至少10000个事件用于每个样品。
流式细胞仪数据分析6.
注意:的FlowJo用于本研究用于流式细胞术数据的分析,但其他软件包也可以使用。门控策略示于图1。
- 使用FSC-A和SSC-A参数标识的活细胞群。
- 在这一群体中排除双峰和使用的FSC-A和FSC-H(FSC-W这里也可以使用)的聚集体。
- 在此人口设置使用7-AAD对x轴和BrdU-APC在y轴的点图。
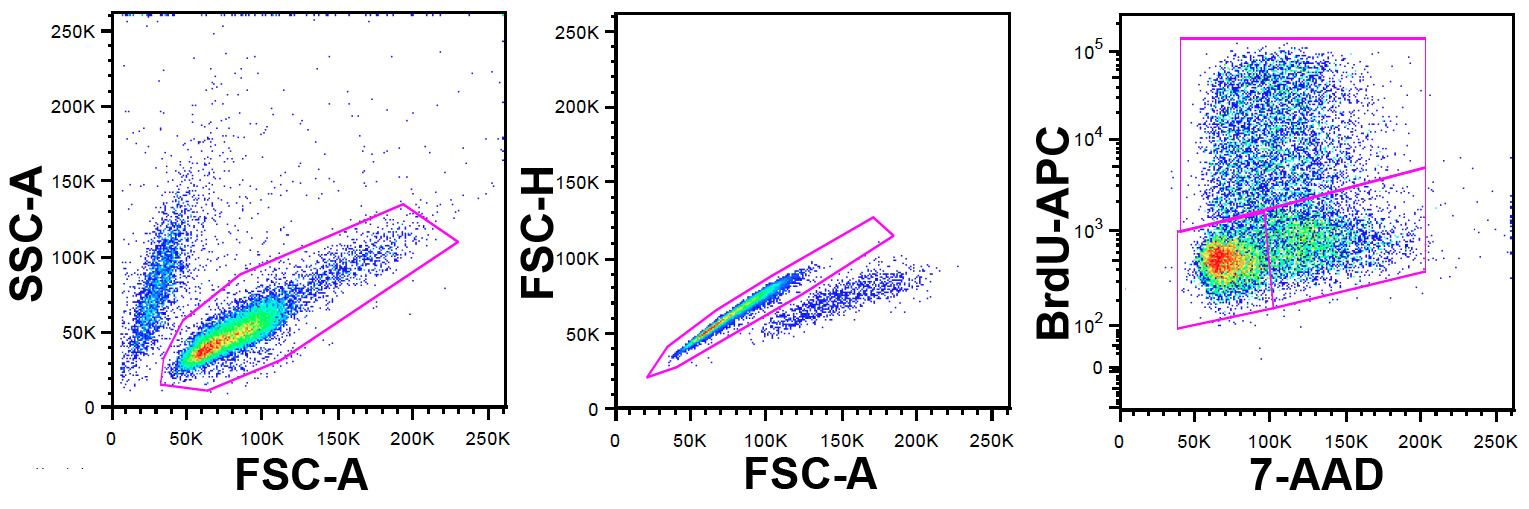
图1:门控策略左PA。道:非门的细胞都显示在一个FCS-A对SSC-A点图。活细胞群体确定所示的门。中心板:细胞从左侧面板选通显示在一个FSC-A对FSC-H散点图(FSC-W能够被用来代替高度)。双峰和聚集体识别,排除所示的门。右面板:细胞在中心面板上的双重排斥日期控显示在7-AAD与APC-A点图。所述的BrdU抗体用的APC允许细胞已掺入的BrdU脉冲标记期间的标识。 7-AAD提供对DNA含量的信息。上闸门定义S期细胞阳性尿嘧啶,因此在BrdU的脉冲,左下门,细胞在G中0/1与下右闸的G中时2 / M。 请点击此处查看更大的版本这个数字。
- 的细胞周期 nalysis
- 打开对细胞中的双峰排除门的第一数据文件和栅极。
- 分析这一群体的细胞周期分布(位于下FloJo软件平台),并使用迪安 - 杰特 - 福克斯模型。
- 获得对G 0/1和G使用create门2 / M峰的位置。
- 门上的BrdU阳性细胞及受这个人口同一个细胞周期分析。
- 通过从创建栅极施加相同的栅极和设置约束(用形成的门),在G 0/1和G 2 / M期峰的位置提供对G 0/1和G 2 / M期峰的位置。这表示在所述第一2板图2。
注意:其它软件也可用于分析数据和指令将相应地变化。
840 / 52840fig2highres.jpg"WIDTH ="700"/>
图2:细胞周期进程的第一面板(全细胞)被选通由所述双峰排除门所限定的细胞群。这一人群用7-AAD对X轴显示以直方图。对G 0/1峰的峰值是由轴下方的箭头表示。在后续板BrdU阳性细胞已被选通打开, 如图1。为双峰排除栅极选通时获得对G 0/1位置的值被施加到内的FlowJo细胞周期软件的BrdU阳性门控细胞。每个随后的面板被选通的BrdU阳性人口如图1和基于当分析整个人群中所示的前两个板得到的值对G 0/1峰的位置。使用的BrdU阴性部分以识别为BrdU阳性细胞在相同的SAMP对G 0/1人口的位置勒控制用于在样品间DNA的染色强度的任何微小的差别。每个面板上显示的数字表示自从BrdU的脉冲结束的时间。计算的细胞周期显示在绿色阴影。 请点击此处查看该图的放大版本。
结果
这个方法可以用于获得信息的范围。一些应用程序在这里列出。
细胞周期的持续时间的评估
为了确定通过细胞周期所需的细胞过境时间,将细胞收获在以下的BrdU的脉冲不同的时间点。评估之间的时间间隔,可以适应于特定的细胞被分析。造血细胞系进行了评估每小时超过在不存在任何药物治疗,以确定细胞周期阶段标准培养条件下的长度的24小时期间, ...
讨论
分析细胞周期的能力,对于癌症生物学的理解和两种药物和基因影响细胞增殖和生长的作用机制重要。虽然有许多测定法,据说测量细胞增殖的,多数只提供的量度指示的数目的细胞存在。这些包括测量通过直接可视化和计数,代谢活性或ATP浓度细胞数测定。许多这些方法的主要优点是,它们相对容易地进行,并适合于微孔板格式和自动化,使它们可用于筛选大量的条件或化合物。许多这些方法?...
披露声明
The authors have nothing to disclose.
致谢
The work was funded by the Leukemia and Lymphoma Society of the USA (6105-08), a Cancer Council NSW grant (13-02), an NHMRC Senior Research Fellowship (LJB) (1042305) and project grant (1041614).
材料
| Name | Company | Catalog Number | Comments |
| APC BrdU Flow Kit | BD Biosciences | 552598 | Contains BrdU antibody, 7-AAD and BD Cytofix/Cytoperm Buffer (referred to as Fixation Buffer) |
| BD Cytoperm Permeabilization Buffer Plus | BD Biosciences | 561651 | Referred to as Permeabilization buffer |
| BD Perm/Wash Buffer | BD Biosciences | 554723 | Referred to as Wash buffer |
| DNase | Sigma | D-4513 | |
| BD Falcon 12 x 75 mm FACS tubes | BD Biosciences | 352008 | |
| BD Pharmingen Stain Buffer | BD Biosciences | 554656 | |
| BD LSR FORTESSA flow cytometer | BD Biosciences | FORTESSA | |
| Pipetman | Gilson | P2, P20, P100, P1000 | |
| RPMI 1,640 w/o L-Gln 500 ml | Lonza | 12-167F | |
| DPBS | Lonza | 17-512F | |
| Fetal Bovine Serum | FisherBiotec | FBS-7100113 | |
| L-Glutamine | Sigma | G7513-100ML | |
| 5-Bromo-2′-deoxyuridine | Sigma | B5002-1G | |
| Falcon TC 150 cm2 vented Flasks | BD Biosciences | 355001 | |
| Pipettes 25 ml | Greiner | 760180 | |
| Aersol Pipettes 200 µl | Interpath | 24700 | |
| Aersol Pipettes 1 ml | Interpath | 24800 | |
| Centrifuge | Spintron | GT-175R | |
| CO2 incubator | Binder | C 150 | |
| AF488 anti-Histone H3 Phospho (Ser10) Antibody | Cell Signalling | 9708S | |
| Phospho-Chk2 (Thr68) (C13C1) Rabbit mAb | Cell Signalling | 2197S | |
| Phospho-Chk1 (Ser345) (133D3) Rabbit mAb | Cell Signalling | 2348S | |
| NALM6 | DSMZ | ACC-128 |
参考文献
- Banfalvi, G., Banfalvi, G. . Methods Mol Biol. 761, 1-23 (2011).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132, 487-498 (2008).
- Harper, J. W., Elledge, S. J. The DNA damage response: ten years after. Molecular Cell. 28, 739-745 (2007).
- Latt, S. A., George, Y. S., Gray, J. W. Flow cytometric analysis of bromodeoxyuridine-substituted cells stained with 33258 Hoechst. The Journal of Histochemistry and Cytochemistry. 25, 927-934 (1977).
- Gratzner, H. G. Monoclonal antibody to 5-bromo- and 5-iododeoxyuridine: A new reagent for detection of DNA replication. Science. 218, 474-475 (1982).
- Carayon, P., Bord, A. Identification of DNA-replicating lymphocyte subsets using a new method to label the bromo-deoxyuridine incorporated into the DNA. Journal of Immunological Methods. 147, 225-230 (1992).
- Gonchoroff, N. J., et al. S-phase detection with an antibody to bromodeoxyuridine. Role of DNase pretreatment. Journal of Immunological Methods. 93, 97-101 (1986).
- Rabinovitch, P. S., Torres, R. M., Engel, D. Simultaneous cell cycle analysis and two-color surface immunofluorescence using 7-amino-actinomycin D and single laser excitation: applications to study of cell activation and the cell cycle of murine Ly-1 B cells. Journal of Immunology. 136, 2769-2775 (1986).
- Saunders, P. O., et al. RAD001 (everolimus) induces dose-dependent changes to cell cycle regulation and modifies the cell cycle response to vincristine. Oncogene. 32, 4789-4797 (2013).
- Hendzel, M. J., et al. Mitosis-specific phosphorylation of histone H3 initiates primarily within pericentromeric heterochromatin during G2 and spreads in an ordered fashion coincident with mitotic chromosome condensation. Chromosoma. 106, 348-360 (1997).
- Draetta, G., Beach, D. Activation of cdc2 protein kinase during mitosis in human cells: cell cycle-dependent phosphorylation and subunit rearrangement. Cell. 54, 17-26 (1988).
- Saunders, P. O., et al. RAD001 (everolimus) induces dose-dependent changes to cell cycle regulation and modifies the cell cycle response to vincristine. Oncogene. , (2012).
- Knudsen, R. C., Ahmed, A. A., Sell, K. W. An in vitro microassay for lymphotoxin using microculture plates and the multiple automated sample harvester. Journal of Immunological Methods. 5, 55-63 (1974).
- Beck, H. P. Proliferation kinetics of perturbed cell populations determined by the bromodeoxyuridine-33258 technique: radiotoxic effects of incorporated [3H]thymidine. Cytometry. 2, 170-174 (1981).
- Miller, M. J., Wei, S. H., Parker, I., Cahalan, M. D. Two-photon imaging of lymphocyte motility and antigen response in intact lymph node. Science. 296, 1869-1873 (2002).
- Collins, J. M., Berry, D. E., Bagwell, C. B. Different rates of DNA synthesis during the S phase of log phase HeLa S3, WI-38, and 2RA cells. Journal of Biological Chemistry. 255, 3585-3590 (1980).
- Schwarting, R., Gerdes, J., Niehus, J., Jaeschke, L., Stein, H. Determination of the growth fraction in cell suspensions by flow cytometry using the monoclonal antibody Ki-67. Journal of Immunological Methods. 90, 65-70 (1986).
- Danova, M., et al. Cell cycle-related proteins: a flow cytofluorometric study in human tumors. Biology of the Cell. 64, 23-28 (1988).
- Juan, G., et al. Histone H3 phosphorylation and expression of cyclins A and B1 measured in individual cells during their progression through G2 and mitosis. Cytometry. 32, 71-77 (1998).
- Langan, T. J., Chou, R. C. Synchronization of mammalian cell cultures by serum deprivation. Methods in Molecular Biology. 761, 75-83 (2011).
- Kues, W. A., et al. Cell cycle synchronization of porcine fetal fibroblasts: effects of serum deprivation and reversible cell cycle inhibitors. Biology of Reproduction. 62, 412-419 (2000).
- Urbani, L., Sherwood, S. W., Schimke, R. T. Dissociation of nuclear and cytoplasmic cell cycle progression by drugs employed in cell synchronization. Experimental Cell Research. 219, 159-168 (1995).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。