需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
h的测量
摘要
A multidimensional gas chromatography method for the analysis of dissolved hydrogen sulfide in liquid crude oil samples is presented. A Deans switch is used to heart-cut light sulfur gases for separation on a secondary column and detection on a sulfur chemiluminescence detector.
摘要
使用一种用于溶解的硫化氢的原油样品中的分析方法中证明气相色谱。为了有效地消除干扰,一个两维列配置的情况下,与用来从所述第一转移硫化氢到第二列(心脏切割)一个的Deans开关。液体粗采样首先分离二甲基聚硅氧烷柱,和轻质气体是心脏切割,并进一步上分离键合的多孔层开管(PLOT)柱,其能够从其他光含硫物质分离硫化氢。硫化氢然后用硫化学发光检测器检测,添加选择性的附加层。以下分离和检测的硫化氢,系统被反冲以除去存在于粗样品中的高沸点烃和保留色谱完整性。溶解的硫化氢已量化液体样品中为1.1至500 p下午,展示出广泛的应用到各种样品。该方法也已成功地用于气体样品从原油顶部空间和工艺气体袋进行分析,以测量在0.7至9700 ppm的硫化氢。
引言
原油的准确的分析是对石油和天然气工业必不可少的,健康和安全法规和经济性油质量的功能。为了保障原油样品的运输,有必要确定原油样品的特性制定安全法规将在释放或溢出的情况下实现的。具体地,硫化氢量化(H 2 S)是重要的,由于在气相中的高毒性;曝光低至100 ppm的可致命(http://www.cdc.gov/niosh/idlh/7783064.html)1,2。溶解硫化氢粗样品中通常被认为是腐蚀性的3,4,和可以停用用于处理油5-7的催化剂。从原油流除去硫化氢的是理想的,但没有一种方法来测量溶解的 H 2 S,这是难以评估的去除治疗的成功。由于这些原因,该协议被开发用于测量dissoLVED 硫化氢重质原油样品中如加拿大的油砂的原油。
为硫化氢的量化打火机基于石油或燃料样品中的许多标准方法存在的,但都没有被验证为与重质原油从加拿大的油砂通常提取中使用。 的 H 2 S和硫醇使用由通用石油产品(UOP)方法163 8滴定技术确定,但这种方法从用户解释偏压导致从滴定曲线的手动阅读受到影响。石油(IP)的方法570研究所采用的是专业硫化氢分析仪,加热燃油样品9,并从简单性和便携性的好处,但缺少准确性较重的样品10。美国社会测试和材料协会(ASTM)方法D5623使用气相色谱(GC)用低温冷却和硫选择性检测来测量的 H 2 S在光石油液体11,12。这个标准可以改善使用环境分离和也可以应用到重质原油,因此它被用来作为基础本文所讨论的协议。
GC是一个频繁使用的技术石油样品的分析。样品被蒸发在热入口和分离发生在气相中。气相分离使得GC理想的 H 2 S的分析,因为它是从液体样品加热在入口时容易释放出来。气相色谱方法可以创建并针对不同的样品,根据所使用的温度程序,柱实现,并且使用多维色谱13-15中 。已经有一些最近的事态发展,使用GC H 2 S的测量。 。良等证实 的 H 2 S和其它轻质硫化合物测量在光线和中间馏分使用多维GC和院长切换,但该方法具有不尚未应用到重质原油16。二三藏等人还定量ħ用GC,2 S在汽油然而它也还没有被使用于重质原油,并且需要子周围冷却17。该方法提出这里演示相当多的时间节省了这些以前的方法,用5分钟的完成分析的时间,相对于10分钟(良)和40分钟(迪三藏)。不幸的是,落实在我们的实验室进行比较准确这些方法是不可能的,由于设备和时间的限制。
多维气相色谱允许用户利用两列的选择性,而不是单一的塔。在传统的气相色谱,分离发生在一列。在多维气相色谱的情况下,将样品上分离两个不同的列,增强了分离和选择性。院长开关是用于采用一个两维列配置中的一个装置。该开关使用外部阀门可怕从到的两个出口18-20之一交换机上的入口克拉气流。从第一塔流出物可以被定向在两个方向上;在这种情况下,光硫气体是"心脏切"21从第一分离到多孔层开管(PLOT)柱进行二次分离,这已被证明是非常适合的H分离来自其他光硫气体2 S的 (http://www.chem.agilent.com/cag/cabu/pdf/gaspro.pdf)22-24。甲硫化学发光检测器用于检测,提供选择性硫化合物和消除可能干扰从可能已经在心脏切期间被转移到PLOT柱任何其他轻质气体。从原油样品烃被保留在第一维列和反吹过程期间被除去;这种保护的情节列从任何污染25-27。这种方法也被成功地实施了肛门氧化抑制剂的变压器油28 ysis。
这里,二维气相色谱方法用于重质原油样品中的分析和溶解硫化氢的定量。该方法被证明是适用在宽范围H 2 S的浓度,并且也可以被用于测量硫化氢气体相位样本在。
Access restricted. Please log in or start a trial to view this content.
研究方案
注意:使用前请咨询所有相关的材料安全数据表(MSDS)的材料。具体而言,CS 2是高度易燃的,并且被储存并适当处理。 硫化氢气体是剧毒,和任何容器或含有硫化氢气体袋不应开启或一个正确排出通风柜之外处理。随着原油样工作都必须以饱满的个人防护设备(手套,防护眼镜,实验室外套,长裤和封闭趾鞋)来完成,所有的原油样品应被打开,传送和处理在通风柜。认证的标准气体会从制造商交付与失效日期,并为最准确的结果应谨慎使用未过期的标准。
1.准备标准
- 液体标准
- 使用自动移液管,取10微升的二硫化碳(CS 2)到50ml volumetrIC烧瓶中。容量瓶填至用HPLC(高效液相色谱)级甲苯标记行。盖上烧瓶并通过反转和漩至少五倍混合溶液;这是500ppm的股票校准解决方案。
- 上分析的每一天,准备4小瓶的CS 2的用于校准。标签41.5毫升自动进样瓶,并把它们放在一个小瓶托盘。
- 使用自动移液管,免除200微升500ppm的股票CS 2溶液到每个小瓶中。使用第二自动移液器,免除800微升HPLC级甲苯到四个小瓶。在分配CS 2和甲苯后,立即盖上每个小瓶中,颠倒三次混合;这些都是100 ppm的校准标准。
- 燃气标准
- 动认证校准气体的气瓶到排气通风柜,并附加装配用于附连到气囊,一个调节器。
- 打开无zzle上的空气袋与气袋连接到气瓶上的调节器。
- 与调节关闭时,通过转动旋钮顶部逆时针打开气瓶。
- 转动旋钮上逆时针直到气体源源不断的填充气袋的调节器。当气袋是满的,转动调节旋钮顺时针关闭燃气流动。
- 关闭喷嘴上的气袋和从调节器分离。转动旋钮在顶部顺时针关闭气瓶。打开调节器以清除任何剩余的气体和释放压力,然后再将它关闭时,监管机构不再有任何气体就在里面。
2,仪器设置
- 方法参数
- 使用以下步骤,配置院长根据设置在气体色谱仪中的列开关,因为每个系统将具有独特的压力设置。
- 在计算打开开关院长计算器程序 r和输入柱尺寸,载气,温度,所需的流动速率使用和检测器( 参见图1).The计算器将定义所需的入口和压力控制模块(PCM)的压力,和限流管所需要的长度对于院长开关和火焰离子化检测器(FID)之间的安装。注意这些压力并将其输入到方法文件。
- 使用来自开关的Deans计算器的信息,并在表1中的信息,节目用的气体或液体分析正确的参数的方法文件。保存方法文件。
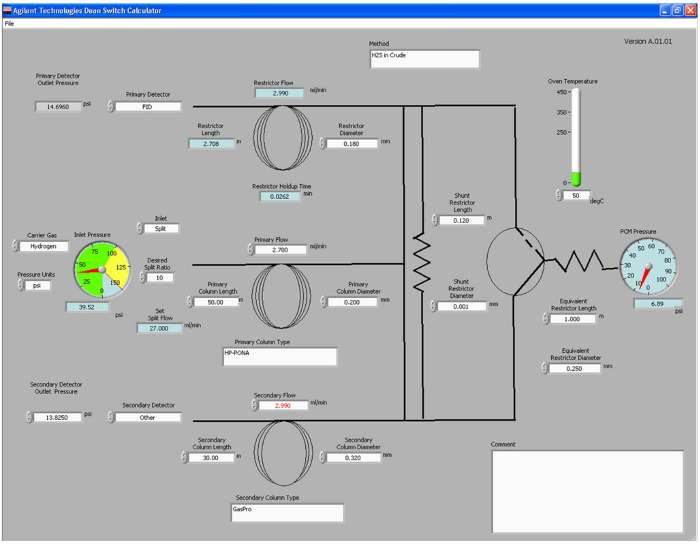
院长的图1.院长开关计算器。截图转换计算器程序。用户可调参数示于白框,和输出参数以蓝色显示框。EF ="https://www.jove.com/files/ftp_upload/53416/53416fig1large.jpg"目标="_空白">点击此处查看该图的放大版本。
- 色谱柱安装
- 确保仪器,烤箱和进口都在室温。关闭气流入口和PCM供给流向的Deans开关。
- 按照制造商的说明,安装分流/不分流进样口和院长开关,院长之间的PLOT柱切换和硫化学发光检测器(SCD)之间,以及限流管(在步骤2.1.2确定长度)之间的二甲基聚硅氧烷柱院长交换机和FID。
- 使用气相色谱仪软件,打开载气流到入口和PCM,并通过在每列和在院长开关末端通过一个电子检漏仪在接头的紧密接近测试系统是否泄漏;泄漏通过在DET的光及/或声音通知指示埃克特。
- 如果泄漏存在,轻轻拧紧管接头,并重新测试与电子检漏仪。关闭烤箱门,并打开气相色谱仪烤箱和进气加热器。
- 通过增加炉温到PLOT柱(发现在柱的文档)的温度上限进行烘烤列和限流管;允许烤箱坐在该温度下至少3小时的。
- 当烘烤完成后,冷却该炉至RT,并重新测试该烘箱气体泄漏与电子检漏仪内部连接,紧固在必要。
- 加载利用软件控制气相色谱仪的预编程的方法文件;该仪器已准备好进行分析。

图2.气相色谱仪烤箱。Configurati在GC柱箱柱安排。 FID:火焰离子化检测器,SCD:硫化学发光检测器请点击此处查看该图的放大版本。
- 确定正确的院长开关时序
- 作为院长开关是通过在气相色谱仪的阀控制;定位在所述方法参数的阀定时点部分。在软件,把开关设置为"ON",并为控制院长开关阀时间的事件,与阀门在0.5分钟开启"关闭"开头,而变成"开"阀门再次在第二个事件3.0分钟。在本说明书中的"关"的位置对应于其中柱流出物将被运送到该SCD的方向。
- 把这个包含校准气体的气体袋(已知的H 2 S在氦量)在通风柜,并放置一个橡胶奶嘴或同等穿透盖在气囊的喷嘴。打开上气袋的喷嘴。
- 用250微升的气密玻璃注射器,穿刺橡皮奶嘴上的袋的顶部和撤回250微升校准气体。盖上注射器具有入口隔垫,并运送到注射器的气相色谱仪。
- 除去从注射器的隔膜帽;手动和迅速地校准气体注入气相色谱仪,同时启动软件采集。为H 2 S会出现在SCD信号迹线的峰值;记录该峰的保留时间。 。
- 开始降低心脏切割窗口的时间,一面在时间 (即,0.1分钟用于顺序注射减小阀"上"事件);以这种方式继续,直到硫化氢峰从色谱中消失。添加0.2分钟至这个时间,并注意其作为心脏切窗口的上限。
- PERFORM对时间窗的下端相同的过程,逐渐增加所述阀的时间"关"的事件为连续喷射直到峰不再可见。减去0.2分钟从这个时候并注意其作为心脏切窗口的下限。
- 保存阀"开"/"关"命令输入到方法文件。
3.仪器校准
- 液体
- 确保液体自动进样器被安装在气相色谱仪的分流/不分流进样口。将四个先前准备的校准小瓶在自动进样器托盘样品瓶位置1-4。
- 使用玻璃吸管,填充用HPLC级甲苯的小瓶,并将其放置在用于在自动进样盘的清洗溶剂小瓶位置。确保废液瓶或水库自动进样器托盘是空的。
- 加载有配置成用于连接到气体色谱软件液相分析的方法图形;确保这两个检测器被开启,并且在气体色谱仪处于准备状态。
- 使用气相色谱仪软件每小瓶根据该方法来执行一个注射,并使用提供的气相色谱仪中的软件每个色谱整合在CS 2峰。
- 使用电子表格程序,通过将CS 2峰的面积计算由校准溶液(100 ppm的)的浓度,然后将此除以2,得到每硫的一个原子响应计算该SCD的平均响应因子。
- 气体
- 确保液体自动进样器塔已经从气相色谱仪除去,并装入用于气体分析的适当方法。确保这两个检测器被打开,并且该气相色谱仪处于准备状态。
- 注入标定气体如步骤2.3.2说明2.3.4。
- 重复手动注入标定气体最小的3倍。
- 使用气相色谱仪的数据分析软件来整合硫化氢的峰在注射三次,并使用电子表格程序,通过用H的浓度除以的硫化氢的峰的平均面积计算为h的平均响应因子2 S的2 S在气囊。
4.样品分析
- 液体
- 通过将少量(<1毫升)中,用玻璃移液器评估原油用于注射。如果粗传送与留在玻璃吸管无显著残余物中,将粗可以注射整齐。如果粗树叶在玻璃吸管一个显著量,稀释如在4.1.2中描述。对于可以注射整齐原油,调〜1毫升原油到气相色谱仪自动进样器小瓶中,并盖上小瓶。
- 稀释高粘度的原油通过转移0.75 ml的粗的用自动移液器自动进样器小瓶中,一个次加入的HPLC级甲苯等体积。盖上盖子并翻转瓶振荡充分混合的解决方案。
- 将填充的小瓶在自动进样器托盘,并加载在气体色谱仪软件的液体的分析方法。
- 使用气相色谱仪的软件和以前配置方法(表1),使用自动采样器,以执行每个样品瓶三个重复注射。
- 气体
- 顶空
- 填写500毫升的琥珀色玻璃瓶进行分析450毫升的原油。附加一个隔膜平顶帽到瓶子的顶部。在执行排气通风柜任何原油转移步骤。
- 放置瓶(多个)在温度控制的环境中,以进行分析(即,水浴30℃)。注意:原油样品可能会变得易失在升高的温度和护理应根据所用的样品来行使。
- 使用1ml玻璃气密注射器,穿刺隔膜顶部并离开注射器在瓶子的顶部,以提供一个渠道压力释放,如果在顶部空间的气体应该建立。
- 离开24小时,在温度控制的环境的瓶子上,轻轻提起和晃动一次一个小时瓶平衡为H液体和顶部空间之间2 S。
- 分析顶空气体,穿破隔膜顶部和撤销微升气体进入气密性玻璃注射器。
- 盖上注射器端用一块入口隔垫的和运输注射器向气相色谱仪。手动和迅速的气体喷入进气,同时开始以开始收集数据的软件。
- 重复此过程,以获得最低的气体三次重复注射。如果H 2 S的峰过于集中,而不是在检测器的规模( 见图 3),与气体的较小的注射器,使上规模的峰值执行的程序; 岛即,100微升或25微升。
- 气袋
- 放置在气袋待分析的喷嘴的橡胶奶嘴或等效穿透罩,并将气囊在排气通风柜。
- 确保正确的方法用于气体分析的气相色谱仪软件被加载,并且该气相色谱仪处于准备状态。
- 打开上气袋的喷嘴,和穿刺乳头的顶端与250μl的气密注射器。填充注射器用250μl气体,撤回注射器,并关闭喷嘴上的气袋。
- 盖上注射器端用一块入口隔垫的和输送到注射器的气相色谱仪,并手动将气体喷入所述入口,同时开始以开始数据收集的软件。
- 重复此过程,以获得最低的气体三次重复注射。如果H 2 S的峰过于集中,并且没有被检测器的规模(See值图3),与气体的较小的注射器执行该程序以使峰上规模; 即,将100μl或25μl的。
- 顶空
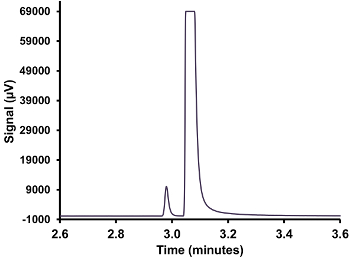
图3.气相色谱与重载H 2 s的峰值。气体注入,在30℃下保持液态原油样品,充分展示了SCD的超载的顶部空间。 请点击此处查看该图的放大版本。
5.数据分析
- 液体
- 确定硫化氢峰保留时间(只需要重复,如果仪器配置的变化)
- 用玻璃吸管,以填补GC自动进样器小瓶液体粗品,确实没有牛逼需要稀释并盖上小瓶。
- 加载适当的方法对气相色谱软件液体分析,并确保安装了液体自动进样器塔。
- 放置在自动进样器托盘中的液体粗样品,并执行一次注射的原油。
- 填充玻璃气密注射器750微升的 H 2 S-含氧气体(2.5%在氦)。除去从自动进样盘的小瓶中,并刺穿在与充满气体的注射器小瓶的帽隔片,并放置在管形瓶中的样品的表面下的注射器的端部。通过粗制样品压下柱塞上的注射器以气泡的气体。
- 将小瓶放回自动进样器托盘和使用该软件直接自动进样器进行单注加标样品。
- 利用伴随气相色谱仪的软件,前和H 2 S的穗后比较的色谱图。一个大的峰值应预先发送,这是不存在于所述第一色谱图中的第二色谱图记录该峰的保留时间(参见图4)。
- 分析
- 使用数据分析软件附带的气相色谱仪来整合峰面积的 H 2 S(识别使用在步骤5.1.1.6指出的保持时间)中的每个色谱图( 图5),并计算平均峰面积用于与每个样本电子表格程序。
- 使用在3.1节中确定的响应因子,由响应因子除以所述平均峰面积为样品,得到的H存在以ppm 2 S的量。用于稀释该样品,通过正确的稀释因子乘以浓度,得到的 H 2 S的未稀释的样品中的量(图6)。
- 确定硫化氢峰保留时间(只需要重复,如果仪器配置的变化)
上传/ 53416 / 53416fig4.jpg"/>
图4.原油样品掺入H 2 S.两个叠加色谱图说明扣球与H 2粗样品S.当预期的变化,请点击此处查看该图的放大版本。
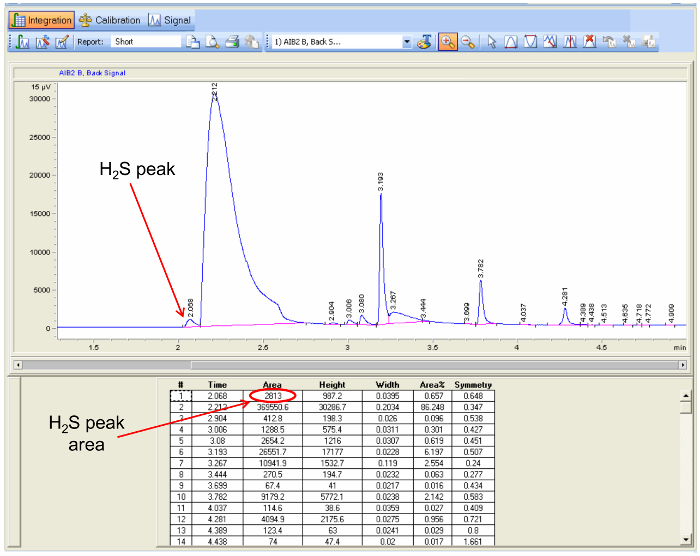
使用图5气相色谱数据分析,数据分析程序突出一个样品和峰面积在H 2 S峰值的位置的屏幕截图,以确定H 2的浓度S. 请点击此处查看大图版本这个数字。请点击他再查看该图的放大版本。
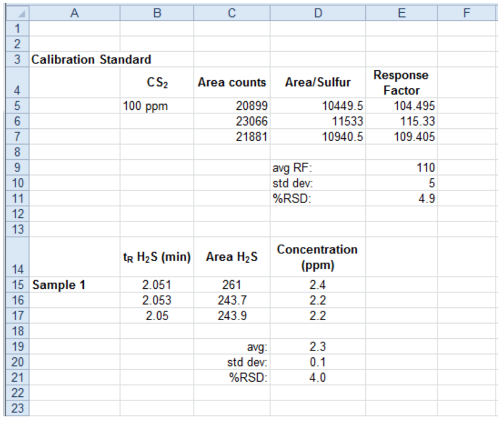
图6.示例电子表格进行数据分析。电子表格程序显示了如何计算使用校正标准峰的面积和样品的峰面积H 2 S的浓度的例子的截图。 请点击此处查看更大的版本这个数字。
- 气体
- 通过匹配用在3.2节以校准硫化氢峰的保留时间确定每个色谱的硫化氢的峰。
- 使用数据分析软件附带的气相色谱仪,以整合的峰面积为在所收集的数据为H 2 S的峰,并计算平均峰面积为每个样品。
- 使用响应因子determin编在第3.2节,除以平均峰面积为样品由响应因子,得到H存在以ppm 2 S的量。对于所使用的更小的注射器容量,通过正确的稀释因子乘以浓度,得到的 H 2 S的将存在于250微升注射器的量的样品(即,(250微升/ 25微升为一25微升注射器)。
Access restricted. Please log in or start a trial to view this content.
结果
为了得到硫化氢的液体和气体样品可靠的量化,适当的校准是必要的。用于校准注射和样品注射时,H 2 S的峰不应当重叠与相邻峰和应该具有可再现的峰面积。 图3示出了注入一个气体样品,其中气体过于集中于该方法的。已经发现,大于500ppm的使用250微升注射器气体浓度过载探测器。这个问题是没有遇到过的液体样品,如气相浓度的硫化氢普遍要比液体较高?...
Access restricted. Please log in or start a trial to view this content.
讨论
为了达到硫化氢的最佳的测量,该方法使用的Deans开关,反冲和硫化学发光检测器(SCD)。甲二甲基聚硅氧烷列用作第一维GC柱,并用于延缓样品中存在的较重烃的流动,使它们不会污染PLOT柱。这种效果是通过一个凉(50℃)初步分离增强。光气体通过第一维列和由心脏切进一步分离期间PLOT柱捕获。在SCD只响应含硫化合物,加入选择性的附加 层,和防止干扰通过任何烃或其他的?...
Access restricted. Please log in or start a trial to view this content.
披露声明
The authors have nothing to disclose.
致谢
The authors would like to acknowledge support from the Government of Canada's interdepartmental Program of Energy Research and Development, PERD 113, Petroleum Conversion for Cleaner Air. N.E.H would like to acknowledge her Natural Sciences and Engineering Research Council of Canada Visiting Fellowship.
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Deans switch | Agilent | G2855A | Or equivalent flow switching device |
| Restrictor tubing | Agilent | 160-2615-10 | Fused silica, deactivated, 180 µm |
| HP-PONA column | Agilent | 19091S-001 | |
| GasPro column | Agilent | 113-4332 | |
| Sulfur chemiluminescence detector, 355 | Agilent/Sievers | G6603A | |
| H2S calibration standard, in He | Air Liquide | Custom order | 211 ppm H2S |
| CS2 | Fisher Scientific | C184-500 | |
| Toluene, HPLC grade | Fisher Scientific | T290-4 | |
| Gas bag, 2 L | Calibrated Instruments, Inc. | GSB-P/2 | Twist on/off nozzle |
| 250 µl gas tight syringe | Hamilton | 81130 | |
| 500 ml amber glass bottle | Scientific Specialties | N73616 | |
| Open top screw caps | Scientific Specialties | 169628 | |
| Tegrabond disc for screw caps | Chromatographic Specialties | C889125C | 25 mm, 10/90 MIL |
| 1 ml gas tight syringe | Hamilton | 81330 | |
| 2.5% H2S in He gas standard | Air Liquide | Custom order |
参考文献
- Guidotti, T. L. Hydrogen sulphide. Occ. Med. 46, 367-371 (1996).
- Reiffenstein, R. J., Hulbert, W. C., Roth, S. H. Toxicology of Hydrogen Sulfide. Annu. Rev. Pharmacol. Toxicol. , 109-134 (1992).
- Qi, Y., et al. Effect of Temperature on the Corrosion Behavior of Carbon Steel in Hydrogen Sulphide Environments. Int. J. Electrochem. Sci. 9, 2101-2112 (2014).
- Ma, H., et al. The influence of hydrogen sulfide on corrosion of iron under different conditions. Corros. Sci. 42, 1669-1683 (2000).
- Kallinikos, L. E., Jess, A., Papayannakos, N. G. Kinetic study and H2S effect on refractory DBTs desulfurization in a heavy gasoil. J. Catal. 269, 169-178 (2010).
- Liu, B., et al. Kinetic investigation of the effect of H2S in the hydrodesulfurization of FCC gasoline. Fuel. 123, 43-51 (2014).
- Si, X., Xia, D., Xiang, Y., Zhou, Y. Effect of H2S on the transformation of 1-hexene over NiMoS/γ-Al2O3 with hydrogen. J. Nat. Gas Chem. 19, 185-188 (2010).
- Hydrogen Sulfide and Mercaptan Sulfur in Liquid Hydrocarbons by Potentiometric Titration. , ASTM International. West Conshohocken, PA. UOP 163-10(2010).
- Standard Test Method for Determination of Hydrogen Sulfide in Fuel Oils by Rapid Liquid Phase Extraction. , ASTM International. West Conshohocken, PA. ASTM D7621-10(2010).
- Lywood, W. G., Murray, D. H2S in Crude Measurement Report. , Canadian Crude Quality Technical Association. (2012).
- Standard Test Method for Sulfur Compounds in Light Petroleum Liquids by Gas Chromatography and Sulfur Selective Detection. , ASTM International. West Conshohocken, PA. ASTM D7621-10(2009).
- Liu, W., Morales, M. Detection of Sulfur Compounds According to ASTM D5623 in Gasoline with Agilent's Dual Plasma Sulfur Chemiluminescence Detector (G6603A) and an Agilent 7890A Gas Chromatograph. , Agilent Technologies. (2008).
- Barman, B. N., Cebolla, V. L., Membrado, L. Chromatographic Techniques for Petroleum and Related Products. Crit. Rev. Anal. Chem. 30, 75-120 (2000).
- Rodgers, R. P., McKenna, A. M. Petroleum Analysis. Anal. Chem. 83, 4665-4687 (2011).
- Nizio, K. D., McGinitie, T. M., Harynuk, J. J. Comprehensive multidimensional separations for the analysis of petroleum. J. Chromatogr. A. 1255, 12-23 (2012).
- Luong, J., Gras, R., Shellie, R. A., Cortes, H. J. Tandem sulfur chemiluminescence and flame ionization detection with planar microfluidic devices for the characterization of sulfur compounds in hydrocarbon matrices. J. Chromatogr. A. 1297, 231-235 (2013).
- Di Sanzo, F. P., Bray, W., Chawla, B. Determination of the Sulfur Components of Gasoline Streams by Capillary Column Gas Chromatography with Sulfur Chemiluminescence Detection. J. High Res. Chromatog. 17, 255-258 (1994).
- Deans, D. R. A new technique for heart cutting in gas chromatography. Chromatographia. 1, 18-22 (1968).
- Hinshaw, J. V. Valves for Gas Chromatography, Part III: Fluidic Switching Applications. LC GC N. Am. 29, 988-994 (2011).
- Seeley, J. V., Micyus, N. J., Bandurski, S. V., Seeley, S. K., McCurry, J. D. Microfluidic Deans Switch for Comprehensive Two-Dimensional Gas Chromatography. Anal. Chem. 79, 1840-1847 (2007).
- Tranchida, P. Q., Sciarrone, D., Dugo, P., Mondello, L. Heart-cutting multidimensional gas chromatography: A review of recent evolution, applications, and future prospects. Anal. Chim. Acta. 716, 66-75 (2012).
- Armstrong, D. W., Reid, G. L. III, Luong, J. Gas Separations: A Comparison of GasPro™ and Aluminum Oxide PLOT Columns for the Separation of Highly Volatile Compounds. Curr. Sep. 15, 5-11 (1996).
- Ellis, J., Vickers, A. K., George, C. Capillary Column Selectivity and Inertness for Sulfur Gas Analysis in Light Hydrocarbon Streams by Gas Chromatography. Fuel Chemistry Division Preprints. 47, 703-704 (2002).
- Ji, Z., Majors, R. E., Guthrie, E. J. Porous layer open-tubular capillary columns: preparations, applications and future directions. J. Chromatogr. A. 842, 115-142 (1999).
- Luong, J., Gras, R., Shellie, R. A., Cortes, H. J. Applications of planar microfluidic devices and gas chromatography for complex problem solving. J. Sep. Sci. 36, 182-191 (2013).
- Hildmann, F., Kempe, G., Speer, K. Application of the precolumn back-flush technology in pesticide residue analysis: A practical view. J. Sep. Sci. 36, 2128-2135 (2013).
- Gray, B. P., Teale, P. The use of a simple backflush technology to improve sample throughput and system robustness in routine gas chromatography tandem mass spectrometry analysis of doping control samples. J. Chromatogr. A. 1217, 4749-4752 (2010).
- Hayward, T., Gras, R., Luong, J. Characterization of selected oxidation inhibitors in transformer oils by multidimensional gas chromatography with capillary flow technology. Anal. Methods. 6, 8136-8140 (2014).
- Hutte, R. S., Johansen, N. G., Legier, M. F. Column Selection and Optimization for Sulfur Compound Analyses by Gas Chromatography. J. High Res. Chromatog. 13, 421-426 (1990).
- Yan, X. Unique selective detectors for gas chromatography: Nitrogen and sulfur chemiluminescence detectors. J. Sep. Sci. 29, 1931-1945 (2006).
- Araujo, P. Key aspects of analytical method validation and linearity evaluation. J. Chromatogr. B. 877, 2224-2234 (2009).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。