Method Article
建立基因组编辑的人多能干细胞系:从定位到隔离
摘要
Genome editing of human pluripotent stem cells (hPSCs) can be done quickly and efficiently. Presented here is a robust experimental procedure to genetically engineer hPSCs as exemplified by editing the AAVS1 safe harbor locus to express EGFP and introduce antibiotic resistance.
摘要
基因组编辑的人类多能干细胞(hPSCs)提供了一个遗传控制和临床相关平台,从中了解人的发展和研究疾病的病理生理学。通过采用特定地点核酸酶(核潜艇)的基因组编辑,新HPSC线窝藏的特定基因变异在其它的等基因设置快速推导成为可能。锌指核酸酶(ZFN),转录活化剂 - 样效应核酸酶(TALENS)和群集定期相互间隔短回文重复序列(CRISPR)/ Cas9是最常用的SSN。所有这些核酸酶的功能通过引入双链DNA断裂在指定站点,从而促进精确的基因编辑的基因组位点。 SSN预谋的基因组编辑利用两个单元的内源DNA修复机制,非同源末端连接(NHEJ)和同源性定向修复的(HDR),要么引入插入/缺失突变或中高音器使用的是同源的修复模板在双链断裂的位点的基因组中。 hPSCs的电穿孔转染是结合了转基因例如荧光记者和抗生素抗性盒的SSN和修复模板的有效手段。电穿孔后,有可能分离那些只hPSCs,通过选择抗生素抗性掺入的修复构建。机械分离HPSC菌落,并在通过基因分型靶部位,确认正确的集成允许对正确的针对性和遗传同质细胞系的分离。该协议的有效性,这里演示用三个SSN平台将EGFP和嘌呤霉素抗性建设成为在人类多能干细胞AAVS1安全港轨迹。
引言
基因组编辑技术正在迅速演变成的分子和细胞生物学1标准的工具。人多能干细胞(hPSCs)的基因工程是特别令人感兴趣的为hPSCs代表基因完整原代人细胞的自我更新的源。 hPSCs可以分化成用于疾病建模或作为用于移植疗法2,3-一个源的各种细胞类型。这里展示是一种协议,利用三种不同类型的位点特异性核酸酶(的SSN),其与用于报道构建的在AAVS1轨迹靶向整合内源DNA修复机制结合使用。转核潜艇进入hPSCs后,我们将演示如何隔离等基因细胞群窝藏记者。
操纵基因组,特别是多能干细胞的基因组的能力,使用的SSN是不是一个新的现象如锌指核酸酶(ZFN)和转录ACTIVAT的效用或样效应核酸酶(TALENS)基因编辑被证明几年前4-10。然而,随着化脓性链球菌CRISPR问世/ Cas9技术11-13,基因编辑已成为普及14。所有的SSN在指定的目标部位1,4,5,11是受内源性细胞机制使用任何非同源末端连接(NHEJ)或同源性定向修复(HDR)15修复引入的双链DNA断裂(DSB)。 NHEJ是容易出错的,并且可以引入导致基因功能的丧失移码突变,而HDR允许新颖元件通过共转染与SSN修复模板引入。而DNA修复促进基因编辑的基本原理被认为是大致相同的每个的SSN,所述平台之间的一些差异可以注意到。 德的ZFN的从头设计允许灵活性和核酸优化16,但是使用的公开可装配库和筛选工具来设计单独的ZFN可能会非常耗时。一旦对ZFN介导的靶向所需的轨迹被确定,ZFN对可设计与在线工具ZiFit 17。设计之后,的ZFN可以模块化方式通过几轮质粒克隆18的组装。可替代地,还有许多市售的预先验证的ZFN 19。 TALE核酸酶也可以使用在线工具和公共可用的部件17,20设计。例如,TALENS可以迅速从五个TALE重复块组装,通过Flash 组件 21或使用基于PCR的层次金门组件 22。易于SSN的设计和使用CRISPR / Cas9建设速度取得了基因组编辑普及的工具。 CRISPR的短导的RNA介导的靶向/ Cas9还允许导的RNA复用为目标的几个位点有一个单一的结构14。该设计Cas9用于基因编辑需要一个protospacer相邻基序(PAM;一个NGG三核苷酸为S. pyrogenes Cas9)的唯一的识别接近目标轨迹。通过插入对应于PAM的进px330质粒14的 20个碱基对的5'寡核苷酸,构建体可以组装在一个克隆步骤。除了S.化脓 Cas9,Cas9从N.脑膜炎 (NmCas9)识别一个5'-NNNNGATT-3'(PAM)已经显示出,以允许有效的基因编辑处于hPSCs 23。
除了在容易SSN设计上的差异,每个平台具有特定的性质。例如,的ZFN和TALENS利用FokI核酸酶结构域,其生成一个4核苷酸的5'突出端24而Cas9被认为产生大多钝端DNA双链断裂。的ZFN,TALENS和Cas9会有不同的蛋白稳定性,对降率上的靶DNA和DNA的扫描模式,所有这些的c乌尔德理论上导致编辑结果1小的差异。而进一步的研究将要求充分理解这些差异的后果,我们在这里描述的协议是在所有三个平台非常健壮并且可以用来容易地产生遗传修饰hPSCs。
不管SSN选择,电是一个强大的程序,转染核潜艇和同源性修复模板到hPSCs 25。选择对抗生素耐药性后存活的集落数依赖于轨迹的具体参数和编辑策略(例如,尺寸转基因插入和选择的模式的)。这里描述的方案通常导致在大约150-400单细胞的集落。
基因编辑在使用这种协议的AAVS1轨迹先前已用于证明的SSN 4,5的有效性。将AAV-CAGGS-EGFP修复模板使用的基因陷阱海峡ategy赋予嘌呤霉素抗性基因座的具体方式。简要地说,修复模板包含剪接受体位点的启动子的嘌呤霉素抗性盒的上游。一旦正确整合入PPP1R12C基因在AAVS1轨迹的第一内含子,抗性盒从编辑基因的启动子表达。这个特定AAVS1测定的鲁棒性使我们能够比较各SSN平台的效率。
使用核潜艇基因编辑功能强大给破坏和/或改变理论上任何基因的能力。施加这种策略hPSCs提供通用性hPSCs随后可以分化成多种人类细胞类型如神经元26的 ,肝细胞27和心肌细胞28。另外,使用源自患者的诱导多能干细胞的允许修理或引入已知的致病突变的患者中的特定的遗传背景29 ,提供从该调查疾病机制和使用患者自身的细胞30试验治疗剂的平台。总之,基因编辑工作hPSCs是一种高效,灵活的调查人的发展和疾病31的基本生物学方法。
研究方案
在这个手稿中描述的步骤进行了审查并批准了加州大学伯克利分校干细胞研究监督委员会。
1.准备干细胞进行编辑
- 生长并在6孔板含有丝裂霉素C灭活的小鼠胚胎成纤维细胞2.4×10 6个细胞/板培养人多能干细胞(hPSCs)(MEF)饲养上生长明胶32。保持在3ml每孔(胚胎干细胞媒体)的人类胚胎干细胞培养基的hPSCs并生长在37 ℃培养箱用3% 的 O 2/5%CO 2。
注:在本协议的成功,就没有必要维持在低氧孵化器hPSCs;然而值得注意的是,hPSCs增殖在高O 2的环境更快,所以倍和细胞数目应当相应调整是非常重要的。还应当指出的是,保持在低氧气hPSCs有自发分化33的比率较低。- ŤØ使500毫升胚胎干细胞媒体结合380毫升DMEM / F12,75毫升胎牛血清(FBS),将25ml淘汰赛血清替代品(KSR)。添加谷氨酰胺(终浓度为1mM),将5ml 100×非必需氨基酸,100单位/ ml青霉素 - 链霉素(P / S),碱性成纤维细胞生长因子(bFGF)的(4纳克/毫升最终浓度),和2-巯基乙醇(5.5μM终浓度)。
- 通过去除培养基(3ml)中的整个体积用玻璃吸管和真空改变介质。更换使用血清吸管3毫升温暖的胚胎干细胞媒体。重复的媒体每天都在变化,直到hPSCs大约50%融合(-1天)。
- 针对(天-1)的前一天,改变胚胎干细胞媒体,删除旧的媒体,并添加补充了10微米的Y-27632温馨胚胎干细胞媒体。
- 同样在第-1天,准备一到两个6孔或10厘米耐药的MEF饲养细胞从DR4小鼠(2.4×10 6个细胞/板)34的板。
注:在一般情况下,6孔板广告vantageous超过10cm板,因为它们容纳更多的媒体。 6孔板也保证不同井,不同的克隆是独立的。然而,10cm平板将方便采摘,取决于可用于这一过程的显微镜。
2.编辑多能干细胞
- 吹打的CRISPR / Cas9 px330编码的质粒(图1)的ZFN 1和2,TALEN 1和2,或15微克每5微克到1.5ml试管制备的转染溶液。移液器30微克修复质粒这个管为好。最后,吸移管1×磷酸盐缓冲盐水(PBS)中入管使体积达到300微升。
注意:准备质粒作为中提(任何试剂盒适用)为300毫微克/微升的最小浓度,以保持在300微升转染溶液的总体积。这是没有必要进行苯酚/氯仿萃取,来线性化的质粒,或使用endoto新自由质粒制备试剂盒。 - 使用玻璃吸管和真空hPSCs取出介质。吸管2毫升温的1×PBS到每个孔中以洗涤细胞。
- 立即使用玻璃吸管和真空除去PBS中。直接添加0.5 ml的0.25%胰蛋白酶-EDTA溶液到细胞每孔中。放置在培养箱中(37℃/ 5%CO 2/3%O 2),约10分钟。或直至饲养层开始抬离板。
- 加入2毫升温暖esWash媒体(470毫升DMEM / F12,将25ml的FBS,100单位/ ml P / S),以每孔以停止胰蛋白酶反应。
- 确保饲养层细胞脱落如纸。吸取每个内容井成一个单一的50ml锥形管中,所有的孔相结合。使用10毫升血清吸管磨碎的细胞。这是没有必要拆散饲养层; hPSCs将脱落的饲养层轻轻研磨的。应约15ml的细胞悬浮液。
- 加25 ml的esWash介质在管带来VOLU我至40ml总。允许大型馈线块,收于试管底部1-2分钟。删除从用血清吸管并沉积在管的上清液(〜38毫升)到一个新的50ml锥形管中。
- 降速5分钟,在190×g下。使用玻璃吸管和真空管去除上清。确保不会干扰细胞沉淀。重悬在500μl1×PBS中的细胞。结合先前准备质粒转方案。计数细胞,在此步骤。每使用电5-10万细胞。
- 吸取整个800微升的悬浮液成4毫米电穿孔杯中,放置在冰上3-5分钟。 250伏,500微法,电阻∞,和4mm杯尺寸:使用指数程序电穿孔系统使用下列参数上电穿孔细胞。电穿孔后,将试管回到冰上3分钟。
注意:遵守时间常数电系统上电的。的时间常数随细胞数和DNA的纯度。成功转染通常使用列出的条件和基因脉冲II的时候有一个时间10-14毫秒之间不变。较低的电效率时可出现的时间常数从这些值各不相同。 - 悬浮于18ml温暖的人类胚胎干细胞媒体辅以10微米的Y-27632电穿孔细胞。板3毫升该单细胞悬液到6孔板的DR4饲养细胞的每个孔中的。返回到培养箱中(37℃/ 5%CO 2/3% 的 O 2)。
3.选择阳性克隆的
- 第2天,取出用玻璃吸管和真空所有媒体。更换用3毫升辅以10微米的Y-27632温馨人类胚胎干细胞媒体。第3天,取出用玻璃吸管和真空所有媒体。用3毫升温胚胎干细胞媒体的更换,而不包括Y-27632。第4天,取出用玻璃吸管和真空所有媒体。更换用3毫升辅以抗生素selecti温暖的胚胎干细胞媒体上。返回到培养箱中(37℃/ 5%CO 2/3% 的 O 2)。
注意:包括在修复模板中使用将取决于抗性盒抗生素的类型。当与WIBR#3 hPSCs(NIH注册表0079),0.5微克/毫升嘌呤霉素,70微克/毫升的G418(遗传霉素)和35微克/毫升潮霉素工作已经成功地使用。浓度的选择应通过建立所需内大约一周杀死野生型细胞的抗生素的最低浓度经验确定。 - 5-12天,每天都在变化的媒体,每次补充有抗生素温暖的胚胎干细胞媒体取代传统媒体。
注:期待大量的细胞死亡。单个菌落将成为各地8-10天明显。可经过12-14天的连续选择使用无抗生素常规胚胎干细胞媒体。如果细胞密度是高或细胞死亡是缓慢的,应避免媒体的酸化和可能有必要增加媒体VOLU在选择过程中的最初几天我(可达4-5毫升)中。
4.采摘筛选出的菌落(12-14日)
- 观察12-14天的殖民地。观察到准备挑选一个解剖显微镜,并确保它们不包含已开始分化细胞集落。近似大小应800-1,200微米。如果菌落12天才达到这个规模,建议他们应该选择即可。
注意:对于每个靶向实验中,根据需要挑选尽可能多的菌落,以确保所期望的基因型是分离的。作为一个例子,AAVS1编辑与AAV-CAGGS-EGFP修复模板显示了一贯的稳固集成,并且只需要12-24菌落要被拾取,以获得约5-10 heterozygously靶向克隆。其它靶向实验可能需要更多的菌落要被拾取( 表1)。正确靶向事件的频率取决于多种因素,例如SS的效率N至引入DSB,插入物的大小,和所述选择策略。在基因捕获方法用于AAVS1轨迹这里介绍的情况下,当正确地整合在靶位点,减少以获得正确靶向克隆所需的菌落数的选择标记仅表达。 - 采摘前一天,准备12孔板的MEF的(2.4×10 6个细胞/板,一个孔将用于各菌落挑)。
- 在采摘的当天,取出用玻璃吸管和真空的12孔MEF板所有媒体,并添加1 ml胚胎干细胞媒体。同样在采摘的当天,在6孔板的将要拿起改变胚胎干细胞媒体。
- 拉玻璃移液器从饲养层个别菌落机械解离。降低移液器过的机罩本生灯和软化的扩展点,直到玻璃具有延展性。从火焰迅速取出并拉动吸管除了创造一个角点。打破从弯曲轴点约2厘米,留下一个狭窄的通道。通过暴露于火焰1-2秒抛光通道的末端。
注意:任选挑菌落P20吸管尖,然而,这可能会降低培养的克隆能力,作为沉闷尖端可以去除更大量的细胞从各菌落进入媒体,潜在的污染后续采摘。 - 组装采取P1000的过滤器枪头,以及将吸球的窄端拾取装置。将在广角端的拉玻璃吸管。
- 放置一个6孔板hPSCs的要在解剖显微镜安装在组织培养罩的阶段拾取。压缩分拣设备的灯泡,轻轻地切除,减少个人的殖民地变成10-20同样大小的块,注意不要放块放入媒体。采取切HPSC件菌落放入吸移管的通过释放灯泡。尝试以尽可能少的媒体,同时尽可能转移。
- TRANSF呃单个菌落,以单个孔12孔的MEF平板,再次压缩灯泡直接进入井,释放现在破菌落。标记每个孔,以允许单细胞衍生的克隆唯一标识。重复尽可能多的殖民地,每次更换玻璃吸管。
注:采摘菌落可能需要一些时间来学习。因此建议在一些对照细胞实验者实践试图隔离针对性菌落之前。 - 返回12孔板的培养箱中(37℃/ 3% 的 O 2/5%CO 2),轻轻第一摆动板,以避免在每个中间细胞堆积良好。
- 第二天和随后的每一天,用玻璃吸管和真空去除媒体全卷,并用1.5毫升温胚胎干细胞媒体的替代,直到细胞约50%融合(这通常需要10-12天)。
- 经过10-12天,挑人两个殖民地从每孔转移到新的12孔MEF板重peating步骤4.1-4.8生成副本板。
- 从原始的MEF平板的每个孔中剩余的菌落中提取的DNA(见下文)。
- 使用玻璃吸管和真空所有孔取出介质。吸管1 ml的1×PBS中至每孔来洗涤细胞。用玻璃吸管和真空除去PBS。吸移管250微升细胞溶解缓冲液(终浓度在H 2 O的:10毫摩尔Tris盐酸,5毫摩尔EDTA,0.2%SDS,200 mM氯化钠,0.08毫克/毫升蛋白酶K)到每个孔中。放置在孵化器(37℃/ 3%O 2/5%的CO 2)O / N。
- 第二天,每个吸管内容以及成单独的1.5 ml的管中。吸移管250微升异丙醇到每个管使DNA沉淀。摇管剧烈。白色沉淀物应该是可见的。
- 旋转每个管向下3分钟在13,000rpm下在台式离心机。降速后,滗析成液体废物弃上清。一个小的DNA沉淀应保持粘在底部管中。吸液管将250μl的70%乙醇到每个管以洗涤DNA沉淀。用力振摇。旋转每个管向下3分钟在13,000rpm下在台式离心机。
- 停转后,滗析成液体废物弃上清。一个小的DNA沉淀应该保持粘在管的底部。吸取出上清液的其余部分,所以没有液体留在管中。离开管开放上干燥台式5-10分钟。干燥后,重悬在250微升TE缓冲液中的DNA。放置在37℃下进行6小时,从而允许DNA溶解。
- 使用预优化的PCR或Southern杂交策略基因型每个样品。
注意 :对于使用AAV-CAGGS-EGFP修复模板AAVS1目标,南部印迹策略可以在Hockemeyer发现等人 ,2009年4月全面Southern杂交协议可以在南部发现2006年35对于多重PCR基因分型。同样的实验,引物和条件可以在表2中36中。 - 弃井没有正确的目标,并继续每一天变化对正常细胞有针对性的胚胎干细胞媒体。冻结下来的细胞时,他们大约50%汇合,请参阅下面的冷冻协议。
- 冷冻前一天,改变胚胎干细胞媒体,删除旧的媒体,并添加补充了10微米的Y-27632温馨胚胎干细胞媒体。
- 冻结之日起每12孔板,正在以两个15毫升锥形管冻结下来也准备将0.5ml溶液A和溶液B的每一个。将解决方案上的冰。解决方案A:50%的胚胎干细胞媒体和50%FBS;溶液B:80%FBS和20%二甲基亚砜(DMSO)中。
- 冷冻前解离HPSC菌落成单个细胞。按照步骤2.2-2.8要做到这一点,相应地扩展容量。在0.5ml溶液A的充分悬浮细胞沉淀
- 加0.5 ml溶液B至细胞悬浮液,吸移管上下,使细胞悬浮液均匀。德E中的总体积的细胞悬浮液(〜1ml)和存款到2ml冻存管。螺丝帽上紧。
- 将冻存管在-80°C冰箱O / N。冷冻后的第二天,除去从-80℃冷冻器冷冻细胞并立即放入液氮罐用于长期存储。
结果
在这里,我们展示了三种不同的SSN平台,并创造遗传工程HPSC线兼容的协议。我们使用以前发表的ZFN 4,TALENS 5和CRISPR / Cas9s 37使用引入了EGFP报告和嘌呤霉素抗性盒4修复模板靶向WIBR#3人类胚胎干细胞在AAVS1轨迹。
我们培养我们的hPSCs上的MEF的细胞培养的工作流程,允许未分化的hPSCs的维护和扩展( 图2),这也是符合成本效益和可扩展性。如果细胞生长超过所需的时间有增加的分化的危险,减少了被转染的多能干细胞的数量,从而获得正确靶向HPSC菌落数。
我们electroporated每SSN平台5.0×10 6细胞并接种来自每个靶向细胞到单个6孔板DR4的MEF的。选择后,每个平台导致EGFP阳性集落(图3)和无目标的,纯合的针对性和heterozygously靶克隆(图4A,B; 表3)的组合。根据这里介绍的条件下,我们发现,对AAVS1 TALENS导致最EGFP阳性克隆。用于此实验的修复模板由一个剪接受体位点的EGFP报告和嘌呤霉素抗性盒的上游。使用这种"基因陷阱"的策略(图1),该构建应插入到AAVS1轨迹的第一内含子,使用内源启动子来驱动的嘌呤霉素抗性盒的表达。启动子的缺乏驱动嘌呤霉素抗性基因的表达的修复模板内应防止表达在事件随机整合。
因此,我们希望所有嘌呤霉素耐药株将在AAVS1网站为目标。应当指出的是,克隆的子集进行异常集成在AAVS1轨迹可检测通过使用内部探针Southern杂交,但不被大多数的PCR策略(图1; 图4C)4。这些积分事件最有可能的异源靶向事件导致的供体质粒4多次整合的结果。我们选择24殖民地从每个SSN实验,结果发现,所有的平台上有非常高的定位效率,结果显示,只有很小的差别。如询问通过PCR,CRISPR / Cas9,得到最正确靶克隆而TALEN平台具有最纯合靶克隆(表3)。
/files/ftp_upload/53583/53583fig1highres.jpg"WIDTH ="700"/>
利用AAV-CAGGS-EGFP修复模板。从Hockemeyer 等。修改图1. 原理基因编辑AAVS1轨迹 ,2009年请点击此处查看该图的放大版本。
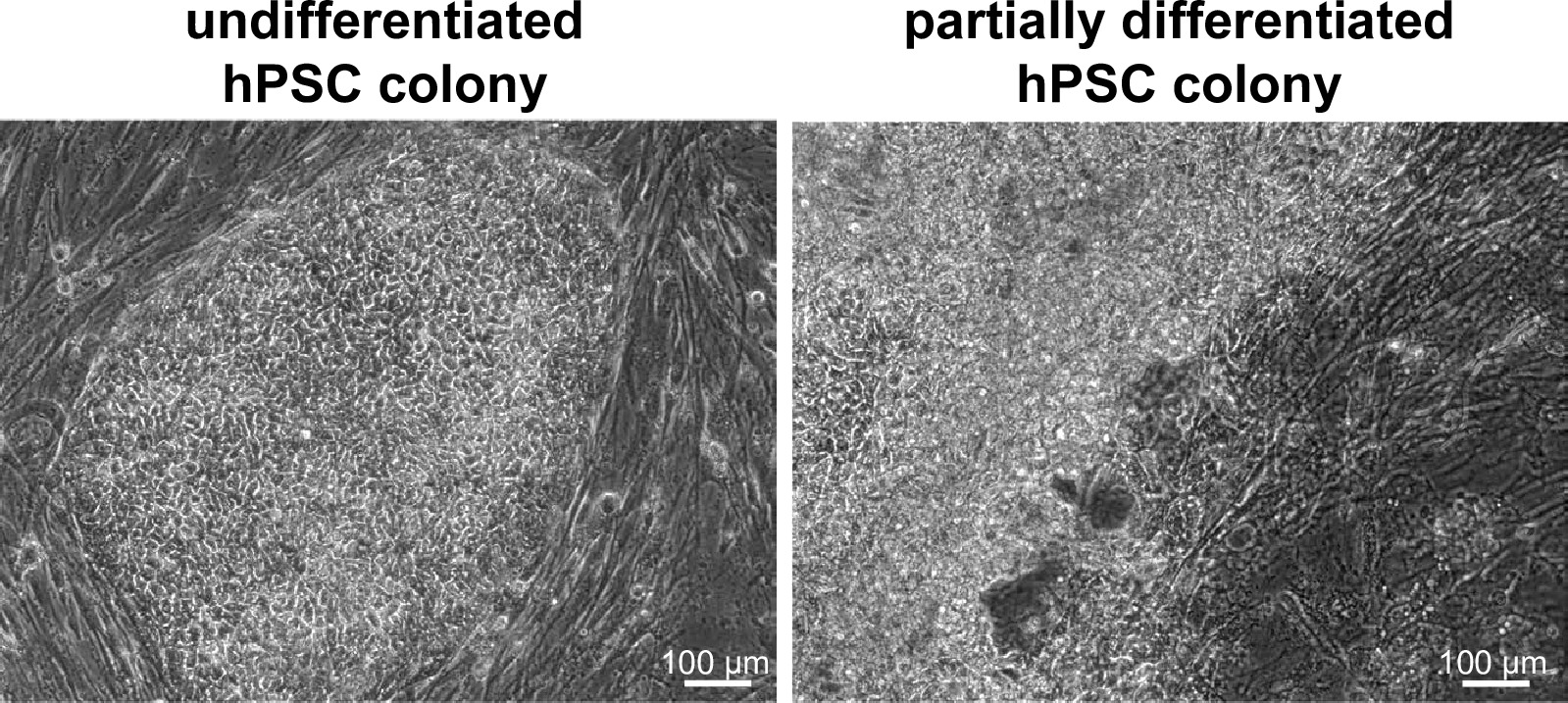
图2.殖民地WIBR#3的细胞。对WIBR#菌落针对前3人类胚胎干细胞,以代表亮场图像。请注意,缺乏差异化和饲养层在一个理想的殖民地(左),而不是一个非理想的(右)的明确分离。 请点击此处查看该图的放大版本。
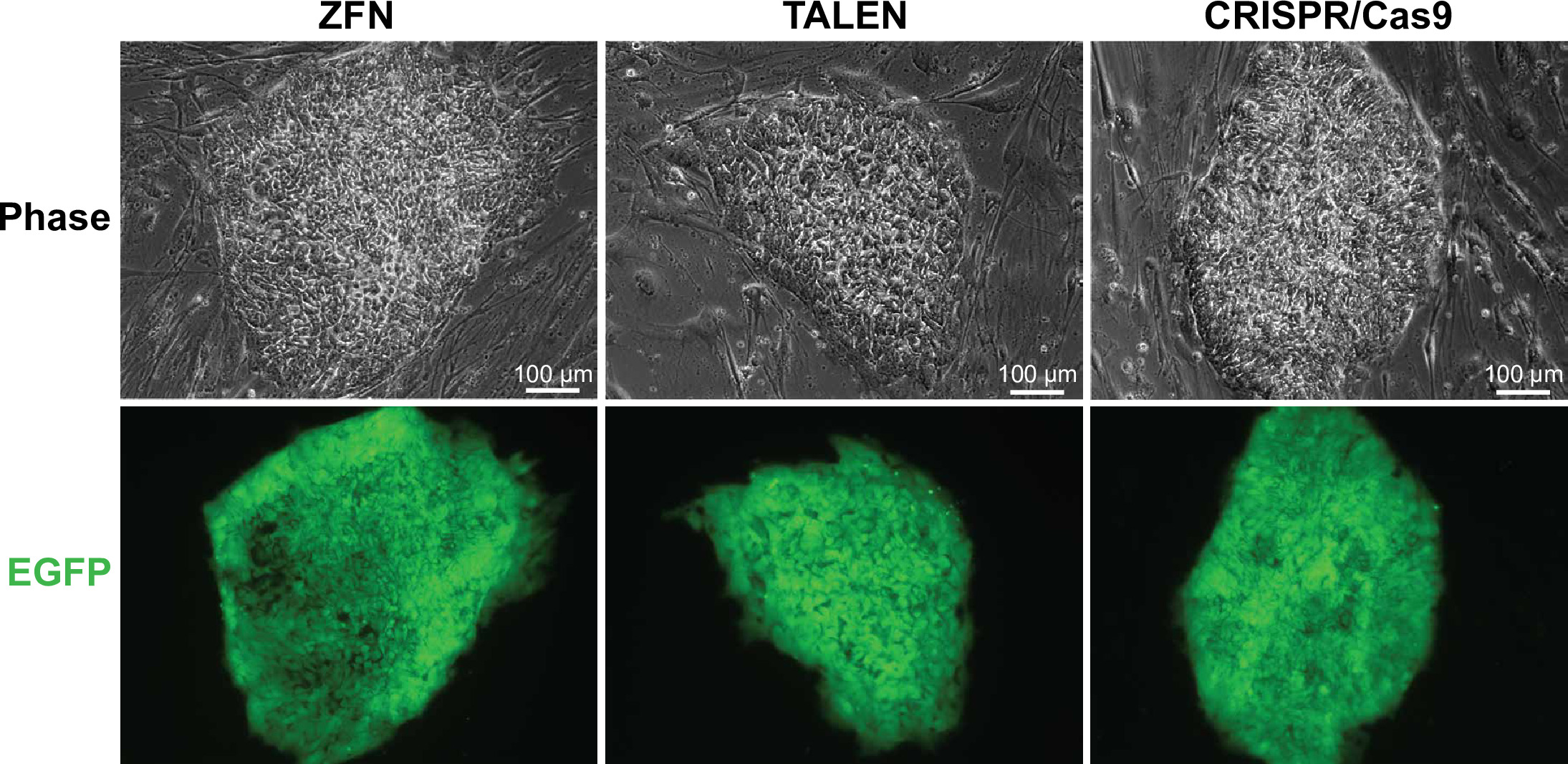
图3.绿色荧光蛋白阳性WIBR#3细胞的WIBR#3单元与目标在AAVS1基因的表达EGFP的修复模板代表性的图像。代表殖民地与编辑图像的ZFN,TALENS和CRISPR / Cas9显示, 请点击这里查看该图的放大版本。
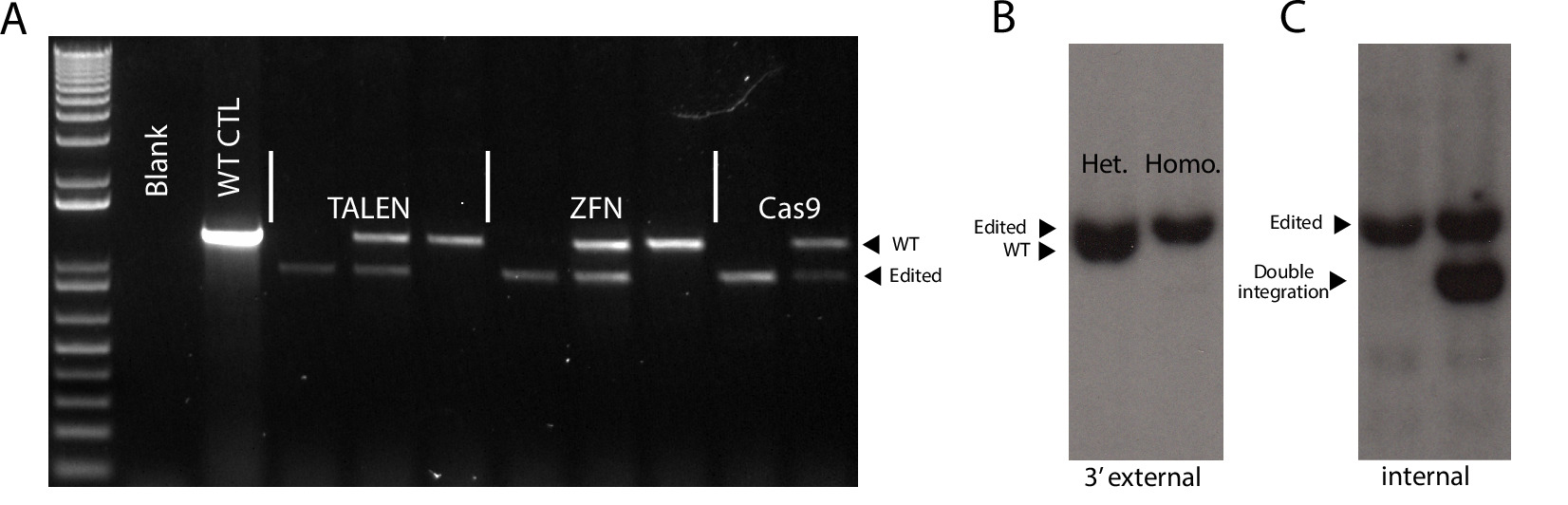
图4.基因分型策略,以确定正确的目标。(A)代表PCR基因分型结果显示在三个SSN平台没有针对性,杂合子有针对性的克隆。 WT CTL =野生型对照。 (二)下列国家代表表性Southern杂交的结果显示杂针对性的克隆和3'外部探头检测到纯合针对性的克隆。片段大小:WT-6.5 KB,编辑-6.9 kb的。 (C)的代表性的Southern印迹的结果示出的合适的编辑克隆和用非随机双积分杂合的克隆。片段大小:正确编辑-6.9 kb的,异常的额外的集成-5 KB 请点击此处查看该图的放大版本。
| 研究 | 基因打靶 | 平台 | 修复模板类型 | #克隆挑 | 靶向性 |
| Sexton等,2014 | TPP1 | ZFN | GFP-普罗 | 未报告 | 未报告 |
| Sexton等,2014 | TERT | ZFN | 潮霉素 | 未报告 | 未报告 |
| Hockemeyer 等人,2009 | POU5F1 | ZFN | GFP-普罗 | 31 | 39.0% |
| Hockemeyer 等人,2009 | PITX3 | ZFN | GFP-普罗 | 74 | 14.9% |
| Hockemeyer 等人,2011 | POU5F1 | TALEN | GFP-普罗 | 68 | 91.0% |
| Hockemeyer 等人,2011 | PITX3 | TALEN | GFP-普罗 | 96 | 13.0% |
| 梅克尔等人 ,2015年 | VASA | Cas9 | 记者-遗传 | 139 | 94.0% |
| 梅克尔等人</ EM>,2015年 | CRH | Cas9 | 记者-遗传 | 三十 | 93.0% |
| 梅克尔等人 ,2015年 | HCRT | Cas9 | 记者-遗传 | 154 | 92.0% |
| 梅克尔等人 ,2015年 | HMX2 | Cas9 | 记者-遗传 | 11 | 45.0% |
| 福斯特等人 ,2014年 | LRG5-NTERM | ZFN | GFP-普罗 | 未报告 | 30.0% |
| 福斯特等人。2014 | LRG5-CTERM | ZFN | GFP-普罗 | 未报告 | 14.0% |
| Soldner 等人,2011 | SNCA | ZFN | 普罗 | 96 | 1.0% |
表1描述的其它基因的靶向使用该方法,与CORRE应的目标从先前公布的研究采取了效率。4,5,38-41
| 轨迹 | 序列 | 笔记 |
| AAVS1-F引物 | CTCTAACGCTGCCGTCTCTC | PCR条件:Tm值= 57°C,35个循环 |
| AAVS1-WT-R引物 | GCTTCTCCTCTTGGGAAGTG | WT乐队:1273基点 |
| AAVS1靶向-R引物 | CGTCACCGCATGTTAGAAGA | 有针对性的频段:992基点 |
| T2-Cas9导 | GGGCCACTAGGGACAGGAT | 来自马里等人 ,2013 |
| AAVS1-ZFN右 | TAGGGACAGGAT | 从Hockemeyer 等人,2009年 |
| AAVS1-ZFN左 | TGGGGTGTCACC | 从Hockemeyer 等人,2009年 |
| AAVS1-TALEN右 | TCCTAACCACTGTCTTT | 从Hockemeyer 等人,2011 |
| AAVS1-TALEN左 | CCCCTCCACCCCACAGT | 从Hockemeyer 等人,2011 |
表2列出的引物和SSN靶向序列。
| 靶向构建 | 的EGFP +菌落总数 | 有针对性的挑克隆(PCR验证) | 以前报告的正确靶向性(Southern杂交) |
| ZFN | 150 | 86.9%(73.9%HET / 13.0%同源) | 56%(50%HET / 6%同源) |
| TALEN | 412 | 91.3%(47.8%HET / 39.1%同源) | 47%(37.5%HET / 9.3%同源) |
| CRISPR-Cas9 | 235 | 95.7%(69.5%HET / 26.3%同源) | 未报告 |
的绿色荧光蛋白阳性表3。对数字和有针对性的TALEN,ZFN和CRISPR / Cas9人类干细胞克隆。PCR验证集成在AAVS1轨迹这个实验进行比较,以Southern印迹在以前的实验4,5验证正确的单一集成。
讨论
这里介绍的用于分离基因编辑人多能干细胞的同质群体的方法,是一种有效的方法,用于产生仅相差在目标轨迹的等基因HPSC线。这些细胞,用于探测人的细胞分化和发育的机制,以及用于理解单基因疾病的病理生理学中的受控遗传设置一个理想的系统。如这里证明,可以使用三个独立的SSN设计策略酶(ZFN,TALENS,和CRISPR / Cas9)实现靶向整合在AAVS1轨迹。每个这些方法都有其自身的优点和缺点。的ZFN的潜在的优点,并在一定程度上,TALENS是其设计的灵活性,这允许迭代工程为了提高DNA结合个别核酸42的域。这种核酸酶的优化可以提高的ZFN和TALENS的特殊性超出了可以实现的CRISPR / Cas9系统。这种选择性可以是对于需要靶特异性的高度临床应用很重要。该CRISPR / Cas9系统的主要优点是它的易用性。虽然TALEN和ZFN建设试剂盒已提供给公众( 即通过 Addgene 21),CRISPR / Cas9型核潜艇是显著更容易构建,因为只需要定制是20个碱基对的寡核苷酸(使用px330质粒时,设计14)。这种简单证明是有利的研究实验室希望包括基因组编辑在学业。
还有另一种转染技术,包括核转43,创造基因编辑HPSC线;然而电穿孔已经被证明是一致的和具有成本效益4,5,25。核转染可用于直接转染Cas9导的RNA核糖络合物进入细胞核,增加SSN效率的ð保真度44。在MEF中成长hPSCs是一个强大的和便宜的方法,以保持多能状态hPSCs没有过多的分化。此外,其允许基因相同的菌落的易于分离。或者,也可以培养hPSCs而不的MEF,但是这些培养条件可以比馈线基于培养物更昂贵。此外,整个过程是可伸缩的,从而允许非常罕见编辑事件的隔离或并联编辑实验的许多不同的细胞系的产生。
这里描述的协议是健壮;然而有一些影响正确编辑的克隆可以得到与该效率几个关键步骤。此方法的最关键的部件是具有高品质的MEF和耐药DR4的MEF。单hPSCs的生存是脆弱的,而低质量的MEF将阻碍未分化HPSC线隔离。二,使用Y-27632的也是键,以允许单个细胞的存活,而不会产生对于细胞的选择性压力具有异常核型45。三,挑选良好的间距殖民地确保衍生的细胞系的遗传同质性。最后,以制备玻璃吸管,使得开口足够小以打破菌落成许多更小的碎片,从而确保多个菌落将在新井成长是很重要的。这允许且分布合理的亚克隆采摘的副本板具有的文化,留下分离出的菌落进行基因分型的原板。在本协议中的一个具有挑战性的部分是手工拉玻璃吸管的;这应该预先实施。应当指出的是,有克隆采摘多种技术,不需要玻璃吸管。实验者被鼓励找到一个最适合他们。
有一些限制这一协议,可以通过简单的修改,加以克服。实验目的邻唯一一句扰乱感兴趣的轨迹而不修复或一个其修复模板不包含一个选择盒,必须使用富集被编辑的细胞的另一方法。注意,必须拾起找到一个阳性克隆菌落数大大增加,在没有选择的情况。一个策略,以提高效率是共同转染一个非整合型质粒表达的荧光蛋白。使细胞恢复两天后,靶细胞可以在正荧光用荧光激活细胞分选来分类并再接种29。此过程富集对已转染了质粒通过电穿孔的细胞,从而增加在细胞中并发的编辑事件的概率。
此处所描述的技术可以被扩展到使用多个导的RNA,以同时靶向多个基因座14,46,47。许多协议已经建立区分hPSCs成不同的细胞类型,允许各种遗传操作在感兴趣30细胞类型。总体而言,我们已经证明,无论SSN的首选高效的基因组编辑在hPSCs的潜力。我们建议,该技术可以适用于创建已基因编辑的任意基因组基因座等基因HPSC线。
披露声明
作者宣称没有竞争的经济利益。
致谢
这项工作是由人脑研究基金会种子格兰特(BRFSG-2014-02),以海伦Bateup支持。德克Hockemeyer是一个新的学者在埃里森医学基金会的老化过程,是支持的格伦基金会还有的Shurl和凯库尔奇基金会。卫生署也由美国国立卫生研究院资助1R01CA196884-01支持。
材料
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Life Technologies | 11320082 | |
| Fetal Bovine Serum (HI) | Life Technologies | 10082-147 | |
| Knockout Serum | Life Technologies | 10828-028 | |
| Fibroblast Growth Factor - basic | Life Technologies | PHG0261 | |
| Pen/Strep | Life Technologies | 15140-122 | |
| Glutamine | Life Technologies | 25030-081 | |
| MEM NEAA | Life Technologies | 11140-050 | |
| 2-mercaptoethanol | Life Technologies | 21985-023 | |
| Y-27632 | Calbiochem | 688000 | |
| 6-well plates | Corning | 3506 | |
| 12-well plates | Corning | 3512 | |
| 4 mm Electroporation cuvettes | Bio-rad | 165-2081 | |
| X-cel gene pulser II | Bio-rad | 165-2661 | |
| 0.25% Trypsin-EDTA | Life Technologies | 25200-056 | |
| 10× Phosphate buffered saline (PBS) pH7.4 | Life Technologies | 70011-044 | |
| Puromycin | Life Technologies | A11138-02 | |
| Pasteur pipettes, plugged | VWR | 14672-412 | |
| Tris-HCl | Sigma-Aldrich | S5941 | |
| NaCl | Sigma-Aldrich | S9888 | |
| SDS | Sigma-Aldrich | L3771 | |
| EDTA | Sigma-Aldrich | E5134 | |
| Proteinase-K | Life Technologies | AM2544 | |
| Ethanol | VWR | TX89125-172SFU | |
| Isopropyl Alcohol | VWR | MK303216 | |
| TE Buffer | Life Technologies | 12090-015 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| 1.8 ml Cryotubes | ThermoScientific | 377267 |
参考文献
- Carroll, D. Genome engineering with targetable nucleases. Annu Rev Biochem. 83, 409-439 (2014).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125(2014).
- Matsa, E., Burridge, P. W., Wu, J. C. Human stem cells for modeling heart disease and for drug discovery. Sci Transl Med. 6 (239), 239ps6(2014).
- Hockemeyer, D., et al. Efficient targeting of expressed and silent genes in human ESCs and iPSCs using zinc-finger nucleases. Nat Biotechnol. 27 (9), 851-857 (2009).
- Hockemeyer, D., et al. Genetic engineering of human pluripotent cells using TALE nucleases. Nat Biotechnol. 29 (8), 731-734 (2011).
- Bozas, A., Beumer, K. J., Trautman, J. K., Carroll, D. Genetic analysis of zinc-finger nuclease-induced gene targeting in drosophila. Genetics. 182 (3), 641-651 (2009).
- Bibikova, M., Golic, M., Golic, K. G., Carroll, D. Targeted chromosomal cleavage and mutagenesis in drosophila using zinc-finger nucleases. Genetics. 161 (3), 1169-1175 (2002).
- Miller, J. C., et al. A TALE nuclease architecture for efficient genome editing. Nat Biotechnol. 29 (2), 143-148 (2011).
- DeKelver, R. C., et al. Functional genomics, proteomics, and regulatory DNA analysis in isogenic settings using zinc finger nuclease-driven transgenesis into a safe harbor locus in the human genome. Genome Res. 20 (8), 1133-1142 (2010).
- Urnov, F. D., et al. Highly efficient endogenous human gene correction using designed zinc-finger nucleases. Nature. 435 (7042), 646-651 (2005).
- Jinek, M., Chylinski, K., Fonfara, I., Hauer, M., Doudna, J. A., Charpentier, E. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Jinek, M., East, A., Cheng, A., Lin, S., Ma, E., Doudna, J. RNA-programmed genome editing in human cells. Elife. 2, e00471(2013).
- Doudna, J. A., Charpentier, E. Genome editing. the new frontier of genome engineering with CRISPR-Cas9. Science. 346 (6213), 1258096(2014).
- Cong, L., et al. Multiplex genome engineering using CRISPR/cas systems. Science. 339 (6121), 819-823 (2013).
- Jasin, M. Genetic manipulation of genomes with rare-cutting endonucleases. Trends Genet. 12 (6), 224-228 (1996).
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nat Rev Genet. 11 (9), 636-646 (2010).
- Sander, J. D., Maeder, M. L., Reyon, D., Voytas, D. F., Joung, J. K., Dobbs, D. ZiFiT (zinc finger targeter): An updated zinc finger engineering tool. Nucleic Acids Res. 38, W462-W468 (2010).
- Carroll, D., Morton, J. J., Beumer, K. J., Segal, D. J. Design, construction and in vitro testing of zinc finger nucleases. Nat Protoc. 1 (3), 1329-1341 (2006).
- Chen, F., et al. High-frequency genome editing using ssDNA oligonucleotides with zinc-finger nucleases. Nat Methods. 8 (9), 753-755 (2011).
- Cermak, T., et al. Efficient design and assembly of custom TALEN and other TAL effector-based constructs for DNA targeting. Nucleic Acids Res. 39 (12), e82(2011).
- Reyon, D., Tsai, S. Q., Khayter, C., Foden, J. A., Sander, J. D., Joung, J. K. FLASH assembly of TALENs for high-throughput genome editing. Nat Biotechnol. 30 (5), 460-465 (2012).
- Sanjana, N. E., Cong, L., Zhou, Y., Cunniff, M. M., Feng, G., Zhang, F. A transcription activator-like effector toolbox for genome engineering. Nat Protoc. 7 (1), 171-192 (2012).
- Hou, Z., et al. Efficient genome engineering in human pluripotent stem cells using Cas9 from neisseria meningitidis. Proc Natl Acad Sci U S A. 110 (39), 15644-15649 (2013).
- Podhajska, A. J., Szybalski, W. Conversion of the FokI endonuclease to a universal restriction enzyme: Cleavage of phage M13mp7 DNA at predetermined sites. Gene. 40 (2-3), 175-182 (1985).
- Costa, M., et al. A method for genetic modification of human embryonic stem cells using electroporation. Nat Protoc. 2 (4), 792-796 (2007).
- Chambers, S. M., Fasano, C. A., Papapetrou, E. P., Tomishima, M., Sadelain, M., Studer, L. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Cai, J., et al. Directed differentiation of human embryonic stem cells into functional hepatic cells. Hepatology. 45 (5), 1229-1239 (2007).
- Kehat, I., et al. Human embryonic stem cells can differentiate into myocytes with structural and functional properties of cardiomyocytes. J Clin Invest. 108 (3), 407-414 (2001).
- Soldner, F., et al. Parkinson's disease patient-derived induced pluripotent stem cells free of viral reprogramming factors. Cell. 136 (5), 964-977 (2009).
- Wen, Z., et al. Synaptic dysregulation in a human iPS cell model of mental disorders. Nature. 515 (7527), 414-418 (2014).
- Chiba, K., Hockemeyer, D. Genome editing in human pluripotent stem cells using site-specific nucleases. Methods Mol Biol. 1239, 267-280 (2015).
- Jozefczuk, J., Drews, K., Adjaye, J. Preparation of mouse embryonic fibroblast cells suitable for culturing human embryonic and induced pluripotent stem cells. J Vis Exp. , (2012).
- Ezashi, T., Das, P., Roberts, R. M. Low O2 tensions and the prevention of differentiation of hES cells. Proc Natl Acad Sci U S A. 102 (13), 4783-4788 (2005).
- Tucker, K. L., Wang, Y., Dausman, J., Jaenisch, R. A transgenic mouse strain expressing four drug-selectable marker genes. Nucleic Acids Res. 25 (18), 3745-3746 (1997).
- Southern, E. Southern blotting. Nat Protoc. 1 (2), 518-525 (2006).
- Henegariu, O., Heerema, N. A., Dlouhy, S. R., Vance, G. H., Vogt, P. H. Multiplex PCR: Critical parameters and step-by-step protocol. BioTechniques. 23 (3), 504-511 (1997).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Sexton, A. N., et al. Genetic and molecular identification of three human TPP1 functions in telomerase action: Recruitment, activation, and homeostasis set point regulation. Genes Dev. 28 (17), 1885-1899 (2014).
- Merkle, F. T., et al. Efficient CRISPR-Cas9-mediated generation of knockin human pluripotent stem cells lacking undesired mutations at the targeted locus. Cell Rep. 11 (6), 875-883 (2015).
- Soldner, F., et al. Generation of isogenic pluripotent stem cells differing exclusively at two early onset parkinson point mutations. Cell. 146 (2), 318-331 (2011).
- Forster, R., et al. Human intestinal tissue with adult stem cell properties derived from pluripotent stem cells. Stem Cell Reports. 2 (6), 838-852 (2014).
- Miller, J. C., et al. Improved specificity of TALE-based genome editing using an expanded RVD repertoire. Nat Methods. , (2015).
- Hohenstein, K. A., Pyle, A. D., Chern, J. Y., Lock, L. F., Donovan, P. J. Nucleofection mediates high-efficiency stable gene knockdown and transgene expression in human embryonic stem cells. Stem Cells. 26 (6), 1436-1443 (2008).
- Lin, S., Staahl, B. T., Alla, R. K., Doudna, J. A. Enhanced homology-directed human genome engineering by controlled timing of CRISPR/Cas9 delivery. Elife. 3, e04766(2014).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nat Biotechnol. 25 (6), 681-686 (2007).
- Sakuma, T., Nishikawa, A., Kume, S., Chayama, K., Yamamoto, T. Multiplex genome engineering in human cells using all-in-one CRISPR/Cas9 vector system. Sci Rep. 4, 5400(2014).
- Ousterout, D. G., Kabadi, A. M., Thakore, P. I., Majoros, W. H., Reddy, T. E., Gersbach, C. A. Multiplex CRISPR/Cas9-based genome editing for correction of dystrophin mutations that cause duchenne muscular dystrophy. Nat Commun. 6, 6244(2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。