需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在口腔生物膜细胞外pH值成比例成像
摘要
pH敏感比例染料以共聚焦激光扫描显微镜和数字图像分析结合用于监测实时牙科生物膜的细胞外pH值。
摘要
牙齿上细菌生物膜的pH值是对于龋齿,具有高的全球流行的疾病至关重要。营养物和代谢物没有在牙科生物膜分布均匀。吸附并反应在生物膜有机物质之间复杂的相互作用降低了溶质的扩散路径,并创建活性分子的陡坡,包括有机酸,整个生物膜。定量荧光显微方法,例如荧光寿命成像或pH ratiometry,可以采用在牙科生物膜不同微环境可视化的pH值。 pH值ratiometry利用在pH敏感染料的荧光发射的pH依赖性移。在两个不同波长的发射的比例的计算允许确定在显微图像局部pH,不论染料的浓度。相反微电极的技术允许与监测实时垂直和水平的pH梯度出机械干扰生物膜。然而,必须小心以生物膜的细胞内外室之间准确区分。在这里,比例染料,seminaphthorhodafluor-4F 5-(和-6)羧酸(C-SNARF-4)被用来监测在未知物种组成的体内生长牙科生物膜的细胞外pH值。在暴露于葡萄糖的染料是向上集中在生物膜的所有细菌细胞内;因此它被用来作为一个通用细菌染色和细胞外pH值的标记。共聚焦显微图像采集后,细菌的生物量从使用数字图像分析软件,它允许以独占方式计算外pH的所有照片删除。 pH值ratiometry与比例染料是非常适合于研究高达75微米厚的薄的生物膜的细胞外pH值,但被限制在pH范围4.5至7.0之间。
引言
这里所描述的方法可以监控在牙科生物膜外pH在4.5和7之间的范围内,使用比例染料seminaphthorhodafluor-4F 5-(和-6)羧酸(C-SNARF-4)在共聚焦激光扫描显微镜组合和数字图像分析。所采用的荧光染料是pH敏感,并显示在其荧光发射取决于质子化的状态的转变。在580处的质子化分子峰的荧光发射,并且去质子分子在640nm 1的发射。荧光发射强度的两个探测窗口包括两个发射峰的比率(576 - 608 nm和629 - 661纳米)从而反映pH值在液相,不论染料浓度。用〜6.4的pK a的染料适用于适度酸性环境中的可视化的pH值。
PH值在细菌生物膜是对所有代谢过程至关重要。在牙科生物膜的情况下,pH值在细胞外基质为龋齿的发展的关键毒力因子。 pH值较低的生物膜牙接口引线过长,以减缓潜在的搪瓷2脱钙。由于生物膜,代谢物,包括有机酸的复杂的三维结构,不是均匀地在整个生物膜分布。高少产酸微环境可以紧密的空间接近3被发现。
几十年来,在生物膜垂直pH梯度进行记录微电极4-6的帮助。虽然他们提供了一个良好的空间分辨率,由于其小针尖大小,他们不是非常适合于监控水平梯度。此外,电极的插入机械干扰生物膜。荧光定量显微技术提供可视化生物膜中的不同区域的pH值的变化没有机械干扰的优势NCE。视不同的显微镜视野可以自由选择和过长时间1,7-9反复成像。然而,解译显微生物膜图像时,它的荧光从微生物生物质和荧光从细胞外空间导出导出区分是重要的。在酸性条件下,pH值的细菌细胞内是从pH值在细胞外基质不同,因为细菌在积极三磷酸腺苷10的费用运输在其细胞膜质子。在龋齿的上下文中,而低外pH导致脱矿质胞内细菌的pH不会对底层搪瓷有直接影响。在同时包含无菌区域和细菌显微图像均pH值会导致错误的结果。为了可视化的细菌的生物量和细胞内外区域之间区分使用具有pH敏感的染料沿着其它污渍带来从头出细胞外空间的荧光污染和假测量11的风险。
因此,本手稿描述了一个双重功能的比例染料;既作为pH标记,并作为通用细菌污点。作为染料是向上集中在细菌细胞中,共焦显微成像的组合和一个准确的数字图像分析过程允许在薄牙科生物膜确定4.5和7.0之间的范围外的pH值。
研究方案
实验方案进行了审查,并通过奥胡斯郡的伦理委员会(M-20100032)的批准。
1.成比例的染料的共聚焦显微镜校准
- 对于图像采集,使用配有孵化器倒置共聚焦显微镜,一个63X / 1.2数值孔径的水浸泡的目的,一个543纳米激光线和一个META检测器。
- 制备的HEPES缓冲液储备溶液(50mM的,以0.1个pH单位的步骤调节至pH 4.5-8.5)。吸取100μl的每种溶液成用于荧光显微镜一个透明底96孔板的孔中。
- 处理比例染料C-SNARF-4时,戴上丁腈橡胶手套。制备在二甲基亚砜染料的1mM储备溶液。加入5微升原液,以每孔HEPES缓冲液。放置在显微镜的96孔板中。
- 打开显微镜。打开显微镜软件。点击以下面板:采集→激光;收购→MICRO;收购→配置;收购→扫描;收购→舞台。热身孵化器至37℃。
- 通过点击543 nm激光和"关于"按钮,在"激光控制"窗口打开543纳米激光线。选择在"显微镜控制"窗口中的63X / 1.2数值孔径的水浸泡的目的。
- 将META探测器576- 608纳米(绿色)和629- 661纳米(红色)的时间间隔("配置控制"→"CHS")中同时监测荧光。调整激光功率("配置控制"→"激励")。设置针孔,得到1.6微米的光学切片厚度("扫描控制"→"针孔")。
- 获得的每个的HEPES缓冲液,5微米的96孔板的玻璃底部上方的图像。注意:只要聚焦平面位于下方的玻璃底部,没有荧光可以看出屏幕上。每三个图像后,将激光功率为零,拍摄图像的背景减除。
- 执行一式三份的标定实验(1.2-1.7)。
- 确定在所有的红色和绿色的图像的平均荧光强度和标准偏差。
- 根据等式计算比R和平均值的标准误差,S R,对于每一个图像(1)和(2)
(1)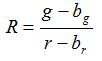
(2)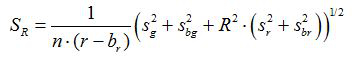
克,R,S G和S R是在各自的绿色和红色的图像的平均值和标准偏差; B G,B R,S BG和宽单峰都是为背景图像的对应值。1. 2是成像像素数。 - 绘制所计算的比率,用于从图中的三次重复校准实验各pH值,并从该系列的数据点的构建拟合曲线( 即使用软件SIGMAPLOT 13)。使从可比率转换成的pH值10的拟合曲线的数学函数。
- 根据等式计算比R和平均值的标准误差,S R,对于每一个图像(1)和(2)
2. 在原位生长的生物膜牙样品采集
- 选择履行相关的研究入选和排除标准的志愿者。使它们的上和下齿弓的藻曝光。使从这些展示铸造模型和下颚制造的丙烯酸系夹板。设计与舌正畸钢丝,使志愿者咬入正常咬合连接12颊丙烯酸法兰夹板。
- 在丙烯酸夹板的颊凸缘钻头衰退( 图1 )牙科丙烯酸钻的帮助,以便收集生物膜玻璃砖的插入。凹陷的深度至少应为1.5毫米,而凹陷的宽度和长度可以根据要插入玻璃板坯的数目而变化。
- 生物膜收集,使用定做的非荧光玻璃板坯(4×4×1毫米3)与砂砾1200的表面粗糙度,以模仿天然釉质11定植图案。
- 通过之前安装高压灭菌玻璃砖。安装在每个侧的颊凸缘稍微凹进至丙烯酸表面的表面上的凹陷粘蜡玻璃板坯,以保护从由面颊11的移动施加剪切力的生物膜。
注意:放置在一个衰退玻璃板坯的数目可以,3和14之间变化取决于研究的目的。 - 插入志愿者口设备。指示volunTEER保留器具口内整个实验期间。指示志愿者以存储在用一块湿纸巾的正畸保持器容器的器具刷牙和食物和水以外的饮料的摄取期间,在室温(保持它湿润)。指示志愿者不接触与玻璃砖颊丙烯酸法兰同时放置和移除设备。
注意:实验周期可以根据研究(一天至几周)的目的而有所不同。 - 仔细实验期结束时删除该设备上的玻璃砖。用刀除去周围的板坯粘性蜡并用一对镊子的传递它们到一个密闭容器中,朝上生物膜,直到显微分析。保持与湿纸巾湿润的容器。生物膜收集后进行几个小时内pH值成像。
3.生物膜的pH成像
- 准备通过根据德容等人 13的方法中加入二硫苏糖醇,以收集唾液的唾液溶液。滴定唾液溶液至pH 7.0,并添加葡萄糖至0.4%(重量/体积)的浓度。每生物膜移液器将100μl要分析成用于显微镜的玻璃底96孔板中。加入5微升每孔的比例染料。
- 放置在显微镜载物台96孔板中。打开显微镜和543纳米的激光线。热身孵化器至37℃。使用相同的显微镜设置作为染料的校准(见步骤1.5-1.6)。等待30分钟,直到96孔板已达到工作温度。
- 拿起一个或多个玻璃砖采用了超薄一套镊子,并将其放置在唾液充满井,每口井一个平板,朝下的生物膜。
- 获取单个图像("扫描控制"→"单")或Z-栈("扫描控制"→"开始")spanni纳克在不同领域的生物膜的深度。获得的z栈选择要被成像("扫描控制"→"Z设置"→"数片")的片数,并标记为第一,并在显微镜软件的最后切片的z位置("扫描控制"→"Z设置"→"标记为先";"马克最后")。
注意:Z-栈具有高达75微米的可与细胞外和细胞内区域之间的良好的对比度被收购的深度。 - 要遵循的观点随着时间的推移微观领域pH值的变化,标志着显微镜软件("第一阶段和聚焦控制"→"马克·波什"),XY位置,并在连续的时间点采取重复图像("扫描控制"→"单")。经常服用的图像与背景减除设置为零激光功率。
4.数字图像分析
- 世博RT显微图像为TIF文件,使用显微镜软件("宏"→"文件批量导出")的文件批量出口。标记要导出的文件,并保存红色和绿色通道图像单独的文件夹为TIF-文件("开始批量导出")。重命名这两个文件夹给他们的顺序编号的文件。
- 导入红色和绿色图像串联成软件如daime(在微生物生态学数字图像分析)14。段与个人选定的亮度阈值(段→自动分割→自定义阈值)的绿色通道图像。小心地选择(通常是20与80之间)的亮度的阈值,以使所有的细菌(除外基质亮),但不是矩阵将被识别为分割期间的对象。验证目视即识别为对象的区域对应井到细菌生物质。
- 传输分段克对象层颖通道图像对应的红色通道图像(段→传输对象层)。使用对象编辑器功能,拒绝和删除红色和绿色通道图像的所有对象。现在仅外基质被留在所述生物膜的图像。导出处理的图像系列为TIF文件。
- 导入图像串联成的ImageJ(http://rsb.info.nih.gov/ij; v.1.47)。确定在与激光拍摄的背景图像的平均荧光强度断开(分析→直方图)。减去红色和绿色的图像适当背景(流程→数学→减)。
- 仍然在ImageJ的,本身(过程→图像计算器)划分绿色形象系列(G1)。然后乘以所产生的图像系列(G2)的绿色形象系列(G1)。这将产生一个图象系列(G3),其中NaN被分配给属于该被确认为在daime对象区域的所有像素。继续在T他相同的方式与红色图象系列(R1 / R1 = R2,R2点¯xR1 = R3)。
注意:作为细菌的生物质从图像在步骤4.3除去,荧光强度是在这些区域0。步骤4.5是必要的值0转换为NaN时,其允许在步骤4.6比计算。 - 应用'是什么意思"过滤器(处理→过滤器→均值;半径:1像素),以补偿检测器噪音。除以红色图像系列(过程→图像计算器)的绿色形象系列。这导致的绿色/红色比在图像的外空间中的每个剩余的像素。利用虚假的着色图像中的比例图示(图像→查找表)。计算每个图像的平均比率(分析→直方图)。
- 根据1.9.2下安装的功能)转换绿/红比值的pH值。注:校正数据和拟合曲线的例子可以在Schlafer 等可见人2015年11。
结果
所提出的方法允许监测外pH在pH范围牙科生物膜从4.5至7中的实时的不同微环境下降。如果如上述被选择的实验条件下,pH值开始于生物膜的所有领域滴暴露于葡萄糖后不久。
当pH值在生物膜滴剂,细菌细胞成为短时间(<1分钟)内可见,随着比例染料在细胞( 图2A)upconcentrated。在一开始,生物膜开始酸生产之前?...
讨论
相比,电极或微电极测量4-6生物膜pH为微观监测提供了若干优点。显微技术允许确定pH值以高空间分辨率和允许在不机械地扰乱生物膜捕获在生物膜水平和垂直的pH梯度。的微观pH监测先前的尝试,但是,没能在生物膜1,7,9外和细胞内pH值之间进行区分。由于细菌的动态平衡,细胞内pH从外pH不同,并且如果内和细胞外隔室向记录荧光发射的pH计算可以是无效的。使用第二荧光染料与pH?...
披露声明
作者什么都没有透露。
致谢
笔者想感谢哈维尔·加西亚·E.琳恩和对格隆克沙尔技术援助和莫雷特K. Raarup了富有成果的讨论。这项工作是由奥胡斯大学研究基金会资助并西蒙基金会探马。
材料
| Name | Company | Catalog Number | Comments |
| Zeiss LSM 510 META | Zeiss | N/A | |
| C-Apochromat 63X water immersion objective | Zeiss | N/A | |
| XL Incubator | PeCON | N/A | |
| SNARF-4F 5-(and-6)-Carboxylic Acid | Life Technologies | S23920 | |
| Dimethyl sulfoxide | Life Technologies | D12345 | |
| HEPES | Life Technologies | 11344-041 | |
| Costar 96-well black clear-bottom plate | Fisher Scientific | 07-200-567 | |
| Custom-made glass slabs (4 x 4 x 1 mm3; 1,200 grit) | Menzel | N/A | |
| Alginate impression material | GC Corporation | N/A | |
| Acrylic Adjusting Logic Sets/set of acrylic dental burs | Axis Dental | LS-906 | |
| Orthodontic retainer containers | Spark Medical Equipment Co., Ltd | SK-WDTC01 | |
| Sticky wax | Dentsply | N/A | |
| Chewing paraffin wax | Ivoclar Vivadent AG | N/A | |
| Dithiothreitol | Sigma Aldrich | D0632 | Used during preparation of salivary solution |
| 0.45 µm and 0.2 µm syringe filters | Sigma Aldrich | CLS431220; CLS431219 | |
| daime | University of Vienna, Austria | http://dome.csb.univie.ac.at/daime | |
| ImageJ | NIH, Bethesda, Maryland, USA | http://imagej.nih.gov/ij/ |
参考文献
- Hunter, R. C., Beveridge, T. J. Application of a pH-sensitive fluoroprobe (C-SNARF-4) for pH microenvironment analysis in Pseudomonas aeruginosa biofilms. Appl. Environ. Microbiol. 71 (5), 2501-2510 (2005).
- Takahashi, N., Nyvad, B. Caries ecology revisited: microbial dynamics and the caries process. Caries Res. 42 (6), 409-418 (2008).
- Schlafer, S., et al. pH landscapes in a novel five-species model of early dental biofilm. PLoS. One. 6 (9), e25299 (2011).
- von Ohle, O. C., et al. Real-time microsensor measurement of local metabolic activities in ex vivo dental biofilms exposed to sucrose and treated with chlorhexidine. Appl. Environ. Microbiol. 76 (7), 2326-2334 (2010).
- Revsbech, N. P. Analysis of microbial communities with electrochemical microsensors and microscale biosensors. Methods Enzymol. 397, 147-166 (2005).
- Vanhoudt, P., Lewandowski, Z., Little, B. Iridium oxide pH microelectrode. Biotechnol. Bioeng. 40 (5), 601-608 (1992).
- Franks, A. E., et al. Novel strategy for three-dimensional real-time imaging of microbial fuel cell communities: monitoring the inhibitory effects of proton accumulation within the anode biofilm. Energy & Environmental Science. 2 (1), 113-119 (2009).
- Hidalgo, G., et al. Functional tomographic fluorescence imaging of pH microenvironments in microbial biofilms by use of silica nanoparticle sensors. Appl. Environ. Microbiol. 75 (23), 7426-7435 (2009).
- Vroom, J. M., et al. Depth penetration and detection of pH gradients in biofilms by two-photon excitation microscopy. Appl. Environ. Microbiol. 65 (8), 3502-3511 (1999).
- Bender, G. R., Sutton, S. V., Marquis, R. E. Acid tolerance, proton permeabilities, and membrane ATPases of oral streptococci. Infect. Immun. 53 (2), 331-338 (1986).
- Schlafer, S., et al. Ratiometric imaging of extracellular pH in bacterial biofilms using C-SNARF-4. Appl. Environ. Microbiol. 81 (4), 1267-1273 (2015).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J Oral Sci. 115 (6), 459-467 (2007).
- de Jong, M. H., van der Hoeven, J. S., van OS, J. H., Olijve, J. H. Growth of oral Streptococcus species and Actinomyces viscosus in human saliva. Appl. Environ. Microbiol. 47 (5), 901-904 (1984).
- Daims, H., Lucker, S., Wagner, M. daime, a novel image analysis program for microbial ecology and biofilm research. Environ. Microbiol. 8 (2), 200-213 (2006).
- Liu, Y. L., Nascimento, M., Burne, R. A. Progress toward understanding the contribution of alkali generation in dental biofilms to inhibition of dental caries. Int. J Oral Sci. 4 (3), 135-140 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。