Method Article
成人脂肪细胞生物体的数字调控机制,通过分化与凋亡的动态平衡
摘要
Adipose tissue (AT) can influence whole body homeostasis, therefore understanding the molecular mechanisms of adipocyte differentiation and function is of importance. We provide a protocol for gaining new insights into these processes by analyzing adipocyte homeostasis, differentiation and hypoxia exposure as a model for induced adipocyte apoptosis.
摘要
Considering that adipose tissue (AT) is an endocrine organ, it can influence whole body metabolism. Excessive energy storage leads to the dysregulation of adipocytes, which in turn induces abnormal secretion of adipokines, triggering metabolic syndromes such as obesity, dyslipidemia, hyperglycemia, hyperinsulinemia, insulin resistance and type 2 diabetes. Therefore, investigating the molecular mechanisms behind adipocyte dysregulation could help to develop novel therapeutic strategies. Our protocol describes methods for evaluating the molecular mechanism affected by hypoxic conditions of the AT, which correlates with adipocyte apoptosis in adult mice. This protocol describes how to analyze AT in vivo through gene expression profiling as well as histological analysis of adipocyte differentiation, proliferation and apoptosis during hypoxia exposure, ascertained through staining of hypoxic cells or HIF-1α protein. Furthermore, in vitro analysis of adipocyte differentiation and its responses to various stimuli completes the characterization of the molecular pathways behind possible adipocyte dysfunction leading to metabolic syndromes.
引言
据世界卫生组织2014年的报告显示,全球成人人口的39%超重,13%肥胖1。在不久的将来,超重的人将包括老年人口的比例显著。肥胖和老化的一个重要特征是相对于发病率和死亡率2的脂肪失调。脂肪因子,由脂肪组织(AT)的分泌的蛋白质,可以触发代谢综合征如肥胖症和2型糖尿病3。代谢性疾病主要是由过多的能量储存在脂肪细胞的脂滴,这导致在扩张4引起的。因此,感兴趣的确定,以便找到的机会,以控制它的原因和AT膨胀的分子机制。
营养过剩导致的AT扩张,这是由两个事件调节:过量的能量存储为脂肪细胞的脂滴,一个处理导致肥大(在脂肪细胞尺寸增加),并增加了脂肪生成,也称为脂肪细胞增生5。脂肪生成是多能间充质干细胞(MSC)为脂肪细胞的分化的方法。首先,干细胞在承诺阶段发展成脂肪前体细胞。其次,前脂肪细胞进一步分化获得成熟和功能的脂肪细胞6的功能。一些转录因子已被确定为主调节器前脂肪细胞测定,如锌指蛋白423(Zfp423)和早期B细胞因子1(EBF1)。而Zfp423诱导早承诺,EBF1需要脂肪细胞祖细胞6的产生。终末分化紧密由转录级联,由此过氧化物酶体增殖物激活受体γ(PPARγ)是必需的转录因子7控制。进一步关键转录因子是CCAAT /增强子结合蛋白(C/ EBP)家族成员( 即 C /EBPα,C /EBPβ和C /EBPδ),Kruppel样因子(KLFs),cAMP反应元件结合蛋白(CREB)和早期生长反应20(猪Krox20)6。
最近,已经表明,激活蛋白-1(AP-1)家族参与在脂肪细胞分化过程8,9。该AP-1系列由二聚体蛋白复合物,低聚果糖,君和/或激活转录因子(ATF)成员组成的形成。 Fos蛋白相关抗原1和2(FRA-1和FRA-2)是能调节脂肪细胞分化。 FRA-1通过抑制C /EBPα8,而FRA-2控制脂肪细胞的营业额9削弱脂肪细胞分化。离-2-从而不仅由脂肪细胞分化过程中抑制PPARγ2表达降低了脂肪细胞数目,而且还通过缺氧诱导因子(HIFs)的表达的直接压制降低脂肪细胞的细胞凋亡。该HIF家庭是一个烯酸rodimeric转录因子复合物,HIF-1α,HIF-2α和HIF-1β组成。该异二聚体由氧敏感的HIF-α蛋白(HIF-1α或HIF-2α)和氧气不敏感的HIF-1β亚单位10。在常氧,HIF-α蛋白聚ubiquitinylated并最终被蛋白酶体降解11。在缺氧条件下,在膨胀过程中的AT发生,HIF-α蛋白是不再羟基化。因此,他们成为稳定并形成二聚体与组成性表达HIF-1β。由HIF应答元件控制的基因的转录激活是参与血管发生,代谢和炎症12的调节。事实上,HIF-1α诱导的葡萄糖耐受性,抑制能量消耗和外围使用脂质,以及通过增加瘦素水平与HFD诱导的肝脂肪变性13促进AT功能障碍。此外,HIF-1α的调节adipocy德凋亡的体内 和体外 9。
本协议描述为就读于状态解开在成年小鼠脂肪细胞稳态的分子特征的方法。它显示了如何凋亡,增殖和体内 和体外脂肪细胞的分化可以通过缺氧调节。要做到这一点,我们使用与携带渡与FABP4-CreERT小鼠9 FRA-2等位基因两侧装接loxP小鼠产生FRA-2的脂肪细胞特异性缺失的小鼠。通过使用FABP4 Cre重组酶的小鼠ERT,删除是脂肪细胞特异性和诱导他莫昔芬注射14。对于成人模型,他莫昔芬的腹膜内注射在连续5天开始至6周的年龄进行。因此,所做的分析之前将小鼠进行正常饮食或高脂肪饮食6周。在此研究中使用的小鼠基于C57BL6背景雄性避免雌激素,如雌激素,显示调节身体脂肪的分布15。使用另一种遗传背景也可能改变的代谢表型,由于在脂质管理16应变相关的差异。
此协议演示了如何使用组织学分析AT缺氧条件下,如何利用免疫组织化学和基因分析分析,以量化的脂肪细胞凋亡,增殖和分化的体内 。这项研究是由体外实验,展示如何分析主要脂肪细胞分化和凋亡暴露在缺氧的改变完成。
研究方案
道德守则:动物被安置在继德国动物福利法的指导标准条件。动物饲喂标准饮食自由采食和饮水 ,并保持了12小时昼/夜循环。与动物的所有实验是由当地伦理委员会的批准。
1. 在成年男性脂肪细胞动态平衡的体内分析
- 在体内量化缺氧,首先确定体重小鼠,然后注入60毫克/公斤体重的盐酸固体pimonidazole的腹膜内(例如:注入1.5毫克到将25g小鼠)。 Pimonidazole是一种有效的缺氧标记物,形成的加合物与蛋白质,肽和氨基酸硫醇基团和由特定的抗体来检测。
- 牺牲小鼠并取出perigonadal脂肪垫( 图1)。
- 注射后45分钟,用CO 2窒息和随后的颈椎脱位牺牲小鼠。
- 牵制小鼠的肢体(如在图1示出)和打开腹腔。卸下左侧和腹膜腔内部的右perigonadal(附睾)脂肪垫。
注意:脂肪垫被绑定到由腹膜小叶附睾如图1(perigonadal脂肪垫由箭头指示)。 - 小心从脂肪垫去除性腺组织。确定脂肪垫的重量来计算的比率:每体重量(g)脂肪垫重(g)。
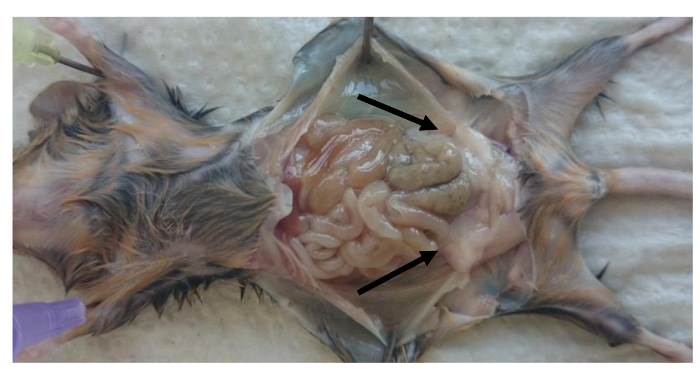
图1: 在小鼠的腹膜腔perigonadal脂肪垫的位置 。牺牲后perigonadal脂肪定位在成年小鼠的图片。 Perigonadal脂肪垫用箭头指示。 请点击此处到vIEW这个数字的放大版本。
- 要编译定量基因表达谱,使用一个perigonadal脂肪垫分离RNA。注意:直到组织被处理后,在-80℃或在液氮中的RNA稳定溶液商店组织样本。
- 均质化脂肪垫,脂肪垫中添加异硫氰酸胍和苯酚1ml的单相溶液。使用含有陶瓷微珠(1.4 MM)管粉碎在均化组织在6,500 rpm转速下(2次,每次20秒,30秒暂停)。
- 分离RNA如下(单步通过Chomczynski和Sacchi 17法)。
- 分离各相,匀化脂肪垫转移到离心管中,增加±ml,此氯仿,振摇15秒,孵育在室温下5分钟,并离心12000 xg离心5分钟。传送上层水相(约400微升),其中包含的RNA,到一个新的离心管中。不包括DNA,含有ING相间或含蛋白质的苯酚相。
- 以沉淀的RNA,加入1倍体积的异丙醇,混合,并在4℃下孵育15分钟(也可以在-20℃过夜孵育)。离心在12,000rpm xg离心10分钟。小心取出异丙醇上清。与拥有12000 XG 10分钟的离心步骤,75%乙醇洗两次。
- 在室温下干燥沉淀的RNA的约10分钟后,将其溶解在50μl 的 H 2 O(无RNA酶)。为方便起见,在65℃下孵育2分钟。
注意:保持RNA的75%的乙醇在-80℃下或在长期贮存液氮中。 - 由A 260/280量化RNA制剂(最佳商在1.8和2.2之间),并用260计算浓度:
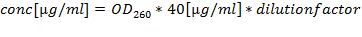
- 为了避免DNA污染,消化RNA样品1微克用1单位DNA酶I在10微升的体积在37℃下30分钟。灭活在65℃下进行10分钟。
注意:此步骤是可选的。 - 使用10微升含有1微克的RNA用于逆转录反应,以产生的单链cDNA,适于定量PCR应用RNA制备的。组分及其用量列于表1中 。
- 使用的PCR主混合物用于定量实时PCR反应。以确定在全脂肪垫代谢变化,使用特异性引物对涉及AT稳态( 表2)和在表3中列出的PCR条件基因。
- 实时PCR数据分析。
- 定义基线( 图2),通常是周期为1〜15,其中,有在荧光信号没有变化。的实时PCR软件正规化特定荧光信号的基线荧光和内部参考染料,ROX,导致特定信号的幅度由引物,增量Rn的(ΔRn)。
- 扩增曲线的指数阶段中设置的阈值。交点定义了阈值循环数(Ct)。根据CT值,计算相对表达(ΔCT)和倍数变化(ΔΔCT):
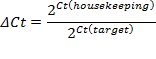
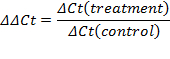
| 零件 | 成交量微升/反应 |
| 10X RT缓冲液 | 2.0 |
| 25X dNTP混合物(100毫米) | 0.8 |
| 10X RT随机引物 | 2.0 |
| MultiScribe逆转录酶 | 1.0 |
| 无核酸-H 2 O | 4.2 |
| 1微克RNA | 10 |
| 总每反应 | 20 |
表1:与各个体积的逆转录酶反应,以产生单链cDNA组件。
| 官方全名 | 符号 | 序列3' - > 5' | ||
| 前锋 | 相反 | |||
| 脂肪形成 | Delta-样1同源基因(PREF-1) | DLK1 | GACACTCGAAGCTCA CCTGG | GGAAGGCTGGGACGG GAAAT |
| 早期的B细胞因子1 | EBF1 | CCACCATCGACTACGG CTTC | TCCTGGTTGTTGTGGGG CATC | |
| 锌指蛋白423 | Zfp423 | GTGCCCAGGAAGAAGA CGTA | GGCGACGTGGATCTGA ATCT | |
| 脂肪酸结合蛋白4(AP2) | FABP4 | TCACCTGGAAGACAGCT CCTC | AAGCCCACTCCCACTTC TTTC | |
| CCAAT /增强子结合蛋白(C / EBP),α- | CEBPA | AAGAGCCGCGACA AGGC | GTCAGCTCCAGCACCT TGTG | |
| CCAAT /增强子结合蛋白(C / EBP),β- | Cebpb | TTTCGGGACTTGATGC AATC | CCGCAGGAACATCTTT AAGG | |
| cAMP反应元件结合蛋白1 | CREB1 | ACTCAGCCGGGTACT ACCAT | TTGCTGCCTCCCTGTT CTTC | |
| CCAAT /增强子结合蛋白(C / EBP),三角洲 | Cebpd | CAGCGCCTACATTGAC 三氯异氰尿酸 | GTTGAAGAGGTCGGCG AAGA | |
| Kruppel-样因子4 | KLF4 | GCAGTCACAAGTCCCC TCTC | TAGTCACAAGTGTGGG TGGC | |
| 早期生长反应2(猪Krox20) | EGR2 | AGGCGGTAGACAAAATC CCAG | GATACGGGAGATCCAG GGGT | |
| 过氧化物酶体增殖物激活受体γ | PPARG | AGAGGTCCACAGAGCTG ATTC | GATGCACTGCCTATGAGC ACTT | |
| 脂肪生成 | 乙酰辅酶A羧化酶阿尔法 | ACACA | TGGGGACCTTGTCTTCA TCAT | ATGGGCGGAATGGTCTC TTTC |
| 脂肪酸合成酶 | FASN | ACATCCTAGGCATCC GAGA | CCGAGTTGAGCTGGGT 塔格 | |
| 硬脂酰辅酶A脱氢酶1 | SCD1 | CGGGATTGAATGTTCTTG TCGT | TTCTTGCGATACACTCTG GTGC | |
| 脂解 | patatin启动般的磷脂酶域containiNG 2 | Pnpla2 | AAGGACCTGATGACCA CCCT | CCAACAAGCGGATGGT GAAG |
| 脂肪酸的摄取 | 脂蛋白脂酶 | LPL | GTATCGGGCCCAGCAA CATTATCC | GCCTTGCTGGGGTTTTC TTCATTC |
| CD36抗原 | CD36 | GTCTTCCCAATAAGCATGT CTCC | ATGGGCTGTGATCGGA ACTG | |
| 缺氧 | 缺氧诱导因子1,α亚基 | HIF1A | CCTGCACTGAATCAAGAG GTGC | CCATCAGAAGGACTTGCT GGCT |
| 内皮PAS结构域蛋白1(也被称为:HIF-2alpha) | EPAS1 | CAAGCTGAAGCTAAAG 葛洲坝 | TTGGGTGAATTCATCG GGGG | |
| 希佩尔 - 林道肿瘤抑制基因 | VHL | ACCGAGGTCATCTTTG GCTC | TTCCGCACACTTGGGT AGTC | |
| 芳香烃受体核转(也称为:HIF-1β) | ARNT | TGGGTCATCTTCTCGC GGTT | TGTCCTATCTGAGCAT CGTG | |
表2: 基因与用于分析脂肪细胞动态平衡的各引物的序列的列表。
| 步 | 温度(℃) | 时间(分:秒) | ||
| 聚合酶激活 | 保持 | 95 | 10:00 | |
| PCR | 40个循环 | Denaturize | 95 | 0:15 |
| 退火/延伸 | 60 | 1:00 | ||
| 熔解曲线 | 60至95 | 0.5℃/秒 | ||
表3:实时PCR条件。
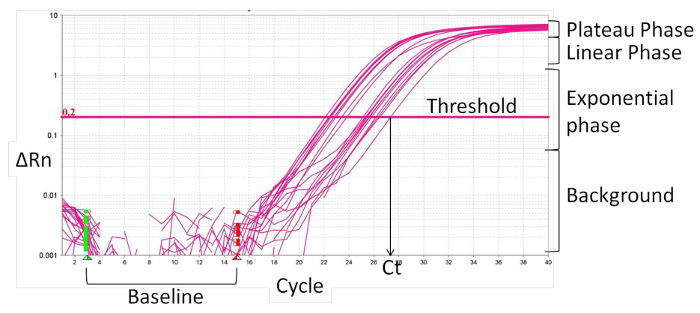
图 2: 实时PCR扩增曲线的特点 ,请点击此处查看该图的放大版本。
- 要执行脂肪细胞动态平衡的病理分析,使用第二个perigonadal脂肪垫。不要变干的组织!
- 修复脂肪垫在3.7%PBS缓冲的甲醛过夜,石蜡嵌入(按照说明18别处描述),并削减包埋组织成2-5微米厚的部分(最多5微米)。
- 确定在明视场显微镜每场和脂肪细胞尺寸脂肪细胞的数目苏木精和曙红(H&E)染色后:
- 洗涤3次,在二甲苯中5分钟,并再水化部分2次,在100%乙醇2分钟,2次,在96%乙醇2分钟Deparaffinize部分。最后,洗节蒸馏水2 O 5分钟。
- 染色用苏木,1:5稀释用蒸馏水2 O,在室温下10分钟,并在H 2ö洗5分钟。染色用曙红溶液(20毫升5%曙红Y / 210毫升蒸馏H 2 O / 25微升冰醋酸)30秒,并用H 2 O洗一遍5分钟。
- 脱水用96%乙醇及100%乙醇各2次切片2分钟,和二甲苯3次,每次5分钟。安装用无水安装代理的部分。
- 评估明场显微镜下的章节。如何分析脂肪细胞用ImageJ的1.48V 19的代表性示例示于图。 3:单位面积细胞(微米2)中 ,编号单元面积(×10 3μm2的),细胞尺寸(微米)。
- 打开ImageJ的用在1.48V部分的图片。如果图像的参数中的像素,而不是长度单位来表示,调整比例。
- 在工具栏中选择*直线*和通过参照比例尺调整线路到一个已知的距离。进入分析 - > 设置比例以像素为单位显示该行的距离。添加的已知距离和长度的单位, 例如 ,微米。按下OK键确认。图像的尺寸和参数的分析在给定长度的单元表示。
- 为了确定脂肪细胞的参数,调整该阈值。转到图像 - > 调整 - > 阈值打开门限窗口。选择以下设置: 阈值法 :默认; 阈值的颜色 :黑白, 色彩空间 :HSB。图片现在显示在黑色和白色。调整亮度以清除白色脂肪细胞,并关闭黑色细胞间隙, 如图。 3B。
- 每计数2微米( 图 3E)脂肪细胞与*多 点*选择工具栏上的号码和标记计数每个单元格。
- 为了确定脂肪细胞的尺寸,在工具栏上再次选择*直线*和绘制脂肪细胞( 图3c)的直径。进入分析 - > 测量和一个新的窗口将出现,与微米直径的长度。
- 为了确定脂肪细胞区域,选择*棒(跟踪)工具*和点击里面的脂肪细胞。脂肪细胞的内壁在红色( 图3d)被选择。进入分析 - > 测量和一个新的窗口会出现,这种脂肪细胞的微米2的区域。
- 对于immunohistochemistry,如下准备抗体和TDT介导的dUTP缺口末端标记(TUNEL)染色的部分:
- 洗涤3次,在二甲苯中5分钟,并再水化部分2次,在100%乙醇2分钟,2次,在96%乙醇2分钟Deparaffinize部分。最后,洗部分在蒸馏H 2 O
- 用于抗原修复,在37℃用蛋白酶K消化的组织切片30分钟的工作溶液(在10mM的Tris /盐酸,pH值7.4-8 20微克/毫升),并用PBS冲洗。
- 执行在潮湿室抗体染色:
- 向阻断内源性过氧化物酶,使用3%过氧化氢的PBS 10分钟,用随后洗涤2次,在PBS中5分钟。要阻止抗体的非特异性结合,用在PBS 10%血清。使用二次抗体的宿主的血清,在这种情况下,山羊。
- 对于染色,使用细胞凋亡,增殖和缺氧检测抗体( 表4)。稀释在PBS / 10%山羊血清的抗体。在4℃孵育过夜。洗切片3次在PBS中5分钟。
- 增强信号使用生物素化的次级抗体,用稀释如表5中列出。对于缺氧检测,使用HRP缀合的兔抗FITC作为二次抗体。孵育在室温下1小时。洗部2次5分钟,用PBS。
注意:用FITC MAB1缺氧染色,跳过步骤1.4.4.4),并继续执行步骤1.4.4.5)。 - 对于每个滑动,预孵育50微升以50微升生物素化的过氧化物酶H表示在室温下30分钟抗生物素蛋白溶液(这种方法也被称为抗生物素蛋白/生物素ABC复合物制剂),然后加入到部分为另一45分钟。洗2次,每次5分钟,用PBS。
- 孵育切片在过氧化物酶底物溶液,直至染色更加激烈(5至10分钟)。洗5分钟,用蒸馏水H 2 O
- 对于复染,用苏木染色1:5稀释用蒸馏水2 O,在室温下10分钟,并在H 2ö洗5分钟。
- 脱水部分在96%乙醇和100%乙醇各2次2分钟,和二甲苯3次,每次5分钟。用密封盖玻片和无水安装代理的部分。评估明场显微镜下的章节。
- TUNEL法测定细胞凋亡,并按照制造商的说明:
- 加入50微升酶溶液注入450微升标签解决方案。然后在组织切片应用50μl的TUNEL反应混合物中,并在黑暗的潮湿气氛中,在+37°C孵育60分钟。用PBS洗涤切片3次,每次5分钟,并用荧光封固剂包括DAPI(4',6-二脒基-2-苯基)用于复染装入。
- 评价用100倍尊在荧光显微镜下的部离子。对于荧光素测量使用488nm的激发波长和515-565纳米(绿色激光)之间检测; DAPI激发约360 nm和在绑定到DNA(蓝色激光)在460纳米发射。
- 量化DAPI和荧光素的叠加:

图 3: 在分析脂肪垫部分脂肪细胞的特性与高脂肪食物(HFD)或正常饮食(ND)与明场显微镜治疗雄性小鼠的perigonadal脂肪垫部分照片(A);阈值被调整成黑白(b)和脂肪细胞的尺寸(长度; c)中 ,区域(d)和每毫米2(E)脂肪细胞的细胞数用ImageJ的1.48V进行量化。F ="https://www.jove.com/files/ftp_upload/53822/53822fig3large.jpg"目标="_空白">点击此处查看该图的放大版本。
| 股权集中度 | 稀释 | |
| 细胞凋亡 | 裂解的caspase-3(Asp175)(5A1E)兔单克隆 | 1:2000 |
| 增殖 | 纯化的鼠抗人Ki-67的克隆B56(RUO) | 1:50 |
| 缺氧 | HIF-1 alpha抗体 | 1:100 |
| FITC-MAB1 | 1:100 |
表4: 与用于AT切片的免疫组织学染色各稀释抗体。
| 抗体 | 稀释 |
| 生物素化抗小鼠IgG(H + L) | 1:200 |
| 生物素化抗小鼠IgG(H + L) | 1:200 |
| HRP缀合物的兔抗FITC | 1:100 |
表5:用稀释用于免疫组织化学染色二级抗体。
2.脂肪细胞动态平衡体外分析影响缺氧
- 牺牲小鼠和去除皮下脂肪组织。
- 通过牺牲二氧化碳窒息和随后的颈椎脱位的小鼠。
- 牵制的小鼠的肢体, 如图4所示,从上腿,腰和后刀面取下皮肤并与针头针下来, 如图4。然后取出皮下脂肪组织,其位于后部处的基后腿,周围腹股沟淋巴结( 如图4,左:皮下脂肪垫S按箭头指示;右:用箭头表示腹股沟淋巴结)。

图4: 皮下脂肪垫的位置 。皮下脂肪垫的图片;左箭头表示皮下脂肪垫和右箭头表示腹股沟淋巴结。 请点击此处查看该图的放大版本。
- 隔离脂肪来源的干细胞(ADSC)先前所描述的20。
- 种子ADSC 4000细胞/ cm 2在Dulbecco改良的Eagle培养基- 火腿的F-12补充了10%正常牛血清,1%青霉素/链霉素,0.5%两性霉素B,16μM生物素,18μM泛酸和100μM的抗坏血酸和成长文化汇合约70至80%,这是后4至6天培养的到达。
- 诱导成脂诱导分化。
- 通过胰蛋白酶处理从表面去除粘附ADSC。
- 除去培养基,用PBS洗,并添加0.025%胰蛋白酶溶液(预热至37℃)2分钟(直到细胞从表面分离)。立即添加培养基和洗涤细胞。
- 算使用Neubauer室中的细胞。
- 把玻璃盖在纽鲍尔室的中心区域。稀释细胞悬浮液1:10和负载10微升稀释的细胞悬浮液的腔室。算在位于角部4正方形,每16个较小的正方形构成的细胞。计算每毫升细胞数:
- 把玻璃盖在纽鲍尔室的中心区域。稀释细胞悬浮液1:10和负载10微升稀释的细胞悬浮液的腔室。算在位于角部4正方形,每16个较小的正方形构成的细胞。计算每毫升细胞数:
- 种子ADSC在12孔培养板(如在点2.2所述)和生长培养至汇合约70%至80%(后4至6天达到)。
- 诱发adipoge通过添加5微克/毫升胰岛素,1μM的地塞米松和5μM的3-异丁基-1-甲基黄嘌呤(IBMX)向培养网卡分化。更新培养基每2天。细胞将在7天之内完全分化。
- 通过胰蛋白酶处理从表面去除粘附ADSC。
- 分析脂肪细胞分化,染色与油红O,其中渍成熟脂肪细胞甘油三酯。
注意:必须工作在通风橱下进行!- 除去培养基,用PBS轻轻洗脂肪细胞和固定细胞60分钟用2毫升10%福尔马林中。
- 为了准备油红O染色解决方案,混合3份红色油O原液(溶解在100毫升99%的异丙醇300毫克红色油O粉)和2份蒸馏水2 O的孵育在室温下10分钟。过滤通过0.2微米的注射过滤器的油红O工作溶液。
注意:工作液是稳定的2小时。 - 对于油红O染色,除去福尔马林,用H 2冲洗脂肪细胞 0,孵化用2毫升60%的异丙醇5分钟,除去异丙醇和加2ml油红O工作液5分钟。用自来水冲洗细胞,直到水是清的。苏木染液在点1.4.4.5)。
- 评价用100倍的倍率相差显微镜下的板。脂肪细胞的脂质会出现红色,细胞核会出现蓝色。
- 可选步骤:用shRNA转沉默感兴趣的基因。
- 改变介质和添加的无血清培养基。
- 为脂肪细胞的转染,使用脂质转染。按照制造商的说明,并使用1微克每shRNA的12孔组织板。加入脂质-DNA复合物后,在37°C孵育脂肪细胞48小时。
- 来分析经受缺氧脂肪细胞,使用一个缺氧工作站或缺氧培养箱保持低氧条件下的细胞。根据研究,缺氧Ç乌尔德是0.5,1%或2%的氧气。
- 通过FITC标记的膜联蛋白V和随后的流式细胞仪分析分析细胞凋亡。
- 收集脂肪细胞与一个额外的柔软细胞刮刀,用PBS冲洗和1×10 6个细胞添加到100μl的膜联蛋白V结合缓冲液(10mM HEPES /氢氧化钠,pH值7.4; 140毫摩尔NaCl; 2.5mM的氯化钙 )。添加膜联蛋白V-FITC的制造商推荐的量和在室温下孵育15分钟。
- 用于流式细胞术的测量,添加200μl的膜联蛋白V结合缓冲液和核染剂1μM的。确定在绿色和紫色通道的荧光。膜联蛋白V + /核染液+细胞被定义为次级坏死和Annexin V + /核染剂-细胞被定义为凋亡细胞( 图5)。
- 定量分析脂肪细胞的RNA水平,以确定在缺氧条件下的稳态。
- 加以及异硫氰酸胍和苯酚到每个1毫升单相溶液和分离的RNA [使用由Chomczynski和Sacchi 17单步方法(步骤1.3.2)〕,并继续如步骤1.3.2.1)至1.3.5.2) 。
- 通过FITC标记的膜联蛋白V和随后的流式细胞仪分析分析细胞凋亡。
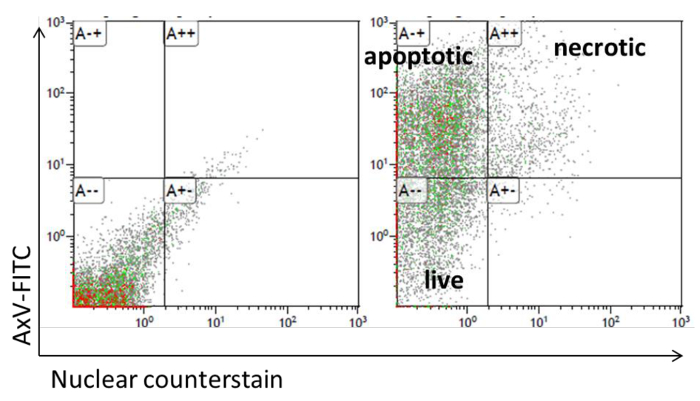
图5:用流式细胞仪脂肪细胞凋亡分析 。流式细胞仪膜联蛋白V-FITC和脂肪细胞的TO-PRO-3染色,点图介绍请点击此处查看该图的放大版本。
结果
我们显示如何使用的实例,以确定在体内和体外的脂肪细胞内稳态FRA-2 FL / FL与野生型同窝FABP4-CreERT小鼠。我们的协议定义了如何提高脂肪细胞的凋亡指示缺氧增加HIF表达与脂肪细胞的功能障碍有关。
增加脂肪细胞尺寸和面积在高脂肪饮食(HFD)的处理的小鼠
营养过剩,除其他因素外,导致脂肪细胞肥大引起的过多的能量存储在脂滴。脂肪细胞的尺寸和面积是肥大的指标。从正常的脂肪垫的区段(ND; 图6a)和高脂肪饮食(HFD; 图6b)小鼠以及脂肪细胞的尺寸和面积的quantifications清楚显示脂肪细胞6周后肥大HFD,第这是由增加的脂肪细胞大小在HFD处理的小鼠( 图6c和d)来表示。
在成人的脂肪组织(AT)的上升缺氧FRA-2 FL / FL FABP4-CreERT小鼠导致增加HIF-1α的水平和脂肪细胞的凋亡
以确定在AT缺氧的体内状态,FRA-2 FL / FL FABP4-CreERT小鼠在12周龄FRA-2缺失6周后进行分析,并与野生型同窝相比。 Pimonidazole施用给小鼠腹膜内作为有效缺氧标记;它是无毒的,并且能够分配到所述AT。在所述AT缺氧脂肪细胞在体内被免疫抗体染色( 图7a)限定。此外,在小鼠中的AT的增加的缺氧状态是伴随着增加HIF-1α阳性ADIP通过免疫组织化学染色图7b),这是由HIF-1α的表达水平和其靶基因9的定量确认所指示ocytes。此外,从FRA-2的AT切片的TUNEL染色FL / FL FABP4-CreERT小鼠和对照同窝( 图7c)示出了增加的脂肪细胞的凋亡与缺氧和HIF-1α表达的存在相关。
通过缺氧诱导的脂肪细胞凋亡增加初级脂肪细胞HIF-1α表达
分析脂肪细胞凋亡作用 ,我们使用来自皮下脂肪垫脂肪细胞产生的其他地方20所描述。正如所料,在脂肪细胞中的HIF-1α表达后缺氧( 图8a)中的24小时的增加。进一步分析,HIF-1α的活动,HIF靶的RNA水平基因如iNOS基因蛋白(诱导型一氧化氮合酶)通过qPCR定量。 图8B显示了HIF-1α的低氧条件下的表达增加导致增加的iNOS mRNA水平的水平。因为我们已经在体内 ( 图8),在脂肪细胞增加HIF-1α的表达具有增加的脂肪细胞的凋亡相关已经示出,凋亡也在体外培养物通过膜联蛋白V染色低氧条件下进行定量。 与体内数据( 图7)相一致,增加HIF-1α的水平是伴随着增加的脂肪细胞的细胞凋亡诱导的缺氧条件下( 图8b)。此外,为了证明缺氧诱导的细胞凋亡是HIF依赖性; HIF-1α或HIF-2α通过RNA干扰在从野生型或FRA-2缺陷型小鼠的脂肪细胞沉默。增加的脂肪细胞的细胞凋亡是由沉默HIF-1α或HIF-2α恢复如由膜联蛋白 V染色在图8b中,证明了低氧传感器HIF-α调节脂肪细胞的细胞凋亡。
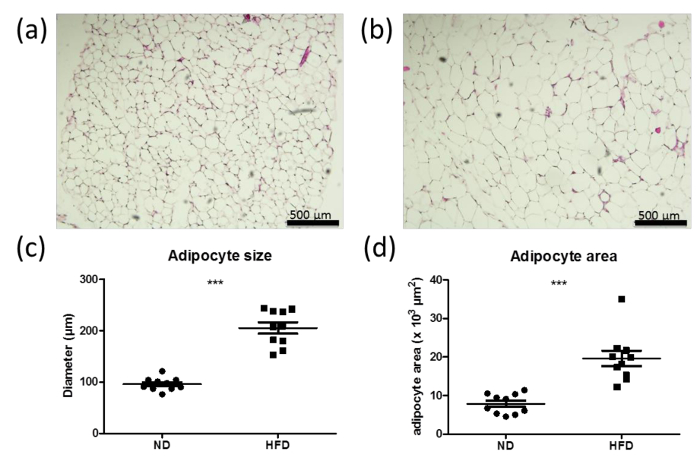
图6:提高在高脂肪饮食(HFD)的小鼠脂肪细胞尺寸和面积从与正常饮食(ND)供给雄性野生型小鼠的perigonadal脂肪垫部(A,B)的H&E染色(a)或高。 -fat饮食(HFD)(b)为6周。条代表500微米。 (C,D)从具有ND(a)或高脂饮食喂养6周(B)野生型小鼠的perigonadal脂肪垫的脂肪细胞大小(c)和区域(d)的Quantifications。每组10数据显示为平均值±SEM表示。使用Student's t检验进行统计分析。 *** P <0.0001。://www.jove.com/files/ftp_upload/53822/53822fig6large.jpg"目标="_空白">点击此处查看该图的放大版本。
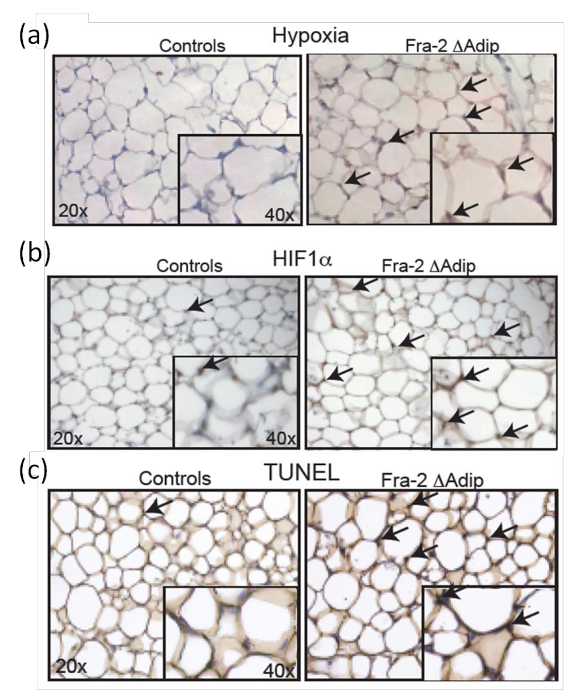
图7:增加HIF-1α水平和凋亡的FRA-2 FL / FL FABP4-CreERT 小鼠 成年脂肪细胞 。缺氧(a)和HIF-1α(b)以雄性FRA-2 FL / FL 6周后FABP4-creERT小鼠和雄性对照同窝三苯氧胺喷射的AT染色。放大倍数20X,40X插入。黑色箭头指示缺氧区和HIF-1α阳性的细胞。 ( 三 )TUNEL法FRA-2 FL / FL FABP4-CreERT小鼠和控制同窝AT他莫昔芬注射后6周。放大倍数20X,40X插入。黑色箭头表示TUNEL阳性细胞。这个数字已经从路德等修饰人9。 请点击此处查看该图的放大版本。
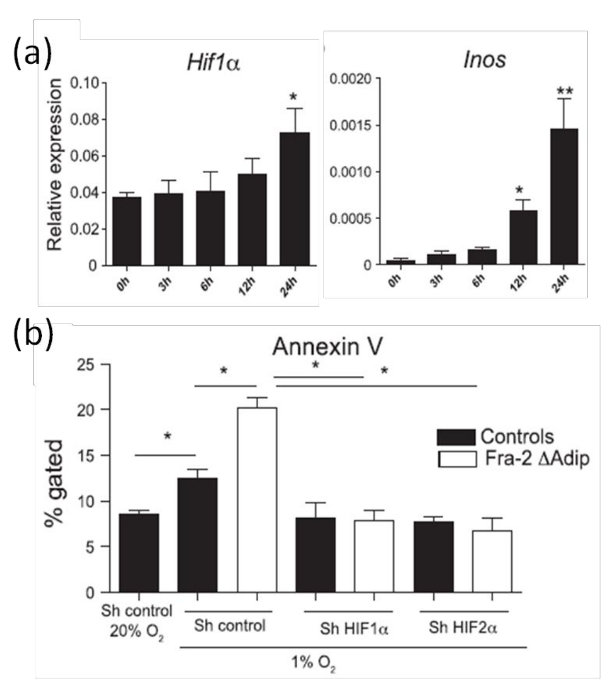
图8: 增加HIF-1α表达和脂肪细胞在缺氧诱导初级脂肪细胞的凋亡 ( 一 )HIF-1α和HIFs目标中iNOS mRNA水平放置在缺氧室原脂肪细胞的实时PCR分析来分析在指定的时间点。 (b)由在从分离的原代脂肪细胞膜联蛋白V FACS染色的细胞凋亡的定量FRA-2 FL / FL与SH对照或抗HIF-1α或HIF-2α的sh质粒转染和缺氧条件下放置FABP4-CreERT小鼠或野生型对照(1%O 2),24小时。这个数字已经从路德等修饰。 9。数据示±用斯氏t检验进行的SD统计分析作为平均值。 * P <0.05,** P <0.01被接受为显著。 请点击此处查看该图的放大版本。
讨论
脂肪细胞是由它们的尺寸,数量和面积表型特征,揭示脂肪细胞增生和肥大,由过多的能量存储诱导由于过度营养5。这些事件导致脂肪酸失调和随后的代谢综合征也与保存的代谢,其也被称为"健康的"脂肪扩张规定增加脂肪量。例如,Kusminski 等人 21表明,大规模的扩张胖老鼠保持健康的新陈代谢,表明脂肪扩张不一定与代谢综合征,需要慎重考虑来评估脂肪细胞的特性。脂肪组织(AT)起着机体代谢的调节了举足轻重的作用。 AT是最大的内分泌器官可能影响血脂异常,动脉粥样硬化,高胰岛素血症和高血糖3。评估AT稳态和分子米echanisms调节它可以允许更好地理解代谢系统疾病。因此,解开调节脂肪细胞分化机制,脂肪细胞的大小和脂肪垫质量,将有助于开发肥胖疾病新的治疗治疗。 使用体内 和体外方法,它能够确定的食物和基因表达的影响对脂肪细胞分化和活性的作用。来确定所述AT稳态,确定脂肪细胞分化,增殖和凋亡之间的平衡的建议由我们的协议是作为分析葡萄糖和胰岛素代谢反应22-24一样重要。
参与脂肪形成,脂肪生成,脂肪分解,脂肪酸的摄取,缺氧,细胞凋亡与增殖的主要脂肪细胞基因的表达谱分析和内脏AT是获得对脂肪细胞稳态和可能的功能障碍的概述的高通量方法。有趣的考生应在通过免疫印迹或免疫组织化学染色的蛋白水平进行进一步分析。使用非对称的花青染料获得通过实时PCR系统获得最佳效果,cDNA的取值范围为1至10毫微克的浓度和最佳引物浓度范围为50至900纳米应当进行测试,以最小化非特异性扩增。关键组件是引物;对于每次运行,熔解曲线需要进行严格的控制,以确保特异性和排除引物二聚体的形成。因此,建议使用用H 2 O代替cDNA的阴性对照。此外,市售不对称菁染料是作为包含一个被动参比染料(如ROX),以提供内部参考信号预混液。的cDNA的信号数据分析的ROX信号期间归纠正小康的好信号波动。另一点,以建立一个咕考虑ð定量PCR系统是看家基因的选择。对于各条件,几个持家基因的使用, 例如,HPRT,β 肌动蛋白 ,GAPDH,β-2微球蛋白或HSP90。
通过在低氧条件稳定HIF蛋白是主调节器确定不仅脂肪细胞的生存,但也代谢改变,如葡萄糖,胰岛素耐受性和脂质代谢11,25,26。为了确定在脂肪垫缺氧地区,HIF-1α是通过免疫组化的部分来确定英寸由于HIF蛋白含氧量正常条件下5至10分钟内迅速降解,该过程和脂肪垫的用于组织学分析的固定应严格控制,以避免等待时间。因此,不仅通过HIF染色确保缺氧,pimonidazole用于确定在AT缺氧区域。 Pimonidazole能够分配到组织中,因为它是在骨头27已经示出和有效地通过结合到特异性在低氧细胞含硫醇的蛋白质,其进一步在组织切片由特异性抗体结合28检测标记缺氧区域。然而,其他的标记物和方法可用于分析缺氧通路。例如,脯氨酰羟化酶(PHD)的酶,从而诱发在常氧脯氨酸残基的羟基化,以及希佩尔 - 林道(VHL)蛋白,其识别羟基脯氨酸和诱导多聚泛素介导的蛋白酶体HIF的参与退化,需要分析的通路29,30的完整概述。此外,HIFs无所不在检测也将确定蛋白质的稳定性和降解,可以改变31,32。
此外,通过Ki67的增殖和凋亡TUNEL染色在体内通过AT组织切片染色确定。通过Ki67和增殖的量化凋亡的影响TUNEL法或膜联蛋白V染色,通过流式细胞仪分析,也进行了33。增殖当然可以通过其它技术,如脂肪细胞的细胞周期,这是不通过的Ki67阳性细胞的测定处理物的分析测定。而且,可以完成用TUNEL凋亡研究膜联蛋白V和TOP-PR-3,其将确定坏死与细胞凋亡的细胞死亡过程的水平通过FACS分析。凋亡是细胞死亡的方案,这是对于AT稳态重要的基本过程。事实上,脂肪细胞凋亡的失调先前已在促进肥胖过程牵连脂肪代谢障碍34。此外,在2011年,Keuper 等挂钩脂肪组织炎症脂肪细胞凋亡。它们表明,巨噬细胞诱导的细胞凋亡中的前脂肪细胞和脂肪细胞,这反过来吸引巨噬细胞。巨噬细胞的招募加速炎症,从而对照ibutes代谢综合征例如葡萄糖和胰岛素耐受性35。然而,脂肪细胞凋亡仍然是一个研究的不良现象,尽管假设,即诱导脂肪细胞的凋亡可导致降低的重量。
本协议采用免疫组化方法来研究不同的现象,如在体内增殖,凋亡和缺氧。因此,将组织用4%的甲醛,这是一个关键步骤。延长组织固定时间导致改变的表位,这成为抗体不可访问的。相反,短的固定时间增加表位的给试剂的敏感性。固定的推荐最佳时间为24小时。此外,该部分的厚度也影响抗体结合到其表位;最佳厚度为2和5微米之间。部分超过5微米厚会由于增加的结合位点得到假阳性结果。相比之下,Sections薄于2μm的含有较少的结合位点和正面的区域没有得到很好的限定。进一步关键因素是所述抗体本身,孵育时间,浓度和温度均匀,这影响特异性结合的表位的质量。因此,验证抗体浓度和温育时间是必要的各条件。
为完成此研究中,我们提供了一种在体外脂肪细胞分化的协议,这可能是由不同的处理,刺激或共培养进行扩展。通过使用体外脂肪细胞培养物,它是可行的,以确定在脂肪细胞分化和功能的缺陷。为了获得可靠的结果,为所有原代细胞,脂肪干细胞的脂肪细胞和的健康行为和外观是非常重要的。粒度,细胞质vacuolations和/或脱离是恶化的迹象,表明不足介质,微生物污染或初级的衰老细胞。此协议是使用分离的脂肪细胞从脂肪垫组织,而其是也可以使用由其它协议36描述从骨髓中分离间充质干细胞。最新的包括间质祖细胞,这可能反映了脂肪细胞分化的非常早一步发生的额外分化的问题,这可能会在我们目前的协议被错过。此外,脂肪干细胞能够迅速地(在一周内的10倍以上)扩大,并且有些段落后长期培养的脂肪干细胞仍保持它们间质多能性37,38。使用脂肪干细胞的另一个优点是,可以很容易地切换到人体中,由于脂肪干细胞可以从患者通过吸脂这是一个简单的微创的方法进行收获。
作为以内分泌方式影响等几个器官,该协议应延长至脂肪细胞因子。脂肪因子,如瘦素,脂联素,肿瘤坏死因子α(TNF)一第二抵抗,脂肪细胞分泌的已知通过控制脂肪代谢,能量平衡和胰岛素敏感性39,影响代谢性疾病。因此,血清和脂肪细胞分泌组分析应该执行。在AT功能障碍,脂肪因子和促炎细胞因子,如IL-6的情况下,可导致器官失调如肝脏和胰腺和肌肉功能4。为了排除全身器官功能障碍,动物模型或细胞培养物可为他们的反应对葡萄糖刺激和摄取进行测试。
在这里,我们分析了AT和体内脂肪细胞的基本状态提供的协议并在体外以显示脂肪细胞内稳态和功能的分子机制。
披露声明
作者什么都没有透露。
致谢
笔者想感谢好心J.路德博士和K. Ubieta准备好数据和BGrötsch博士校对稿件。这项工作是由德意志研究联合会(BO3811 / 1-1-埃米诺特)的支持。
材料
| Name | Company | Catalog Number | Comments |
| RNAlater solution | Ambion | AM7021 | RNA stabilization solution |
| High-Capacity cDNA Reverse Transcription Kit | Applied Biosystems | 4368813 | |
| SYBR Select Master Mix | 4472908 | ||
| Purified Mouse Anti-Human Ki-67 | BD Biosciences | 550609 | Clone B56 (RUO) |
| Purified Mouse Anti-Human Ki-67 Clone B56 (RUO) | 550609 | Proliferation marker | |
| FITC Annexin V | BioLegend | 640906 | |
| Cleaved Caspase-3 Rabbit mAb | Cell signalling | 9664S | Clone 5A1E |
| Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb | 9664 | Apoptosis marker | |
| Lipofectamine2000 Reagent | Invitrogen | 11668-027 | |
| TO-PRO-3 Iodide | T3605 | Nuclear counterstain, Monomeric cyanine nucleic acid stain, Excitation⁄Emission: 642⁄661 nm | |
| Mayer’s hemalum | Merck | 109249 | hematoxylin |
| pegGOLD TriFast | Peqlab | 30-2030 | TRIzol, single-phase solution of guanidine isothiocyanate and phenol |
| Percellys Ceramic Kit 1.4 mm | 91-PCS-CK14 | tubes containing ceramic beads (1.4 mm) | |
| Precellys 24 | 91-PCS24 | homogenizer | |
| HIF-1 alpha Antibody | Pierce | PA1-16601 | |
| HIF-1 alpha Antibody, 16H4L13 | 700505 | Hypoxia marker | |
| In Situ Cell Death Detection Kit, Fluorescein | Roche | 11 684 795 001 | TdT-mediated dUTP-biotin nick end labeling (TUNEL) |
| Eosin | Sigma | 318906 | |
| DNase I Solution (1 unit/µl) | Thermo Scientific | EN0525 | |
| biotinylated anti mouse IgG (H+L) | Vector Laboratories | BA-9200 | |
| biotinylated anti mouse IgG (H+L) | BA-1000 | ||
| Vectastain ABC Kit | PK-4000 | ||
| VECTASHIELD Mounting Medium with DAPI | H-1200 |
参考文献
- Obesity and Overweight. Fact Sheet °113. WHO. , (Jan 2014) (2014).
- Gong, Z., Muzumdar, R. H. Pancreatic function, type 2 diabetes, and metabolism in aging. Int J Endocrinol. , 320482(2012).
- Deng, Y., Scherer, P. E. Adipokines as novel biomarkers and regulators of the metabolic syndrome. Ann N Y Acad Sci. 1212, 1-19 (2010).
- Rezaee, F., Dashty, M. Role of Adipose Tissue in Metabolic System Disorders Adipose Tissue is the Initiator of Metabolic Diseases. J Diabetes Metab. , 008(2013).
- Rutkowski, J. M., Stern, J. H., Scherer, P. E. The cell biology of fat expansion. J Cell Biol. 208, 501-512 (2015).
- Ma, X., Lee, P., Chisholm, D. J., James, D. E. Control of adipocyte differentiation in different fat depots; implications for pathophysiology or therapy. Front Endocrinol (Lausanne). 6, 1(2015).
- Farmer, S. R. Transcriptional control of adipocyte formation. Cell Metab. 4, 263-273 (2006).
- Luther, J., et al. Elevated Fra-1 expression causes severe lipodystrophy. J Cell Sci. 124, 1465-1476 (2011).
- Luther, J., et al. Fra-2/AP-1 controls adipocyte differentiation and survival by regulating PPARgamma and hypoxia. Cell Death Differ. , (2014).
- Semenza, G. L. Regulation of mammalian O2 homeostasis by hypoxia-inducible factor 1. Annu Rev Cell Dev Biol. 15, 551-578 (1999).
- Kim, W., Kaelin, W. G. The von Hippel-Lindau tumor suppressor protein: new insights into oxygen sensing and cancer. Curr Opin Genet Dev. 13, 55-60 (2003).
- Aragones, J., Fraisl, P., Baes, M., Carmeliet, P. Oxygen sensors at the crossroad of metabolism. Cell Metab. 9, 11-22 (2009).
- Sun, K., Halberg, N., Khan, M., Magalang, U. J., Scherer, P. E. Selective inhibition of hypoxia-inducible factor 1alpha ameliorates adipose tissue dysfunction. Mol Cell Biol. 33, 904-917 (2013).
- Imai, T., Jiang, M., Chambon, P., Metzger, D. Impaired adipogenesis and lipolysis in the mouse upon selective ablation of the retinoid X receptor alpha mediated by a tamoxifen-inducible chimeric Cre recombinase (Cre-ERT2) in adipocytes. Proc Natl Acad Sci U S A. 98, 224-228 (2001).
- Clegg, D. J., Brown, L. M., Woods, S. C., Benoit, S. C. Gonadal hormones determine sensitivity to central leptin and insulin. Diabetes. 55, 978-987 (2006).
- Haluzik, M., et al. Genetic background (C57BL/6J versus FVB/N) strongly influences the severity of diabetes and insulin resistance in ob/ob mice. Endocrinology. 145, 3258-3264 (2004).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical biochemistry. 162, 156-159 (1987).
- Paraffin Processing of Tissue. Protocolsonline. , Available from: http://protocolsonline.com/histology/sample-preparation/paraffin-processing-of-tissue/ (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9, 671-675 (2012).
- Planat-Benard, V., et al. Plasticity of human adipose lineage cells toward endothelial cells: physiological and therapeutic perspectives. Circulation. 109, 656-663 (2004).
- Kusminski, C. M., et al. MitoNEET-driven alterations in adipocyte mitochondrial activity reveal a crucial adaptive process that preserves insulin sensitivity in obesity. Nat Med. 18, 1539-1549 (2012).
- Trajcevski, K. E., et al. Enhanced lipid oxidation and maintenance of muscle insulin sensitivity despite glucose intolerance in a diet-induced obesity mouse model. PLoS One. 8, 71747(2013).
- Montgomery, M. K., et al. Mouse strain-dependent variation in obesity and glucose homeostasis in response to high-fat feeding. Diabetologia. 56, 1129-1139 (2013).
- de Queiroz, K. B., et al. Molecular mechanism driving retroperitoneal adipocyte hypertrophy and hyperplasia in response to a high-sugar diet. Mol Nutr Food Res. 58, 2331-2341 (2014).
- Ye, J. Emerging role of adipose tissue hypoxia in obesity and insulin resistance. Int J Obes (Lond). 33, 54-66 (2009).
- Xiong, Y., et al. The local corticotropin-releasing hormone receptor 2 signalling pathway partly mediates hypoxia-induced increases in lipolysis via the cAMP-protein kinase A signalling pathway in white adipose tissue. Mol Cell Endocrinol. 392, 106-114 (2014).
- Bozec, A., et al. Osteoclast size is controlled by Fra-2 through LIF/LIF-receptor signalling and hypoxia. Nature. 454, 221-225 (2008).
- Varia, M. A., et al. Pimonidazole: a novel hypoxia marker for complementary study of tumor hypoxia and cell proliferation in cervical carcinoma. Gynecol Oncol. 71, 270-277 (1998).
- Park, M. H., Choi, K. Y., Jung, Y., Min do, S. Phospholipase D1 protein coordinates dynamic assembly of HIF-1alpha-PHD-VHL to regulate HIF-1alpha stability. Oncotarget. 5, 11857-11872 (2014).
- Tennant, D. A., et al. Reactivating HIF prolyl hydroxylases under hypoxia results in metabolic catastrophe and cell death. Oncogene. 28, 4009-4021 (2009).
- Kim, J., So, D., Shin, H. W., Chun, Y. S., Park, J. W. HIF-1alpha Upregulation due to Depletion of the Free Ubiquitin Pool. Journal of Korean medical science. 30, 1388-1395 (2015).
- Amelio, I., et al. TAp73 opposes tumor angiogenesis by promoting hypoxia-inducible factor 1alpha degradation. Proceedings of the National Academy of Sciences of the United States of America. 112, 226-231 (2015).
- Suga, H., et al. Adipose tissue remodeling under ischemia: death of adipocytes and activation of stem/progenitor cells. Plast Reconstr Surg. 126, 1911-1923 (2010).
- Moreno-Indias, I., Tinahones, F. J. Impaired adipose tissue expandability and lipogenic capacities as ones of the main causes of metabolic disorders. J Diabetes Res. 2015, 970375(2015).
- Keuper, M., et al. An inflammatory micro-environment promotes human adipocyte apoptosis. Mol Cell Endocrinol. 339, 105-113 (2011).
- Sera, Y., et al. Hematopoietic stem cell origin of adipocytes. Experimental hematology. 37, 1108-1120 (2009).
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue engineering. 7, 211-228 (2001).
- Zuk, P. A., et al. Human adipose tissue is a source of multipotent stem cells. Molecular biology of the cell. 13, 4279-4295 (2002).
- Scherer, P. E. Adipose tissue: from lipid storage compartment to endocrine organ. Diabetes. 55, 1537-1545 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。