Method Article
在微孔聚集尺寸优化人类多能干细胞的基于悬浮心脏分化
摘要
常规的方法以引发人多能的悬浮聚合基于心脏分化干细胞(hPSCs)的困扰与培养异质相对于聚集体的尺寸和形状。在这里,我们描述了采用微孔产生大小控制HPSC心脏推进的条件下培养聚集心脏分化一个可靠的方法。
摘要
Cardiac differentiation of human pluripotent stems cells (hPSCs) is typically carried out in suspension cell aggregates. Conventional aggregate formation of hPSCs involves dissociating cell colonies into smaller clumps, with size control of the clumps crudely controlled by pipetting the cell suspension until the desired clump size is achieved. One of the main challenges of conventional aggregate-based cardiac differentiation of hPSCs is that culture heterogeneity and spatial disorganization lead to variable and inefficient cardiomyocyte yield. We and others have previously reported that human embryonic stem cell (hESC) aggregate size can be modulated to optimize cardiac induction efficiency. We have addressed this challenge by employing a scalable, microwell-based approach to control physical parameters of aggregate formation, specifically aggregate size and shape. The method we describe here consists of forced aggregation of defined hPSC numbers in microwells, and the subsequent culture of these aggregates in conditions that direct cardiac induction. This protocol can be readily scaled depending on the size and number of wells used. Using this method, we can consistently achieve culture outputs with cardiomyocyte frequencies greater than 70%.
引言
在体外细胞培养可以在若干方式来进行,但通常是在二维粘附条件下或在三维悬浮条件, 在体内系统更充分地概括进行。因此有在研究许多领域有增多的趋势,开发用于产生三维组织构建稳健方法。在细胞类型和过程需要一个支持细胞外基质(ECM)的表面和粘合信号方案,三维培养物可通过脚手架构建体,其中细胞培养上或外源支撑基质1被启用。细胞和过程不要求到一个支持性基质的粘附可以在悬浮液作为主要或专门细胞(然后它可进行到产生自己的内源矩阵)2,3构成unscaffolded系统来进行。在这里,我们提出了心脏分化邻协议˚F人多能干细胞(hPSCs - 源于胚胎或其他来源能够变成在体内的任何细胞类型的细胞,无论是)的大小控制的,均匀的,unscaffolded聚集体。
hPSCs悬浮聚集的分化是由两个内运行和运行之间的骨料粒径大的变化的困扰。这种变化典型地是用于产生这些聚集体的方法,其中涉及细胞集落的机械解离的结果。为了减少这种可变性,已经使用许多方法来控制每个聚集体的细胞数,以及聚集体直径和均匀性。实例包括形成聚集在离心管4或者作为悬挂滴5,图案化限定二维HPSC菌落6然后可以传输到悬浮液中,或细胞的离心分离成U或V形底的多孔板7,8 9。然而,所有这些APPRoaches由其总代的吞吐量较低的限制。好为基础的系统使用类似的方法来V形底板系统,然而微孔的小尺寸(在这个协议中,每个具有400微米的宽度),使较大的均匀的聚集体的数目的产生从单个培养板孔比将从整体V型底板10中产生(的〜含15.5毫米〜1200微孔标准口径)。以及基于聚集体的形成已在许多设置包括hPSCs分化被用来外胚层11,内胚12,中胚层13和胚外14命运;间充质干细胞软骨15;代毒理学筛查16均匀基板;和力学生物学17调查。
在开发强大的制造协议,生产HPSC衍生cardiom的一个重大挑战yocytes一直缺乏运行之间的心脏分化效率的重现性。我们以前表明,这种变化可以在开始HPSC人口,包括表达与内胚层和神经分化6,18相关的基因都自我更新的hPSCs和分化细胞归因于异质性。这些分化细胞分泌的信号影响心脏感应。具体来说,胚外内胚层促进心脏感应,而神经祖细胞抑制心肌细胞的诱导。在HPSC聚集,聚集分化中的细胞和组织,使得未分化hPSCs是由聚合表面13上开发胚外内胚层细胞层包围。通过控制聚集体尺寸,就可以调节心脏诱导内胚层细胞向未分化hPSCs(表面积与体积之比)的比例和优化该比对最大心脏感应13。
研究方案
1.培养基成分制备
- 准备洗涤介质。每100毫升的DMEM / F12的,加入1ml 100×青霉素/链霉素(青霉素/链霉素)的1毫升100倍的L-谷氨酰胺和5毫升血清更换。
- 根据制造商的说明制备化学上确定的基础心肌诱导培养基。
- 准备以下股票试剂媒体表示,将在本协议中使用。
- L型抗坏血酸:在锥形管中准备的5毫克每毫升的储备溶液在4℃,无菌超纯蒸馏水。
- 离开在冰上该溶液中,周期性地涡管,直到溶质完全溶解。过滤-消毒用0.22微米注射器过滤器的抗坏血酸溶液。
- 制备抗坏血酸溶液的1ml等份和这些等分试样在-20℃下储存。使用新鲜解冻等分试样每次培养基制备。
- 在媒体准备的一天,在1毫升心脏基础诱导培养基中稀释13微升一硫代(MTG)的。丢弃未使用的稀释MTG。
- 制备转(30毫克/毫升)的1ml等份在-20℃储存。储存在4℃下解冻等分长达3个月。
- 制备含有0.1%牛血清白蛋白(BSA)4mM的盐酸(HCl)。在通风橱中,加入30微升的6.0当量盐酸溶液至50ml超纯蒸馏水。过滤-消毒用0.22微米注射器过滤该溶液。加入2ml 25%BSA溶液加到50ml的HCl溶液。
- 制备含有0.1%BSA磷酸缓冲盐水(PBS)中。加入20μl的每毫升PBS中的25%BSA溶液。
- 准备人骨形态发生蛋白4(BMP-4)原液(10毫微克/微升)。溶解为10μg冻干的BMP-4的1ml的含有0.1%BSA的4mM HCl缓冲溶液。制备50微升等分试样在-20℃储存。
- 准备人类成纤维细胞生长因子2(bFGF)的原液(10毫微克/微升)。在含有0.1%BSA1毫升磷酸盐缓冲盐水(PBS)中溶解为10μg冻干的bFGF。制备50微升等分试样在-20℃储存。
- 准备人血管内皮生长因子(VEGF)原液(5纳克/微升)。溶解5微克冻干VEGF在1ml的PBS含有0.1%BSA。制备50微升等分试样在-20℃储存。
- 准备激活素原液(10毫微克/微升)。溶解10微克在1ml PBS中冻干活化素A含有0.1%牛血清白蛋白(BSA)。制备50微升等分试样在-20℃储存。
- 制备的Wnt生产-2(IWP-2)储备溶液(10毫摩尔)的抑制剂。溶解2mg的IWP-2在429微升二甲基亚砜(DMSO)中。制备10微升等分试样在-80℃下储存。
- L型抗坏血酸:在锥形管中准备的5毫克每毫升的储备溶液在4℃,无菌超纯蒸馏水。
- 准备完整的心脏诱导培养基。到100ml基础心肌诱导培养基的,加入1ml 100×青霉素/链霉素的1毫升100倍的L-谷氨酰胺,500微升转的,1毫升刚解冻的抗坏血酸,和300微升的MTG。丢弃未使用的网上平台。
2.微孔板的制备
注意:所有步骤应在生物安全柜中进行。
- 将0.5ml漂洗溶液(盒成分),这将在平板上可使用每个孔中。以确保该溶液接触各微孔内的整个面上,离心板在840×g离心2分钟。
- 将培养板在室温30〜60分钟。
- 从孔中吸出漂洗溶液。在840×g离心2分钟1ml的PBS添加到各孔中,离心平板,然后吸出PBS:洗各孔两次如下。
3. HPSC形成聚集体的微孔板
注意:所有步骤应在生物安全柜中进行。
- 将洗涤介质在37℃水浴。
注:卷所需马力井= 1毫升×号SC将解离。 - 分离hPSCs单细胞
注意:这些步骤描述6孔板中培养细胞的分离 - 试剂卷可以按比例对不同的文化形式进行缩放。- 从每个HPSC培养以及用于解离吸出培养基。用1ml解离酶的冲洗每个孔,然后立即吸来自每个解离酶良好。
注:残余离解酶应足以解离的细胞。 - 孵育在37℃的板3分钟。
- 1毫升洗涤介质添加到每个孔中,并通过用P1000移液器在组织培养表面吹打洗涤介质机械解离从组织培养表面上的细胞。如果离解似乎是不完整的,细胞团块保持,通过在这点上一个过滤通过悬浮液中。
- 细胞悬液转移到15毫升锥形管中并储存在孵化器中的管,而细胞计数在下一步骤中进行。
- 进行细胞计数:
- 采取在前面步骤中收集的细胞悬浮液的10微升样品。加入30微升台盼蓝和吹打混合悬挂好。
- 转移10微升台盼蓝染色的细胞对血球的各腔室,并与10倍物镜的倒置显微镜下可视化。计数细胞。
- 从细胞计数结果,计算有多少井可以在每微孔板的井1.2×10 6个细胞接种。计算所需的聚合中的种子细胞以每孔1毫升
- 准备集合中。每10毫升完整心脏诱导培养基,加入0.5微升BMP4原液(终浓度= 0.5纳克/毫升)和Y-27632 ROCK抑制剂(最终浓度=10μM)。
- 删除含有从孵化器和centrifu的hPSCs锥形管GE的管中,在200×g离心5分钟。吸出洗涤介质和悬浮在聚合介质中的细胞以每毫升1.2×10 6个细胞的密度。
- 吸从微孔板的每个孔的PBS洗涤溶液中。使用P1000移液器,均匀地分布和种子将1ml细胞悬浮液以每孔在微孔板。种子的大量井,周期性地涡细胞悬浮液,以防止沉降。
- 离心板在200×g离心5分钟。观察在显微镜下板以确认细胞已纺成各微孔的底部。
- 在一个5%CO 2,5%O 2( 缺氧 )培养箱培养24小时的板在37℃。
- 从每个HPSC培养以及用于解离吸出培养基。用1ml解离酶的冲洗每个孔,然后立即吸来自每个解离酶良好。
4.心脏感应第1阶段
- 一天以下聚合(第1天),制备第1阶段诱导介质的需要的体积(对于24孔板孔中,体积= 1毫升×号)。 1毫升完整心肌诱导培养基中,添加1微升BMP4原液(最终浓度= 10毫微克/毫升),0.5微升的bFGF原液(最终浓度= 5纳克/毫升),和0.6微升活化素A(终浓度= 6纳克/毫升)中。放置在37℃水浴中的介质为至少15分钟。
- 从孵化器中取出微孔板。检查显微镜下聚集体。比起立时离心机后聚集,他们应该会出现完整的边缘平滑(更圆,较前一交易日平方米以下)。
- 而不干扰微孔内的聚集体除去上清:
- 横握微孔板水平( 即 ,不能倾斜)。每孔上微孔板,放置P1000移液器的尖端在培养基的表面上,并针对井的边缘。
- 慢慢松开介质,小心不要在微孔底部扰乱聚集。减少to后他介质水平以从该纹理化微孔表面约1至2毫米,慢慢倾斜板在井(一侧收集介质后的体积是足够低的,流体运动大大降低,这是更容易避免聚集体得到解除他们的个人微孔)。慢慢吸取出在阱剩余介质。
- 要添加新的阶段1诱导培养基,同时确保骨料留在自己的个人微孔:绘制1阶段诱导培养基毫升用P1000微量。持枪头靠在孔的内侧边缘和非常缓慢地分配对井的内壁的介质。重复其余孔中。
- 返回板的孵化器低氧条件下3天。
5.心脏感应阶段2
- 在第4天,地点洗涤介质在37℃的水浴(体积=数井×2毫升)中至少15分钟。
- 准备阶段2诱导培养基(体积=井×1毫升数)的必要量:每毫升完整心脏诱导培养基,加入2微升的VEGF的储液(最终浓度= 10毫微克/毫升)和0.5微升IWP-2储备溶液(最终浓度= 5微米)。放置在37℃水浴中制备的第2阶段的诱导培养基中至少15分钟。
- 使用5ml的血清吸管,从微孔板的每个孔收获聚集体,并收集在15毫升的总悬浮液的锥形管(收集高达每15ml试管10孔)。
- 允许聚集在缺氧培养箱沉降15分钟。
注:该步骤是重要的,以单细胞和细胞碎片从完整聚集体中分离出来。 - 小心吸出上清液和重悬在10毫升的预温洗涤介质的聚集体以除去残余的电感的细胞因子( 例如 ,激活素A是即使在非常低共一个有力的信号分子ncentrations)。
- 离心的聚集体,在50×g离心2分钟。吸出上清液。重悬在预温热诱导2中的丸状聚集体。
- 以每孔1毫升转移聚合悬浮液至24孔超低附件(ULA)板。观察显微镜均匀,致密细胞簇下的聚集。 缺氧条件下孵育直到下午6一天。
6.心脏诱导第3阶段
- 在第6天,制备第3阶段诱导培养基(体积=井×1毫升数)的必要量。 1毫升完整心脏诱导培养基,加入2微升的VEGF原液(最终浓度= 10毫微克/毫升),和0.5微升的bFGF原液(最终浓度= 5纳克/毫升)。放置在37℃水浴中制备第3阶段诱导培养基为至少15分钟。
- 使用5ml的血清吸管到聚集体转移到15ml锥形管中,汇集高达10毫升聚合每人S管。
- 允许聚集体沉降10分钟。吸出上清液,并在预热阶段3诱导培养基悬浮聚集体。使用5毫升血清吸管,重新分配聚集成一个24孔ULA板,每孔1毫升
- 在第10天,制备第3阶段诱导培养基如每步6.1(体积=井×1毫升数)的必要量。
- 使用5ml的血清吸管到聚集体转移到15ml锥形管中,汇集高达10毫升,每管集合体。
- 允许聚集体沉降10分钟。吸出上清液,并在第3阶段诱导培养基悬浮聚集体。使用5毫升血清吸管,重新分配聚集成一个24孔ULA板,每孔1毫升
- 在低氧条件下孵育两天。在第12天,开始在含氧量正常的氧含量孵育细胞的培养期间的剩余(37℃,20%O 2,5%的CO 2)。
注意:该时间点后,将细胞不再低氧条件下培养。 - 重复此完全培养基交换(步骤6.2和6.3),每4天,开始14天直到收获细胞(通常是心肌峰值浓度分化的第14天观察后)。
心肌肌钙蛋白T(cTnT)的微孔文化输出的频率表达7.流式细胞仪分析
- 解离的聚集体如下:
- 使用5ml的血清吸管1以及聚集体转移到15毫升锥形管中。离心的聚集体,在50×g离心2分钟,并小心地吸出上清液。
- 1毫升新鲜溶解1毫克/毫升胶原酶II型溶液加入到聚集体。转移聚合悬浮到1.5ml微量离心管中。孵育在胶原酶II聚集物在室温下过夜。
- 次日,使用P1000移液器轻轻分离骨料成均匀的单细胞悬浮液。如果聚集体不容易解离,沉降聚集体,吸出上清液,并孵育在700微升解离酶的聚集体为1至2分钟,在室温。轻轻地用P1000移液器以解离吸取聚集体1至2次。
- 稀释的离解酶:添加700μl的洗涤介质的含有14微升的1毫克/毫升DNA酶原液。取10微升样品在300 xg离心进行细胞计数,并离心使用台式微量剩余的悬浮液2分钟。
- 进行细胞计数:用等体积的台盼蓝的染色10微升计数样品并用血细胞计数器计数。
- 删除包含从离心剩余的细胞1.5 ml离心管。吸出上清液,重悬细胞,以每100微升200,000至500,000个细胞的浓度,在Hanks平衡盐溶液含2%胎牛血清(HF)。
- 对于各条件,转移细胞悬液每孔100μl到2孔96孔板(一个孔将与cTnT的抗体染色,并另将二级抗体对照)。
- 离心板在300×g离心2分钟。删除与多通道移液器将上清液。
- 固定细胞:加入200μl每孔固定溶液(试剂盒成分)和孵化板在室温下15分钟。
- 离心板在300×g离心2分钟。使用多通道移液器从孔中小心撤回上清液。在处置一个多聚甲醛废物容器上清。
- 洗固定细胞两次:添加200μl的HF与每个孔中。离心板在300×g离心2分钟。吸出上清液,并重复该洗涤步骤一次。固定的细胞可以在4℃保存用于在高频长达一周。
- 通透的单元格:
- 离心300板xg离心2分钟。
- 添加100μl的透液(试剂盒成分)到每个孔中,并孵育在室温下将板5分钟。
- 离心板在300×g离心2分钟,吸出上清液。
- 在对于给定批号的最佳浓度制备抗肌钙蛋白T短波一个主混合物(最佳稀释必须通过滴定来确定,并且通常范围从1:500至1:2000)。
- 每个条件(每个条件2孔),添加100微升主混合物到一个孔(染色样本)和100微升纯HF与其他井(二次抗体对照)。孵育细胞在4℃下进行30分钟。
- 离心细胞,在300×g离心2分钟。吸上清,每孔加入200微升HF的。重复该洗涤步骤一次。
- 制备二级抗体的一个主混合物。转移HF的体积对应于100微升的每个井(二次抗体的控制和肌钙蛋白染色)正在接受治疗。加入1μl每200微升的HF的山羊抗小鼠-APC第二抗体(1:200稀释)。
- 染色样品。加入100μl的染色溶液至每孔(两个次级抗体对照和抗肌钙蛋白染色孔)。孵育细胞在黑暗中在4℃下进行30分钟(保持覆盖的板或在黑暗中加入荧光二级抗体后,以避免光漂白)。
- 离心细胞,在300×g离心2分钟。吸上清,每孔加入200微升HF的。重复该洗涤步骤一次。
- 转移样品至5毫升圆底流式细胞仪分析管,并使用标准协议为仪器19中的APC通道流式细胞执行对信号流。
结果
hPSCs的大小控制的聚集体可以有效地利用微孔系统中,仅取决于细胞的浓度和微孔的表面积来形成。以下一个短暂离心,将细胞的适当的数字(1000在这个协议)在每个微孔( 图1A)汇聚。重要的是,这些细胞重新建立连接内24小时之内,不应再填写好,但表现为边缘光滑( 图1B)紧凑聚集。这些聚集提供了对心脏的命运进一步分化的原料。如果细胞不能形成紧密的簇,这表明如下的解离和再聚集可能的细胞死亡,和单细胞传代和ROCK抑制剂浓度的对特定细胞系的适宜应检查。以下三天显示微孔合计形态变化不大呆呆,虽然有些增长是显而易见的。当从微孔移除,聚集体应保持其圆形,紧凑的形态并成为一个类似尺寸彼此( 图1C)的。在ULA 24孔板培养将允许进一步细胞扩增和生长。
由第8天,暴露第一至活化素信号传导,和Wnt抑制后,聚集体将开始显示为更大和更亮的聚集体( 图1D)。在此期间,相当大的细胞碎片将在每个孔的底部明显,并且必须通过允许聚集体去除介质之前沉降除去。偶尔,许多聚集会融合在一起。这不会抑制在阱其他聚集体的分化,虽然这些"超级集合"倾向于不呈现具有较小的聚集体看到的形态变化,而且不太可能经历完整的分化。
"jove_content"FO:保持-together.within页="1">续分化导致具有增加的大小和有组织的纤维区域的外观显着的形态变化到聚集体。通过12天收缩聚集体可以观察到。这些将始终由大,透明细胞和通常包括集合体( 图2)的外广泛的细胞外基质。而聚合的全收缩指示成功分化,心脏标志物的表达,也可以在不出现收缩聚集体观察。以下聚集体和免疫标记的离解,一大部分细胞将是积极为心肌细胞标记物的cTnT通过流式细胞术( 图3)。此标记的表达是在细胞中稳定,并且可以在聚集体迟分化第19天被观察到。
1.JPG"/>
图1:HPSC的时间轴朝心脏命运分化汇聚后,立即细胞几乎占满每个微孔(A)。一天后,这些聚集体出现冷凝和光滑(B)。即使当聚集体从微孔取出并铺板于孔板(C)的这种形态存在。由第8天,聚集体开始膨胀,并且出现在色(D)的打火机。比例尺:250微米请点击此处查看该图的放大版本。
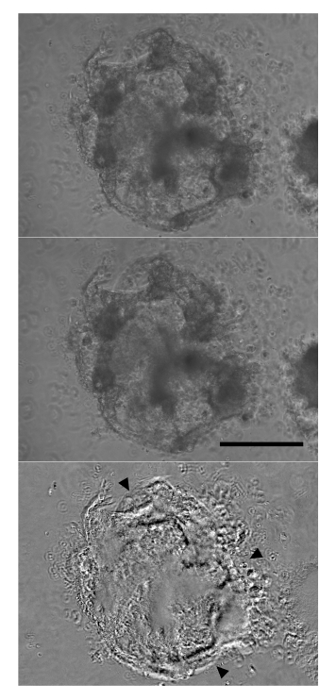
图2:聚集由分化的第12天开始缔约心脏诱导阶段3培养基六天,观察有力骨料全收缩后(上图:放松通货膨胀,中间面板:收缩)。下部面板从减去上部和中部板衍生出来的,表现为黑色或白色(箭头)最显著差异。比例尺:250微米请点击此处查看该图的放大版本。
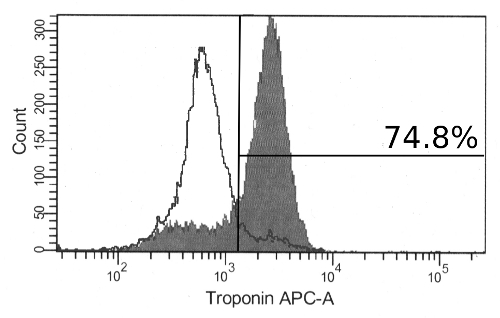
图3:免疫标记的心肌肌钙蛋白T在分化hPSCs 17岁的一天,大部分细胞呈阳性,流式细胞仪(填充柱状图)肌钙蛋白T。同时显示只用二抗(未填充柱状图)染色的细胞。 请点击此处查看该图的放大版本。
讨论
已经观察到该多能干细胞的有效心脏分化是高度可变的过程。虽然这是不奇怪的不同的细胞系表现出分化能力的特定细胞类型不同的倾向,已观察到心脏分化效率使用相同的细胞系6次复制之间急剧波动。这里所描述的协议通过直接控制每个聚集体的输入细胞数解决了这个变异性的一个主要来源。为了进一步降低运行间变异性,则建议适于单细胞传代HPSC线被使用,因为这种形式的更一致的多潜能的人群相对于多能性标记的表达频率( 例如 ,Oct4的,Nanog的HPSC扩展和维护的结果, TRA-1-60, 等 )。
这里写的协议规定1000细胞邻的骨料粒径ptimal心脏感应从HES-2胚胎干细胞系。应用此协议不同的细胞系,这是至关重要的初始聚集体尺寸屏幕来执行,以确定细胞系特异性最佳聚集体尺寸。虽然它没有直接影响的程序在这里随后,我们提醒改变在聚集体尺寸和整体细胞密度预期影响氧气输送读者。这可能会成为在下游应用相关的考虑因素。此外,凋亡性细胞死亡是hPSCs到单个细胞的解离过程中一个问题。因此,重要的是确保ROCK抑制剂是在微孔被迫细胞聚集过程中存在。最后,这是至关重要的分化第4天的聚集体是公洗涤以除去痕量活化素A,存在于感应1培养基,在诱导2培养基再悬浮之前。分化的第4天之后,激活素A促进内胚层分化在中观的代价真皮感应20。
该技术的主要应用是筛选促进高效心脏分化聚集体尺寸。然而,目前的技术的局限性之一是,它是具有挑战性的比例心脏生产使用微孔板临床相关水平。心脏分化的规模达在搅拌的生物反应器21批量培养条件下典型地进行。因此,一旦微孔系统已被用于确定可接受的聚集体尺寸的范围为高效心脏感应,下一步扩大规模是确定生物反应器叶轮的速度,可以产生所需的细胞聚集体尺寸。
一个这种技术相对于其它方法用于基于聚合心脏分化的显著差异是,它使直接调查调制在聚集体的内源信号的影响以及在集合体13感应/抑制组织类型与hPSCs的共培养。这些类型的调查可以通知大规模心动生产工艺开发。
披露声明
M.U. has a financial interest in the underlying microwell technology.
致谢
We thank Dr. Peter Zandstra, in whose laboratory this protocol was developed, and Drs. Mark Gagliardi and Gordon Keller who provided assistance in establishing the initial methods on which this process was based. Protocol development was supported by an Ontario Graduate Scholarship in Science and Technology to C.B. and a grant from the Heart and Stroke Foundation of Ontario to Peter Zandstra.
材料
| Name | Company | Catalog Number | Comments |
| Biological safety cabinet | |||
| Pipette aid | |||
| Serological pipettes (5 to 25 ml) | |||
| Aspirator | |||
| Aspirator or Pasteur pipettes | |||
| 15 and 50 ml conical tubes | |||
| Fume hood | |||
| 0.22 µm syringe filter | |||
| 5% CO2, 5% O2, and humidity controlled cell culture incubator | Hypoxic (low oxygen) incubator | ||
| 5% CO2, 20% O2, and humidity controlled cell culture incubator | |||
| Low speed centrifuge with a swinging bucket rotor fitted with a plate holder | |||
| P2, P20, P200, and P1000 micropipettors and associated tips | |||
| Inverted microscope with 4X, 10X and 20X phase objectives | |||
| Ultra-Low Attachment (ULA) 24 well plates | Corning/Costar | 3473 | |
| 1.5 ml microcentrifuge tubes | |||
| Bench-top microcentrifuge | |||
| L-Ascorbic Acid | Sigma-Aldrich | A4403 | |
| Sterile Ultrapure distilled water | Sigma-Aldrich | W3500 | |
| Vortex | |||
| Ice | |||
| -20 °C freezer | |||
| Monothioglycerol | Sigma-Aldrich | M6145 | Toxic; Aliquoting of MTG is strongly recommended to minimize oxidation due to repeated opening. Aliquots can be stored at 4 °C for up to 3 months, -20 °C is recommended for long-term storage. |
| StemPro-34 Medium | Thermo Fisher Scientific | 10639-011 | Basal Cardiac Induction Medium; The supplement is stored at -20 °C and the basal medium at 4 °C. |
| Transferrin | Roche | 10652202001 | |
| BMP-4 | R&D Technologies | 314-BP | |
| bFGF | R&D Technologies | 233-FB | |
| VEGF | R&D Technologies | 293-VE | |
| Activin A | R&D Technologies | 338-AC | |
| IWP-2 | Reagents Direct | 57-G89 | |
| Phosphate buffered saline (PBS) | Thermo Fisher Scientific | 14190 | |
| Bovine Serum Albumin (BSA) | Thermo Fisher Scientific | 15561 | |
| Hydrochloric acid | Sigma-Aldrich | 258148 | Corrosive |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| DMEM/F-12 | Thermo Fisher Scientific | 12660 | |
| 100x Penicillin/Streptomycin | Thermo Fisher Scientific | 15140 | |
| 100x L-glutamine | Thermo Fisher Scientific | 25030 | |
| Knockout Serum Replacement | Thermo Fisher Scientific | 10828010 | |
| TrypLE Select | Thermo Fisher Scientific | 12563 | Dissociation enzyme |
| Hemocytometer | |||
| Trypan Blue | |||
| Aggrewell 400 plates | StemCell Technologies | 27845 | Microwell Plates |
| Aggrewell Rinsing Solution | StemCell Technologies | 7010 | Microwell Rinsing Solution |
| Y-27632 ROCK Inhibitor | Tocris | 1254 | |
| Collagenase Type II | Sigma-Aldrich | C6885 | |
| Hank's Balanced Salt Solution | Thermo Fisher Scientific | 14025092 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 12483 | |
| 96 well plate (for FACS staining) | |||
| Intraprep Permeabilization Reagent | Beckman Coulter | IM2389 | Kit with 2 parts: Fixation Solution and Permeabilization Solution; Toxic |
| cTnT antibody | Neomarkers | MS-295 | |
| goat anti-mouse-IgG APC antibodyThermoFisher | Molecular Probes | A865 | |
| 5 ml round bottom flow cytometry tubes | FACS machine dependent |
参考文献
- Wintermantel, E., et al. Tissue engineering scaffolds using superstructures. Biomaterials. 17, 83-91 (1996).
- Lazar, A., et al. Formation of porcine hepatocyte spheroids for use in a bioartificial liver. Cell Transplant. 4, 259-268 (1995).
- Sachlos, E., Auguste, D. T. Embryoid body morphology influences diffusive transport of inductive biochemicals: a strategy for stem cell differentiation. Biomaterials. 29, 4471-4480 (2008).
- Johnstone, B., Hering, T. M., Caplan, A. I., Goldberg, V. M., Yoo, J. U. In vitro chondrogenesis of bone marrow-derived mesenchymal progenitor cells. Exp. Cell Res. 238, 265-272 (1998).
- Steinberg, M. S. Does differential adhesion govern self-assembly processes in histogenesis? Equilibrium configurations and the emergence of a hierarchy among populations of embryonic cells. J. Exp. Zool. 173, 395-433 (1970).
- Bauwens, C. L., et al. Control of human embryonic stem cell colony and aggregate size heterogeneity influences differentiation trajectories. Stem Cells Dayt. Ohio. 26, 2300-2310 (2008).
- Koike, M., Kurosawa, H., Amano, Y. A Round-bottom 96-well Polystyrene Plate Coated with 2-methacryloyloxyethyl Phosphorylcholine as an Effective Tool for Embryoid Body Formation. Cytotechnology. 47, 3-10 (2005).
- Ng, E. S., Davis, R. P., Azzola, L., Stanley, E. G., Elefanty, A. G. Forced aggregation of defined numbers of human embryonic stem cells into embryoid bodies fosters robust, reproducible hematopoietic differentiation. Blood. 106, 1601-1603 (2005).
- Burridge, P. W., et al. Improved human embryonic stem cell embryoid body homogeneity and cardiomyocyte differentiation from a novel V-96 plate aggregation system highlights interline variability. Stem Cells Dayt. Ohio. 25, 929-938 (2007).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PloS One. 3, e1565 (2008).
- Kozhich, O. A., Hamilton, R. S., Mallon, B. S. Standardized generation and differentiation of neural precursor cells from human pluripotent stem cells. Stem Cell Rev. 9, 531-536 (2013).
- Ungrin, M. D., et al. Rational bioprocess design for human pluripotent stem cell expansion and endoderm differentiation based on cellular dynamics. Biotechnol. Bioeng. 109, 853-866 (2012).
- Bauwens, C. L., et al. Geometric control of cardiomyogenic induction in human pluripotent stem cells. Tissue Eng. Part A. 17, 1901-1909 (2011).
- Golos, T. G., Giakoumopoulos, M., Garthwaite, M. A. Embryonic stem cells as models of trophoblast differentiation: progress, opportunities, and limitations. Reprod. Camb. Engl. 140, 3-9 (2010).
- Markway, B. D., et al. Enhanced chondrogenic differentiation of human bone marrow-derived mesenchymal stem cells in low oxygen environment micropellet cultures. Cell Transplant. 19, 29-42 (2010).
- Fey, S. J., Wrzesinski, K. Determination of drug toxicity using 3D spheroids constructed from an immortal human hepatocyte cell. Toxicol. Sci. Off. J. Soc. Toxicol. 127, 403-411 (2012).
- Wallace, L., Reichelt, J. Using 3D culture to investigate the role of mechanical signaling in keratinocyte stem cells. Methods Mol. Biol. Clifton NJ. 989, 153-164 (2013).
- Ungrin, M., O'Connor, M., Eaves, C., Zandstra, P. W. Phenotypic analysis of human embryonic stem cells. Curr. Protoc. Stem Cell Biol. , (2007).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. J. Vis. Exp. JoVE. , e52010 (2014).
- Nostro, M. C., et al. Stage-specific signaling through TGFβ family members and WNT regulates patterning and pancreatic specification of human pluripotent stem cells. Dev. Camb. Engl. 138, 861-871 (2011).
- Niebruegge, S., et al. Generation of human embryonic stem cell-derived mesoderm and cardiac cells using size-specified aggregates in an oxygen-controlled bioreactor. Biotechnol. Bioeng. 102, 493-507 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。