需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
三维培养试验探索肿瘤细胞浸润和卫星肿瘤形成
摘要
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
摘要
在单层哺乳动物细胞培养被广泛用于研究各种生理和分子过程。然而,这种方法来研究生长的细胞往往会产生不希望的痕迹。因此,在一个三维(3D)环境的细胞培养,通常使用细胞外基质组分,成为一个有趣的选择,因为它接近相似的体内组织或器官中的原生。我们开发了使用两个室,即(i)一个三维细胞培养系统包含嵌入在胶原凝胶充当伪主macrospherical肿瘤和(ii)的周边无细胞隔室制成的纤维蛋白凝胶的癌细胞的中心隔室, 即细胞外基质组分从在中心使用的不同,其中,癌症细胞可以迁移(侵入前)和/或形成代表仲或卫星肿瘤微球肿瘤。卫星肿瘤的外围隔室的形成是显着相关与天然肿瘤细胞的已知攻击性或转移性原点,这使得这种三维培养系统是唯一的。这种细胞培养物的方法可以考虑以评估癌细胞侵袭和运动性,细胞 - 细胞外基质相互作用并作为评价抗癌药物性能的方法。
引言
调查癌细胞侵袭/迁移和随后的转移机构的基本和生物医学特征是强烈的研究1,2的主题。转移是癌症的最终阶段,临床管理仍然遥遥无期。在细胞和分子水平上更好地了解转移将使更有效的疗法3的发展。
转移细胞的几个属性可以在体外 4包括它们的干性和潜在的获得的过渡状态( 例如 ,上皮-间质转化)迁移和内部以及从原发肿瘤5侵入进行探讨。然而,侵袭/转移过程的体外评估一直是一个挑战,因为它几乎排除了血液/淋巴循环的贡献。在胶原凝胶中嵌入肿瘤碎片器官文化有页上一页狡猾被用于监测癌症的侵袭性。虽然肿瘤的复杂性被保留( 例如 ,非癌细胞的存在),肿瘤片段暴露于有限介质扩散,以采样变化,并且对基质细胞6的过度生长。另一种方法包括在细胞外基质(ECM),它模仿了三维(3D)细胞环境的组分中生长的癌细胞。的乳腺癌细胞系中胶原凝胶和/或基底膜衍生基质的扩散是之中三维细胞培养物的最佳表征的例子。通过使用特定的三维细胞培养物的环境中,在标准条件下生长的乳腺癌细胞中观察到的紊乱组件可被反向以自发形成乳腺腺泡和管状结构7-10的。此外,来自腺癌细胞的多细胞肿瘤球状体的形成使用不同的技术(聚集例如,悬滴,浮球体,琼脂嵌入)现在构成了最常用的三维细胞培养物测定法11-13。然而,该测定是由限制集合的癌细胞系可以形成球状体,并通过提供研究细胞在这些条件下,短周期的限制。
在这种可视化技术,我们这里所介绍其中感兴趣癌细胞嵌入在胶原凝胶,以允许可替代地涂覆有基底膜衍生矩阵的伪原发肿瘤的体外形成复杂的三维细胞培养物测定法。一旦形成,所述伪原发性肿瘤,然后夹在无细胞基质(在本例中纤维蛋白胶),它允许癌细胞跨越两个矩阵隔间之间的界面(参见图1)。有趣的是,从伪原发性肿瘤始发侵袭性癌细胞沿继发性肿瘤样结构出现在纤维蛋白胶。这样的三维培养系统提供调查所需的灵活性,例如,抗癌药物,基因表达和细胞-细胞和/或细胞-ECM相互作用14-16。
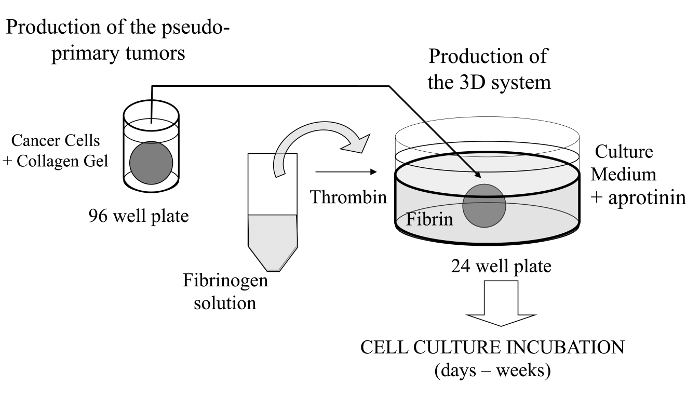
图 1: 该方法的概述 ,生成三维细胞培养系统作为癌症研究的模型方法的原理总结,请点击此处查看该图的放大版本。
研究方案
注:没有道德的考虑,因为动物和人类癌细胞购买或慷慨地提供给我们。
1.使胶原蛋白插头(伪原发灶)
- 制备胶原分散液。 I型从鼠尾腱(RTT)既可以提取胶原消毒如先前报道17,或购买。分散用混合机冻干RTT胶原(3.25-3.50毫克/毫升0.02N的乙酸);对于均匀的混合(高速设置5 2分钟运行)。
- 收获(胰蛋白酶-EDTA,通常情况下),并使用台盼蓝排除了使用血球计数活细胞。调整到所需的细胞密度(每插头5×10 4细胞)。
- 制备在无菌条件下的所有解决方案(氢氧化钠,胎牛血清,DMEM 5倍, 碳酸氢钠 )分别( 表1),并保持在冰上冷却。注:加入各种解决方案的顺序是重要的,以防止渗透或酸性震荡细胞。
- 进行细胞分散液(1.25×10 6个细胞)到最终的胶原溶液(5毫升)尽快。拌匀(通过上下吹打),同时避免气泡,然后在96孔板的每个孔中迅速分布200微升准备使用的溶液。轻轻敲击细胞培养罩的工作区表面上的多孔板,以去除气泡,并均匀地散布在孔内的溶液。
- 填充所有孔之后(此步骤需要每96孔板约15-20分钟),将其存储到孵化器。
- 从2小时到过夜孵育,在37℃下的板。胶原凝胶化( 即 ,原纤维)在30分钟内发生。培养基(100μl/孔)添加到培养以进行过夜孵育。
2.纤维蛋白胶的第一层
- 纤维蛋白原溶液制备方法。
注:同一批次的纤维蛋白胶的理想情况下应该使用更重现resulTS,如血纤维蛋白凝胶形成可以商业冻干纤维蛋白原的不同批次之间有所不同。- 始终使用新鲜配制的纤维蛋白原溶液。在打开的小瓶,以避免水合物晶体形成之前使冻干的纤维蛋白原至室温。
- 逐渐溶解在预热(37℃)的Hank氏平衡盐溶液(HBSS)以钙 /镁离子以3毫克/毫升的工作浓度(考虑制备15%过量的最小最终体积的所需的纤维蛋白原: 例如 ,17.25毫克5.75毫升为5ml的溶液)。
- 添加预热的HBSS滴加起初以溶解纤维蛋白原片段。分解较大的片段与在烧杯刮刀。搅动烧杯不时以促进混合。在手术过程中不要使用搅拌器板。通过上下吹打悬浮液溶解剩余的粉末。
- 保持纤维蛋白原溶液不冷不热,而免缝使其通过一个0.22微米的过滤器LIZING溶液。注意:如果HBSS是不够暖或血纤维蛋白原不完全溶解,该溶液可能堵塞过滤器。如果适用的话,更换过滤器一次或两次,这可以降低纤维蛋白原浓度,从而纤维蛋白凝块的刚度。
- 暂停的利益( 例如 ,内皮细胞)的细胞分化为准备使用的纤维蛋白原溶液中,同时调整其最终体积,作为替代程序。
- 准备凝血酶解决方案。
- 准备在DDH 2 O(50 NIH单位/ ml)的储备液,然后用0.22微米的过滤消毒的。
- 使用的纤维蛋白原/凝血酶比率≥1:0.0075(体积/体积),以生成血纤维蛋白凝胶。
- 生成纤维蛋白胶。
- 保持无菌纤维蛋白原和在所有的后续步骤凝血酶在冰上原液。血纤维蛋白凝胶允许形成在24孔板中。
- 及时覆盖日每个电子表面很好地与纤维蛋白原溶液(200μl/孔),同时避免气泡形成。一次处理6个孔。
- 一旦纤维蛋白原溶液完全覆盖孔的表面,倾斜板以45°角和通过丢弃凝血酶入井的中心添加1.5微升的凝血酶溶液到第一井,然后轻轻水平摇动板1-2秒。
- 离开板在层流罩(5-10分钟),直至凝胶化/凝固过程已经完成下一个稳定的位置(注:在聚合过程中必须不被干扰, 例如 ,通过输送板的孵化器)。
- 一旦第一个六口井已经聚合,重复相同的序列( 即 3之前的步骤),在接下来的6口井,直到所有的水井都被处理。
3.纤维蛋白胶并夹塞胶原第二层
- 选项答:(使用胶原蛋白立即插件)。
- 确保纤维蛋白胶的第一层已在所有孔中通过微妙地倾斜板聚合。放置装有由侧的胶原凝胶插头侧与24孔板(包含纤维蛋白凝胶)的96孔板来缓解胶原插头传送。
- 添加HBSS一滴到含有胶原塞板的各孔中。
- 除去从井各胶原插头与安装在一注射器(用作把手)细针或使用微勺(见视频)。每个胶原插头传送到使用一个或两个微匙第一纤维蛋白凝胶层,同时确保胶原塞孔中心到井和无菌状态保持良好。
- 用的纤维蛋白原溶液的第二层覆盖在预先形成的纤维蛋白胶(300微升/孔),并在2.3中描述介绍凝血酶,保持一个最小的1:在一个时间0.0075比率和六个孔中的序列
- 选项B(涂敷胶原插头与生长因子减少基底膜(GFRBM)的薄层)。
- 酷派所有准备的解决方案和手段事先并自GFRBM冷冻等分处理过程中让他们在4℃或冰上( 例如 ,移液器,吸头,试管)的解冻过程中过度加热速度非常敏感(按照制造商的说明) 。
- 从板孔中以下的去除,浸泡各胶原插头2分钟在1.5毫升离心管中含有100μl的纯GRFBM溶液的冰上。
- 每个涂覆插头转印到第一纤维层,同时确保它是良好居中,如前面所述。在37°C孵育含插件板5分钟,以允许GRFBM以形成凝胶。添加第二个纤维层在步骤3.1.4。
4.细胞培养基条件
- 用培养基填充每口井(400微升)。培养基和补充剂将基于所述细胞系和实验条件中选择。
- 在100激肽释放酶抑制剂单位(KIU)/ ml的终浓度添加抑肽酶,一个抗纤维蛋白溶解剂,培养基中。
注:在用于测试的细胞系的条件下的细胞培养孵化器存放板。 - 补充用新鲜培养基培养隔日或根据实验时间表,并添加抑肽酶。加入新鲜培养基之前,稍有倾斜板(以30-35°角)和倾斜吸管针对井的侧,同时小心抽吸下恒定观测条件培养基。
结果
如前面提到的,这个三维细胞培养物测定法的一个有趣的特征是肿瘤细胞不仅可以从胶原插头向相邻的血纤维蛋白凝胶迁移,而且还建立继发性肿瘤( 例如 ,卫星瘤样结构)。这可以在用凝胶厚度低和高放大倍数的倒置相差显微镜直接观察到,尤其是具有长工作距离聚光镜( 图2)。采用这种三维细胞培养的方法,公知的转移性细胞的行为可以容易地?...
讨论
作为一个重要的技术脚注,至关重要的是,没有间隙存在于中央和周边的凝胶之间的接口。否则,可能会降低细胞迁移/侵袭纤维蛋白凝胶的能力。如果凝血酶未被适当地稀释的胶原蛋白和纤维蛋白凝胶之间的空间可以培养的第24小时的过程中可形成。它也可能是测试可能导致的胶原蛋白凝胶的细胞系培养过程中收缩,从而导致相当大的空间都凝胶之间形成。当基质细胞中的胶原凝胶与癌细胞由于?...
披露声明
The authors have no disclosure.
致谢
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
材料
| Name | Company | Catalog Number | Comments |
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65 - 85% protein with ≥ 75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5 - 10T IU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
参考文献
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。