需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
为提高训练大鼠绩效的创新运行基于轮机制
摘要
这项研究提出了一个创新型轮运行动物的调动制度的大鼠量化一个有效的锻炼活动。将大鼠友好测试平台构建,使用预定义的自适应加速曲线,并有效地行使率和梗塞体积之间的高相关性表明该协议的中风预防实验潜力。
摘要
这项研究提出的动物移动性系统,配备有定位跑步轮(PRW),作为一种方法来量化的锻炼活动的功效降低的大鼠中风的影响的严重性。该系统提供了比商用系统,如跑步机和电动跑步轮(MRWs)更有效的动物运动训练。与此相反的MRW,只有能够达到以下速度20米/分钟,只被允许在30米的速度稳定运行/分钟由15厘米宽的丙烯酸轮与支持的更宽敞,高密度橡胶跑道一个直径为55厘米的这项工作。使用预定义的自适应加速曲线,该系统不仅降低了操作错误,但也训练的老鼠,直到达到规定的强度持续运行。作为一种方法来评估锻炼效果,大鼠的实时位置被四对部署在跑轮红外线传感器检测到。一旦自适应加速曲线是使用微控制器发起的,由红外传感器得到的数据自动记录和分析的计算机。为了便于比较,3个星期的训练中使用了跑步机,MRW和PRW老鼠进行的。手术诱导大脑中动脉闭塞(MCAO)后,修饰的神经严重性评分(MNSS)和一个倾斜面测试进行了对神经损伤评估给大鼠。 PRW,实验验证作为该动物移动系统中最有效的。此外,运动效果的措施,根据大鼠位置分析,表明存在有效行使和梗死体积之间的高的负相关,并且可用于量化在任何类型的脑减少损伤实验的大鼠的训练。
引言
笔画持续存在,作为一个财政负担在全球范围内的国家,留下了无数患者的身体和智力残疾1,2。有临床证据表明,经常运动可以改善神经再生和神经加强连接3,4,它也表明,锻炼可以降低患缺血性中风5的风险。无论使用哪种跑步机或正在运行的轮作为运动训练系统,啮齿动物,如老鼠,作为代理人类在绝大多数的临床实验测试6演习的有效性- 8。一个培训系统通常包括训练老鼠在一定时间内,在此期间,大鼠以一定的速度运行。 8 -因此,训练强度是根据运动速度和持续时间6一般计算。同样的方法也适用于估计的运动对神经生理学保护所需的量。然而,实验练习,有时发现是无效的,比如当老鼠绊倒,跌倒,或抓住栏杆,一旦他们无法赶上跑车轮转速9 - 11。不用说,无效运动的事件显著减少运动益处。即使没有任何普遍接受的做法目前量化减少脑损伤的有效练习,有效的锻炼水平依然矗立作为一个客观的评价,为临床研究来说明神经生理学学科锻炼的好处。
存在于在今天的脑损伤减少实验12中使用市售的动物移动系统许多限制。在跑步机上的情况下,老鼠被迫用电击的方式运行,引起了巨大的心理应力的动物,从而干扰在最终神经生理学测试结果8,13,14。运行车轮可分为两种类型,即自愿和被迫的。自愿转轮让老鼠自然运行,创造到期大鼠的身体特征和能力15的差异过大的可变性,而电动行驶轮(MRWs)采用电机转动轮子,迫使老鼠跑。尽管也被强迫训练的一种形式,MRWs强加给大鼠比跑步机13,16,17心理压力较少。然而,使用MRWs实验已经报道,大鼠通过抓住轮轨道上的轨道和拒绝在速度超过20米/分钟9运行有时中断锻炼。这些例子表明,目前可用的动物移动系统具有固有的缺点,即抑制有效锻炼。对于客观鼠训练目的,一种高效的培训体系的发展,但与低干扰,因此被视为神经生理学实验练习一个紧迫的问题。
这项研究提出关于减少的行程11的影响的严重性为实验一种高效运行的轮系统。除了干扰因素的数量减少时的训练过程中,这个系统利用嵌入在轮,从而实现有效的运动活动的更可靠的估计的红外传感器的大鼠的运行位置。由传统的跑步机和在MRWs都频繁行使中断所施加的心理应激歪斜所得运动估计的客观性。在本研究中提出的定位跑步轮(PRW)系统,以试图最小化不必要的干扰发达而用于量化有效的exe提供了可靠的训练模型rcise。
Access restricted. Please log in or start a trial to view this content.
研究方案
伦理声明:实验过程是由科学技术实验动物中心南台科技大学,国家科学委员会,中华民国(台湾台南)的动物伦理委员会批准。
1.构建跑轮结构
注:所有丙烯酸应该是透明的。用清水清洗拆卸车轮,然后用酒精擦拭每次使用后的橡胶履带和亚克力板材。
- 得到丙烯酸跑轮为55厘米,直径在宽15厘米
注意:此轮比传统传动轮(直径= 35厘米;宽度= 12cm)中较大的(F igure 1A)。 - 使用切割机,切四分之一圆开口进入运行车轮的一侧充当一个入口和一个出口以及对大鼠( 图1B)。将高摩擦橡胶履带上一层ACR的内ylic轮( 图1B)。
- 放置铁棒用轴承连接正在运行的车轮( 图1B)。放置在运行车轮的两侧的两个丙烯酸三角形列充当支撑框架( 图1B)。
- 附加一个1mm厚的半圆形,透明压克力板用螺钉两个三角柱的外部侧面。使用此表来部署红外传感器。确保丙烯酸系片材是从正在运行的轮的每一侧约3厘米。
2.部署红外传感器和定义的有效行使区
注意:考虑到正在运行的车轮尺寸和在红外系统的设计大鼠长度。一只老鼠只能触发一次一个传感器。在该实验中,老鼠是厘米20和23之间长。
- 钻一个洞,压克力板材每45°(ARC间隔= 21厘米),随着距离两孔之间是大致相当于一个测试大鼠的长度。使孔的大小相同的红外传感器( 图2A)。
注:对于传统MRWs,钻一个孔每隔70°(ARC间隔= 21厘米, 图2B)。 - 期间PRW实验,维持大鼠在0℃之间运行,以135℃的稳定状态。
注:这样定义这个区域作为有效演习区域,同时鉴于所有其他部分为无效运动领域。对于传统MRWs,限定有效行使区域为140°( 图2B)0°之间的部分。
3.驾驶跑轮
- 使用无刷DC电动机和电动机驱动器来驱动的运行车轮。
- 安装在电机的中轴线( 图1B)一个直径10厘米的橡胶盘。
- 使用铁框和弹簧以支撑电机,从连接橡胶磁盘电机的中心轴线到正在运行的车轮的外侧。
注:弹簧必须用螺丝合作,允许动态电机高度调节,防止橡胶盘被断开,因为弹簧松动的运行轮距。 - 操作马达来驱动使用微控制器10厘米直径的橡胶盘,并观察车轮转动由于橡胶盘和车轮的跑道之间的摩擦,形成一个机动运行车轮的平台。
- 安装4红外传感器顺序地为0°至135°( 图2A)之间。
注:对于传统MRWs,0°之间安装传感器以140°( 图2B)。 - 连接4双安装在两个丙烯酸类片材,使用单芯电缆,从而形成一定位跑轮系统微控制器的一般销红外线传感器。
4.构建自适应Accelerati曲线上
- 官方3周运动训练开始前三天,通过手动操作运转轮系老鼠。
注意:我们的目标是让大鼠熟悉的运行环境,并且是检测各大鼠是否能够忍受在20米/分钟运行。- 在手工操作的培训,逐步加快运行速度,直到老鼠是无法跟上时代的步伐。发生这种情况时,降低速度,直到老鼠重新获得稳定的运行速度,然后逐步直到老鼠达到20米/分钟( 图3虚线)再次提高速度。该手册的培训涉及7只构建培训曲线。
- 使用数字式,以适应在手动测试的第3天的测定数据,计算最靠近手动训练(有圆圈的曲线, 图3)的加速度曲线。拟合方程1的原始数据,其中C INI = 8,C 翅 = 20,τ= 30表示的初始速度,最后的速度和时间常数,分别地)。
注:此公式适应老鼠的身体状况。因此,请参照所计算的曲线作为自适应加速训练模式。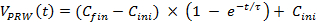 (1)
(1) - 用公式1为正式训练1周。
- 对于周2和培训3,调整公式1的参数,也就是说,改变从12到22,让速度达到30米/分钟。
5.控制软件程序
注:独占开发代码为基于微控制器的马达的操作和用于从红外传感器用于随后的数据分析的计算机信号传输。
- 用C编程语言编写包含一个主程序和两个中断服务例程的定时器的软件控制程序微控制器18。
- 确保主程序初始化微控制器的寄存器和构造在微控制器的存储器中的自适应加速曲线模型。
- 使用定时器0的中断服务程序激活自适应加速曲线,并计算出整个训练持续时间。
- 用定时器1的中断服务例程,以从红外传感器提取信号数据和将数据传送到计算机。
- 使用主节目录制0°的位置来调整运行车轮的速度。
- 一旦在0℃的接收红外传感器被触发,它解释为跌倒发生率,这是由主程序积累。此刻秋季发生率的发生次数击中大鼠位置检测数的10%的阈值时,自动deaccelerate运行车轮作为训练大鼠安全措施。注:速度O˚F运行车轮降低,直到老鼠可以返回到安全区域(0°到135),并保持稳定的运行状态的安全措施。
6.操作定位跑轮系统
- 打开微控制器和等待操作员按下按钮开始每星期的训练模式。
- 按"开始"按钮,开始培养模式1周。
注:电机,直到达到20米/分钟,自动后30分钟停止基于自适应加速曲线自动加速。 - 按"开始"按钮,开始培养模式2周。
注:电机,直到达到30米/分钟,自动后30分钟停止基于自适应加速曲线自动加速。 - 按"开始"按钮,开始培养模式为3周。
注:电机自动accelera基于自适应加速度曲线上,直到达到30米/分钟,并自动TES 60分钟后停止。
注意:在整个培养过程中,发送从红外传感器接收到的计算机无线地将信号数据。
- 按"开始"按钮,开始培养模式1周。
- 使用计算机,分析所述位置数据,以获得在整个锻炼过程中有效的锻炼度量(
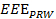 )。见公式2。
)。见公式2。 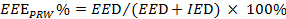 (2)
(2)
注:EEE,EED和IED代表有效行使的措施,有效和无效的锻炼持续时间分别。
7.训练大鼠
- 随机分为成年雄性SD大鼠分为五组(n = 9每个组):假,控制,跑步机,MRW和PRW组。
- 进行3周的运动训练三个运动组, 即 TReadmill,MRW和PRW群体,而假组和对照组则没有。
注意:每个练习组3周的运动训练为20米/分钟的第1周30分钟,30米/分钟30分钟2周期间和30米/分钟60分钟3周期间。
8.动物和中风模型
- 如第说明。 7.1,随机分为所有涉及的成年雄性SD大鼠,250〜280 g的体重,分成5组。
- 权衡所有的动物,以确保准确的药物剂量计算。麻醉用戊巴比妥钠的大鼠(25毫克/千克,腹膜内[IP])和含混合物氯胺酮(4.4毫克/千克,肌肉注射[IM]),阿托品(0.02633毫克/千克,[IM])和赛拉嗪(6.77毫克/公斤,[IM])。
- 通过监测呼吸率(正常70-115次/ min),节奏,呼吸,粘膜颜色和反射的定期检测的深度, 例如脚趾捏,尾捏,眼睑/睫毛评估麻醉深度和眼睑。
- 将温度探头插入直肠,并使用独立的加热灯保持37之间的直肠温度37.5℃。
- 通过插入灯丝插入内颈动脉以阻塞通过外颈动脉的方法19中脑动脉的孔诱导局灶性缺血,暂时性大脑中动脉闭塞(MCAO)。
- 执行在假手术动物相同的操作程序,而不要插入灯丝插入颈内动脉。维持脑缺血1小时后,取出长丝,关闭切口,然后离开1厘米尼龙缝合突出,这可以被收回,以允许再灌注。
- 辖皮下(sc)止痛剂(丁丙诺啡(0.05毫克/公斤,SC))的注射剂,成动物镇痛一天两次3天。
9.评估神经损伤
- EVAL审视你们神经和运动功能,分别由神经严重性评分(MNSS)20和一个倾斜面测试21。
注:MNSS是电动机(肌肉状态,异常的运动),感觉(视觉,触觉和本体)和反射测试的复合物。给予对未执行任务一点。在0-18的刻度率神经功能(正常得分= 0;最大缺陷评分= 18)。 - 前一天和每日评估所有大鼠中的行为性能方面在手术后7天的时间跨度。
- 测量使用斜面的大鼠后肢握力。
- 放置在每天的基础上的倾斜攀登装置大鼠和试验前1周使其恢复的大鼠的装置和试验条件。
- 放置在该装置的每个大鼠和鼓励大鼠爬上平台直到该装置的过程中的环境适应期的顶部。
- 放置在老鼠与在测试过程中向下方的头装置的顶部。确保开始在25°的角度大鼠停留的体轴沿一个20×20厘米2橡胶带肋表面上的倾斜面。
- 增加角度动态使用与步进电机相连的滚珠丝杠,以确定在该动物可容纳于所述平面的最大角度。增大倾斜面的角度逐渐直到鼠标未能保持在倾斜面,然后检测一个往下滑事件。倾斜面的基线程度是在开始时25°。
- 请两位观察员(不知道已经给大鼠什么待遇),独立审查和评分所有的行为测试, 即左侧和右侧的最大角度的平均值。
- Sacri科幻CE所有第7天的动物缺血后。 (100毫克/千克,IP戊巴比妥钠)用盐水灌注22深麻醉下的动物的心。删除,然后浸入冷生理盐水的脑组织进行5分钟,然后将其切成使用组织切片机222.0毫米冠状切片。
- 淹没新鲜脑切片成2,3,5-三苯基氯化四唑(TTC)中于37℃进行30分钟,然后在4℃转移片至5%的甲醛溶液为音响xation 24小时。将染色的脑片上有机玻璃支架上。
- 拍摄TTC染色切片用使用链接到装载有图像处理软件的个人计算机的CCD照相机校准的刻度。使用半自动化图像分析系统,以及估算从每个TTC染色的脑切片23上的梗塞面积(mm 2)。
- 计算所有脑片梗死区的总和,每一片总梗死体积。标记分别对2毫米厚的片每侧未染色区域(缺血性脑),然后计算梗死体积和的平均值。
- Calcu后期修正梗死体积(CIV)作为
CIV = {长线(RT-RI)}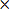 D(3)
D(3)
注意:如果Lt和Rt表示为mm 2的左和右半球的区域,分别RI为以mm 2梗塞面积,d = 2毫米是切片厚度。
Access restricted. Please log in or start a trial to view this content.
结果
这部分是专门的比较,手术后制成1周,在MNSS分数,斜面测试结果和脑的梗死体积五组之一。 图4A和图4B分别呈现平均MNSS分数和斜面试验结果的平均值。该PRW组作为最好的出现在MNSS改善方面。 PRW和MRW之间以及跑步机和PRW之间的差异显著清楚地表明,PRW更有效地预防中风比目前市面上其他动物的移动系统。倾斜的平面测试在所有的运动组显著陡倾?...
Access restricted. Please log in or start a trial to view this content.
讨论
这个协议描述了用于减少在动物中的中风的影响的严重性一种高效运行的轮系统。作为一只老鼠友好的测试平台,该平台是在一个稳定的运行速度,可以由老鼠在整个运行过程中通过预定的自适应加速曲线来保持这样一种方式设计为好。在典型的培训制度,培训预置速度和持续时间手动设置。一旦运动开始,达到预设的速度很快。在这种情况下,这是非常可能的是老鼠都无法达到更高的速度,使?...
Access restricted. Please log in or start a trial to view this content.
披露声明
The authors have nothing to disclose.
致谢
The authors would like to thank Dr. Jhi-Joung Wang, who is the Vice Superintendent of Education at Chi-Mei Medical Center, and Dr. Chih-Chan Lin from the Laboratory Animal Center, Department of Medical Research, Chi-Mei Medical Center, 901 Zhonghua, Yongkang Dist., Tainan City 701, Taiwan, for providing the shooting venue. They would also like to thank Miss Ling-Yu Tang and Mr. Chung-Ham Wang from the Department of Medical Research, Chi-Mei Medical Center, Tainan, Taiwan, for their valuable assistance in demonstrating the prototype system in real experiments with rats. The author gratefully acknowledges the support provided for this study by the Ministry of Science and Technology (MOST 104- 2218-E-167-001-) of Taiwan.
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Brushless DC motor | Oriental Motor | BLEM512-GFS | |
| Motor driver | Oriental Motor | BLED12A | |
| Motor reducer | Oriental Motor | GFS5G20 | |
| Speedometer | Oriental Motor | OPX-2A | |
| Treadmill | Columbus Instruments | Exer-6M | |
| Infrared transmitter | Seeed Studio | TSAL6200 | |
| Infrared Receiver | Seeed Studio | TSOP382 | |
| Microcontroller | Silicon Labs | C8051F330 | |
| CCD camera | Canon Inc. | EOS 450D | |
| Image processing software | Adobe Systems Incorporated | ADOBE Photoshop CS5 12.0 | |
| Image analysis | Media Cybernetics | Pro Plus 4.50.29 | |
| Sodium pentobarbital | Sigma-Aldrich (Saint Louis, MO, USA) | SIGMA P-3761 | |
| Ketamine | Pfizer (Kent, UK) | 1867-66-9 | |
| Atropine | Taiwan Biotech Co., Ltd. (Taoyuan, Taiwan) | A03BA01 | |
| Xylazine | Sigma-Aldrich (Saint Louis, MO, USA) | SIGMA X1126 | |
| Buprenorphine | Sigma-Aldrich (Saint Louis, MO, USA) | B9275 |
参考文献
- Mayo, N. E., Wood-Dauphinee, S., Cote, R., Durcan, L., Carlton, J. Activity, participation, and quality of life 6 months poststroke. Arch Phys Med Rehabil. 83 (8), 1035-1042 (2002).
- Duncan, P. W., Goldstein, L. B., Horner, R. D., Landsman, P. B., Samsa, G. P., Matchar, D. B. Similar motor recovery of upper and lower-extremities after stroke. Stroke. 25 (6), 1181-1188 (1994).
- Raichlen, D. A., Gordon, A. D. Relationship between exercise capacity and brain size in mammals. PLoS One. 6 (6), (2011).
- Trejo, J. L., Carro, E., Torres-Aleman, I. Circulating insulin-like growth factor I mediates exercise-induced increases in the number of new neurons in the adult hippocampus. J Neurosci. 21 (5), 1628-1634 (2001).
- Zhang, F., Wu, Y., Jia, J. Exercise preconditioning and brain ischemic tolerance. Neuroscience. 177, 170-176 (2011).
- Wang, R. Y., Yang, Y. R., Yu, S. M. Protective effects of treadmill training on infarction in rats. Brain Res. 922 (1), 140-143 (2001).
- Ding, Y., et al. Exercise pre-conditioning reduces brain damage in ischemic rats that may be associated with regional angiogenesis and cellular overexpression of neurotrophin. Neuroscience. 124 (3), 583-591 (2004).
- Li, J., Luan, X. D., Clark, J. C., Rafols, J. A., Ding, Y. C. Neuroprotection against transient cerebral ischemia by exercise pre-conditioning in rats. Brain Res. 26 (4), 404-408 (2004).
- Leasure, J. L., Jones, M. Forced and voluntary exercise differentially affect brain and behavior. Neuroscience. 156 (3), 456-465 (2008).
- Chen, C. C., et al. A Forced running wheel system with a microcontroller that provides high-intensity exercise training in an animal ischemic stroke model. Braz J Med Biol Res. 47 (10), 858-868 (2014).
- Chen, C. -C., et al. Improved infrared-sensing running wheel systems with an effective exercise activity indicator. PLoS One. 10 (4), (2015).
- Fantegrossi, W. E., Xiao, W. R., Zimmerman, S. M. Novel technology for modulating locomotor activity as an operant response in the mouse: Implications for neuroscience studies involving "exercise" in rodents. J Neurosci Methods. 212 (2), 338-343 (2013).
- Hayes, K., et al. Forced, not voluntary, exercise effectively induces neuroprotection in stroke. Acta Neuropathol. 115 (3), 289-296 (2008).
- Arida, R. M., Scorza, C. A., da Silva, A. V., Scorza, F. A., Cavalheiro, E. A. Differential effects of spontaneous versus forced exercise in rats on the staining of parvalbumin-positive neurons in the hippocampal formation. Neurosci Lett. 364 (3), 135-138 (2004).
- Waters, R. P., et al. Selection for aerobic capacity affects corticosterone, monoamines and wheel-running activity. Physiol Behav. (4-5), 1044-1054 (2008).
- Ke, Z., Yip, S. P., Li, L., Zheng, X. -X., Tong, K. -Y. The effects of voluntary, involuntary, and forced exercises on brain-derived neurotrophic factor and motor function recovery: A rat brain ischemia model. PLoS One. 6 (2), (2011).
- Caton, S. J., et al. Low-carbohydrate high-fat diets in combination with daily exercise in rats: Effects on body weight regulation, body composition and exercise capacity. Physiol Behav. 106 (2), 185-192 (2012).
- C8051F330/1/2/3/4/5 datasheet. , Silicon Laboratories Inc. Available from: https://www.silabs.com/Support%20Documents/TechnicalDocs/C8051F33x.pdf (2006).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Chen, J. L., et al. Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats. Stroke. 32 (4), 1005-1011 (2001).
- Chang, M. -W., Young, M. -S., Lin, M. -T. An inclined plane system with microcontroller to determine limb motor function of laboratory animals. J Neurosci Methods. 168 (1), 186-194 (2008).
- Gartshore, G., Patterson, J., Macrae, I. M. Influence of ischemia and reperfusion on the course of brain tissue swelling and blood-brain barrier permeability in a rodent model of transient focal cerebral ischemia. Exp Neurol. 147 (2), 353-360 (1997).
- Chen, F., et al. Rodent stroke induced by photochemical occlusion of proximal middle cerebral artery: Evolution monitored with MR imaging and histopathology. Eur J Radiol. 63 (1), 68-75 (2007).
- Almenning, I., Rieber-Mohn, A., Lundgren, K. M., Lovvik, T. S., Garnaes, K. K., Moholdt, T. Effects of high intensity interval training and strength training on metabolic, cardiovascular and hormonal outcomes in women with polycystic ovary syndrome: a pilot study. PLoS One. 10 (9), (2015).
- Costigan, S. A., Eather, N., Plotnikoff, R. C., Taaffe, D. R., Lubans, D. R. High-intensity interval training for improving health-related fitness in adolescents: a systematic review and meta-analysis. Br J Sports Med. 49 (19), (2015).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。