需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
程序的微生物实验室自适应演化的恒化
摘要
在这里,我们提出了一个协议,以获得使用恒化培养条件下微生物实验室适应性进化。此外,演进的株的基因组分析进行了讨论。
摘要
Natural evolution involves genetic diversity such as environmental change and a selection between small populations. Adaptive laboratory evolution (ALE) refers to the experimental situation in which evolution is observed using living organisms under controlled conditions and stressors; organisms are thereby artificially forced to make evolutionary changes. Microorganisms are subject to a variety of stressors in the environment and are capable of regulating certain stress-inducible proteins to increase their chances of survival. Naturally occurring spontaneous mutations bring about changes in a microorganism's genome that affect its chances of survival. Long-term exposure to chemostat culture provokes an accumulation of spontaneous mutations and renders the most adaptable strain dominant. Compared to the colony transfer and serial transfer methods, chemostat culture entails the highest number of cell divisions and, therefore, the highest number of diverse populations. Although chemostat culture for ALE requires more complicated culture devices, it is less labor intensive once the operation begins. Comparative genomic and transcriptome analyses of the adapted strain provide evolutionary clues as to how the stressors contribute to mutations that overcome the stress. The goal of the current paper is to bring about accelerated evolution of microorganisms under controlled laboratory conditions.
引言
微生物可以生存和适应不同的环境。在严峻的压力,可以通过随机的基因组突变和随后的正选择1-3取得有益的表型发生调整。因此,微生物细胞可以通过改变代谢或调控网络对于最佳生长,这被称为"自适应进化"适应。最近的重要微生物的倾向,比如超级细菌爆发和强大的微生物菌种的发生,关系非常密切的压力条件下的适应性进化。下定义的实验室条件下,我们能够研究分子进化的机制和甚至控制各种应用微生物进化的方向。与多细胞生物,单细胞生物是非常适合自适应进化实验室(ALE),原因如下:他们很快再生,他们认为大量的人口,而且很容易创建和维护坎ogeneous环境。随着DNA测序技术和高通量技术最新进展相结合,ALE允许对基因组的变化,导致系统性监管政策的变化直接观察。突变动力学和人口的多样性也观察到。遗传工程策略可以从ALE菌株4,5的分析来确定。
恒化器培养是用于获得稳态细胞和发酵过程6提高生产率的方法。新鲜培养基,并将该过程(后者包括介质和生物量)中培养液收获。长期培养恒然而,改变了文化的稳态生产力和文化( 图1a)期间带来的自发突变和选择的积累。在各种选择压力(压力),突变的积累被提高。应力的长期逐渐增加恒化器提供了用于对给定的压力工作的突变,如温度,pH,渗透压,营养饥饿,氧化,有毒最终产品等菌落转移从液体介质中的固体培养基和串行传输(重复的连续选择分批培养),也让研究人员获得进化微生物( 图1b和1c)。虽然恒化培养需要复杂的方法中,分集的池(复制和人口规模的数目)比由菌落转移和串行传输技术获得更高。稳定的压力接触到单个细胞和培养恒(稳态)进行比较,以一批以文化为基础的技术ALE其他福利过程中的细胞状态下降的变化。经受高琥珀酸条件大肠杆菌应激诱导ALE这篇文章中介绍。
尔斯/ ftp_upload / 54446 / 54446fig1.jpg"/>
图1:自适应进化实验室方法 (A)恒化。 (B)串行传送; (C)菌落转移。顶部图说明为ALE方法的概念,底部数字说明ALE期间增长了细胞的数量。 请点击此处查看该图的放大版本。
研究方案
1.设备的准备
- 得到恒化器罐子(150-250毫升)或含有一个入口的Erlenmeyer烧瓶(250ml)和一出口。用硅管允许10-100毫升/小时的流速连接的端口。任选地,使用空气通气口,出气口,和温度控制的水的入口和出口端口。
- 获得适合的恒化器罐子提供用于搅拌和温度控制装置(或使用旋转式摇床)。
- 以提供新鲜培养基,并收集培养获得两个蠕动泵。
- 得到含有介质出口和一个吸入口的储存罐(10-20升)。
- 获得适合于稀释率硅管( 即 ,ID0.8毫米,流量范围0.06-36毫升/分钟; L / S 13管)。
2.中型准备和灭菌
- 初始介质
- 溶解0.3克葡萄糖,0.08克NH 4氯,0.05克氯化钠,0.75克Na 2 HPO 4·2H 2 O,和0.3g KH 2 PO 4在90ml蒸馏水(DW)以恒化器罐子。
- 密封罐子恒用夹子管子一起。不密封该通气孔。
- 消毒在高压釜中的恒化器罐子在121℃下进行15分钟。灭菌后,在室温下储存的恒化器罐子。
- 溶解0.02克用MgSO 4·7H 2 O 0.01克CaCl 2,并在10ml DW(溶液A)0.1毫克硫胺素。
- 过滤溶液A使用注射器和一个预先灭菌的注射器过滤器(0.45微米孔径过滤器)。
- 加入溶液A滤液于恒罐子。
- 中等压力
- 溶解30克葡萄糖,将8g 氯化铵 ,5克氯化钠,75克Na 2 HPO 4·2H 2 O,将30g KH 2 PO 4,和300克琥珀酸二钠六水合物(钠2·琥珀酸盐·6H <子> 2 O;在这个实验中使用的应激)在9.9大号DW在贮罐。
- 密封罐藏用夹子管子一起。不密封该通气孔。
- 消毒在高压釜中贮存罐在121℃下15分钟。灭菌后,在室温下储存罐。
- 溶解2克用MgSO 4·7H 2 O,1个克CaCl 2,并在100ml DW(溶液A)10毫克硫胺素。
- 过滤溶液A用注射器和一个预先灭菌的注射器过滤器(0.45微米孔径过滤器)。
- 加入溶液A滤液对储层罐子。
- 无菌连接无菌硅管的水库罐子,装上蠕动泵。
- 高应力中
- 制备培养基如2.2节,但与压力源的一个更大的浓度( 即 ,3-5克/升的琥珀酸适应更高)。
注:该协议是适应应力日在可以经由介质递送。在物理应激如温度,搅拌,或照明的情况下,栽培应相应地设计。
- 制备培养基如2.2节,但与压力源的一个更大的浓度( 即 ,3-5克/升的琥珀酸适应更高)。
3.初始培养
- 接种野生型大肠杆菌的单个菌落大肠杆菌在含有4毫升起始培养基的15毫升试管中。
- 孵育试管在振荡培养箱中于37℃12小时和220的转速。
- 无菌转移1毫升预培养到恒罐子。
- 孵育恒化器罐子,6小时提供用于充气(空气50ml /分钟)和搅拌(200rpm)下,在37℃下。
4.适应压力
- 无菌地连接来自泵至恒化器罐子的硅管的端部。
- 启动出口泵(10毫升/小时或更高),并收集培养。
注意:培养应该在指数期,典型地初始培养后4-8小时。 - 通道ECK从出口管培养物的光密度(600nm处)。
- 启动入口泵(10毫升/小时,相当于0.1小时-1的稀释速率)。
- 从出口管每24小时检查在600nm培养物的光密度。
- 操作恒为96小时(9.6倍周转)以上。如果光密度是稳定的,交换包含高应力介质贮存器。如果光学密度低于0.2时,停止进料口泵6小时。重新启动进口泵,检查光密度超过0.2。
- 逐渐改变到含有较高压力源浓度的储增加应激物的浓度。
- 采取适于培养的样品时,它达到一个里程碑( 例如 ,适于至100克/升琥珀酸应力应变),并存储用于进一步的基因组的分析。
- 样品存储,用无菌80%甘油soluti混合培养样品(0.5毫升)中上(0.5毫升),并将其存储在-80℃。
注意:如果该微生物获取期间ALE过程降解应激的能力,在发酵罐的压力源的浓度是不一样的,在新鲜的贮存器。
应力 - 应变适应5.单菌落分离
- 制备含有相同压力源,并在介质的相同浓度的琼脂平板培养基(1.6%琼脂)。
- 板从恒化器的出口培养(0.1毫升)中,并在37°C孵育16小时。
- 使用无菌牙签挑从板单菌落并且在含有相同应激15毫升试管,并在相同的培养基中的浓度如在恒化器接种他们,孵育6小时。
- 传送1毫升培养液中成含有50毫升培养基的250毫升锥形瓶中。收获将0.5ml培养液的每1小时,并测量在600nm的OD值。比较适应strai的增长速度n至给定的压力源的野生型菌株的。
结果
对于高琥珀酸应力适应,野生型E.大肠杆菌 W3110菌株是一个恒化器培养在D = 0.1小时-1 270天( 图2)。
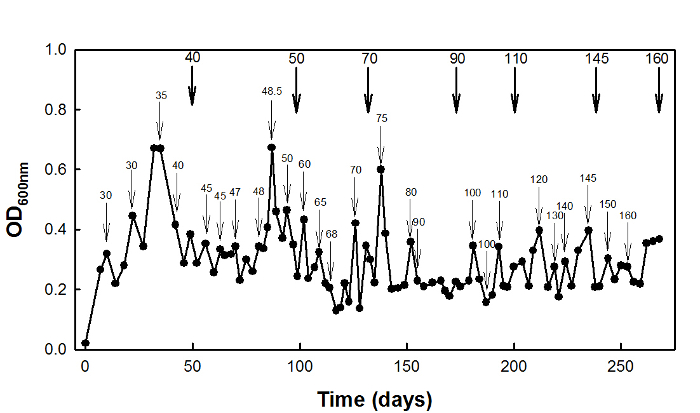
图2:E的高琥珀酸压力调适大肠杆菌 W3110采用恒化的文化。细箭头表示在该压力源浓度增加,与时俱进,大胆的箭头表示在该培养物保存的时间。用...
讨论
微生物能够适应,因为他们的速度快速增长和遗传多样性几乎所有的环境。自适应实验室进化使微生物设计条件,这提供了选择个体生物窝藏自发突变是在给定的条件下有利的方式下发展。
恒化器的技术是用于实现比转移技术人工驱动进化原因如下更健壮:(a)一种稳定的环境 - 因为传输技术基于分批培养物无论是在固体或在液体介质中,该细胞的环境批次期间变化文化而恒...
披露声明
The authors have nothing to disclose.
致谢
This study was financially supported by the Korean Ministry of Science, ICT and Future Planning (Intelligent Synthetic Biology Center program 2012M3A6A8054887). P. Kim was supported by a fellowship from the Catholic University of Korea (2015).
材料
| Name | Company | Catalog Number | Comments |
| Mini-chemostat fermentor | Biotron Inc. | - | manufactured by special order |
| silicon tubing | Cole-Parmer | Masterflex L/S 13 | tubing size can be varied depending on the dilution rate and the size of fermentor jar. |
| reservoir jar | Bellco | Media storage bottle | 20 L |
| chemicals | Sigma-Aldrich | - | reagent grade |
| glucose | Sigma-Aldrich | G5767 | ACS reagent |
| NH4Cl | Sigma-Aldrich | A9434 | for molecular biology, suitable for cell culture, ≥99.5% |
| NaCl | Sigma-Aldrich | 746398 | ACS reagent, ≥99% |
| Na2HPO4·2H2O | Sigma-Aldrich | 4272 | 98.5-101% |
| KH2PO4 | Sigma-Aldrich | 795488 | ACS reagent, ≥99% |
| MgSO4·7H2O | Sigma-Aldrich | 230391 | ACS reagent, ≥98% |
| CaCl2 | Sigma-Aldrich | 793639 | ACS reagent, ≥96% |
| thiamine·HCl | Sigma-Aldrich | T4625 | reagent grade, ≥99% |
| Na2·succinate·6H2O | Sigma-Aldrich | S2378 | ReagentPlus, ≥99% |
参考文献
- Rando, O. J., Verstrepen, K. J. Timescales of genetic and epigenetic inheritance. Cell. 128, 655-668 (2007).
- Kim, H. J., et al. Short-term differential adaptation to anaerobic stress via genomic mutations by Escherichia coli strains K-12 and B lacking alcohol dehydrogenase. Front Microbiol. 5, 476 (2014).
- Mendizabal, I., Keller, T. E., Zeng, J., Yi, S. V. Epigenetics and evolution. Integr Comp Biol. 54, 31-42 (2014).
- Lee, J. Y., Seo, J., Kim, E. S., Lee, H. S., Kim, P. Adaptive evolution of Corynebacterium glutamicum resistant to oxidative stress and its global gene expression profiling. Biotechnol Lett. 35, 709-717 (2013).
- Lee, J. Y., et al. Artificial oxidative stress-tolerant Corynebacterium glutamicum. AMB Express. 4, 15 (2014).
- Narang, A. The steady states of microbial growth on mixtures of substitutable substrates in a chemostat. J Theor Biol. 190, 241-261 (1998).
- Kwon, Y. D., Kim, S., Lee, S. Y., Kim, P. Long-term continuous adaptation of Escherichia coli to high succinate stress and transcriptome analysis of the tolerant strain. J Biosci Bioeng. 111, 26-30 (2011).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nat Rev Genet. 14, 827-839 (2013).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25, 2078-2079 (2009).
- McKenna, A., et al. The Genome Analysis Toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data. Genome Res. 20, 1297-1303 (2010).
- Deatherage, D. E., Barrick, J. E. Identification of mutations in laboratory-evolved microbes from next-generation sequencing data using breseq. Methods Mol Biol. 1151, 165-188 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。