需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
多峰成像和光谱学纤维束显微内窥镜纲要非侵入性,
摘要
The assembly and use of a multimodal microendoscope is described which can co-register superficial tissue image data with tissue physiological parameters including hemoglobin concentration, melanin concentration, and oxygen saturation. This technique can be useful for evaluating tissue structure and perfusion, and can be optimized for individual needs of the investigator.
摘要
最近纤维束显微内窥镜技术使用两种成像技术或分光技术的组合在体内组织的非侵入性的分析。结合成像和光谱学技术成一个单一的光学探针可提供组织健康的更完整的分析。在这篇文章中,两种不同的方式组合,高分辨率荧光显微内窥镜成像和漫反射光谱,成一个单一的光学探头。高分辨率荧光显微内窥镜成像是用于可视化根尖组织微结构的技术,虽然大多是定性的技术,已经证明肿瘤和非肿瘤组织之间的有效实时分化。漫反射光谱是一种技术,它可以提取组织的生理参数,包括当地的血红蛋白浓度,黑色素浓度和血氧饱和度。本文介绍的规格řequired构建光纤探头,如何建立仪器仪表,然后演示了在体内对人体皮肤的技术。这项工作表明该组织的微架构,特别是心尖皮肤角质,可以和其相关的生理参数共同注册。这里介绍的仪器和纤维束探针可以被优化为在各种器官系统的使用任一手持或内窥镜兼容设备。另外的临床研究来测试此技术对于不同的上皮疾病状态的可行性。
引言
纤维束显微内窥镜技术通常使用两种成像技术或分光技术的组合分析体内组织中 1-3一种这样的成像技术,高分辨率荧光显微内窥镜,可以形象根尖组织微架构具有亚细胞分辨率的小,微尺度场的图,利用局部造影剂如原黄素,荧光素,或羟基芘磺酸油墨。1,3-11该成像模态已示于定性实时低区分患病的和健康上皮组织有前途的临床表现间观察员变异8偶尔,调查人员将使用高分辨率荧光显微镜的数据中提取定量的功能,如细胞与核的大小或腺区,但这仍然瞄准往可视化的组织形态的主要定性技术。1,3,8- 10在另一方面,光谱技术等作为漫反射光谱,正朝着提供功能组织信息并显示在多个器官定量识别病变癌变看好的临床表现有针对性的。2,12-15
因此,有必要对掺入两种类型的模式,从而可能进一步降低观察者间变异性,维持组织微架构的实时可视化,并提供组织健康的一个更完整的分析的装置。为了实现这个目标,在基于探针的多峰仪器构建结合在一个单一的光纤探针两种模式:高分辨率荧光显微内窥镜和分漫反射光谱11此方法共寄存器定性心尖的高清晰度图像组织形态(结构特性)与来自两个不同的组织深度定量光谱信息(功能性),包括局部血红蛋白浓度([血红蛋白]),黑色素浓度([梅尔])和氧饱和度(SAO 2)。11,12,16这个特定副漫反射光谱形态使用两个源-检测器分离(SDSS)采样两个独特的组织深度,以提供通过采样到地下室膜和皮下组织间质组织健康更全面的了解。11
纤维探头由具有大约50,000 4.5微米直径的纤维元件,1.1mm的包层直径和1.2mm的整体涂层直径的中央毫米直径的1个图像的纤维。图像纤维是通过用220微米的包层直径5 200微米直径的纤维包围。每200μm多模光纤位于中心到中心的距离864微米从图像光纤的中心了。每200微米的多模光纤的相隔25°。使用最左边的200μm多模光纤为"源"的纤维,以及附加次稀土元素200μm多模光纤为"收藏"的纤维,这种几何必然创建三个中心到中心的科学数据集的374微米,730微米,1051微米,1323微米。纤维尖端封闭在保持纤维常数之间的距离的筒状金属外壳。圆筒形金属外壳的直径为3毫米。前端(朝向光纤探针尖端)的光纤探针的为2英尺长。探针然后分离成在近端(朝向仪表)的六个相应的各个纤维是额外的2英尺长,对于4英尺总长度。 图1示出了光纤探针的表示。

图1:光纤探头设计的光纤探针包括一个毫米直径的1图像纤维和四个200微米的多模光纤。这个图中显示的表示(a)该金属端盖这限制了纤维的几何形状在探头尖端,得到的安全数据表374,730,和1 051微米相对于最左边的200微米的多模光纤(比例尺≈1毫米), (b)该纤维被约束在金属盖内,示出了纤维芯,光纤包层,和纤维涂层(比例尺≈1毫米),(C)周围的纤维保护聚酰胺护套(比例尺≈1毫米),( 四 )成品远侧尖端的探头,与金属手指抓握和含有所有纤维单黑线(比例尺≈4毫米),和(e)的探针(比例尺≈为4mm远侧尖端的一个图片)。 请点击此处查看该图的放大版本。
这种多模式的仪器和相关TECHNI阙是一个探头内的这些方式的第一组合,但也存在其他组合结构/功能技术,结合不同的方式。例如,高光谱成像结合定量血红蛋白和黑色素特性,17,18和其它技术已经开发了与组织蛋白表达的分析,19结合光学相干断层扫描(OCT),仅举几宽视场成像。对使用的一般的光纤探针可用于各种目的,包括在口腔中的下胃肠道和食道或作为手持式探头内窥镜用途的使用进行优化的紧凑和易于实施的仪器设置本文报告和外部皮肤位置。11,20
该仪器的硬件既需要自定义的数据采集和处理后的代码来获得漫反射光谱,然后提取所产生的volumE-平均组织的生理参数,包括[血红蛋白],[梅尔]和血氧饱和。定制数据获取代码的建立是为了允许来自摄像头的同时采集(高分辨率荧光显微镜)和一个分光计(对于漫反射光谱)。驱动程序通常可从制造商的网站以允许与各种编程语言的融合。定制后处理代码出口先验吸收值的体内 [血红蛋白]和[梅尔] 21,然后利用创建该光谱的拟合曲线一个先前开发的非线性优化拟合过程22的拟合曲线是通过最小化建本身和原光谱和之间χ2值从拟合曲线并具有最低χ2值22的代码确定该组织的生理参数([血红蛋白],[梅尔]和血氧饱和2)可修改成包括吸收来自其他发色为好,如这里使用的外源性羟基芘磺酸墨水,使目标生理参数均不受影响。
组织健康的生理指标,如[血红蛋白],[梅尔]和血氧饱和,可作为肿瘤对治疗的反应的报告或本地血管和血管生成的指标。14,23包括一个高分辨率荧光显微内窥镜形态有助于引导探头的位置,并提供与调查上皮组织结构和功能之间的关系更完整的画面。在这篇文章中,建设和多式联运显微内窥镜的应用说明。11
Access restricted. Please log in or start a trial to view this content.
研究方案
在阿肯色大学从人类受试者的研究项目,获得了本次研究的方方面面机构审查委员会的批准(IRB#15-09-149)。所描述的方法是在按照批准的指导方针进行,并从所有参与者获得知情同意书。
1.高分辨率荧光显微内窥镜成像设备的组装
注意:对于高分辨率荧光显微内窥镜形态的组件的概述的步骤可以在图2中被可视化。
- 将一个470 nm的分色镜内30毫米笼式立方体。
- 获得30毫米笼式立方体和删除二向色滤光片安装。
- 放置一个470nm的分色镜的分色滤光器装入。
- 重新插入并确保二向色滤光片装回笼子里面的立方体。
- 安装笼式支杆至30毫米笼式立方体。
- 安全4节1.5英寸的笼式支杆的笼式立方体的前面。
- 安全4 3.0英寸的笼式支杆的笼式立方体的右侧。
- 安全双2.0英寸的笼式支杆斜着笼式立方体的左侧。
- 构建笼板/镜头管组件。
- 获得一个1.0英寸的螺纹30毫米笼板,并使用所提供的螺纹应力自由卡环固定在笼板的内侧。
- 拧一个1.0英寸镜头管无应力卡环。
- 将第二个1.0英寸螺纹30毫米笼板的1.0英寸镜筒和调整标准卡环使两笼板齐平。
- 1.0英寸笼板/镜头管组件滑到30毫米笼式立方体的左侧。
- 构建直角镜座组件。
- 获取一个直角镜座和一个1.0英寸紫外增强铝镜。
- 放置1.0 INC^ h紫外增强铝镜入镜安装并拧紧。
- 安全4 2.0英寸的笼式支杆到镜子前安装
- 安全双2.0英寸的笼式支杆斜着笼式立方体的右侧。
- 连接直角反射镜组件贴装到1.0英寸笼板/透镜管组件的左侧由通过30毫米笼板的各自的开口放置在相对保持架组件杆。
- 螺纹z轴平移通过3.0英寸的笼式支杆安装在组件的右侧。
- 附加10X消色差物镜z轴平移安装。
- 建立一个1.0英寸光纤适配器板/ XY轴平移透镜安装组件。
- 获取XY轴平移安装和一个1.0英寸光纤适配器板。
- 固定1.0英寸光纤适配器板进入XY轴平移镜头卡口。
- 幻灯ŧ他1.0英寸光纤适配器/ XY轴平移透镜在物镜的前方安装组件。
- 获得两个0.5英寸长,1.0英寸直径的镜筒,一是四十零分之四百四十○纳米带通滤波器(激发滤光片)和一个三十六分之五百二十五纳米带通滤波器(发射滤波器)。
- 将每个过滤器的0.5英寸长,1.0英寸直径的透镜管内,使得在过滤器的外部的箭头朝向透镜管的侧面与外螺纹。
- 装上过滤器组装。
- 获得两个标准的护环。
- 固定0.5英寸长,1.0英寸直径的镜片管道内的过滤器与标准的护环。
- 螺杆与所述激发滤光片至30毫米笼立方体的前镜筒并与所述发射滤波器的直角反射镜安装镜头筒螺丝。
- 螺杆与所述发射滤波器的直角镜座前部的0.5英寸透镜管。
- Obtain两个1.0英寸的螺纹30毫米笼板,并将其放置在包含过滤器的0.5英寸长,1.0英寸直径的镜片管的前面。
- 使用环氧树脂或粘结力强,附加一个455纳米的LED连接到激发滤光片笼板。
- 获取一个0.5英寸长,1.0英寸直径的透镜管和1.0英寸消色差双管透镜为50毫米焦距。
- 放置透镜管这样,关于透镜的外侧的箭头朝向与外螺纹的镜筒的侧面内侧的管透镜。
- 拧在管镜头的装配。
- 获取一个标准挡圈。
- 固定0.5英寸长,1.0英寸直径的镜头管内的镜头与标准挡圈。
- 与管透镜到最左边的笼板安装镜头筒。
- 将30毫米笼板的0.5英寸长,1.0英寸口径镜头包含镜头筒管的前面。
- 附加强调自由的扣环到30毫米笼板的内部。
- 将USB黑白摄像机与无应力卡环笼板。
- 构建光后安装设备。
- 获得4 0.5英寸杆支架,四0.5英寸光学员额,四人安装基座。
- 固定0.5英寸杆架内的0.5英寸光学职位。
- 固定0.5英寸杆支架上安装底座。
- 螺钉在四个光后安装装置至位于30毫米笼立方体下的螺丝孔,直角反射镜支架,连接到LED笼板,和连接到摄像机的笼板。
- 在四个螺杆光后安装装置到任何一个光学平台或光表完成高分辨率荧光显微内窥镜形态的构造。
ftp_upload / 54564 / 54564fig2.jpg"/>
图2:高分辨率荧光显微内窥镜形态的组装高分辨率荧光显微内窥镜形态可以通过构建1.0英寸直径大小的组件的外壳构成,与在处理分色镜采取特别的照顾,物镜,激发/发射滤波器,和管透镜。这些组件的玻璃表面必须用镜头纸小心处理。 请点击此处查看该图的放大版本。
2.小组漫反射光谱形态的大会
注意:对于子漫反射光谱形态的组件的概述的步骤可以在图3中被可视化。
- 得到钨卤素光源和,使用环氧树脂或强粘合剂,确保一个1.0英寸threadeð30毫米笼板推上前台。
- 安全4 3.0英寸的笼式支杆的笼板。
- 附加的z轴平移安装到笼式支杆。
- 拧在20X消色差物镜z轴平移装入。
- 建立一个光纤适配器板/ XY轴平移透镜安装组件。
- 获取XY轴平移安装和1.0英寸光纤适配器板。
- 固定光纤适配器板进入XY轴平移镜头卡口。
- 滑动1.0英寸光纤适配器/ XY平移在物镜的前方安装组件。
- 构建电机臂总成。
- 获取定制的铝合金电机臂和一个SMA光纤适配器板。
- 拧在光纤适配器板(带外螺纹)进入铝壳电机臂(带内螺纹)。
- 有四个#4-400.5英寸螺丝将定制铝合金电机手臂适配器连接到电机的手臂。
- 构建电机/马达臂/电机壳组件。
- 获得定制铝马达壳体和400步的步进电机。
- 排队的步进电机和电机壳体的螺钉孔,然后固定有四个#4-40 0.5英寸螺钉。
- 通过电动机臂组件的开口进给步进电机的旋转电机杆和紧固铝马达臂适配器上的锁紧螺钉。
- 构建光开关总成。
- 获取定制铝光开关和三个1.0英寸光纤适配器板。
- 螺纹接合板到光开关的螺纹孔。
- 有四个#4-40 0.5英寸螺丝将定制铝光开关荧光屏上的光开关。
- 通过T的中心孔进给步进电机的旋转电动机杆连接马达/电动机臂/马达壳体组件到光开关他光开关。
- 获取电路板及步进电机驱动器,然后将步进电机驱动程序在线路板的中心凹槽。
- 观察的电连接示意图( 图3,2.12)的步进电机驱动器,12伏电源和步进电机。
- 如在电路图( 图3,2.12)指定完成电动光学开关的结构连接步进电机驱动器,12伏电源和步进电机。
- 在光开关组件和卤钨灯光源拧到光学面包板或光学平台附近,以前构造( 图2,1.24)高分辨率荧光显微内窥镜组装。
- 附加一个550微米的一端,0.22 NA跳线到马达臂组件的1.0英寸光纤适配器板。
- 附上550微米的另一端,0.22 NA贴片电缆光纤连接或USB光谱仪。
- 在五个远侧探针电缆拧到在仪器的各1.0英寸光纤适配器板,以完成多峰高分辨率成像和分漫反射光谱纤维束显微内窥镜的完成。
- 拧在中央直径1毫米的图像光缆在步骤1.9.2中提到的1.0英寸光纤适配器板。
- 拧在最左边的200μm多模光纤电缆在步骤2.6中提到的1.0英寸光纤适配器板。
- 在第2 次 200微米的多模光纤电缆螺丝附着于在步骤2.9.2中提到的钨-卤素灯最左边的1.0英寸光纤适配器。
- 第3 届 200μm多模光纤电缆螺丝步骤2.9.2中提到的中间1.0英寸光纤适配器板。
- 在第4 次 200μm多模光纤电缆螺丝步骤2.9.2中提到的最右边的1.0英寸光纤适配器板。

图3:子漫反射光谱形态的装配可以使用耦合到物镜碱性钨-卤素灯通过200微米的多模传输光纤将光聚焦来构造副漫反射光谱形态,和一个分光计。此外,定制的电动光学开关可以将灯泡纤维光谱仪路径内被构造为每SDS之间切换。使用多个光谱仪从多个科学数据采集可以绕过光开关器件调查。 请点击此处查看该图的放大版本。
3.小组漫反射光谱成像设备校准
注:在Following步骤(第3节)之前,必须光谱数据采集(第4)完成。
- 打开仪器的所有部件,包括455毫微米的LED,宽带钨卤素灯,CMOS摄像头,USB分光计,步进电机,和电机控制电路板。确保对钨 - 卤素灯快门打开。
- 关闭所有环境光。
- 打开自定义的数据采集软件。
- 保持设备运行的灯30分钟达到适当的温度和用于从分光计固有噪声,以稳定。
- 放置定制,3D印刷校准标准设备的底部开口内的20%的漫反射率标准。
- 放置定制的最左边的槽内的光纤探头,3D印刷光纤保持器,在图4中展示。最左边的槽固定为2.1毫米,这是从光纤探头尖端到反射率标准的垂直距离运timum距离在到达光谱仪的信号最大化的374微米的第一SDS。
- 调节电动光学切换到最左侧的位置,使得分光计被连接到374微米的第一SDS。
- 设置积分时间为500毫秒。这种整合时间必须选择为不饱和光谱仪,但维持一个较低的实际积分时间。
- 通过点击"获得频谱"中的软件获得的频谱,R最大374μm。
- 关闭快门的钨-卤素灯和记录的频谱中,R 暗,374μm,背景噪声,通过点击"获取谱"的软件。一旦收购,再次打开快门。
- 放置光纤探针的定制的最右端的插槽内,3D印刷光纤保持器,在图4中展示。最右边的槽固定从纤维-邻的垂直距离PTIC探针尖端到3.9毫米的反射率标准,这是在其中到达分光计的信号被最大化为730微米的第二SDS的最佳距离。
- 调节电动光学开关至中间位置,使得分光计被连接到730微米的第二SDS。
- 通过点击"获得频谱"中的软件获得的频谱,R最大730μm。
- 关闭快门的钨-卤素灯和记录的频谱中,R 暗,730μm,背景噪声,通过点击"获取谱"的软件。
- 再次打开快门。

图4:该子漫反射光谱方式的校准对于实验性预校准,光纤探针尖端必须放置在不同从依赖于SDS的20%的漫反射标准垂直距离。达到一致在所有实验这些垂直距离,校正标准的设备被设计为保持在从20%的漫反射标准精确距离的探针((a)中所示的装置的横截面)。在这种特定的光纤探头的设置,从钨-卤灯的光通过光开关在源-检测分离(b)所示374微米和(c)730微米(以从光路中除去电机和电机臂为清楚起见)。 ( 四 )距离2.1毫米为374微米SDS,及(e)3.9毫米为需要校准的730微米SDS。 请点击此处查看该图的放大版本。
4. 体内数据习得n和光学特性提取人体皮肤
在本节中,多峰显微内窥镜技术将在体内对人皮肤来证明。
- 打开自定义数据采集软件,并通过点击"积分时间"调整分光计积分时间并进行设置,以便它是相同的校准,这是在这种情况下,(步骤3.8)500毫秒期间。
- 确定皮肤在其中获取数据的区域,其可以在研究者的应用程序不同。在这种情况下,前臂的皮肤薄被选为一个示范。
- 如果皮肤区域包含毛,去除毛用一次性无菌剃须刀。
- 获得一个黄色荧光笔,其中含有羟基芘磺酸墨水,轻轻标记选择的皮肤面积。
- 打开455nm的LED和关闭快门的钨 - 卤素灯。
- 把探头与皮肤轻柔接触。
- 移动探头轮上的组织的染色区域来查看软件的观察窗上心尖角化结构的现场高分辨率饲料。
- 选择适当的曝光时间和增益,150毫秒,在此壳体10 dB的增益,以避免图像的饱和度,通过点击"曝光时间"和"增益",在适当的值输入,然后点击"应用设置"的软件接口。
- 通过点击软件界面"获取图像"获取图像。
- 同时保持探针在相同的图像部位,关掉455nm的LED和打开快门的钨 - 卤素灯。
- 调节电动光学切换到左侧位置,使得分光计被连接到374微米的第二SDS。
- 获取的光谱,R 组织,374μm,点击"获取光谱"的软件界面。
- 调节电动光学开关至中间位置,使得第在分光计被连接到730微米的第二SDS。
- 获取的光谱,R 组织,730μm,点击"获取光谱"的软件界面。
- 打开自定义后处理软件。
- 通过点击"运行"从其中当由软件提示数据被保存在文件夹运行后处理软件,并选择高分辨率荧光图像,四校准光谱,和两个在体内光谱。
注:定制软件获得使用以下公式真绝对反射(R 腹肌,374μm和R 腹肌,730μm)。
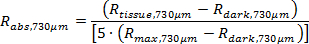
后处理代码,如先前描述的,计算的漫反射光谱的拟合曲线(等式1和2),然后DETErmines组织的生理参数,包括([血红蛋白],[梅尔],和圣保罗2)。11,22,24
Access restricted. Please log in or start a trial to view this content.
结果
按照此协议,研究者将获得组织部位的在焦高分辨率图像与全视场( 图5)。细胞的轮廓可以看出,如果沾有墨水羟基芘磺酸从一个黄色荧光笔,而单个细胞核,如果能与染料染色,如原黄素可以看出。下列光谱采集,后处理软件使用体内血红蛋白浓度([血红蛋白])和黑素浓度([梅尔])21的先验知识,以适应子漫反射光谱,并确定为[血...
Access restricted. Please log in or start a trial to view this content.
讨论
多峰高分辨率成像和分漫反射光谱纤维束显微内窥镜此处报告可以被优化并用于各种应用,包括内窥镜或手持使用用于人类或动物研究中使用由调查员。因此,它提供了用于在体内根尖组织微结构可视化与来自两个不同的组织深度的血红蛋白浓度,黑色素浓度和组织氧饱和度的测量值的灵活的方法。本文介绍了用于光纤探针的说明书,所述的协议用于组装高分辨率成像系统和分漫反射?...
Access restricted. Please log in or start a trial to view this content.
披露声明
The authors declare that they have no competing financial interests.
致谢
This material is based on work supported by the National Institutes of Health (1R03-CA182052, 1R15-CA202662), the National Science Foundation Graduate Research Fellowship Program (G.G., DGE-1450079), the Arkansas Biosciences Institute, and the University of Arkansas Doctoral Academy Fellowship. Any opinions, findings, and conclusions or recommendations expressed in this material are those of the authors and do not necessarily reflect the views of the acknowledged funding agencies.
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 30 mm Cage Cube with Dichroic Filter Mount | Thorlabs, Inc. | CM1-DCH | |
| 470 nm Dichroic Mirror (Beam Splitter) | Chroma Corporation | T470lpxr | |
| Cage Assembly Rod, 1.5", 4-Pack | Thorlabs, Inc. | ER1.5-P4 | |
| Cage Assembly Rod, 3.0", 4-Pack | Thorlabs, Inc. | ER3-P4 | |
| Cage Assembly Rod, 2.0", 4-Pack | Thorlabs, Inc. | ER2-P4 | |
| SM1-Threaded 30 mm Cage Plate | Thorlabs, Inc. | CP02 | |
| SM1 Series Stress-Free Retaining Ring | Thorlabs, Inc. | SM1PRR | |
| SM1 Lens Tube, 1.00" Thread Depth | Thorlabs, Inc. | SM1L10 | |
| Right-Angle Kinematic Mirror Mount | Thorlabs, Inc. | KCB1 | |
| 1" UV Enhanced Aluminum Mirror | Thorlabs, Inc. | PF10-03-F01 | |
| Z-Axis Translation Mount | Thorlabs, Inc. | SM1Z | |
| 10X Olympus Plan Achromatic Objective | Thorlabs, Inc. | RMS10X | |
| XY Translating Lens Mount | Thorlabs, Inc. | CXY1 | |
| SMA Fiber Adapter Plate with SM1 Thread | Thorlabs, Inc. | SM1SMA | |
| SM1 Lens Tube, 0.50" Thread Depth | Thorlabs, Inc. | SM1L05 | |
| 440/40 Bandpass Filter (Excitation) | Chroma Corporation | ET440/40x | |
| 525/36 Bandpass Filter (Emission) | Chroma Corporation | ET525/36m | |
| Quick Set Epoxy | Loctite | 1395391 | |
| 455 nm LED Light Housing Kit - 3-Watt | LED Supply | ALK-LH-3W-KIT | |
| 1" Achromatic Doublet, f = 50 mm | Thorlabs, Inc. | AC254-050-A | |
| Flea 3 USB Monochrome Camera | Point Grey, Inc. | FL3-U3-32S2M-CS | |
| 0.5" Post Holder, L = 1.5" | Thorlabs, Inc. | PH1.5 | |
| 0.5" Optical Post, L = 4.0" | Thorlabs, Inc. | TR4 | |
| Mounting Base, 1" x 2.3" x 3/8" | Thorlabs, Inc. | BA1S | |
| Long Lifetime Tungsten-Halogen Light Source (Vis-NIR) | Ocean Optics | HL-2000-LL | |
| 20X Olympus Plan Objective | Edmund Optics, Inc. | PLN20X | |
| Custom-Built Aluminum Motor Arm | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Arm Adaptor | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Housing | N/A | N/A | Custom designed and built |
| Stepper Motor - 400 steps/revolution | SparkFun Electronics | ROB-10846 | Multiple suppliers |
| Custom-Built Aluminum Optical Fiber Switch | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Optical Fiber Switch Face-Plate | N/A | N/A | Custom designed and built |
| Arduino Uno - R3 | SparkFun Electronics | DEV-11021 | Multiple suppliers |
| Electronic Breadboard - Self-Adhesive | SparkFun Electronics | PRT-12002 | Multiple suppliers |
| EasyDriver - Stepper Motor Driver | Sparkfun Electronics | ROB-12779 | |
| 12 V, 229 mA Power Supply | Phihong | PSM03A | Multiple suppliers |
| Enhanced Sensitivity USB Spectrometer (Vis-NIR) | Ocean Optics | USB2000+VIS-NIR-ES | |
| 550 µm, 0.22 NA, SMA-SMA Fiber Patch Cable | Thorlabs, Inc. | M37L01 | |
| Custom-Built Fiber-Optic Probe | Myriad Fiber Imaging | N/A | |
| 20% Spectralon Diffuse Reflectance Standard | Labsphere, Inc. | SRS-20-010 | |
| Standard Yellow Highlighter | Sharpie | 25005 | Multiple suppliers, proflavine or fluorescein can be substituted |
参考文献
- Muldoon, T. J., et al. Subcellular-resolution molecular imaging within living tissue by fiber microendoscopy. Opt Express. 15, 16413-16423 (2007).
- Rajaram, N., Reichenberg, J. S., Migden, M. R., Nguyen, T. H., Tunnell, J. W. Pilot clinical study for quantitative spectral diagnosis of non-melanoma skin cancer. Lasers Surg Med. 42, 716-727 (2010).
- Louie, J. S., Richards-Kortum, R., Anandasabapathy, S. Applications and advancements in the use of high-resolution microendoscopy for detection of gastrointestinal neoplasia. Clin Gastroenterol Hepatol. 12, 1789-1792 (2014).
- Chang, S. S., et al. High resolution microendoscopy for classification of colorectal polyps. Endoscopy. 45, 553-559 (2013).
- Muldoon, T. J., et al. Noninvasive imaging of oral neoplasia with a high-resolution fiber-optic microendoscope. Head Neck. 34, 305-312 (2011).
- Muldoon, T. J., et al. Evaluation of quantitative image analysis criteria for the high-resolution microendoscopic detection of neoplasia in Barrett's esophagus. J Biomed Opt. 15, 026027(2010).
- Prieto, S. P., Powless, A. J., Boice, J. W., Sharma, S. G., Muldoon, T. J. Proflavine Hemisulfate as a Fluorescent Contrast Agent for Point-of-Care Cytology. PLoS One. 10, e0125598(2015).
- Parikh, N., et al. In vivo diagnostic accuracy of high resolution microendoscopy in differentiating neoplastic from non-neoplastic colorectal polyps: a prospective study. Am J Gastroenterol. 109, 68-75 (2014).
- Shin, D., et al. Quantitative analysis of high-resolution microendoscopic images for diagnosis of esophageal squamous cell carcinoma. Clin Gastroenterol Hepatol. 13, 272-279 (2015).
- Prieto, S. P., et al. Qualitative and quantitative comparison of colonic microendoscopy image features to histopathology. Proc SPIE Int Soc Opt Eng. 9328, (2015).
- Greening, G. J., et al. Fiber-bundle microendoscopy with sub-diffuse reflectance spectroscopy and intensity mapping for multimodal optical biopsy of stratified epithelium. Biomed Opt Express. 6, 4934-4950 (2015).
- Rajaram, N., Gopal, A., Zhang, X., Tunnell, J. W. Experimental validation of the effects of microvasculature pigment packaging on in vivo diffuse reflectance spectroscopy. Lasers Surg Med. 42, 680-688 (2010).
- Spliethoff, J. W., et al. Monitoring of tumor response to cisplatin using optical spectroscopy. Transl Oncol. 7, 230-239 (2014).
- Chang, V. T., et al. Quantitative physiology of the precancerous cervix in vivo through optical spectroscopy. Neoplasia. 11, 325-332 (2009).
- Yu, B., Shah, A., Nagarajan, V. K., Ferris, D. G. Diffuse reflectance spectroscopy of epithelial tissue with a smart fiber-optic probe. Biomed Opt Express. 5, 675-689 (2014).
- Hennessy, R., Goth, W., Sharma, M., Markey, M. K., Tunnell, J. W. Effect of probe geometry and optical properties on the sampling depth for diffuse reflectance spectroscopy. J Biomedical Opt. 19, 107002(2014).
- Ghassemi, P., Travis, T. E., Moffatt, L. T., Shupp, J. W., Ramella-Roman, J. C. A polarized multispectral imaging system for quantitative assessment of hypertrophic scars. Biomed Opt Express. 5, 3337-3354 (2014).
- Vasefi, F., et al. Polarization-sensitive hyperspectral imaging in vivo: a multimode dermoscope for skin analysis. Sci Rep. 4, (2014).
- Winkler, A. M., Rice, P. F. S., Drezek, R. A., Barton, J. K. Quantitative tool for rapid disease mapping using optical coherence tomography images of azoxymethane-treated mouse colon. J Biomedl Opt. 15, 041512(2010).
- Bish, S. F., et al. Handheld Diffuse Reflectance Spectral Imaging (DRSi) for in-vivo characterization of skin. Biomed Opt Express. 5, 573-586 (2014).
- Prahl, S. A. Optical Absorption of Hemoglobin. , http://omlc.org/spectra/hemoglobin/ (1999).
- Rajaram, N., et al. Design and validation of a clinical instrument for spectral diagnosis of cutaneous malignancy. Appl Opt. 49, 142-152 (2010).
- Hennessy, R., Markey, M. K., Tunnell, J. W. Impact of one-layer assumption on diffuse reflectance spectroscopy of skin. J Biomed Opt. 20, 27001(2015).
- Rajaram, N., Nguyen, T. H., Tunnell, J. W. Lookup table-based inverse model for determining optical properties of turbid media. J Biomed Opt. 13, 050501(2008).
- Nichols, B. S., Rajaram, N., Tunnell, J. W. Performance of a lookup table-based approach for measuring tissue optical properties with diffuse optical spectroscopy. J Biomed Opt. 17, 057001(2012).
- Greening, G. J., James, H. M., Muldoon, T. J. Optical Phantoms: Diffuse and Sub-diffuse Imaging and Spectroscopy Validation. , SPIE Spotlights. 1-37 (2015).
- Karsten, A. E., Smit, J. E. Modeling and verification of melanin concentration on human skin type. Photochem Photobiol. 88, 469-474 (2012).
- Glennie, D. L., Hayward, J. E., Farrell, T. J. Modeling changes in the hemoglobin concentration of skin with total diffuse reflectance spectroscopy. J Biomed Opt. 20, 035002(2015).
- Lim, L., Nichols, B., Rajaram, N., Tunnell, J. W. Probe pressure effects on human skin diffuse reflectance and fluorescence spectroscopy measurements. J Biomed Opt. 16, 011012(2011).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。