需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
人全血中NK细胞杀伤活性的流式细胞仪分析
摘要
This work describes an advanced workflow for the accurate and fast determination of NK (Natural Killer) cell count and NK cell cytotoxicity in human blood samples.
摘要
NK细胞细胞毒性是一种广泛使用的度量,以确定外部干预的对NK细胞功能的影响。然而,该测定的准确性和重复性可以认为不稳定的,或者是因为用户的错误,或者因为NK细胞的实验操纵的敏感性。为了消除这些问题,即它们减少到最低限度的工作流正式成立,这里提出。为了说明,我们获得的血液样品中,在不同的时间点,从流道(N = 4)被提交给运动的激烈比赛的。首先,NK细胞被同时确定,并通过CD56标记和基于磁分选分离,直接从全血和从少1毫升。排序后的NK细胞被删除任何试剂或封盖抗体。他们可以以每毫升血液建立一个准确的NK细胞数量进行计数。其次,分类NK细胞(细胞效应或E)可以与3,3'- Diotade混合cyloxacarbocyanine高氯酸盐(DIO)标记的K562细胞(靶细胞或T)在一个测定最优1:5 T:E比率,并分析使用成像流式细胞仪,其允许每个事件的可视化和任何假阳性的消除或假阴性(如双峰或效应细胞)。该工作流可以在大约4小时内完成,并允许甚至与人类的样品时非常稳定的结果。空闲时,研究团队可以在人类受试者的测试几种实验的干预措施,并比较不同的几个时间点测量,而不影响数据的完整性。
引言
自然杀伤细胞是先天免疫系统的一个基本要素。而他们非常规,他们必须识别并通过细胞-细胞接触,而不事先活化1消除异常细胞的能力。因此,它们构成抵御感染的快速线。运动,尤其是剧烈的,已经显示出瞬时抑制免疫系统的2,3,4,5。 NK细胞是特别容易出现这种效果4,6,7,从而有效地创建增强疾病敏感性的一个窗口。因此,干预措施的研究之前,期间或剧烈运动后以减少其对NK细胞功能的影响的目的是为运动员后比赛福祉特别的兴趣。
然而,这种措施的研究是由多种因素复杂:1)的NK细胞是稀疏8,在白血细胞室的约1%; 2)NK细胞对压力非常敏感,依靠不断的暴露在生理条件下保持在实验过程中可行,稳定;和3)的标准测定法来确定NK细胞细胞毒性,如聚蔗糖梯度9和释放测定法10中 ,是不可靠的和不一致的。人样品的固有变异性只会加重了这些问题。干预期间收集的新鲜人类样本是相当受管制,很难弄到,相对于动物的样品或永生细胞系的至少。这减少的机会,重复实验或增加参与者的研究队列达到显著的统计阈值。总的来说,这些问题的支持简化协议,允许FO的需要R 2均高吞吐量和人类样品中NK细胞裂解活性的高可靠性分析。
我们建立了缩短所需的时间,以确定,同时尽量减少暴露于外来因素从人全血分离和测试NK细胞的工作流。该方法优化了使用两个仪器,在基于磁细胞分选和流式细胞仪的成像流,和一个特定的化验-,优化的T:E比率为允许减少或NK细胞细胞毒性的增加的检测。
Access restricted. Please log in or start a trial to view this content.
研究方案
注:所有采血程序是按照由阿巴拉契亚州立大学(ASU)机构审查委员会(IRB)规定的准则进行。
1.全采血车
- 有一个认证抽血根据世界卫生组织的指引抽血。
- 抽血到含有二钾乙二胺四乙酸14毫升采血管(K 2 EDTA)。根据制造商的说明倒置血液收集管。保持采血管在室温下在台式摇杆,直到分离。
2. DIO-标记的靶细胞的制备
- 生长K562细胞中完整的Iscove氏改良的Dulbecco氏培养基(IMDM)补充有10%胎牛血清(FBS)和1%青霉素链霉素为之前测定,以保证细胞的健康几个星期。调整concentrat细胞的离子至3×10 5个细胞/ mL每日通过的小区的完成计数和细胞随后通过。执行完整的媒体变化每2至3天。
- 在测定当天,执行使用1细胞计数:1血细胞计数。
- 从K562烧瓶除去10μL的并放入1.5毫升管中。
- 加台盼蓝染料的10微升到同为1.5毫升管为1:1的稀释因子:1。
- 轻轻一抖管混合K562细胞台盼蓝染料。
- 允许的K562细胞的台盼蓝染料孵育在室温下1分钟。
- 从管中取出染K562细胞的15微升。
- 吸移管到血球细胞计数。
- 算在四角方块细胞以及总共五个方块的中间正方形。
- 通过使用方程式计算细胞计数:
总细胞/ mL =总细胞数×(稀释倍数/平方数)×10000个/毫升
- 重悬的K562靶细胞以无血清IMDM培养基1×10 6个细胞/ ml的终密度。
- 对未染色的K562靶细胞,以1×10 6个细胞/ mL的密度加10毫升的K562靶细胞于一个15毫升管,共10×10 6个 K562细胞。放入37℃培养箱中,用5% 的 CO 2,直到准备使用。
- 对于DIO染的K562靶细胞,以1×10 6个细胞/ mL的密度加10毫升的K562靶向细胞于一个15毫升管,共10×10 6个 K562细胞。
- 添加细胞悬浮液的每毫升1 DIOμL的细胞标记溶液中指定为DIO染色,轻轻涡旋15ml试管。例如,以1×10 6个细胞/ mL的量添加的DIO细胞标记溶液10微升至10×10 6个 K562细胞/ ml。
- 在一个15毫升管20分钟孵育的K562-DIO溶液,在37℃,5%的CO 2。
- 跟随ING孵育,添加3毫升室温磷酸盐缓冲盐水(PBS),以含有15毫升管的K562-DIO溶液。
- 在室温下以135 xg离心离心10分钟。
- 小心取出上清液,而不会干扰与1000微升音量可调移液器细胞沉淀。
- 加入10 mL新鲜IMDM至15毫升管细胞含丸。
- 轻轻涡管向悬浮细胞。
- 重复步骤2.7至2.10两次。
- 商店的细胞在37℃培养箱,用5% 的 CO 2,直到准备使用。
注:细胞可以存储在培养箱长达24小时,但它是优选使用它们在同一天。
3.控制的制备
- 传输以下为单独的和适当的标记好的1.5毫升管:
- 补充新鲜IMDM 500微升含有悬浮DIO标记的K562细胞进入"双重利好"标记1.5毫升管。
- 加入新鲜的IMDM 500μL含有悬浮DIO标记的K562细胞进入"仅DIO"标记1.5毫升管。
- 添加含悬浮的未标记的K562细胞到新鲜的IMDM的500μL"碘化丙锭(PI)的唯一的"标记的1.5mL管中。
- 放置双阳性和PI仅管在55℃水浴中5分钟。
- 在5分钟已经过去之后,取出管和擦拭用70%的乙醇。
- 加入10升PI的双阳性和PI只有1.5毫升管。
- 放置所有三个的K562靶细胞对照在孵化器在37℃下30分钟。
- 后30分钟温育已经过去时,离心机所有三种的K562靶细胞对照为在163×g下2分钟。
- 小心取出上清液,而不会干扰细胞沉淀。
- 悬浮用新鲜的IMDM细胞培养基20μL的各控制,并在37℃培养箱,用5% 的 CO 2离开至少30分钟最佳DIO信号。
注意:控制现在已经准备好通过成像流式细胞仪运行。
4. NK细胞分离自动化
- 打开电池用隔板,并允许启动周期来完成。
- 确保所有液体的瓶子照明是绿色的,该废液瓶是空的。
- 获得室温15毫升管架。
注意:选择是基于样品体积。例如,对于一个容积小于3毫升使用15毫升管架和用于体积超过3毫升用50毫升管架。 - 标签样品管据此(每个样品/参与者重复):参与者1全血样品;参与者1负分数;参与者1正分数。
- 轻轻吸取1.5毫升的全血,从1.2步进入"全血样本"15毫升管。
- 从步骤4.5将适当标记的15毫升"全血样品"管和标签15毫升"阴性部分"和从管架4.4步"阳性分数"管。使用以下几部件样品架设置:行(R1)A:全血标本,行(R2)B:阴性,未标记的部分,行(R4)C:正,磁标记部分。
- 插入分隔架到MiniSampler为autolabeling。
- 选择"试剂"的菜单上并突出,其中所述小瓶将被放置在隔板架的位置。
- 选择"读取试剂"激活二维码阅读器。
- 放置在从读码器盖0.5-2.5厘米之间的二维码阅读器的前部的适当的试剂瓶中。
注意:例如,对于NK细胞分离所需要的试剂是CD56。 - 在二维码阅读器前最佳阅读的角度握住试剂瓶。
- 将试剂瓶到适当的分离器机架位置。
- 突出显示在屏幕上分离选项卡下的所需的位置。
- 从标签子菜单,分配一个保姆tolabeling程序。
- 分配细胞分离试剂CD56微珠机架位置1,2,3和4。
- 选择"posselwb"离职计划。
- 选择"冲洗"洗程序。
- 将在"卷"子菜单使用数字键盘1500μL的样本量。
- 选择键盘上的"Enter"选项。
- 选择"运行",启动细胞分离。
- 选择"确定",以确认有足够的缓冲区可用于处理所有样本。
5. NK细胞计数随着细胞分离
- 紧随与细胞分离细胞分离,检索阳性部分。留在室温下。这个级分含有所需纯的NK细胞群。
- 对于每个单独的样本,执行使用血球按照步骤2.2中的细胞计数。
- 计算后,记录细胞计数。
6.细胞毒性测定样品的制备
- 准备和相应的标签1.5 mL管每个样品/参与者。
- 吸管所需NK细胞和DIO-标有K562细胞比到每个管中。
注意:例如,K562靶细胞和NK效应细胞的所需的比例为1:5。 - 离心机在135×g下5分钟。
- 小心取出上清液,而不会干扰细胞沉淀。
- 重悬的NK-DIO标记的K562细胞混合物中的NK细胞培养基的500微升无白细胞介素-2(IL-2)和2-巯基乙醇(2-ME)(不完全的NK细胞培养基)。
注:不完全的NK细胞培养基是最低基本培养基Eagle用碳酸氢钠,不含L-谷氨酰胺,核糖核苷和脱氧核糖核苷。 - 添加5μL的PI的每管。
- 离心机在163×g下2分钟。
- 孵育细胞在37℃下2小时。
- 继2小时培养,centrifuGE在163×g的2分钟。
- 小心取出上清液,而不会干扰细胞沉淀。
- 悬浮细胞在25μL的不完整的NK细胞培养基。
7.准备自发的("S")样本
- 吸移管将500μlDIO标记K562细胞到1.5mL管中(1×10 6个细胞/ mL的浓度)。
- 加的PI的10微升每管。
- 离心管在163×g下2分钟。
- 孵育细胞在37℃下2小时。
- 继2小时培养,离心机在163×g的2分钟。
- 小心取出上清液,而不会干扰细胞沉淀。
- 悬浮细胞在25μl的不完整的α-最低必需培养基(α-MEM)的细胞培养介质。
8.数据采集与成像流式细胞仪
- 按成像前门内侧的绿色按钮,流式细胞仪,打开仪器。
- 打开人与成像相关联的升计算机流式细胞仪。
- 启动软件流式细胞仪成像流程。
- 点击"启动"按钮,冲洗系统,并准备样品线。
- 一旦"启动"完成后,关闭了"校准"窗口。
- 分配渠道:在顶部左侧,为了给它们分配点击每个通道上。
- 在右侧,点击散点图按钮创建4散点图:生最大像素_MC_6 VS Area_M06,原最大像素_MC_2 VS Area_M02,原最大像素_MC_5 VS Area_M05和FieldArea_M01 VS AspectRatio_M01。
- 开始先使用"双重利好"控制分析样品。
- 点击"加载"。
- 将1.5 ml管从3.4步"双积极"样品3.9到样品装载器。
- 在"放大"选项卡下面的40X目标。
- 打开405毫瓦642毫瓦的激光。
- 打开"明场"通道。
- 点击"选择强度。"
- 基于"双阳性"对照样品,确定为405毫瓦的激光所需的强度,这样,探测器不会过载。
注意:例如,对于这个实验的最佳强度设定在11毫瓦。
- 所需的设置,实现后,采集数据。
- 在"文件获取"选项卡,输入自定义的文件名的文本。选择保存数据文件(S)的文件夹。
- 进入细胞的数目,以获得下一个为"收集"。通常,这个数字1000之间变化至10000。
- 点击"采集"。
注意:一旦获取的细胞的期望数目时,数据文件自动保存先前选择的文件夹中。
- 收购完成后,加载下一个对照样品-迪欧唯一控制。
- 点击"加载"。
- 将1.5 ml管的"DIO只是"样品放入样品装载器。
- 请选中"放大"选项卡下的40倍的目标。
- 离开405毫瓦的激光开启。
- 关掉642毫瓦的激光和"明场"通道。
注意:现在,所需的设置已经实现,可以将数据获取。 - 在"文件获取"选项卡,输入自定义的文件名的文本并选择保存数据文件(S)的文件夹。进入细胞的数目,以获得下一个为"收集"。通常此数目为1,000。
- 点击"采集"。
注意:一旦获取单元的期望数量的数据文件自动保存先前选择的文件夹中。
- 重复步骤8.10,为"PI唯一的"对照样品。实验样品现已可供收集。
- 办理remaini纳克实验样品,其中包括"自发的"S"样本",如下所示:
- 请选中"放大"选项卡下的40倍的目标。
- 接通405毫瓦和642毫瓦的激光。
- 启用"明场"通道。
- 点击"组强度。"
- 在"文件获取"选项卡,输入自定义的文件名的文本并选择保存数据文件(S)的文件夹。输入自定义文件名的文本。
- 进入细胞的数量来获取旁边的"收集"。
- 点击"采集"按钮。
注意:一旦获取单元的期望数量的数据文件自动保存先前选择的文件夹中。
- 重复步骤8.12对所有实验样品。
- 所有的实验数据和文件已被收集后,点击"关闭"按钮,消毒系统。
9. IMAGIN摹流式细胞仪样品分析
- 打开流式细胞仪分析软件应用的摄像流动。
- 在"文件",打开一个实验.RIF文件。
- 建立一个使用单一颜色.RIF文件(DIO-只控制,只有PI控制,在步骤8.10和8.11创建)选择一个新的矩阵在成像流式细胞仪软件补偿选项卡下的"创建一个新的矩阵"。
注:该软件将提示输入单色文件的选择和将它们合并以创建一个矩阵文件(.ctm文件扩展名),即要被选择应用的信道补偿。 - 通过使用该软件的"积木"功能创建点图。
- 创建一个点图(BrightFieldGradient_RMS VS频率)门聚焦细胞。调用门"焦点访谈"( 图1A)。
- 使用"焦点访谈"门,共创美好的场区的点积VS明场长宽比至G吃了单细胞。调用门"单"( 图1B)。
- 使用"单次"门,创造Intensity_MC_Ch02的VS Intensity_MC_Ch5点图。使用此图来识别和门DIO阳性细胞只(目标,活的)和PI-DIO双阳性细胞(靶,死)( 图1C)。
注:所有地块的步骤9.4.1,9.4.2所述,9.4.3可以通过软件的"积木"功能来创建。
- 点击散点图的统计功能来访问每个门的细胞数量。
- 计算使用下面的公式自发样品中死目标和实验样品的百分比:
样品%的死目标=(#dead目标×100)/(#活靶子+ #dead目标) - 使用下列公式计算细胞毒性:
%细胞毒性= [(实验死自发死亡)/(100-自发性死亡)]×100
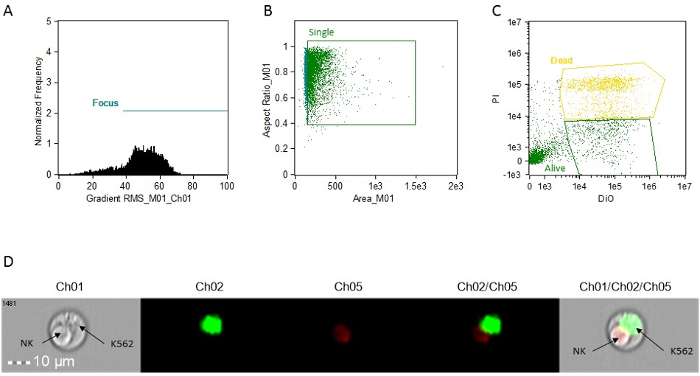
图1:代表直方图,散点图和图像细胞毒活性分析。 ( 一 )重点细胞分析。 (B)单细胞分析。 (C)靶细胞染色分析。所有测定都使用连接到每个事件的图象制作。这可以在分析软件,只需点击图形上的事件进行访问。 (D)一种双峰事件的代表图像,表示凋亡NK细胞和活的K562靶。 CH01,明视。 CH02,DIO。 CH05,PI。 请点击此处查看该图的放大版本。
Access restricted. Please log in or start a trial to view this content.
结果
NK细胞计数的测定
测定对全血中的NK细胞数重运行的效果,使用图2中描述的运动方案。血样的初始抽血后运动前拉伸,运动后即刻,运动后1.5小时,最后24小时和48小时。每全血毫升NK细胞的浓度为每个转轮( 图3A)和平均( 图3B)对每个时间点进行测量。
我们的研究结果( 图3A...
Access restricted. Please log in or start a trial to view this content.
讨论
在这项研究中所描述的方法直接测量一个人的NK细胞响应于刺激的比活性(在此特定情况下,长时间运动)。通常情况下,NK细胞是从使用密度梯度或细胞用标记物的组合排序一个人的血液中分离。虽然这些方法被广泛使用,它们具有许多缺点:它们是耗时的,涉及多个操作,并且在很大程度上依赖于用户的。其结果是,过度的应力被放置在分离的NK细胞,这可以导致增加的可变性,从实验进行实验...
Access restricted. Please log in or start a trial to view this content.
披露声明
The authors have nothing to disclose.
致谢
This project was supported by Agriculture and Food Research Initiative Competitive Grant no. 2100-68003-30395 from the USDA National Institute of Food and Agriculture.
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| K-562 lymphoblasts | ATCC | CCL-243 | |
| Iscove's Modified Dulbecco's Media | ATCC | 30-2005 | High glucose, with L-Glutamine, with HEPES, Sterile-filtered |
| Alpha Minimum Essential medium | ATCC | CRL-2407 | Without ribonucleosides and deoxyribonucleosides but with 2 mM L-glutamine and 1.5 g/L sodium bicarbonate |
| Trypan Blue Solution 0.4% | Amresco | K940-100ML | Tissue culture grade |
| Propridium Iodide Staining Solution | BD Pharmingen | 51-66211E | |
| Vybranto DiO cell-labeling solution | Vybranto | V-22886 | |
| autoMACS Pro Separator | Miltenyi Biotec | 130-092-545 | |
| autoMACS Running Buffer | Miltenyi Biotec | 130-091-221 | |
| autoMACS Washing Buffer | Miltenyi Biotec | 130-092-987 | |
| autoMACS Columns | Miltenyi Biotec | 130-021-101 | |
| Whole Blood CD56 MicroBeads, human | Miltenyi Biotec | 130-090-875 | |
| ImageStream X Mark II Imaging Flow Cytometer | EMD Millipore | ||
| Speedbeads | Amnis Corporation | 400030 | |
| 0.4-0.7% Hypochlorite (Sterilizer) | VWR | JT9416-1 | |
| Coulter Clenz | Beckman Coulter | 8546929 | |
| 70% Isopropanol (Debubbler) | EMD Millipore | 1.3704 | |
| D-PBS (Sheath fluid) | EMD Millipore | BSS-1006-B (1X) | No calcium or magnesium |
| INSPIRE Software | EMD Millipore | Version Mark II, September 2013 | |
| Ideas Application Software | EMD Millipore | Version 6.1, July 2014 |
参考文献
- Cerwenka, A., Lanier, L. L. Natural killer cells, viruses and cancer. Nat Rev Immunol. 1 (1), 41-49 (2001).
- Nieman, D. C. Exercise, infection, and immunity. Int J Sports Med. 15, Suppl 3 131-141 (1994).
- Romeo, J., Warnberg, J., Pozo, T., Marcos, A. Physical activity, immunity and infection. Proc Nutr Soc. 69 (3), 390-399 (2010).
- Nieman, D. C. Marathon training and immune function. Sports Med. 37 (4-5), 412-415 (2007).
- Simpson, R. J., Kunz, H., Agha, N., Graff, R. Exercise and the Regulation of Immune Functions. Prog Mol Biol Transl Sci. 135, 355-380 (2015).
- Walsh, N. P., et al. Position statement. Part one: Immune function and exercise. Exerc Immunol Rev. 17, 6-63 (2011).
- Timmons, B. W., Cieslak, T. Human natural killer cell subsets and acute exercise: a brief review. Exerc Immunol Rev. 14, 8-23 (2008).
- Westermann, J., Pabst, R. Distribution of lymphocyte subsets and natural killer cells in the human body. Clin Investig. 70 (7), 539-544 (1992).
- Boyum, A. Isolation of leucocytes from human blood. Further observations. Methylcellulose, dextran, and ficoll as erythrocyteaggregating agents. Scand J Clin Lab Invest Suppl. 97, 31-50 (1968).
- McMillan, R., Scott, J. L. Leukocyte labeling with 51-Chromium. I. Technic and results in normal subjects. Blood. 32 (5), 738-754 (1968).
- Berk, L. S., et al. The effect of long endurance running on natural killer cells in marathoners. Med Sci Sports Exerc. 22 (2), 207-212 (1990).
- McAnulty, L. S., et al. Effect of blueberry ingestion on natural killer cell counts, oxidative stress, and inflammation prior to and after 2.5 h of running. Appl Physiol Nutr Metab. 36 (6), 976-984 (2011).
- Millard, A. L., et al. Brief Exercise Increases Peripheral Blood NK Cell Counts without Immediate Functional Changes, but Impairs their Responses to ex vivo Stimulation. Front Immunol. 4, 125(2013).
- Janeway, C. A., Travers, P., Walport, M., Shlomchik, M. J. Immunobiology: The Immune System in Health and Disease. 5th edn. , Garland Science. (2001).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。