需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
制造的UV-Vis和拉曼光谱免疫平台
摘要
Nanoparticle-based optical probes have been designed as a vehicle for detecting antigens using Raman and UV-Vis spectroscopy. Here we describe a protocol for preparing such probes for a UV-Vis/Raman spectroscopy immunoassay in such a way to incorporate future multiplexing capabilities.
摘要
免疫测定用于检测基于相关联的抗体的存在的蛋白质。因为他们的研究和临床广泛使用,免疫仪器和材料的大型基础设施都可以找到。例如,96和384孔聚苯乙烯板是市售的,并有一个标准设计,以容纳不同制造商紫外可见(UV-VIS)光谱法的机器。此外,各种各样的免疫球蛋白,检测标记和定制免疫测定的设计,如酶联免疫吸附测定(ELISA)阻断剂是可用的。
尽管现有的基础设施,标准ELISA试剂盒不符合所有研究的需要,要求个体免疫的发展,这可能是昂贵和费时的。例如,酶联免疫吸附试剂盒具有低复用(一次检测多于一种分析物的)的能力,因为它们通常依赖于荧光或栏orimetric方法进行检测。比色法和基于荧光分析已经有限的,由于宽光谱峰复用功能。与此相反,拉曼基于光谱的方法有用于复更大能力由于窄发射峰。拉曼光谱的另一个优点是,喇曼记者遇到显著少漂白比荧光标签1。尽管优势拉曼记者有超过荧光灯和比色标记,协议制造基于拉曼免疫是有限的。本文的目的是提供一种协议来制备官能化的探针结合使用以用于直接检测由UV-VIS分析和拉曼光谱的分析物的聚苯乙烯板。该协议将允许研究人员同时在预先建立的基础设施资本采取做它自己的方式为未来的多分析物检测。
引言
典型的三明治免疫测定法间接检测使用两种抗体的抗原的存在。捕获抗体结合至固体表面,并形成一种抗体 - 抗原时复杂接近适当的抗原。然后,检测抗体被引入并与抗原结合。洗涤后,将抗体/抗原/抗体复合物的遗体和由标记的检测抗体, 如图1A表明被检测到。典型的检测是通过荧光或比色检测完成后,限制了复用,由于宽光谱峰2,3 10分析物。相反,基于拉曼系统具有导致与源声称高达100分析物2,3的同时检测增强复用功能窄得多的发射峰。
许多文献资料都可以覆盖到免疫测定相关的重要方面4 - 6如一步一步细节打造个性化的ELISA试剂盒。不幸的是,这些协议是用于荧光或比色检测,限制定制免疫测定的复用能力。为了满足这一需求,我们提出了一个详细过程来制作, 如图1B所示此前7直接免疫公布的紫外-可见分光光度计/拉曼免疫。
这个协议包括官能化金基于纳米颗粒探针的制造中,在图2中所示,使拉曼/紫外可见探针通过拉曼记者结合金纳米颗粒的表面(金纳米粒子)开始的过程。该金纳米粒子,然后与使用聚乙二醇(PEG)相关抗体官能化。在金纳米粒子其余结合位点通过结合甲氧基聚乙二醇硫醇(MPEG-SH)至金纳米粒子,以防止在分析过程中后续的非特异性结合阻断。的制备金纳米粒子探针通过结合到抗原测试如在图1B所示固定到聚苯乙烯板的孔中。在洗涤所述板,所述金纳米粒子探针使用UV-Vis光谱检测到,同时用拉曼光谱检测相关的拉曼记者。结合紫外 - 可见和拉曼光谱数据提供分析的两种方法,从而增强该免疫的能力。
研究方案
1.缓冲区的制备
- 磷酸盐缓冲盐水(PBS)中
- 稀释50毫升10倍的PBS用450ml HPLC级水,使1×PBS中的浓度。无菌过滤器以0.22微米过滤器的溶液。
- 在室温下商店溶液。
- Tris缓冲盐水+吐温20(TBST)的制备
- 稀释50毫升10倍的Tris缓冲盐水(TBS)中的用450ml HPLC级水,使1×浓度。加入250微升吐温20的吐温20的0.05%(体积/体积)。无菌过滤器以0.22微米过滤器的溶液。
- 室温保存。
- 人血清白蛋白的制备(HSA)的封闭液
- 权衡0.45克的HSA为15个毫升无菌过滤的1×PBS中,以使3%w / v的HSA溶液。涡的解决方案,直到HSA完全溶解。
- 在4°C储存HSA解决方案。
注意:牛血清白蛋白(BSA)也可以用来作为封闭液。
- PEG化的抗体的制备(PEG-AB)溶液
注:抗体溶液必须是自由的,从载体或稳定的蛋白质如牛血清白蛋白,这将通过为N-羟基琥珀酰亚胺(NHS)的结合位点的竞争与缀合反应干扰。如果抗体是在一个的Tris或甘氨酸缓冲液溶液,它必须经过缓冲液交换,以防止胺或铵盐从与NHS缀合反应的干扰。如果抗体是在冻干形式,它可以根据制造商的在1-10毫克/毫升的浓度推荐再悬浮。- 对于Tris或甘氨酸缓冲液的抗体,执行使用脱盐柱的缓冲液交换至100mM碳酸氢钠。使用100mM的缓冲液将pH值提高至约8.5,以加快缀合反应。
- 水合物邻吡啶基二硫化物-PEG-NHS(OPSS-PEG-NHS)用100mM小号裂果碳酸氢到以1mg / ml或更高的浓度的1毫升的体积。
注:OPSS-PEG-NHS应新鲜和大约20分钟内使用。在OPSS-PEG-NHS的NHS基团具有约20分钟的半衰期在pH 8.5的水溶液。 - 添加OPSS-PEG-NHS在一个2的抗体溶液:1的比例(PEG:抗体)缀合比率要用于测试样品。在一个单独的离心管中,加入OPSS-PEG-NHS在一个2的抗原溶液:1结合比例要用于控制。
注:2:1的比例是假设50%的缀合效率。的目的是标记各抗体与一个PEG链。在这个步骤中,过贴标比下标记更好。使用下面的公式来确定OPSS-PEG-NHS和抗体溶液的适当体积:
其中V是体积,C是在分子或表达的浓度每毫升tibodies。标PEG和AB是OPSS-PEG-NHS和抗体,分别为。最终的体积应为大约250微升。 - 孵育的PEG抗体溶液在4℃下8小时或过夜。在-20°C的工作约25微升等分限制冻融循环,并确保使用低结合管存储解决方案。
2.准备紫外 - 可见光/拉曼探头
- 准备裸金纳米粒子的解决方案
- 制备金纳米粒子的2ml的溶液每毫升约1×10 11粒子的浓度。
- 如果纳米金需要集中,补低结合离心管股票金纳米粒子的2000微升和离心5000 XG 20分钟或直到上清液是显而易见的。吹打除去上清液,小心不要去打扰金纳米粒子沉淀。
- 结合剩余的金纳米粒子溶液加入一个试管并估计concentra通过获得紫外可见测量和值,因为这是一个线性关系进行比较,以已知浓度和灰。
- 制备金纳米粒子的2ml的溶液每毫升约1×10 11粒子的浓度。
- 确定合适的拉曼记者标记比率
- 制备拉曼记者溶于甲醇的工作溶液。该浓度将取决于所使用的记者。在这项工作中,以200μM的工作溶液制备3,3'- diethylthiatricarbocyanine碘(DTTC)。
- 假定100微升的每个的终体积以及,补充足够的工作记者溶液到96孔板中第一行的每一孔中,使得拉曼记者将浓度范围在0.2到10μm。加入足够的HPLC级水至每个孔,使得体积为80微升。加入20μl金纳米粒子的到各孔使100微升的每个的终体积良好。一个例子是在表1中提供。
- 测量UV-Vis光谱400至使用板阅读紫外可见分光光度计700纳米。适当的浓度与用于UV-Vis光谱中定义的峰的最高浓度。在浓度增加,直到拉曼记者金纳米颗粒的最高浓度比重复步骤2.2.2中找到。
注:染料和金纳米粒子的形状,大小,和制造商影响适当的浓度。因此,列出的步骤,必须根据所使用的部件进行评估和修改。该协议涉及使用带正电荷的染料。因此,金纳米粒子和记者之间的结合是通过使用带负电荷的金纳米粒子的改善。这是通过使用柠檬酸盐封端金纳米粒子进行。详细内容见讨论部分。
- 结合拉曼记者和PEG抗体,以金纳米粒子
- 制备金纳米粒子和拉曼记者两1.5毫升批次在预先确定的浓度,允许拉曼记者结合到纳米金在室温下30分钟。
- 聚乙二醇化抗体(PEG-AB)添加到一个批金纳米粒子和拉曼记者溶液来创建200:抗体与颗粒1的比例。这种解决方案将是为测试样品。在一个单独的离心管中,加入聚乙二醇化抗原与其它批次在200金纳米粒子和拉曼记者溶液:抗体的1比例的颗粒被用作对照。孵育在室温下30分钟的解决方案。
注:抗体与粒子的比率将是特定于金纳米粒子和染料使用,应为每个单独的情况下被优化。这里的目的是为了有抗体的比例最高为金纳米粒子探针结合而防止颗粒聚集。用下面的公式来确定适当的卷加在一起:
其中V是体积,C是在每毫升的颗粒或抗体表达的浓度。翅片人体积应为约1.5毫升
- 其余座采用MPEG-SH的金纳米粒子表面上的网站。
- 由固体甲氧基聚乙二醇硫醇溶解到使用水200μM的浓度制备的mPEG-SH。涡溶液直到的mPEG-SH被完全溶解。
- 添加的mPEG-SH在40,000:1的比例,在步骤2.3所作的金纳米粒子-PEG抗体溶液。在室温下孵育该溶液10分钟,以确保在金纳米粒子的剩余位置被阻断。用下面的公式来确定适当的卷加在一起:
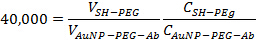
其中V是体积,C是在每毫升的颗粒或抗体表达的浓度。最终的体积应为约1.5毫升
- 恢复功能化拉曼探头。
- 离心颗粒在5000 XG在低绑定C的20分钟entrifuge管或直至上清液是明确的。吹打小心不要打扰金纳米颗粒去除上清。
- 用1ml的1×PBS溶液先前制成悬浮颗粒。通过取溶液(3微升)的一个小体积的紫外可见测量估算金纳米粒子浓度,并比较结果从已知金纳米粒子浓度测量。调整音量,使得最终溶液是每毫升至少为1×10 11颗粒。
- 在4℃储存的解决方案,直到它被用于免疫测定板的官能。一周内使用的解决方案。
| 卷添加每个组件(毫升) | |||
| DTTC终浓度(MM) | DTTC工作溶液(200毫摩尔) | 金纳米粒子 | 水 |
| 0.2 | 0.1 | 20 | 79.9 |
| 0.6 | 0.3 | 20 | 79.7 |
| 1 | 0.5 | 20 | 79.5 |
| 2 | 1.0 | 20 | 79 |
| 五 | 2.5 | 20 | 77.5 |
| 7 | 3.5 | 20 | 76.5 |
| 10 | 5 | 20 | 75 |
表1. DTTC稀释例子。DTTC的各种稀释液和股票DTTC,金纳米颗粒溶液,和水的相关卷。
3.免疫板准备
- 结合所需抗原的免疫测定板。
- 准备足够的稀释抗原(50微克/毫升),以填补聚苯乙烯井。涡的解决方案,并立即将溶液加入到板的孔中。允许所述抗原结合到板在室温下1小时。
- 洗掉未结合的抗原。
- 倾倒溶液放入处理容器,打对抗纸巾覆盖桌面板去掉多余的抗原的解决方案。
- 添加TBST到孔洗表面,然后取出洗净以同样的方式如前所述。重复此步骤两次。
- 在板块剩余的结合位点以防止非特异性结合。
- 加70微升的HSA封闭溶液至板的各孔中,在室温下孵育30分钟。
- 除去并在步骤3.2中指定冲洗使用相同的步骤的板。覆盖在4℃在板和商店干燥,直到准备用于进一步使用。
- 功能化免疫板。
- 加入70微升的t他探针在第2制备一个96孔板的第一列的纳米颗粒,并用1稀后续列:2系列稀释。允许所述板孵育至少1小时。如何制备免疫测定板的例子在图3中给出。
- 用TBST洗板五倍步骤详细说明3.2,并确保适当处置金纳米粒子。最后一次洗涤后,加70微升1×PBS中的各孔中,用板密封覆盖。
注:对照样品应当明确。如果非特异性结合已经发生,则控制样本将具有类似的颜色作为试验样品。
- 通过紫外-可见和拉曼光谱测试测定灵敏度。
- 对于每个孔,测量UV-Vis光谱使用平板读取紫外可见分光光度计范围从400至700纳米。
- 使用倒置拉曼显微镜,聚焦物镜上具有金纳米粒子探针的孔的表面上。 OB覃的井的拉曼光谱。采集的光谱范围1800 -1 400 -1。重复此步骤,所有的井。
- 使用适当的光谱软件,执行对拉曼光谱的11 阶多项式基线校正和一个三阶多项式的UV-Vis光谱。
- 使用适当的光谱软件,正常化拉曼和UV-Vis光谱。最大值设置为1,并相应地缩放所有其他值。正常化的拉曼光谱中,选择一个独特的聚苯乙烯峰值并将它设置为1,并相应地缩放所有其他值。
- 使用适当的光谱软件,执行峰积分对每个光谱。对于拉曼光谱,代表拉曼记者峰值必须位于区域不存在聚苯乙烯的峰。执行峰积分,指定所期望的峰的积分界限并记录对于所有样品包括对照的所需峰面积。
- PL加时赛感兴趣的平均峰面积作为日志的金纳米粒子浓度与每个点表示其相关联的标准偏差误差线的的功能。适合这些校准点至4参数逻辑曲线。
- 通过平均为空白样品感兴趣的峰的面积测定空白的平均值。确定这些区域的标准偏差;这是空白的标准偏差。
- 对于在先前步骤中所分析的相同的峰值,发现峰面积为最低浓度的标准偏差。
- 作为代表结果部分规定计算检测的空白,下限的限制。使用与4PL校准曲线这些值来确定金纳米粒子浓度而言LLOD。
结果
在这项研究中,被用于UV-Vis光谱60nm的金颗粒。紫外可见从收集400〜700纳米,峰面积为每个金纳米粒子浓度使用开放源码频谱分析软件8确定吸收光谱。峰值积分之前,所收集的光谱使用三点多项式拟合进行基线校正。峰面积被用作图4中展示了生成的对数的校准曲线,它应该指出的是图4和5结合对数的校准曲线。采用非线性校正曲线可以显著扩大的检测...
讨论
在详细的协议,有解决几个关键点。一个问题是拉曼记者和金纳米粒子的选择。虽然该协议被写入适于个人使用,拉曼记者DTTC用作一个例子。 DTTC是带正电的记者和结合至带负电荷的表面,如柠檬酸盐封端的金纳米粒子。该协议可以通过使用金纳米颗粒带有正表面电荷适于带负电荷的记者。例如,聚乙烯亚胺(PEI)封端的AuNPs提供正的表面电荷和带负电荷的记者更好结合。
维...
披露声明
The authors declare that they have no competing financial interests.
致谢
This work was supported by a Research Catalyst Award from Utah State University. The authors would like to thank Annelise Dykes, Cameron Zabriskie, and Donald Wooley for their contributions.
材料
| Name | Company | Catalog Number | Comments |
| 60 nm Gold Nanoparticle | Ted Pella, Inc. | 15708-6 | These are citrate capped gold nanoparticles. Please see Discussion for relationship between Raman reporter and AuNP surface charge and its imporance to proper selection of AuNP and/or Raman reporter. |
| Sodium Bicarbonate | Fisher Scientific | S233-500 | |
| Methanol | Pharmco-Aaper | 339000000 | |
| Tris Buffered Saline (10x) pH 7.5 | Scy Tek | TBD999 | |
| Bottle Top Filtration Unit | VWR | 97066-202 | |
| Tween 20 (polysorbate 20) | Scy Tek | TWN500 | Used as an emulsifying agent for washing steps. |
| Phosphate Buffered Saline 10x Concentrate, pH 7.4 | Scy Tek | PBD999 | |
| Protein LoBind Tube 2.0 ml | Eppendorf Tubes | 22431102 | LoBind tubes prevent binding of proteins and AuNPs to surfaces of the tubes. |
| Protein LoBind Tube 0.5 ml | Eppendorf Tubes | 22431064 | LoBind tubes prevent binding of proteins and AuNPs to surfaces of the tubes. |
| Microplate Devices UniSeal | GE Healthcare | 7704-0001 | Used for sealing and storing functionalized plates. |
| Assay Plate, With Low Evaporation Lid, 96 Well Flat Bottom | Costar | 3370 | |
| HPLC grade water | Sigma Aldrich | 270733-4L | |
| 3,3′-Diethylthiatricarbocyanine iodide (DTTC) | Sigma Aldrich | 381306-250MG | Raman reporter |
| mPEG-Thiol, MW 5,000 - 1 gram | Laysan Bio, Inc. | MPEG-SH-5000-1g | |
| OPSS-PEG-SVA, MW 5,000 - 1 gram | Laysan Bio, Inc. | OPSS-PEG-SVA-5000-1g | OPSS-PEG-SVA has an NHS end. |
| Mouse IgG, Whole Molecule Control | Thermo Fisher Scientific | 31903 | Antigen |
| Goat anti-Mouse IgG (H+L) Cross Adsorbed Secondary Antibody | Thermo Fisher Scientific | 31164 | Antibody |
| Human Serum Albumin Blocking Solution | Sigma Aldrich | A1887-1G | Bovine serum albumin can be used instead. |
| Mini Centrifuge | Fisher Schientific | 12-006-900 | |
| UV-Vis Spectrophotometer | Thermo Scientific | Nanodrop 2000c | |
| UV-Vis Spectrophotometer | BioTek | Synergy 2 | |
| Desalting Columns | Thermor Scientific | 87766 | |
| In-house built 785 nm inverted Raman microscope unit | N/A | N/A | An inverted Raman microscope is best for proper focusing onto surface of the well plate. Otherwise a very low magnification will be used due to height of the 96-well plate. An in-house built system was used as it was cheaper than buying from a vendor. However, any commercially available inverted Raman microscope system can be used. |
参考文献
- Israelsen, N. D., Hanson, C., Vargis, E. Nanoparticle properties and synthesis effects on surface-enhanced Raman scattering enhancement factor: an introduction. Sci. World J. , e124582 (2015).
- Wang, Y., Schlücker, S. Rational design and synthesis of SERS labels. Analyst. 138 (8), 2224-2238 (2013).
- Wang, Y., Yan, B., Chen, L. SERS tags: novel optical nanoprobes for bioanalysis. Chem. Rev. 113 (3), 1391-1428 (2013).
- . . The Immunoassay Handbook: Theory and applications of ligand binding, ELISA and related techniques. , (2013).
- Cox, K. L., Devanarayan, V., Kriauciunas, A., Manetta, J., Montrose, C., Sittampalam, S. Immunoassay Methods. Assay Guid. Man. , (2004).
- . . ELISA development guide. , (2016).
- Israelsen, N. D., Wooley, D., Hanson, C., Vargis, E. Rational design of Raman-labeled nanoparticles for a dual-modality, light scattering immunoassay on a polystyrene substrate. J. Biol. Eng. 10, (2016).
- Menges, F. . Spekwin32 - optical spectroscopy software. Version 1.72.1. , (2016).
- Findlay, J. W. A., Dillard, R. F. Appropriate calibration curve fitting in ligand binding assays. AAPS J. 9 (2), E260-E267 (2007).
- Yu, X. Quantifying the Antibody Binding on Protein Microarrays using Microarray Nonlinear Calibration. BioTechniques. 54, 257-264 (2013).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. Clin. Biochem. Rev. 29 (Suppl 1), S49-S52 (2008).
- . . EP17-A2: Evaluation of Detection Capability for Clinical Laboratory Measurement Procedures; Approved Guideline. 32. No 8, (2012).
- Leigh, S. Y., Som, M., Liu, J. T. C. Method for assessing the reliability of molecular diagnostics based on multiplexed SERS-coded nanoparticles. Plos One. 8 (4), e62084 (2013).
- Sinha, L. Quantification of the binding potential of cell-surface receptors in fresh excised specimens via dual-probe modeling of SERS nanoparticles. Sci. Rep. 5, 8582 (2015).
- Shi, W., Paproski, R. J., Moore, R., Zemp, R. Detection of circulating tumor cells using targeted surface-enhanced Raman scattering nanoparticles and magnetic enrichment. J. Biomed. Opt. 19, 056014 (2014).
- Xia, X., Li, W., Zhang, Y., Xia, Y. Silica-coated dimers of silver nanospheres as surface-enhanced Raman scattering tags for imaging cancer cells. Interface Focus. 3 (3), 20120092 (2013).
- McLintock, A., Cunha-Matos, C. A., Zagnoni, M., Millington, O. R., Wark, A. W. Universal surface-enhanced Raman tags: individual nanorods for measurements from the visible to the infrared (514-1064 nm). Acs Nano. 8 (8), 8600-8609 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。