需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
生产,结晶和结构测定
摘要
Proline-proline endopeptidase-1 (PPEP-1) is a secreted metalloprotease and promising drug-target from the human pathogen Clostridium difficile. Here we describe all methods necessary for the production and structure determination of this protein.
摘要
New therapies are needed to treat Clostridium difficile infections that are a major threat to human health. The C. difficile metalloprotease PPEP-1 is a target for future development of inhibitors to decrease the virulence of the pathogen. To perform biophysical and structural characterization as well as inhibitor screening, large amounts of pure and active protein will be needed. We have developed a protocol for efficient production and purification of PPEP-1 by the use of E. coli as the expression host yielding sufficient amounts and purity of protein for crystallization and structure determination. Additionally, using microseeding, highly intergrown crystals of PPEP-1 can be grown to well-ordered crystals suitable for X-ray diffraction analysis. The methods could also be used to produce other recombinant proteins and to study the structures of other proteins producing intergrown crystals.
引言
难辨梭状芽孢杆菌是院内抗生素相关性腹泻感染1的主要原因之一。这种革兰氏阳性厌氧细菌通过其孢子形式通过粪 - 口途径传播。在过去的十年,新的'流行''或''超毒'株( 如 BI / NAP1 / 027)造成的在北美和欧洲的2个新的感染和死亡率急剧增加。 艰难梭菌病机相关性(CDAD)是一种威胁生命结肠炎的高死亡率3。症状的范围从腹泻4至伪膜性肠炎5和经常致命的中毒性巨结肠6。
CDAD治疗是困难的,因为该毒株是耐多药,复发率高7。此刻疗法包括抗生素甲硝唑,fidaxomicin或万古霉素,或者在repetitively复发病例粪便菌群移植。新的治疗策略,迫切需要8。一些进展记录为治疗性单克隆抗体Bezlotoxumab,瞄准艰难梭菌毒素B 9,日前顺利通过III期临床试验,并申请了与FDA和EMA的批准。此外,新的抗生素被此刻测试在临床试验10的不同阶段。
要制定有效的治疗新的治疗靶点必须进行标识。最近发现的艰难梭菌蛋白酶脯氨酸脯氨酸内肽酶-1(PPEP-1; CD2830 / Zmp1; EC 3.4.24.89)是这样一种有前途的靶,如在敲除菌株缺乏PPEP-1的降低的C毒力。难辨体内 11。 PPEP-1是分泌金属蛋白酶12,13在它们的C-末端裂解2 梭状粘附13从而释放粘合杆菌IA从人体肠道上皮细胞。因此,参与维持艰难梭菌的固着和能动表型之间的平衡。为了开发选择性抑制剂对PPEP-1,了解它是如何认识它的底物的三维结构的深入了解是必不可少的。我们已经解决PPEP-1单独和复合物的第一晶体结构的衬底的肽14。 PPEP-1是第一个已知的蛋白酶的两个脯氨酸残基的15之间选择性裂解肽键。其结合在双扭结方式在基片和通过位于在S环覆盖蛋白酶活性位点14个残基的延伸脂族-芳族的网络稳定它。此底物结合模式是唯一的PPEP-1和人蛋白酶迄今未找到。这使得它有前途的药物靶标,以及脱靶酶抑制剂不太可能的影响。
为了发展和屏幕选择PPEP-1 INHibitors在将来需要大量的纯净,单分散PPEP-1蛋白。此外,为了确定与PPEP-1第一抑制剂,共晶体结构的结合将要确定的模式。在我们的手中PPEP-1不断推出共生晶体。因此,我们已开发出一种优化过程,以产生PPEP-1的单衍射质量的晶体。在这个协议中,我们详细描述了PPEP-1 14的生产,纯化,结晶和结构的解决方案。我们在缺乏分泌信号序列,亲和层析和大小排阻色谱法除去纯化标记的一个PPEP-1变体的大肠杆菌用胞内表达,随后通过锌单波长异常色散microseeding 16成优化屏幕和结构确定(锌- SAD)17。这个协议可以适于生产和结构确定的其他蛋白质( 例如</ em>的金属蛋白酶),特别是用于生产共生晶体蛋白质。根据要求,构建体的质粒DNA(质粒pET28a-NHIS-rPPEP-1)和衍射数据可以提供用于教育目的。
研究方案
1.克隆和构造设计
- 克隆艰难梭菌 PPEP-1的密码子优化的序列(用于大肠杆菌 ),而不该信号肽[氨基酸27-220,命名以下重组PPEP-1(rPPEP-1)11]成使用的Nde I的的pET28a载体和Xho I限制性位点( 图1)与在3'-端(所得载体pET28a-NHIS-rPPEP-1)一个终止密码子。这将产生一个N-末端6xHis标签蛋白(NHIS-rPPEP-1)与凝血酶切割位点允许在纯化过程中除去标记( 图1)。该质粒含有用于选择的卡那霉素抗性盒。用于克隆的引物被别处14中描述。
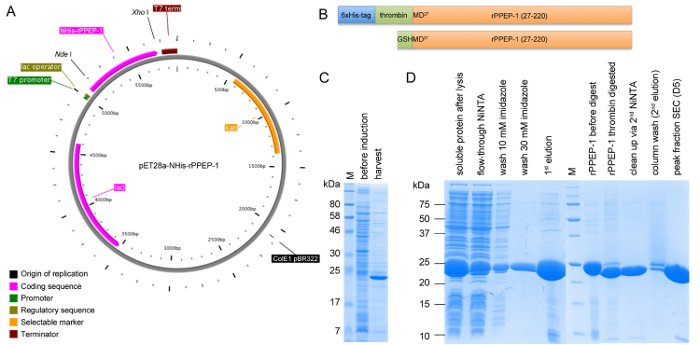
图1:expre的构造的pET28a-NHIS-rPPEP-1和SDS-PAGE分析的示意图裂变和所有纯化步骤。 (A)NHIS-rPPEP-1的矢量地图使用无损检测 I / Xho I 位与PlasMapper创建克隆到载体的pET28a。 (B)中的NHIS-rPPEP-1构建体(上面板)的示意图,并与在N末端(下图)所得的附加GSHM-序列的6xHis标签的凝血酶裂解后的最终构建体。在37℃下从所有纯化步骤(:分子量标记M),4小时和样品的(D)在BL21(DE3)星表达的SDS-PAGE分析(C)。 请点击此处查看该图的放大版本。
2.表达及rPPEP-1的纯化
- NHIS-rPPEP-1的表达
- 补和高压釜的LB(LB培养基)培养基(10克/升胰蛋白胨,5克/升酵母提取物,10克/升的NaCl,adju日至pH为7.5,用NaOH)。用硫酸卡那霉素(50微克/毫升)之前使用(LB /侃介质)的补充。
- 在LB /简中新鲜的转化大肠杆菌接种200毫升过夜培养。在37℃下以220rpm振荡生长过夜。
- 第二天早晨,检查过夜培养的OD 600(在600纳米波长的光密度)。接种2 2.8升百思不得其解每个含有1升LB /侃培养基中过夜培养至OD 0.1 600瓶。与水 - 有机硅乳液的三滴补充,以防止形成泡沫过多。生长在37℃的细胞以180rpm振荡培养直至OD 600达到0.6。
- 取为SDS-PAGE分析一个感应前样品(从一个培养1毫升当量在OD 600 = 1);添加IPTG至0.5mM的最终浓度来诱导NHIS-rPPEP-1的表达。继续在37℃/ 180rpm下4小时增长。
- 确定在10倍迪OD 600lution并采取样品的收获(1毫升相当于从文化的OD 600 = 1)。
- 收集细胞离心在7000 xg离心20分钟,4℃。从1升培养物除去残留的LB培养基重悬细胞沉淀在40ml TBS缓冲液(Tris-缓冲盐水:20mM的Tris-盐酸,pH值7.5,200mM的NaCl)中,并转移到50毫升离心管中。收集细胞离心以10,000 xg离心10分钟,4℃,并存储在-80℃下直到使用。通过分析SDS-PAGE 18表达(总裂解液和可溶性分数)。
- 未标记rPPEP-1的纯化
- 取为SDS-PAGE分析每个纯化步骤的50微升样品。从在TBS缓冲液1L培养的补充有10微克/毫升DNA酶I重悬细胞沉淀。使用5毫升TBS / DNA酶I的每克细胞。
- 裂解的细胞上,用30%的幅度为15分钟(2 2秒暂停秒脉冲)冰/水中超声处理。通过CENTR清除杂物ifugation为以10,000 xg离心10分钟,4℃,并转移上清液至超速离心管。在30分钟的超速离心澄清的裂解16.5万XG和4℃。
- 在4-6℃的工作。用蠕动泵或色谱系统平衡2毫升镍 - 次氮基三乙酸(NiNTA)树脂在用补充有10mM咪唑pH为7.5的TBS缓冲液中的玻璃柱。另外,利用重力流。
- 调整用1M咪唑pH为7.5的澄清的裂解液以10mM的终浓度。适用的裂解物的柱,并用补充有10毫米和30 mM咪唑,分别TBS缓冲液洗逐步,直到在280紫外吸收波长已经达到基线。
- 洗脱与TBS缓冲液加250 mM咪唑的蛋白质。重新平衡色谱柱至补充有10mM咪唑的TBS并存储过夜。
- 通过使用消光coeffi确定在280nm的蛋白浓度或的cient 25900 M -1 -1或通过任何其它方法( 例如 Bradford方法19)。加2单位每毫克蛋白凝血酶并在4℃下过夜透析的蛋白溶液对50倍体积的TBS(在NiNTA洗脱体积的50倍)。
注:采取正确的空白测定蛋白质的浓度,如咪唑在280 nm处强烈吸收。 - 越过平衡NiNTA树脂的蛋白质溶液以除去未裂解的蛋白。接下来,应用的TBS的相同体积的补充有10mM咪唑到塔以回收所有裂解蛋白。要清洁柱,洗脱用250mM咪唑所有剩余的蛋白质。分析通过SDS-PAGE( 图1)的样品。
- 集中在10分钟的间隔将蛋白质溶液到4ml在4000 xg离心,并用离心超滤单元4℃。混合浓缩蛋白质每个间隔后,以防止沉淀和聚集。在此步骤偶尔LY一些沉淀为rPPEP-1,尽管混合过程观察。
- 在4-6℃下的浓缩蛋白应用于(在TBS缓冲液中)一平衡预大小排阻层析柱。洗脱用TBS缓冲柱中,收集1-毫升级分和主体5微升每一第二级分进行SDS-PAGE的分析。 rPPEP-1洗脱中对应于单体( 图2)的单峰。偶尔在较大分子量较小的峰被观测到(面向峰),对应于蛋白的二聚体。产率应是每培养L的纯蛋白质的约50毫克。分析( 图2)通过SDS-PAGE 18的所有样本。
- 取为SDS-PAGE分析每个纯化步骤的50微升样品。从在TBS缓冲液1L培养的补充有10微克/毫升DNA酶I重悬细胞沉淀。使用5毫升TBS / DNA酶I的每克细胞。
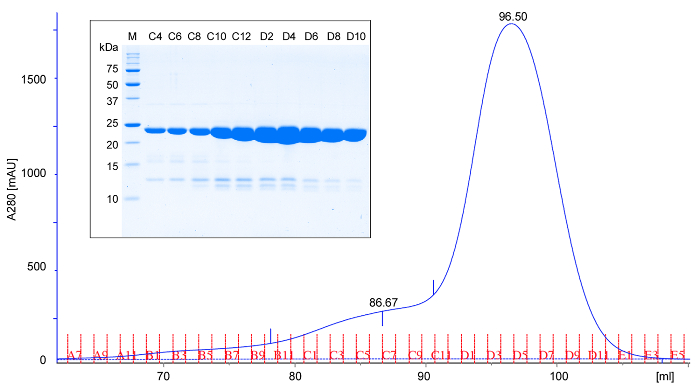
图2:rPPEP-1的代表性尺寸排阻层析和SDS-PAGE分析。尺寸排阻色谱(A280;在280nm纯化的未标记rPPEP-1的吸光度)使用的Tris-HCl,pH值7.5,200mM的NaCl的(600分之16)柱在6℃。基于洗脱体积上,如预期的22 kDa蛋白rPPEP-1迁移,这表明它主要是单体。很少次要前拖峰出现对应于二聚体。 (插图)从大小排阻层析的级分的SDS-PAGE分析(M;分子量标记)。每个第二级分被应用。主要rPPEP-1带下面的微弱的波段对应偶尔出现的微小杂质。 请点击此处查看该图的放大版本。
3.结晶和结晶优化使用Microseeding
注:rPPEP-1的条件中结晶该不断产生不适合的X射线衍射分析高度共生晶体( 图3)。因此,优化策略( 图4)的开发是为了获得高品质的结晶( 图5)。
- 使用商业屏幕rPPEP-1初步筛选
注:执行结晶试验使用标准的市售屏幕和结晶机器人坐滴格式。- 浓缩纯化的蛋白质以12毫克在4000 xg离心和4℃/毫升使用离心超滤装置在5分钟为间隔。混合浓缩蛋白质每个间隔后,以防止沉淀和聚集。通过使用25900 M -1 -1的消光系数,或通过任何其它方法( 例如 Bradford法)测定280nm处的蛋白浓度无论是。平衡的蛋白至20℃。为16,000 XG 10分钟和20℃,清除所有的粒子和灰尘离心。
- 无论是使用已经预填充结晶板本身ALED并储存在4℃或70微升每结晶条件填充板的贮存井。平衡所有的结晶板至20℃。迅速开展工作,为小体积迅速干透。如果可能的话使用湿度室周围机器人的基座。
注:使用以下屏幕为标准的过程:SaltRx,指数,PEG /离子,水晶,向导,PACT ++,JCSG ++。 - 吹打蛋白质和藏进subwells 2-4设置屏幕。滴体积是300 n1和比率(蛋白质:容器)200:100(subwell 2),150:150(subwell 3)和100:200(subwell 4)(以NL)。在20℃立即密封在一个腔室中的盘和地点。
- 立即检查后托盘设置,然后在第一周后每周检查每天可检验。
- rPPEP-1共结晶与配体
- 对底物肽-rPPEP-1复合物的共结晶混合rPPEP -1-在24毫克/毫升以1:1的比例(V / V)用7倍摩尔过量的肽溶液(AC-EVNPPVPD-NH 2)的TBS缓冲液中的冻干粉),这将给12的终浓度毫克/毫升的r-PPEP-1蛋白和7倍摩尔过量的肽的多PPEP-1。孵育30分钟,在20℃,清除所有的颗粒和灰尘通过离心10分钟以16,000 xg离心和20℃。与使用microseeding过程结晶作为绑定R-PPEP-1蛋白的说明操作。

图3:从初始屏幕代表晶体。从rPPEP-1在12毫克共生晶体/ ml的条件下种植。 (A)水晶屏幕I / 38(柠檬酸1.4酸钠三代脱水,0.1M HEPES钠pH为7.5; 200 NL:100 NL)。 (B)SaltRx屏幕/ 52(2.4米磷铵DIBASIC,0.1M的Tris pH值8.5; 100 NL:200 NL)和(C)(200 NL:100 NL)。 (D)SaltRx屏幕/ 96(60%V / V Tacsimate pH为7.0,0.1M BIS-TRIS丙烷pH为7.0; 200 NL:100 NL)。的比例尺= 0.2毫米。体积比总是蛋白质:水库。 请点击此处查看该图的放大版本。
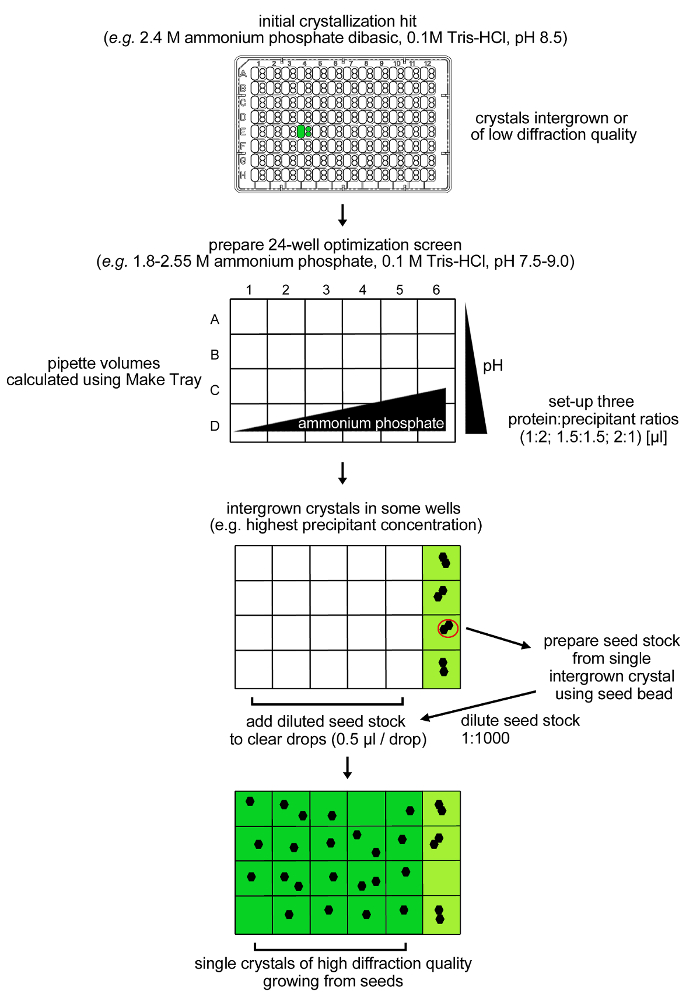
图4:rPPEP-1结晶的优化过程。从rPPEP-1在12毫克/毫升的低衍射质量的并且具有多个棱(共生)初始晶体在24条件优化屏幕被再现。再次,在含有2.55酸铵磷酸氢条件下观察到仅共生晶体。种子股是从一个单一的共生晶体制备稀释1:1000到同一康迪特离子(microseeding)。 0.5微升稀释种子储备的体积加入到剩余的清晰滴和单晶生长在几乎所有条件。 请点击此处查看该图的放大版本。
- 使用microseeding水晶优化
注:rPPEP-1的高度共生结晶两天后出现在含有2.4米磷酸铵二元,0.1M的Tris-HCl,pH值8.5(SaltRx屏幕,状态E4,所有三个subwells)( 图3)的条件。周围使用的初始条件与microseeding组合的网格筛选优化过程施加( 图4)。- 制备包含24条件1.8网格屏幕( 图4) - 2.55米磷酸氢二铵(在0.15M的步骤)和0.1M的Tris-HCl pH值7.5-9.0(以0.5个pH单位的步骤)从appropri吃了储备液(4M磷酸铵和1M的Tris缓冲液)。
注:使用化妆托盘小程序(http://hamptonresearch.com/make_tray.aspx)来计算量和移液方式取得2毫升每一个允许执行10优化屏幕状态。所述的4M磷酸铵原液难以制备。搅拌以完全溶解在水中的粉末中加热该溶液。 - 吸管每格画面溶液到24孔板的孔中的200μl的和在20℃下平衡。
- 手动设置结晶板。滴体积为3微升和比(蛋白质:容器)是2:1,1.5:1.5和1:2(以微升)。在这里,使用正移液管,避免气泡的形成。在20℃立即密封在一个腔室中的盘和地点。避免气泡的形成。
注意:一至四个天后高度共生晶体出现在含有坡2.55酸铵四个条件sphate二元和0.1M的Tris-HCl pH为7.5 - 9.0( 图4)。形成在剩余的20的条件与磷酸铵浓度低于2.55 M的microseeding过程用于在这些条件下,得到rPPEP-1的单晶无晶体。 - 通过收获从两个条件之一的单个共生晶体2.55酸铵磷酸氢和0.1M的Tris-HCl pH 8.0的或8.5制备microseed库存。该晶体可能会附着在塑料表面。周围的塑料用针灸针小心变形有助于分离晶体。
- 转移50微升各自母液到1.5毫升管含有一个小高度抛光的玻璃珠(珠换种子)。使用安装尼龙环晶体转移到母液的1微升放置到玻璃盖玻片。
- 传送含有晶体进入管和涡流的液体以高速,持续30秒。制作1:1000稀释的种子的库存的入含有相同新鲜制备条件和涡旋彻底为5秒的新的1.5毫升管。
注:种子种群可以储存在-80℃以备后用。
- 取下板覆盖的20个条件有明确的下降和吸管0.5微升种股票的印章(1:1000稀释)入井。在20℃下密封在一个腔室中的盘和地点。的高衍射品质单晶中出现2-7天( 图5)。
- 制备包含24条件1.8网格屏幕( 图4) - 2.55米磷酸氢二铵(在0.15M的步骤)和0.1M的Tris-HCl pH值7.5-9.0(以0.5个pH单位的步骤)从appropri吃了储备液(4M磷酸铵和1M的Tris缓冲液)。
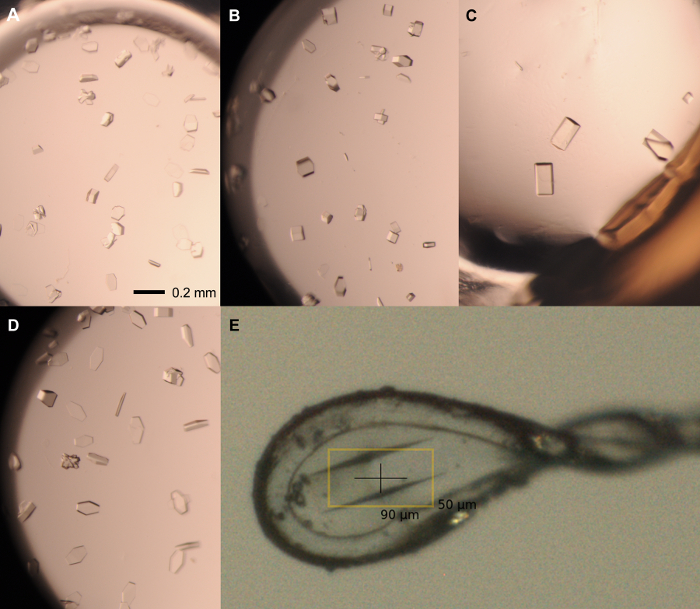
图5:优化屏幕代表晶体。从rPPEP-1在12毫克单晶/ ml的种子以1:在下列条件下生长的1000种稀释股票:(A)2.1酸铵磷酸氢钙,0.1米的Tris pH值7.5; 1.5微升:1.5微升; (B)2.1酸铵磷酸氢钙,0.1米的Tris pH值7.5; 2微升1微升; (C)的2.25米磷酸铵二元,0.1M的Tris pH值8; 2微升1微升; (D)2.1米铵磷酸氢钙,0.1米的Tris pH值8; 1微升2微升。 (E)安装晶体中0.1-0.2微米的尼龙环,在2.1米磷铵二元长大,0.1M的Tris pH值8(2微升1微升)和低温保护在2.1米铵磷酸氢钙,0.1M的Tris pH值8, 20%的甘油。的比例尺= 0.2毫米(AD)。体积比总是蛋白质:水库。 请点击此处查看该图的放大版本。
4.晶体安装和数据收集
注:要获得衍射数据晶体质量最好应安装在他们的质量和规模的高峰。晶体可以保存在液氮中直至它们AR在100 K。因此进行X射线衍射分析即,从它们起源的条件,必须调整到低温条件下。 rPPEP-1的结晶可以是冷冻保护通过加入任一20%甘油或30%蔗糖(在由冷冻保护的条件下更换水)。
- 安装水晶
注意:所有的水晶操作步骤应该立体显微镜下进行。- 选择尼龙循环的最佳规模为所选结晶的最大长度。 rPPEP-1晶体的典型最长轴为约100-200微米( 图5)。制备盖板滑动和适当的低温条件下( 例如 2.1米磷酸铵二元,0.1M的Tris,pH 8.0的,20%甘油)。
- 填用液氮泡沫杜瓦瓶,用小瓶装入小瓶夹紧,并在充满液体的含氮800毫升泡沫杜瓦预冷却。放置冷冻套筒和标有合适的标识符的低温藤架液体充满氮气的2升泡沫杜瓦。装载有安装尼龙循环磁力棒。
注:液氮时穿戴防护服(光速蒙面侠/眼镜,手套)。温暖的物体投入液氮可能产生泄漏。
- 填用液氮泡沫杜瓦瓶,用小瓶装入小瓶夹紧,并在充满液体的含氮800毫升泡沫杜瓦预冷却。放置冷冻套筒和标有合适的标识符的低温藤架液体充满氮气的2升泡沫杜瓦。装载有安装尼龙循环磁力棒。
- 切用锋利的手术刀打开密封带和镊子取出。吸取1μL的低温条件到封面幻灯片(或者在空以及在同一盘),并通过与安装尼龙环( 图5)捞删除它从下拉列表中结晶。附晶体可容易地由周围的塑料用针刺针变形从地面分离。
- 快速晶体转移到的低温条件下降,并让它平衡1秒。尽快鱼结晶出来的液氮可能和瀑布冻结。
- 当周围的安装环液氮停止沸腾,放置在小瓶中循环。放置在冷冻甘蔗保持器的小瓶中,并在与6小瓶加载放置支架围绕冷冻套筒。在充满液氮直到使用一个罐储存晶体。
- 选择尼龙循环的最佳规模为所选结晶的最大长度。 rPPEP-1晶体的典型最长轴为约100-200微米( 图5)。制备盖板滑动和适当的低温条件下( 例如 2.1米磷酸铵二元,0.1M的Tris,pH 8.0的,20%甘油)。
- 数据采集
注意:数据收集可以在家里衍射进行,如果有的话,或在同步加速器束线。对于已使用混合光子计数探测器在瑞士光源,保罗谢勒研究所,菲利根,瑞士的束线X06DA收集rPPEP-1数据。在结构测定所使用的原始数据和所有文件都可以根据要求提供。- 设置光束到1.282埃(9,667千电子伏),这是该元件锌的特性X射线吸收端能量(峰值)的波长。 rPPEP-1是包含在活性位点每分子单锌金属蛋白酶。
- 收集在10°楔在逆波束模式在100K数据在每个directio的总共270°ñ。曝光时间为0.1秒与每个图像0.1°旋转。传输设定为14%(0.14)。
- 收集从第二晶体从同一结晶条件始发天然高分辨率数据集的光束的波长设置为1.00埃(12398千电子伏)。收集在100 K的曝光时间为0.1秒与每个图像0.1°的旋转数据。传输设定为70%(0.7)。
5.通过锌SAD结构测定
注意:为了通过锌- SAD需要一些基本的晶体知识以及软件包XDS 20,凤凰21和程序护踝22确定rPPEP-1的结构。对于结构的可视化所需要的程序PyMOL的23或24嵌合体。在对应于峰在元件锌的吸收边缘的波长收集的数据可以用于单波长异常DISP版为(SAD)25,以获得可扩展的所有蛋白质原子相位信息。
- 数据处理
- 处理用软件的XDS(或者iMosflm或HKL3000)在空间群P2 1 2 1 2 1(空间群19)分离弗里德尔的配合(异常数据)两个峰值的数据集(正常和反向)。晶胞参数应在A,B,C(A)= 43.17,71.68,117.70和α=β=γ(°)= 90。这给出了两个HKL-文件(反射文件)。
- 检查文件CORRECT.LP。使用数据到其中的CC 1/2为至少50%的分辨率。使用缩放XSCALE两个数据集/反射文件(HKL文件)在一起。检查文件XSCALE.LP。检查多远异常信号延伸(SigAno)并记为约30%,这是2埃这里使用收集到1.67埃的数据的情况下的异常相关(Anomal更正件)的分辨率。这是在分辨率截止于凤凰AutoSol使用的异常信号。
- 使用XDSCONV创建的5%的R 免费子集,并保持异常数据(FRIEDEL'S_LAW = FALSE)的(缩放的)HKL-文件转换成CCP4格式反射文件(命名,例如,peak_anom.mtz)。检查MTZ-文件与程序mtzdmp检查晶胞参数,空间群和r 无子的存在(标签FreeRflag)和异常数据的一致性(标签戴诺/ SIGDANO)。还准备一个额外的MTZ-文件,XDSCONV无需解压的异常数据(FRIEDEL'S_LAW = TRUE;命名,例如,peak_native.mtz)进行细化在后一阶段。
- 子结构的解决方案(相位检测)
- 使用反射文件peak_anom.mtz运行凤凰AutoSol。选择SAD / MAD峰的数据类型,并选择2锌网站(因为有不对称单位两个分子)。选择要么更准确experi为F'/ F''参数(在荧光扫描的束线确定的)或theotetical值F'= -8.245和f'= 3.887心理值。还加载包含结晶蛋白质的氨基酸序列的FASTA文件。
- 设置分辨率限制为约30%(在5.1.2测定的)的异常相关(Anomal更正件)的分辨率,在这种情况下,2埃,选择"自动构建模型"选项。使用由凤凰HySS(的凤凰AutoSol管道的一部分)中发现的两个锌部位为整个蛋白质的相位可以推断并建模型(由凤凰RESOLVE)插入电子密度的相位。最佳模型被称为"overall_best.pdb"。
- 建立模型,细化和验证
- 选择选项"自动构建模式"自动构建大部分rPPEP-1模式。使用编程的,是检查电子密度为1.0σ轮廓水平米库特( 图6)。它应该是结缔组织和围绕该模型的原子。理想的情况下也有一些水分子应该(比2.5,分辨率更高)内置到模型中。散装水(分子间的空间)应该不包含密度。
- 检查整个模型是完整的(内置于电子密度所有氨基酸)。如果不是,利用笨人所提供的工具手动构建它们。通过运行迭代轮凤凰瑞风与5细化优化结构中每个使用overall_best.pdb模型文件,该peak_native.mtz反射文件和FASTA序列文件轮;和手动模式建设库特。
- 验证与库特相应工具的结构模型的质量。
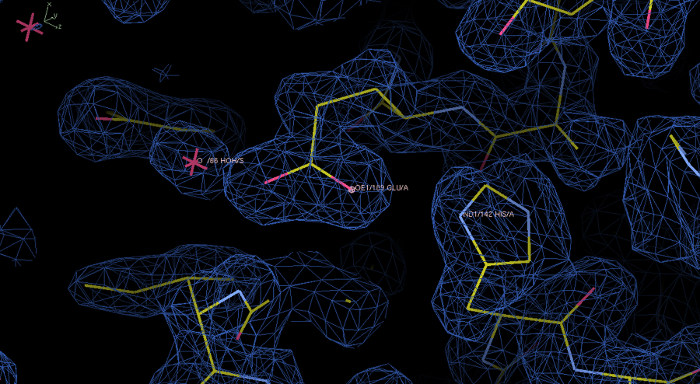
图6:实验电子密度图和rPPEP-1的模型后,凤凰Autosol运行。在程序库特显示1.0σ轮廓水平电子密度为蓝色。在该初始图的电子密度是很好解决,该模型构筑成的电子密度。在放大显示了残基His142和Glu189,以及一个水分子。 请点击此处查看该图的放大版本。
6.结构测定通过分子置换高分辨率
注意:为了获得大约rPPEP-1的天然集高分辨率结构信息被收集。然后,使用通过锌SAD作为模型确定的结构采用使用软件移相器26,27(凤凰的软件包中)的分子更换程序。这个程序可以解决与小分子复合rPPEP-1的结构时也以后使用。
- 以获得具有更高分辨率的晶体结构(在这种情况下高达1.4埃)处理在空间群P2 1 2 1 2 1(空间群19)使用软件的XDS(或者iMosflm或HKL3000)天然数据集。晶胞参数应在A,B,C(A)= 43.17,71.77,117.80和α=β=γ(°)= 90。这给人一种HKL-文件(反射文件)。
- 检查文件CORRECT.LP。使用数据到其中的CC 1/2为至少50%的分辨率。使用XDSCONV创建的5%的R 免费子集HKL-文件转换成CCP4格式反射文件(命名,例如,native.mtz)。检查MTZ-文件与程序mtzdmp检查晶胞参数,空间群和r 无子(标签FreeRflag)的存在一致性。
- 准备包含从早期确定overall_best.pdb模型中的PDB文件,并删除所有的水分子和所有的配体( 即。锌原子)。还加载包含结晶蛋白质的氨基酸序列的FASTA文件。使用反射文件native.mtz凤凰运行移相器。搜索不对称单位两个分子。
- 成功后的结构解决方案(TFZ分数大于8时,在这里10.2)检查模型(名为native_phaser.1.pdb)和库特的电子密度图。建立和运行迭代轮凤凰瑞风与5细化细化结构中每个使用native_phaser.1.pdb模型文件,该native.mtz反射文件和FASTA序列文件轮;和手动模式建设库特。
- 验证与库特相应工具的结构模型的质量。
结果
rPPEP-1过表达的几个大肠杆菌菌株,在大肠杆菌 BL21(DE3)中星( 图1C)的最高产率。第一NiNTA亲和层析步骤之后的6xHis标签可以从大多数蛋白质的成功切除和在第二NiNTA步骤未消化的蛋白质可以从凝血酶消化蛋白质( 图1D)完全分离。上的S200六百分之十六柱未标记rPPEP-1迁移与偶尔面向最有可能对应于二聚体物种( 图2A)?...
讨论
X射线晶体学仍然是确定的蛋白质28三维近原子分辨率的结构最快,最准确的方法。但是,它需要秩序井然单晶的生长。这些往往难以得到与结晶状态是人为的。然而,通过X射线晶体与用其他方法,测定确定蛋白质结构的比较特别NMR,通常显示出非常良好的一致性。在PPEP-1的情况下,一个NMR结构最近发表29示出良好的协议与我们的晶体结构14,包括S-环路的流动性。
披露声明
The authors have nothing to disclose.
致谢
我们感谢员工同步数据采集期间在瑞士光源,保罗谢勒研究所,菲利根,瑞士支持束线X06DA。我们感谢莫妮卡Gompert优秀的技术支持。该项目由科隆大学,并授予由德国研究委员会INST 216 / 682-1 FUGG支持。从国际研究生院在发展健康和疾病给CP一个博士研究生奖学金是公认的。导致这些结果的研究号赠款协议283570(BioStruct-X)下收到的资金来自欧盟第七框架计划(FP7 / 2007-2013)。
材料
| Name | Company | Catalog Number | Comments |
| Genes / Vectors / cell strains | |||
| pET28a vector | Merck-Millipore | 69864 | Thrombin cleavable N-terminal His-tag |
| E. coli strain BL21 (DE3) Star | ThermoFisher Scientific | C601003 | RNase H deficient |
| Codon-optimized gene (for E. coli) of PPEP-1 (CD630_28300) | Geneart (Thermo Fisher Scientific) | custom | amino acids 27-220 |
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Yeast extract | any | ||
| Tryptone | any | ||
| Antifoam B | Sigma-Aldrich | A5757 | aqueous-silicone emulsion |
| Agar | any | ||
| Kanamycin | any | ||
| IPTG | AppliChem | A1008 | |
| Tris-HCl | AppliChem | A1087 | Buffer grade |
| NaCl | any | Buffer grade | |
| DNaseI | AppliChem | A3778 | |
| Imidazole | AppliChem | A1073 | Buffer grade |
| Thrombin | Sigma-Aldrich | T4648 | |
| Ammonium phosphate dibasic | Sigma-Aldrich | 215996 | |
| Glycerol 100% | any | purest grade | |
| Sucrose | Sigma-Aldrich | 84097 | |
| Liquid nitrogen | any | for storage and cryocooling of crystals | |
| Name | Company | Catalog Number | Comments |
| Equipment (general) | |||
| Shaking incubator | any | providing temperatures of 20 °C - 37 °C | |
| Glassware | any | baffled Erlenmeyer flasks (50 ml - 2.8 L) | |
| Centrifuge for large culture volumes | any | centrifuge for processing volumes up to 12 L | |
| Sonicator Vibra-Cell VCX500 | Sonics | SO-VCX500 | or any other sonicator / cell disruptor |
| Ultracentrifuge | any | centrifuge providing speeds up to 150,000 x g | |
| NiNTA Superflow resin | Qiagen | ||
| Empty Glass Econo-Column | Bio-Rad | 7371007 | or any other empty glass or plastic column |
| Size exclusion chromatography column HiLoad Superdex 200 16/600 | GE Healthcare | 28989335 | |
| Chromatography system Äkta Purifier | GE Healthcare | 28406264 | or any other chromatography system |
| Dialysis tubing Spectra/Por 3 | Spectrum Labs | 132724 | |
| Dialysis tubing closures | Spectrum Labs | 132738 | |
| Ultrafiltration units (concentrators) 10,000 NWCO | any | ||
| UV-Vis spectrophotometer | any | ||
| Name | Company | Catalog Number | Comments |
| Equipment (crystallography) | |||
| Low volume pipette 0.1-10 µl | any | ||
| Positive displacement pipette Microman M10 | Gilson | F148501 | |
| Crystallization robot | any | ||
| 96-well crystallization plates TTP IQ with three protein wells | TTP | 4150-05810 | or any other 96-well crystallization plate |
| 24-well CombiClover Junior Plate | Jena Bioscience | EB-CJR | |
| Crystal Clear Sealing Tape | Hampton Research | HR3-511 | |
| Siliconized Glass Cover Slides | Hampton Research | HR3-225 | |
| Commercial crystallization screens: SaltRx, Index, PEG/Ion, Crystal | Hampton Research | diverse | |
| Commercial crystallization screens: Wizard, PACT++, JCSG++ | Jena Bioscience | diverse | |
| JBS Beads-for-Seeds | Jena Bioscience | CO-501 | |
| CrystalCap SPINE HT (nylon loops) | Hampton Research | diverse | loop sizes 0.025 mm - 0.5 mm |
| CrystalCap Vial | Hampton Research | HR4-904 | |
| Cryogenic Foam Dewar 800 ml | Hampton Research | HR4-673 | |
| Cryogenic Foam Dewar 2 L | Hampton Research | HR4-675 | |
| Vial Clamp, Straight | Hampton Research | HR4-670 | |
| CrystalWand Magnetic, Straight | Hampton Research | HR4-729 | |
| CryoCane 6 Vial Holder | Hampton Research | HR4-711 | |
| CryoSleeve | Hampton Research | HR4-708 | |
| CryoCane Color Coder - White | Hampton Research | HR4-713 | |
| Scalpel | any | ||
| Straight microforcep | any | for manipulation of sealing tape. etc. | |
| Acupuncture needle | any | e.g. from a pharmacy | |
| Stereo microscope | any | for inspection of crystallization plates and crystal mounting, magnification up to 160X |
参考文献
- Bouza, E. Consequences of Clostridium difficile infection: understanding the healthcare burden. Clin Microbiol Infect. 18 (Suppl 6), 5-12 (2012).
- O'Connor, J. R., Johnson, S., Gerding, D. N. Clostridium difficile infection caused by the epidemic BI/NAP1/027 strain. Gastroenterology. 136 (6), 1913-1924 (2009).
- Mitchell, B. G., Gardner, A. Mortality and Clostridium difficile infection: a review. Antimicrob Resist Infect Control. 1 (1), (2012).
- George, W. L., Sutter, V. L., Finegold, S. M. Antimicrobial agent-induced diarrhea--a bacterial disease. J Infect Dis. 136 (6), 822-828 (1977).
- George, R. H., et al. Identification of Clostridium difficile as a cause of pseudomembranous colitis. Br Med J. 1 (6114), 695 (1978).
- Bartlett, J. G. Narrative review: the new epidemic of Clostridium difficile-associated enteric disease. Ann Intern Med. 145 (10), 758-764 (2006).
- Kelly, C. P., LaMont, J. T. Clostridium difficile--more difficult than ever. N Engl J Med. 359 (18), 1932-1940 (2008).
- Ünal, C. M., Steinert, M. Novel therapeutic strategies for Clostridium difficile infections. Expert Opin Ther Targets. 20 (3), 269-285 (2016).
- Kelly, C. P., et al. The Monoclonal Antibody, Bezlotoxumab Targeting C. difficile Toxin B Shows Efficacy in Preventing Recurrent C. difficile Infection (CDI) in Patients at High Risk of Recurrence or of CDI-Related Adverse Outcomes. Gastroenterology. 150 (4), S122 (2016).
- Tsutsumi, L. S., Owusu, Y. B., Hurdle, J. G., Sun, D. Progress in the discovery of treatments for C. difficile infection: A clinical and medicinal chemistry review. Curr Top Med Chem. 14 (1), 152-175 (2014).
- Hensbergen, P. J., et al. Clostridium difficile secreted Pro-Pro endopeptidase PPEP-1 (ZMP1/CD2830) modulates adhesion through cleavage of the collagen binding protein CD2831. FEBS Lett. 589 (24), 3952-3958 (2015).
- Cafardi, V., et al. Identification of a novel zinc metalloprotease through a global analysis of Clostridium difficile extracellular proteins. PLoS One. 8 (11), e81306 (2013).
- Hensbergen, P. J., et al. A novel secreted metalloprotease (CD2830) from Clostridium difficile cleaves specific proline sequences in LPXTG cell surface proteins. Mol Cell Proteomics. 13 (5), 1231-1244 (2014).
- Schacherl, M., Pichlo, C., Neundorf, I., Baumann, U. Structural Basis of Proline-Proline Peptide Bond Specificity of the Metalloprotease Zmp1 Implicated in Motility of Clostridium difficile. Structure. 23 (9), 1632-1642 (2015).
- Rawlings, N. D., Waller, M., Barrett, A. J., Bateman, A. MEROPS: the database of proteolytic enzymes, their substrates and inhibitors. Nucleic Acids Res. 42 (Release 10.0), D503-D509 (2014).
- Bergfors, T. Seeds to crystals. J Struct Biol. 142 (1), 66-76 (2003).
- Dauter, Z., Dauter, M., Dodson, E. Jolly SAD. Acta Crystallogr D Biol Crystallogr. 58 (Pt 3), 494-506 (2002).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Kabsch, W. XDS. Acta Crystallogr D Biol Crystallogr. 66 (Pt 2), 125-132 (2010).
- Adams, P. D., et al. PHENIX: a comprehensive Python-based system for macromolecular structure solution. Acta Crystallogr D Biol Crystallogr. 66, 213-221 (2010).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallogr D Biol Crystallogr. 66 (Pt 4), 486-501 (2010).
- . . The PyMOL Molecular Graphics System. , (2002).
- Pettersen, E. F., et al. UCSF Chimera--a visualization system for exploratory research and analysis. J Comput Chem. 25 (13), 1605-1612 (2004).
- Wang, B. C. Resolution of phase ambiguity in macromolecular crystallography. Methods Enzymol. 115, 90-112 (1985).
- McCoy, A. J., Grosse-Kunstleve, R. W., Adams, P. D., Winn, M. D., Storoni, L. C., Read, R. J. Phaser crystallographic software. J Appl Crystallogr. 40 (Pt 4), 658-674 (2007).
- Zwart, P. H., et al. Automated structure solution with the PHENIX suite. Methods Mol Biol. 426, 419-435 (2008).
- Zheng, H., Handing, K. B., Zimmerman, M. D., Shabalin, I. G., Almo, S. C., Minor, W. X-ray crystallography over the past decade for novel drug discovery - where are we heading next?. Expert Opin Drug Discov. 10 (9), 975-989 (2015).
- Rubino, J. T., et al. Structural characterization of zinc-bound Zmp1, a zinc-dependent metalloprotease secreted by Clostridium difficile. J Biol Inorg Chem. 21 (2), 185-196 (2016).
- Carson, M., Johnson, D. H., McDonald, H., Brouillette, C., Delucas, L. J. His-tag impact on structure. Acta Crystallogr D Biol Crystallogr. 63 (Pt 3), 295-301 (2007).
- Gasteiger, E., Walker, J. M., et al. Protein Identification and Analysis Tools on the ExPASy Server. The Proteomics Protocols Handbook. , 571-607 (2005).
- Dummler, A., Lawrence, A. M., de Marco, A. Simplified screening for the detection of soluble fusion constructs expressed in E. coli using a modular set of vectors. Microb Cell Fact. 4, 34 (2005).
- Stura, E. A., Wilson, I. A. Applications of the streak seeding technique in protein crystallization. J Crys Growth. 110 (1), 270-282 (1991).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。