需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
戒毒治疗和
摘要
Small laboratory fish have become popular models for bone research on the mechanisms underlying human bone disorders and for the screening of bone-modulating drugs. In this report, we describe a protocol to assess the effect of alendronate on bone cells in medaka larvae with osteoporotic lesions.
摘要
骨形成的成骨细胞与骨再吸收的破骨细胞相互作用,以协调的骨基质的营业额,并控制骨骼稳态。青鳉和斑马鱼幼体被广泛用于分析骨细胞的骨形成,变性,修复期间的行为。其光学清晰度允许荧光标记的骨细胞和结合到矿化的骨基质的荧光染料的可视化。我们的实验室已产生的转基因黑点青鳉鱼表达热激诱导型启动子的控制下的破骨细胞诱导因子核因子κB配体(RANKL)的受体激活剂。在过量形成活化的破骨细胞,其可以在记者线路用nlGFP表达的组织蛋白酶K(CTSK)启动子的控制下,被可视化的RANKL结果的异位表达。 RANKL诱导和异位破骨细胞形成导致了严重的骨质疏松样的表型。复合转基因青鳉李表达CTSK内斯:nlGFP在破骨细胞,以及在过早的成骨细胞的osterix的 (OSX)启动子的控制下,mCherry,可用于研究两种细胞类型的相互作用。这有利于细胞行为骨退化和修复的条件下, 在体内观察。在这里,我们描述了使用该系统的测试在人骨质疏松症的治疗中通常使用的药物和描述了用于实时成像的协议。在青鳉模型补充在细胞培养物和小鼠中的研究,并提供一种新颖的系统,用于骨骼系统药物作用的体内分析。
引言
脊椎动物骨架提供了器官的结构支撑和保护,允许的移动性,并作为钙源。在整个生命中,细胞外骨基质连续上交保持骨的稳定性和刚性。这个过程需要紧密协调的活性和骨形成的成骨细胞和骨再吸收的破骨细胞的相互作用。成骨细胞是从多能间充质祖细胞衍生的和产生胶原,以形成类骨质,骨基质10的蛋白质的部分。成骨细胞的破骨细胞相互作用以实现这两种细胞类型,这是需要控制骨稳态7的平衡的活性。由于这些复杂的调控相互作用,药物治疗和骨稳态反应不能充分使用体外研究审查。因此,存在对动物模型的强烈需求。相比于细胞培养物的设置, 在体内模型可以提供有价值的洞察骨环境中的多细胞网络。
众多的小鼠模型,适用于各种人类骨骼疾病包括骨质疏松症16存在。但是,大小和小鼠胚胎的无障碍代表骨架过程实时成像显著局限性。小硬骨鱼,另一方面,作为体内成像一个有吸引力的替代方案。斑马鱼( 斑马鱼 )和青鳉( 青鳉 )已经成为骨骼研究流行的动物模型,在过去二十年中17,19,22,24。骨在硬骨鱼和哺乳动物是非常相似的,无论在结构和生理水平,和许多关键调节基因和信号途径的是保守3。作为哺乳动物,硬骨鱼仔细调节成骨细胞和破骨细胞,以平衡骨形成和骨吸收26的活性。最重要的是,网络连接的光学透明性sh的幼虫允许使用荧光报告标记骨细胞和钙化骨骼基质8,9,12,21,23,这有利于细胞过程在活的动物中观察。另外,已经产生了一系列的遗传工具,以促进在鱼类生物医学相关的研究。特别是对于青鳉,用于通过CRISPR / Cas9 2,细胞谱系追踪6,和转基因14最近已建立和现在都在使用15广泛点特异性靶向基因突变的方法。
小硬骨鱼类幼虫已成功地用于化工屏幕,这导致了一些药理相关药物1,18发现。
鱼幼体耐受低浓度的DMSO,并且能够吸收化合物从它们的水生环境中,无论是通过皮肤或通过胃肠道1,5。我们以前的实验室代表表达在骨细胞荧光报告各种osteoblast-和破骨细胞特异性启动子的控制下orted转基因黑点青鳉的行。这些包括过早成骨细胞( 骨胶原10A1,COL10A1; osterix的 ,OSX)20,21,成熟的成骨细胞( 骨钙蛋白 ,OSC)27,和破骨细胞( 组织蛋白酶K,CTSK)24。我们还产生了一个热休克诱导型启动子24的控制下表达的破骨细胞诱导因子核因子κB配体(RANKL)的受体激活剂的转基因线。
在这个系统中RANKL诱导导致异位形成活跃的破骨细胞。这导致增加的骨吸收和严重的骨质疏松症样表型,与在椎体急剧降低矿化。我们最近发现,在此模型中的破骨细胞活性可通过二膦酸盐依替和阿仑,总重量被阻止Ø药物在人类治疗骨质疏松症常用,从而验证青鳉作为一个合适的模型系统,骨质疏松症27。
由于其大尺寸育雏,快速发展,胚胎的体积小,转基因青鳉幼虫是唯一适用于骨质疏松症药物的大规模筛选和骨细胞行为的体内分析。在青鳉研究从而可以有效地在细胞培养物和在那些旨在发现新的治疗靶点和新疗法为人类骨疾病的小鼠互补实验。
在本研究中,我们描述了一个协议,把青鳉骨记者幼虫常见的骨质疏松症药物阿仑膦酸钠。我们还详细描述了如何治疗幼虫安装和骨基质和骨细胞的实时成像准备。这些协议可以很容易地适用于其他的小的化学化合物,要么工作作为骨合成或抗骨吸收的药物。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有实验均按照新加坡国立大学(R14-293)批准的机构动物护理和使用委员会(IACUC)协议执行。
1.鱼饲养和胚胎的收集
- 提高WT,CTSK:nlGFP 24,RANKL:HSE:CFP 24和OSX:mCherry 21单,或在26°C复合转基因鱼青鳉控制的光周期下(14小时光照,10小时黑暗)来诱导产卵。
- 每日产卵的灯打开后的第一个30分钟内发生。鸡蛋丝,通过粘在一起,并连接到女性的腹部了好几个小时。用细孔网搭上了成年女性携带一个鸡蛋集群。让鱼短暂地休息了网,然后轻轻按摩鱼的腹部从女性腹部仔细剥离受精卵集群。
注:健康女性的青鳉能生产10 - 每天20个蛋大约5个月。 - 将鸡蛋打入60毫米的塑料培养皿。用塑料吸管5冲洗胚胎- 0.3X Danieau 10毫升的溶液(鱼介质; 19.3毫摩尔NaCl,0.23毫摩尔的KCl,0.13毫硫酸镁 ,0.2毫米的Ca(NO 3)2,和1.7毫米的HEPES,pH值7.0)。添加1毫升的0.25%(重量/体积)亚甲蓝原液2.5升鱼介质,以防止霉菌生长。
- 轻轻摇动鸡蛋集群,形成附着丝结。使用镊子小心地从受精卵集群删除附件细丝,以获得单个胚胎( 图1A)。
- 根据2004年13岩松阶段的胚胎。
- 文化20 - 为60毫米的塑料培养皿30胚胎在28℃培养箱。每天更换介质,以保证胚胎的正常发育。
注:各地孵化阶段(8时 - 9天受精后,DPF)是生存尤为关键。删除自由浮动绒毛膜保持中等清洁,以确保良好的幼体成活率。
2.转基因胚胎筛选
- 使用配有汞灯荧光成像和GFP,RFP和CFP过滤器立体显微镜来筛选使用40X放大倍率荧光记者表达转基因胚胎。
- 可视地识别OSX:mCherry胚胎由mCherry记者表达在早期形成颅骨,如cleithrum上后头部( 图1B,箭头),和副蝶骨的两侧,在腹侧颅骨的中央位置( 图1B中 ,箭头)。
注:记者表情从5 DPF起21开始。 - 确定CTSK:nlGFP胚胎强nlGFP表达的头部( 图1C,箭头)和尾部( 图1C,箭头),启动6 DPF。
注:内源性破骨细胞只能形成后的21 DPF。 nlGFP表达在早期阶段(6 DPF)细胞不是破骨细胞,但另一方面,到目前为止未鉴定,CTSK阳性细胞24。 - 确定RANKL:HSE:由无处不在CFP CFP表达转基因胚胎短暂热激处理20分钟,在39°C,在2 DPF或更高版本用于筛选后进行。
注:RANKL和CFP转基因是相同的双向热休克元件(HSE)的控制之下。 CFP表达式表示成功RANKL诱导24。 - 在9 DPF 2小时热激处理或更高版本诱使大量异位破骨细胞在树干地区,从而导致骨质疏松症样表型24 -执行1.5。
注:在休眠破骨细胞的祖细胞,内源性没有被触发的异位激活在9 DPF结果转基因诱导RANKL表达前21 DPF。使用水浴,以获得稳定的39℃的条件。让含培养皿鳉胚胎浮在水面上。确保培养皿的盖子是干燥,防止菜沉没。 - 从化合物系,例如RANKL屏幕胚胎:HSE:CFP / CTSK:nlGFP双转基因和OSX:mCherry / RANKL:HSE:CFP / CTSK:nlGFP三重转基因,根据每个单独的转基因的表达模式。
注:半合子和纯合子转基因胚胎是由记者转基因的不同荧光水平区分。纯合胚胎有荧光强度被大致相比,半合子转基因的一倍。 HSE:CFP和CTSK:这是纯合子两者RANKL复合线nlGFP被反复incrossing几代获得。对于三转基因OSX:mCherry / RANKL:HSE:CFP / CTSK:nlGFP鱼,纯合子RANKL:HSE:CFP / CTSK:mCherry运营商:nlGFP鱼纯合子OSX交叉。由此产生的杂合三转基因后代中提出并incrossed获得胚胎纯合子RANKL:HSE:CFP。该RANKL:HSE:CFP转基因必须以获得异位破骨细胞的有效诱导纯合的。
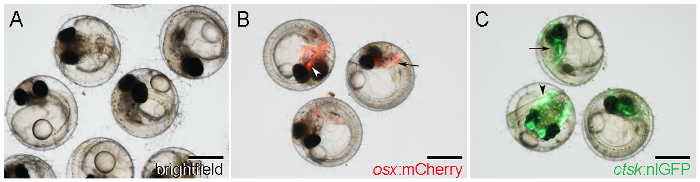
图1:WT和转基因青鳉胚胎7天受精后(DPF)。 一 。 WT胚胎明照明观察。 B点 。转基因胚胎显示OSX:各地cleithrum(箭头)和副蝶骨(箭头)mCherry表达。 ℃。转基因胚胎显示CTSK:头部(箭头)nlGFP表达和尾(箭头)。比例尺:500微米。025 / 55025fig1large.jpg"目标="_空白">点击此处查看该图的放大版本。
3.鳉幼虫双膦酸盐治疗
- 制备含有用于剂量 - 反应研究不同浓度的二膦酸盐(BPS)的解决方案。
注:此协议使用的示范性BP是阿仑膦酸钠。- 溶解在鱼网上平台阿仑以100μg/ mL的浓度,以制备原料溶液。
- 使用涡旋混合器以确保完全溶解。储存在4℃的储液。
- 由原液鱼介质稀释到一系列浓度的准备不同的工作的解决方案( 即 ,25%,37.5,50,62.5,和75微克/毫升)。
注意:不同的药物可以具有不同的吸收,分布,代谢和排泄(ADME)的参数,它必须在使用该鳉幼虫系统在测试过程中被考虑。此外,药物的溶解度和稳定性可能会发生变化,当施加作为水溶液。较少的水溶性化合物可能需要先溶解在有机溶剂,例如DMSO。在这种情况下,一个储备液在DMSO中,然后将其进一步在鱼培养基稀释制备。需要注意的是在水(鱼介质)工作溶液可以储存在冰箱中若干周。然而,含有DMSO溶液必须存储在RT以防止结晶。
- 鳉转移到幼虫6孔板(SIX幼虫/孔)随后BP(阿仑膦酸钠)的治疗。
- 取出鱼中仔细用干净的塑料吸管,并添加阿仑膦酸钠解决每一个体积小(大约0.5毫升)好。
- 避免剩鱼的介质,因为加入的BP溶液可能稀释,这是浓缩不太阿仑解决方案尤其重要。
- 除去从每个孔阿仑溶液(高达0.5毫升)的小体积,用干净的塑料吸管和具有较大VOLU取代它箱(4毫升)阿仑膦酸钠溶液。
- 每天换液,以保证正常的胚胎发育。
4.矿化骨基质的活染
- 溶解0.5克茜素配位的(ALC;茜素-3-甲基亚膦酸)或在50mL鱼介质加入0.05g钙黄绿素的制备1%和0.1%的储备溶液,分别。使用涡旋混合器以确保完全溶解。
注:不加入亚甲蓝鱼介质在此被使用和随后的步骤,以减少在幼虫自发荧光。 - 使用注射器和单次使用的过滤器(0.2微米)过滤染色液。存储在黑暗中在RT下过滤溶液。
注:过滤,清晰的ALC染色溶液的颜色为暗黄色至橙色。过滤后,清钙黄绿素溶液的颜色为亮黄色。解决方案可以用于数月。 - 稀释鱼介质过滤ALC或钙黄绿素原液1:10在28℃培养箱2.5小时(0.01%钙黄绿素溶液),如果使用的幼虫和17之间9 DPF - 孵育1.5鳉幼虫 - 2小时(0.1%ALC溶液)或2。保持样品在黑暗中。
- 传输用干净的塑料吸管幼虫鲜鱼网上平台。
- 用干净的塑料吸管取出鱼中,添加新鲜的鱼网上平台。重复此步骤3 - 4次,直到没有巴西龟或黄色染色溶液(ALC或钙黄绿素,分别)被遗留下来的。它们安装成像避免从介质表面荧光前60分钟 - 留在30鱼介质的幼虫。
注:0.1%ALC染色液是有害的青鳉幼虫延长曝光时间。长于2小时的孵育时间影响幼虫的存活。因此,浓度和染色时间需以达到最佳的胚胎存活率和染色结果的不同阶段进行优化。
5.实时荧光成像 p>
- 麻醉中鱼培养基含0.01%三卡因(3-氨基苯甲酸乙酯甲磺酸盐)的青鳉幼虫。
注:麻醉幼虫变成固定后5 - 在三卡因溶液10分钟,通常要么趴在其两侧或他们的背上。 - 使用塑料微加载根据感兴趣的区域,以定向的幼虫。在这个协议中使用的幼虫的方向是横向。
- 使用荧光照明的成像立体显微镜。拍摄图像时,侧重于幼虫(头,躯干前,后躯干和尾巴)的不同部分使用高倍率。在使用适当的图像处理软件(在图3G插图)重叠的区域拼接单个图像一起。
注意:这有助于提高所有相关身体部分的正确的焦平面的图像质量。 - 返回幼虫鱼介质恢复后成像。
- 麻醉鱼中有0.01%三卡因幼虫5 - 10分钟,直到他们成为固定的。
- 溶解通过在微波炉中加热低熔点琼脂糖在鱼类中1.5%。凉爽该溶液到约30℃。
- 在鱼介质1毫升液体1.5%低熔点的琼脂糖玻璃底培养皿 - 添加0.5。转移麻醉幼虫变成用干净的塑料吸管的解决方案。
注意:要特别防范措施,液体低熔点琼脂糖的温度足够低,以不伤害幼虫。 - 琼脂糖固化之前,用塑料微加载到幼虫推到培养皿的底部,并根据感兴趣的区域定向的幼虫。在这个协议中使用的幼虫的方向是横向。
注:该样品是准备共聚焦实时成像琼脂糖完全凝固后。 - 使用激光共聚焦显微镜ACQuire图像。
- 对于mCherry和ALC染色分析使用543纳米激光线。使用488nm的激光线nlGFP和钙黄绿素染色分析。
- 成像后,鱼介质添加到培养皿,并使用一对细的注射器针头(27国祥1.5")的仔细从琼脂糖除去幼虫。琼脂糖残余附着到培养皿鱼介质以回收转移幼虫。
- 处理使用图像分析软件27的图像。
Access restricted. Please log in or start a trial to view this content.
结果
丰富的产蛋数,以及幼虫的小尺寸,使青鳉药物筛选的优秀典范。单个6孔板被用来培养多达36个幼虫,这是足以提供统计学显著数据。用鱼骨骼分析的另一大优势是在做实时成像的可能性。仔鱼的透明度允许使用荧光蛋白的标记的骨细胞,以及利用结合于骨基质,以可视化矿化染料。鱼幼体易于处理,并用于成像样品制备是简单的( 图2)。
Access restricted. Please log in or start a trial to view this content.
讨论
该议定书中的关键步骤
至关重要的是,比较不同样品时对热休克处理的条件是一致的和稳定的。稳定的温度条件下保证RANKL诱导的相似的水平在转基因幼虫,因此,可比破骨细胞形成,其可以通过筛选CTSK予以确认:nlGFP表达。最终,这将导致类似的程度诱导异位骨吸收和骨质疏松症样病变,如通过ALC染色验证。这样的实验设计,然后允许确定和各种抗吸收药物或以不同的浓...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者宣称,他们没有竞争或经济利益。
致谢
这个项目是由教育的新加坡教育部(MOE,授权号2013-T2-2-126)和健康,美国国家研究院(NIH,授予数量1R21AT008452-01A1)赠款。 TY从生物科学系新加坡国立大学获得了硕士研究生奖学金。我们感谢新加坡国立大学中心生物成像科学(CBIS)的共焦单位的一贯支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Alendronate | Sigma | A4978 | |
| alizarin-3-methyliminodiacetic acid, Alizarin Complexone | Sigma | A3882 | |
| Calcein | Sigma | C0875 | |
| ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma | A5040 | |
| ImageJ (1.4.3.67) | National Institute of Health (NIH) | https://imagej.nih.gov/ij/ | |
| LSM 510 Meta confocal | Zeiss | ||
| LSM Image Browser (4.2.0.121) | Zeiss | http://www.zeiss.com/microscopy/en_de/downloads/lsm-5-series.html | |
| Micro-loader | Eppendorf | 5242956003 | Eppendorf ep T.I.P.S 20 μL |
| NIS-Elements BR 3.0 software | Nikon | ||
| Photoshop CS6 (13.0.0.0) | Adobe | ||
| SMZ1000 stereomicroscope | Nikon |
参考文献
- Ablain, J., Zon, L. I. Of fish and men: using zebrafish to fight human diseases. Trends Cell Biol. 23 (12), 584-586 (2013).
- Ansai, S., Kinoshita, M. Targeted mutagenesis using CRISPR/Cas system in medaka. Biol Open. 3 (5), 362-371 (2014).
- Apschner, A., Schulte-Merker, S., Witten, P. E. Not all bones are created equal-using zebrafish and other teleost species in osteogenesis research. Methods Cell Biol. 105, 239-255 (2011).
- Bajoghli, B., Aghaallaei, N., Heimbucher, T., Czerny, T. An artificial promoter construct for heat-inducible misexpression during fish embryogenesis. Dev Biol. 271 (2), 416-430 (2004).
- Barrett, R., Chappell, C., Quick, M., Fleming, A. A rapid, high content, in vivo model of glucocorticoid-induced osteoporosis. Biotechnol J. 1 (6), 651-655 (2006).
- Centanin, L., Ander, J. J., Hoeckendorf, B., Lust, K., Kellner, T., Kraemer, I., Urbany, C., Hasel, E., Harris, W. A., Simons, B. D., et al. Exclusive multipotency and preferential asymmetric divisions in post-embryonic neural stem cells of the fish retina. Development. 141 (18), 3472-3482 (2014).
- Charles, J. F., Aliprantis, A. O. Osteoclasts: more than 'bone eaters. Trends Mol Med. 20 (8), 449-459 (2014).
- DeLaurier, A., Eames, B. F., Blanco-Sanchez, B., Peng, G., He, X., Swartz, M. E., Ullmann, B., Westerfield, M., Kimmel, C. B. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505-511 (2010).
- Du, S. J., Frenkel, V., Kindschi, G., Zohar, Y. Visualizing normal and defective bone development in zebrafish embryos using the fluorescent chromophore calcein. Dev Biol. 238 (2), 239-246 (2001).
- Eriksen, E. F. Cellular mechanisms of bone remodeling. Rev Endocr Metab Disord. 11 (4), 219-227 (2010).
- Hockendorf, B., Thumberger, T., Wittbrodt, J. Quantitative analysis of embryogenesis: a perspective for light sheet microscopy. Dev Cell. 23 (6), 1111-1120 (2012).
- Inohaya, K., Takano, Y., Kudo, A. The teleost intervertebral region acts as a growth center of the centrum: in vivo visualization of osteoblasts and their progenitors in transgenic fish. Dev Dyn. 236 (11), 3031-3046 (2007).
- Iwamatsu, T. Stages of normal development in the medaka Oryzias latipes. Mech Dev. 121 (7), 605-618 (2004).
- Kirchmaier, S., Hockendorf, B., Moller, E. K., Bornhorst, D., Spitz, F., Wittbrodt, J. Efficient site-specific transgenesis and enhancer activity tests in medaka using PhiC31 integrase. Development. 140 (20), 4287-4295 (2013).
- Kirchmaier, S., Naruse, K., Wittbrodt, J., Loosli, F. The genomic and genetic toolbox of the teleost medaka (Oryzias latipes). Genetics. 199 (4), 905-918 (2015).
- Komori, T. Animal models for osteoporosis. Eur J Pharmacol. 759, 287-294 (2015).
- Mackay, E. W., Apschner, A., Schulte-Merker, S. A bone to pick with zebrafish. Bonekey Rep. 2, 445(2013).
- MacRae, C. A., Peterson, R. T. Zebrafish as tools for drug discovery. Nat Rev Drug Discov. 14 (10), 721-731 (2015).
- Mitchell, R. E., Huitema, L. F., Skinner, R. E., Brunt, L. H., Severn, C., Schulte-Merker, S., Hammond, C. L. New tools for studying osteoarthritis genetics in zebrafish. Osteoarthritis Cartilage. 21 (2), 269-278 (2013).
- Renn, J., Buttner, A., To, T. T., Chan, S. J., Winkler, C. A col10a1:nlGFP transgenic line displays putative osteoblast precursors at the medaka notochordal sheath prior to mineralization. Dev Biol. 381 (1), 134-143 (2013).
- Renn, J., Winkler, C. Osterix-mCherry transgenic medaka for in vivo imaging of bone formation. Dev Dyn. 238 (1), 241-248 (2009).
- Schilling, T. F., Kimmel, C. B. Segment and cell type lineage restrictions during pharyngeal arch development in the zebrafish embryo. Development. 120 (3), 483-494 (1994).
- Spoorendonk, K. M., Peterson-Maduro, J., Renn, J., Trowe, T., Kranenbarg, S., Winkler, C., Schulte-Merker, S. Retinoic acid and Cyp26b1 are critical regulators of osteogenesis in the axial skeleton. Development. 135 (22), 3765-3774 (2008).
- To, T. T., Witten, P. E., Renn, J., Bhattacharya, D., Huysseune, A., Winkler, C. Rankl-induced osteoclastogenesis leads to loss of mineralization in a medaka osteoporosis model. Development. 139 (1), 141-150 (2012).
- Wakamatsu, Y., Pristyazhnyuk, S., Kinoshita, M., Tanaka, M., Ozato, K. The see-through medaka: a fish model that is transparent throughout life. Proc Natl Acad Sci USA. 98 (18), 10046-10050 (2001).
- Witten, P. E., Huysseune, A. A comparative view on mechanisms and functions of skeletal remodelling in teleost fish, with special emphasis on osteoclasts and their function. Biol Rev Camb Philos Soc. 84 (2), 315-346 (2009).
- Yu, T., Witten, P. E., Huysseune, A., Buettner, A., To, T. T., Winkler, C. Live imaging of osteoclast inhibition by bisphosphonates in a medaka osteoporosis model. Dis Model Mech. 9 (2), 155-163 (2016).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。