Method Article
通过神经树桩将钙染料加载到青蛙神经末梢:青蛙神经肌肉接头中的钙瞬态登记
摘要
在这里,我们描述一种通过青蛙神经残端将钙敏感染料载入神经末梢的方法。我们还提出了记录和分析周围神经末梢快速钙瞬变的方案。
摘要
测量突触前神经末梢突触前钙水平的最可行方法之一是光学记录。它基于使用钙敏感的荧光染料,其根据细胞中游离钙的浓度改变其发射强度或波长。有几种方法用钙染料染色细胞。最常见的是通过微量移液管装载染料或与染料的乙酰氧基甲酯形式预孵育的过程。然而,由于出现的方法问题,这些方法不太适用于神经肌肉接头(NMJ)。在本文中,我们提出了一种通过蛙神经的青蛙神经残基将钙敏感染料载入神经末梢的方法。由于外部钙进入神经末梢并随后与钙染料的结合发生在毫秒级时间内,所以有必要使用快速成像系统来记录这些相互作用纳秒。在这里,我们描述了一种使用快速CCD相机记录钙瞬态的协议。
引言
钙离子(Ca 2+ )参与许多神经元信号过程,包括介体释放1,2,3,4,5的起始,维持和可塑性。当动作电位到来时,细胞外Ca 2+进入神经末梢并启动神经递质释放。在一些突触中,钙电流可以通过电生理方法6,7,8直接测量。在神经肌肉接头(NMJ)的情况下,由于神经末梢的微小尺寸,不能使用直接膜片钳和双电极电压钳技术。
NMJ神经末梢的内向Ca 2+电流的记录可以通过间接电泳进行生理方法9,10 。然而,这些方法需要由钠和钾离子通道阻断剂预处理突触。光学方法不需要神经末梢中的离子电流的药理学分离,并允许由动作电位触发的Ca 2+内流的记录,以及随后在轴突质体11,12,13,14中升高Ca 2+离子。这些方法基于在游离Ca 2+离子15,16,17,18,19的结合时记录特定Ca 2+敏感染料的荧光变化。
Ca 2+指示剂可以加载到c通过各种方法,取决于实验的目的。研究人员使用通过贴片移液管22或显微注射23,24,25加载的透膜性染料形式20,21的浴液。然而,所有这些方法在NMJ的情况下都有一些限制,因为它在突触建筑学中的特性。对于NMJ,最方便和最成功的方法是将染料载入神经残端,一种正向填充法26,27,28,29 。该技术可用于将各种荧光染料加载到周围神经末梢。该方法成功应用于果蝇神经末梢28 ,蜥蜴运动神经28 ,青蛙运动神经终端17,26,27,30 。根据研究对象,有条不紊的细节可能会有所不同。玻璃微量吸管可用于来自幼虫28的小神经。一些研究人员已经描述了一种方法27,28 ,其中将肌肉神经支配的新鲜切割的末端浸入预充满染料的孔中。然后将制剂放置几个小时以浸泡染料。染料被轴突浸泡并运送到神经末梢。在本文中,我们描述了通过神经残端将荧光指示剂加载到青蛙运动神经末梢的方法。我们的协议使用塑料移液器吸头来孵育组织和染料。我们还描述了如何获取和分析Ca 2+荧光transients。
研究方案
对来自蛙蛙蛙青蛙的肌肉皮肤 斑块的分离神经 - 肌肉制剂进行实验。两性的动物大小约5-9厘米。实验程序按照"喀山联邦大学和喀山医科大学实验动物使用指南"进行,符合NIH"实验动物护理和使用指南"。实验方案符合欧洲共同体理事会指令86/609 / EEC的要求,经喀山医科大学道德委员会批准。
1.准备解决方案
- 林格氏溶液的制备。
- 准备林格氏溶液:113.0mM NaCl,2.5mM KCl,3.0mM NaHCO 3和1.8mM CaCl 2 。将pH调节至7.2-7.4。
- 用低Ca 2+制备林格氏溶液2+含量:113.0mM NaCl,2.5mM KCl,3.0mM NaHCO 3,6.0mM MgCl 2,0.9mM CaCl 2 。将pH调节至7.2-7.4。
- 染料负载液的制备。
- 制备含有10mM(pH 7.2-7.4)的HEPES-Na的水溶液。
- 将14μL的HEPES溶液加入到具有染料30的小瓶中。
注意:Ca 2+指示剂染料在500μL的小瓶中加入500μg粉末。 - 涡旋旋转,彻底混合。
- 稀释溶液使Ca 2+指示剂的最终浓度降至30mM。避免暴露于光线并储存在-20°C。
2.染色加载程序
- 用一块胸大肌神经解剖皮肤肌肉。
注意:解剖程序可用在Blioch 等人的文章的免费下载中,1968 31 。- 对于解剖手术,使用两个精细钳子和角膜剪刀(参见表格 )。将解剖的组织转移到预先填充有林格氏溶液的硅弹性体涂覆的培养皿中,并用精细的不锈钢针固定组织,使其在培养皿中略微拉伸。
- 用新鲜的等份的林格氏溶液重新填充培养皿。取出结缔组织。不要伤害神经。
- 准备灌装移液器:使用剃刀刀片,切出标准塑料10μL移液管尖端的圆锥形部分〜2 mm长的一段。
- 准备一块造型粘土,将填充移液管安装在培养皿上。
- 将填充移液器的背面连接到塑料注射器,通过硅胶管和由移液器吸头制成的塑料连接适配器。
- 之前d加载程序,使用塑料移液器从培养皿中取出林格氏溶液。使用精细注射器干燥肌肉 - 神经制剂;这将防止在随后加载灌装移液管时稀释Ca 2+染料。
- 从冰箱中取出Ca 2+指示剂小瓶,并在室温下在黑暗的地方解冻。
- 在立体显微镜控制下,低倍率(10×),检测肌肉和神经之间的连接。用精细的镊子和剪刀,将肌肉附近的胸骨神经切开(见步骤2.1)。留下2毫米长的神经残端。
- 使用造型粘土将连接到管道和注射器上的注射器固定在培养皿上。
- 移动吸头的尖端靠近神经残端。
- 不夹住它,轻轻地将神经残端吸入灌装移液管的尖端。
- 从白中取出吸管t填充移液器的末端。
- 用长针头的注射器小心地从填充移液管中清除多余的溶液(参见材料表 )。不要捏住神经残端。
- 轻轻地垂直抬起填充移液管的尖端,使神经残端吸入尖端。
- 使用凡士林,从灌装移液管尖端的外部绝缘吸入的神经残端部分。
- 如果需要,可以将填充移液管中绝缘的神经残基干燥:使用长针头注射器从灌装移液管中轻轻吸出过量的溶液。
- 使用长吸液管吸头吸取0.5μL染料加载溶液(参见步骤1)。
- 轻轻地将移液管尖端与装载溶液插入到填充移液器中。将混合物直接喷到神经残端上。
- 用凡士林密封灌装移液器的开口端。
- 添加一小块林格的注意培养皿以保持准备湿润。
- 在黑暗和潮湿条件下室温孵育5小时。
- 用加载溶液取出填充移液器,用林格氏溶液冲洗准备物质,并在8°C的冰箱中保持过夜。
3.准备显微镜组织
- 将制备物装入硅弹性体涂层室中,并用钢微针固定,使其略微拉伸。
- 用新鲜的林格氏溶液等份冲洗组织。
- 使用吸电极刺激神经;电极的构造可从Kazakov 等人免费下载。 ,2015 32 。将电极尖靠近神经的切割端并将神经残端吸入电极孔。
- 将准备室安装在显微镜平台上。的Plac温度探头和腔室中的入口和出口点火。
- 将电源线连接到珀耳帖元件。
- 为了超级准备,请使用简单的重力驱动系统。要清除多余的溶液,请打开灌注抽吸泵。
- 打开热控制器单元。
- 将温度控制设置为20°C。
- 安装紫外线防护罩。
- 将刺激线电极连接到电刺激器,并用4x物镜观察显微镜下的肌肉收缩。
- 用低Ca 2+和高Mg 2+含量的林格氏溶液填充灌注系统。
注意:该解决方案用于预防肌肉收缩。外部钙浓度的降低和外部镁的升高导致Ca 2+瞬变幅度的降低。然而,根据以前的经验,将0.9mM CaCl 2和6mM MgCl 2仍足以可靠地分辨Ca 2+瞬变的幅度。值得一提的是存在一些减少肌肉收缩而不降低Ca 2+浓度的方法。例如,使用d-tubocurarine或α-银环蛇毒素,特异性阻断烟碱乙酰胆碱受体将完全或部分阻断肌肉抽搐17,27,28,30。然而,这些毒素的添加也可以影响突触前钙进入33 。为了避免这种情况,可以使用μ-芋螺毒素GIIIA。 - 打开泵,并用低Ca 2+和高Mg 2+的林格氏溶液启动制剂的灌注。
- 在显微镜上切换到40×物镜。
- 打开t他单色仪(见材料表 )。
- 在单色仪控制软件中选择488 nm的发射波长和连续的照明模式。
- 在高放大倍数的荧光模式下,确保神经末梢装载染料。
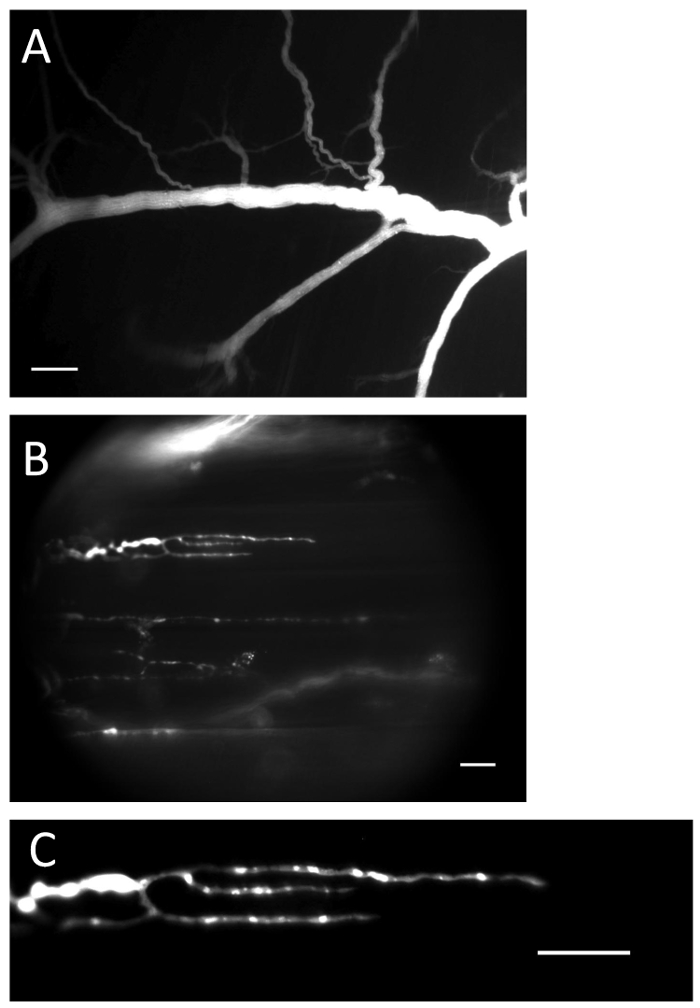
图1 :带有Ca 2+指示剂的神经和终端。 ( A )装载程序后,神经中装有Ca 2+指示剂。刻度棒= 200μm。 ( B )充满Ca 2+指示剂的神经末梢。刻度棒=20μm。 ( C )Ca 2+指示剂荧光在神经末梢清晰可见。刻度棒=20μm。_blank">请点击此处查看此图的较大版本。
- 允许制剂在低Ca 2+和高Mg 2+溶液中平衡至少30分钟。
4.采用数字CCD相机进行视频采集
注意:捕获荧光信号的细节对于每种显微镜和相机类型都是特定的,但关键考虑的是图像捕获速度。
- 使用1 kHz作为记录NMJ中单个Ca 2+瞬变的最小捕获频率。
注意:快速数字CCD摄像机是荧光成像所必需的(见材料表 )。数据采集系统和软件(参见" 材料表" )用于摄像机,单色仪和刺激器的同步。简而言之,该协议允许在数据的数字输出上产生同步脉冲采集系统打开快门,捕获视频信号,并启动刺激。可以在协议和/或设备上设置所有时间参数。一个典型的协议是一系列以1 kHz(80 x 80像素)获得的500帧。用激发光照射可以漂白Ca 2+指示剂并对细胞组织造成光损伤。因此,避免激发光的长时间曝光。在此协议中,快门仅在拍摄视频所需的时间打开。每个特定神经末梢获取二十个系列。目的是监控对照组和给药后的相同部位。 - 在显微镜的4X物镜下,使用亮场方式来显现肌肉和神经分支。
- 切换到40X物镜,使用落射荧光方式和488nm的激发波长,寻找负载染料的神经末梢。确定感兴趣的神经末梢区域。
- 在三目管of显微镜,选择光路交换等级:100%照相机。
- 启动CCD摄像机的采集软件。
- 在"实时"模式下,找到ROI并调整焦点。
- 选择菜单"更改"设置。
- 使用"基本配置",每秒1000帧(fps),分辨率为80 x 80。
- 将输入帧数设置为500。
- 输入实验的名称。
- 选择"外部触发"。
- 将预触发时间设置为10 ms。
- 将重复次数设置为20。
- 在单色仪控制软件中,选择488 nm的发射波长和"外部触发照明"模式。
- 运行数据采集软件。
- 加载刺激方案。
- 在录制视频之前,请使用视频采集软件捕获暗帧。
- 运行刺激方案。
- 选择ROI和check记录的信号。
数据分析
NoOTE:对于数据分析,请使用CCD相机软件和ImageJ;数据表示为电子表格程序中的曲线。在CCD相机软件中,平均20次重复并将结果导出到ImageJ支持文件。在ImageJ中,选择ROI和背景。从ROI中减去背景。将数据表示为:(ΔF/ F 0 -1)×100%,其中ΔF是刺激期间的荧光强度,F 0是静止时的荧光强度。
- 在CCD摄像机的采集软件中,单击文件>平均文件。选择文件并对其进行平均。
- 将平均文件保存为.fit文件,方法是单击"另存为文件"。
- 运行ImageJ软件。执行以下步骤:
- 点击图像>调整>亮度/对比度。
- 单击图像>堆栈>工具>;堆垛机
- 点击分析>工具>投资回报率管理器。
- 将平均的.fit文件拖放到ImageJ窗口中。
- 放大窗口以获得更好的视野。
- 通过移动光标,选择最后一帧并将其删除(这是黑框)
- 在被认为是背景的区域上选择一个矩形ROI。将其添加到ROI管理器
- 单击更多>多尺度测量背景。注意平均值。复制数据,将其导出到电子表格程序,并计算一个比率的阈值的平均值。
- 通过单击"处理">"主">"减",减去堆栈中的阈值。输入阈值的平均值。
- 在神经末梢周围选择一个矩形ROI。将其添加到ROI管理器。
- 单击更多>多尺度测量。注意平均值。复制并将其导出到电子表格程序。
- 平均信号的偏移。
注意:使用第一几十点显示基色染料无刺激;这是休息时的荧光。 - 将信号除以休息时的荧光。
- 减去"1"乘以100%。
- 绘制信号并计算Ca 2+瞬变的幅度。
结果
染色剂负载后,运动神经刺激后,可以在神经末梢检测到荧光信号(Ca 2+瞬态)振幅的增加( 见图2 )。 Ca 2+瞬变的参数如表1所示 。从数量上看,本研究中测量的Ca 2+瞬态参数与其他科学家在冷血动物15,34的突触中获得的数据接近。 Ca 2+瞬变的参数取决于Ca 2+与染料的结合速率和随后的解离。 Ca 2+进入神经末梢,与染料的相互作用和细胞质扩散的速率都影响Ca 2+瞬时的上升时间。荧光信号的衰变时间取决于染料的亲和力,Ca 2+与细胞内缓冲液相互作用的速度以及离子泵35的去除。 Ca 2+瞬变的振幅分析可用于研究各种物质对参与神经递质释放的钙进入的影响33 。

图2 :平均Ca 2+ 在青蛙NMJ中进行瞬态测量。基于来自13只青蛙NMJ的信号的平均值计算Ca 2+瞬变。 请点击此处查看此图的较大版本。
| 峰ΔF/ F(%) | 上升时间20%-80%(ms) | τ(ms) |
| 12,6±1,1(n = 13) | 4.6±0.5(n = 13) | 115.3±8.3(n = 13) |
表1: Ca 2+瞬态 的 平均 参数 。数据表示为平均值±SE; n是不同NMJ中的测量次数。峰值ΔF/ F是ΔF/ F的平均振幅。
讨论
在本文中,我们介绍了通过神经残端对青蛙神经末梢进行Ca 2+敏感染料负载的方法。在装载程序结束时,神经近端部分的所有端子都具有显着的荧光水平。已经估计探针的端内浓度在40和150μM之间变化17 。
孵育过程分两步进行:在室温下,然后在较低温度下在冰箱中进行。在室温下控制染料组织培养的时间很重要。根据神经残端的实际长度,特定染料和温度,孵育时间可能会有所不同。如果曝光过度,靠近神经残端的近端部位的终端可能过载。然而,在神经的中间部分,仍然可以找到令人满意的载物。期间在冰箱中长时间保温,染料均匀分布于神经末梢。
我们自己的观察33,35以及其他研究人员的数据30证明了加载过程对突触后反应的振幅或微型端板电位的频率没有任何明显的影响。在装载的准备中记录了良好的寿命。我们想提请注意一些重点。在切除后几分钟内将神经残基置于染色剂加载溶液中是非常重要的,以使染料进入切割神经的轴突;延迟可能导致无效的负载,大概是由于神经轴突27,36的重新密封。一些研究者将神经残体浸入100mM EDTA(Ca 2+和Mg 2+螯合剂)中)切除神经后立即防止切口轴突重新密封。 1-2分钟后除去缓冲液,用染料加载溶液37代替。使用石油井代替塑料管用于装载程序允许使用较短的神经残端。在使用这种方法时,在用染料浸入HEPES溶液中之后切断神经,并且由于染料溶液27,28中缺少二价离子,轴突不会重新密封。
在我们的研究中,我们使用Ca 2+指示剂的水溶性盐形式而不是葡聚糖。葡聚糖结合物在轴突中比盐形式更慢地扩散。然而,使用葡聚糖缀合物减少了神经和NMJs的染色分隔和处理。钙绿色1-3,000MW葡聚糖共轭物具有良好的扩散速率并表现出减少的区室化 up class ="xref"> 38。
避免组织长时间的荧光照射是非常重要的,因为这会影响组织的健康和生存。我们在可见光通道中使用Nomarski光学器件来搜索神经末梢。在录制过程中,我们使用隔膜来限制照明场。
值得注意的是,这种加载方法仅适用于可以承受长时间孵化的制剂。为了减少对较脆弱的组织( 例如温血动物的突触)进行研究时的染色加载时间,有必要缩小神经残端长度并使用微量移液管装载29,39。
这种加载技术非常适合于细胞溶质Ca 2+的成像变化,具有单神经刺激和节律突触活动下的荧光指示Ca 2+ -瞬态振幅的分析可用于研究不同物质对参与神经递质释放的钙进入的影响33 。
披露声明
作者没有什么可以披露的。
致谢
这项研究是根据俄罗斯政府的喀山联邦大学竞争力增长计划和俄罗斯基础研究基金会的资助(16-04-01051; 16-34-00817; 15-04-02983)进行的。我们感谢四位匿名审稿人对原稿草稿提供有用的意见。我们对Yuliya Aratskaya的录音表示感谢。我们非常感谢Victor Ilyin博士提供的许多有用的评论以及对手稿的最终编辑的帮助。
材料
| Name | Company | Catalog Number | Comments |
| Ca2+ indicator | Molecular Probes, USA | Oregon Green 488 BAPTA-1 hexapotassium salt, O6806 | 500 μg |
| Silicone Elastomer | Dow Corning, USA | Sylgard 184 elastomer | |
| Pipette | Biohit, Russia | 720210 | 0.5-10µL |
| Pipette tip | Fisher Scientific, USA | 02-707-175 | 10µL |
| Pipette tip | Biohit, Russia | 781349 | 10µL |
| Razor Blade | Fisher Scientific, USA | 12-640 | |
| Minutien Pins | Fine scince tools, Canada | 26002-20 | |
| Corneal Mini-Scissors | MT MEDI CORP, Canada | S-1111 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9610 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9611 | |
| Modelling clay | local producer | can be replaced by any local producer | |
| Petroleum jelly | local producer | can be replaced by any local producer | |
| Microspin FV 2400 | Biosan, Latva | BS-010201-AAA | |
| Multi-spin MSC 3000 | Biosan, Latva | BS-010205-AAN | |
| Single-use hypodermic needles | Bbraun | 100 Sterican | 0.4×40mm |
| Syrynge | local producer | 0.5 ml | |
| HEPES | Sigma-Aldrich, USA | H0887 | 100ml |
| Microscope, BX51 | Olympus, Japan | ||
| Data acquisition system | Molecular Devices, USA | Digitdata 1550 | |
| software | Molecular Devices, USA | pClamp software, Version 10 | protocol can be download from : http://kpfu.ru/portal/docs/F_230007060/Video.capture.with. RedShirt.Neuro.CCD.camera.pro |
| Bath and bath temperature controler | Experimental Builder | can be replaced by any chamber with temperature control. For example from https://www.warneronline.com/ | |
| Monochromator | Till Photonics, Germany | Polychrome V | no longer available, can be replaced by other sutable stable light source 488 nm |
| monochromator control software | Till Photonics, Germany | Polycon | |
| Digital CCD camera | Redshirt imaging, USA | Neuro CCD SMQ | |
| Model 2100 Isolated Pulse Stimulator | A-M Systems, USA | ||
| Acquisition software for CCD camera | Redshirt imaging, USA | Turbo SM software | |
| ImageJ | National Institutes of Health, USA | http://rsb.info.nih.gov/ij/download.html | |
| Spreadsheet program | Microsoft, USA | Microsoft Office Excel |
参考文献
- Llinás, R., Sugimori, M., Silver, R. B. Microdomains of high calcium concentration in a presynaptic terminal. Science. 256, 677-679 (1992).
- Augustine, G. J. How does calcium trigger neurotransmitter release?. Curr Opin Neurobiol. 11, 320-326 (2001).
- Burnashev, N., Rozov, A. Presynaptic Ca2+ dynamics, Ca2+ buffers and synaptic efficacy. Cell Calcium. 37, 489-495 (2005).
- Schneggenburger, R., Neher, E. Presynaptic calcium and control of vesicle fusion. Curr Opin Neurobiol. 15, 266-274 (2005).
- Pang, Z. P., Südhof, T. C. Cell biology of Ca2+-triggered exocytosis. Curr Opin Cell Biol. 22, 496-505 (2010).
- Borst, J. G., Sakmann, B. Calcium influx and transmitter release in a fast CNS synapse. Nature. 383, 431-434 (1996).
- Borst, J. G., Sakmann, B. Calcium current during a single action potential in a large presynaptic terminal of the rat brainstem. J Physiol. 506, 143-157 (1998).
- Yazejian, B., DiGregorio, D. A., Vergara, J. L., Poage, R. E., Meriney, S. D., Grinnell, A. D. Direct measurements of presynaptic calcium and calcium-activated potassium currents regulating neurotransmitter release at cultured Xenopus nerve-muscle synapses. J Neurosci. 17, 2990-3001 (1997).
- Molgó, J., Mallart, A. Effects of Anemonia sulcatatoxin II on presynaptic currents and evoked transmitter release at neuromuscular junctions of the mouse. Pflugers Arch. 405 (4), 349-353 (1985).
- Slutsky, I., Rashkovan, G., Parnas, H., Parnas, I. Ca2+-independent feedback inhibition of acetylcholine release in frog neuromuscular junction. J Neurosci. 22 (9), 3426-3433 (2002).
- Haugland, R. P., Gregory, J. Indicators for Ca2+, Mg2+, Zn2+ and other metal ions. Handbook of fluorescent probes and research products. , 771-826 (2002).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Tsien, R. Y. Fluorescent indicators of ion concentrations. Methods Cell Biol. 30, 127-156 (1989).
- Adams, S. R. How calcium indicators work. Cold Spring Harb Protoc. 2010 (3), (2010).
- DiGregorio, D. A., Vergara, J. L. Localized detection of action potential-induced presynaptic calcium transients at a Xenopus neuromuscular junction. J Physiol. 505, 585-592 (1997).
- Sabatini, B. L., Regehr, W. G. Optical measurement of presynaptic calcium currents. Biophys J. 74, 1549-1563 (1998).
- Suzuki, S. Ca2+ dynamics at the frog motor nerve terminal. Pflug Arch Eur J Phisiol. 440, 351-365 (2000).
- Sabatini, B. L., Oertner, T. G., Svoboda, K. The life cycle of Ca2+ ions in dendritic spines. Neuron. 33, 439-452 (2002).
- Luo, F., Dittrich, M., Stiles, J. R., Meriney, S. D. Single-pixel optical fluctuation analysis of calcium channel function in active zones of motor nerve terminals. J Neurosci. 31, 11268-11281 (2011).
- Regehr, W. G., Yuste, R., Konnerth, A. Monitoring presynaptic calcium dynamics with membrane-permeant indicators. Imaging in neuroscience and development: a laboratory manual. , 307-314 (2005).
- Macleod, G. T. Topical Application of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 786-790 (2012).
- Eilers, J., Konnerth, A. Dye loading with Patch Pipettes. Cold Spring Harb Protoc. 2009 (4), 277-281 (2009).
- Coleman, W. L., Bill, C. A., Simsek-Duran, F., Lonart, G., Samigullin, D., Bykhovskaia, M. Synapsin II and calcium regulate vesicle docking and the cross-talk between vesicle pools at the mouse motor terminals. J Physiol. 586 (19), 4649-4673 (2008).
- Macleod, G. T. Direct Injection of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 797-801 (2012).
- Talbot, J. D., David, G., Barrett, E. F., Barrett, J. N. Calcium dependence of damage to mouse motor nerve terminals following oxygen/glucose deprivation. Exp Neurol. 234 (1), 95-104 (2012).
- Peng, Y. Y., Zucker, R. S. Release of LHRH is linearly related to the time integral of presynaptic Ca2+ elevation above a threshold level in bullfrog sympathetic ganglia. Neuron. 10, 465-473 (1993).
- Tsang, C. W., Elrick, D. B., Charlton, M. P. alpha-Latrotoxin releases calcium in frog motor nerve terminals. J Neurosci. 20 (23), 8685-8692 (2000).
- Newman, Z., Malik, P., Wu, T. Y., Ochoa, C., Watsa, N., Lindgren, C. Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. Eur J Neurosci. 25 (6), 1619-1630 (2007).
- Macleod, G. T. Forward-filling of dextran-conjugated indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harb Protoc. 2012 (7), 3440-3450 (2012).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Blioch, Z. L., Glagoleva, I. M., Liberman, E. A., Nenashev, V. A. A study of the mechanism of quantal transmitter release at a chemical synapse. J Physiol. (1), 11-35 (1968).
- Kazakov, A., Aleksandrov, M., Zhilyakov, N. V., Khaziev, E. F., Samigullin, D. V. A simple suction electrode for electrical stimulation of biological objects. Mezhdunarodnyj nauchno-issledovatel'skij zhurnal. 40 (9), 13-16 (2015).
- Khaziev, E. Acetylcholine-induced inhibition of presynaptic calcium signals and transmitter release in the frog neuromuscular junction. Front Physiol. 7 (621), 1-10 (2016).
- Bélair, E. L., Vallée, J., Robitaille, R. Long-term in vivo modulation of synaptic efficacy at the neuromuscular junction of Rana pipiens frogs. J Physiol. 569 (1), 163-178 (2005).
- Samigullin, D., Fatikhov, N., Khaziev, E., Skorinkin, A., Nikolsky, E., Bukharaeva, E. Estimation of presynaptic calcium currents and endogenous calcium buffers at the frog neuromuscular junction with two different calcium fluorescent dyes. Front Synaptic Neurosci. 6 (29), 1-10 (2015).
- Angleson, J. K., Betz, W. J. Intraterminal Ca2+ and spontaneous transmitter release at the frog neuromuscular junction. J Neurophysiol. 85 (1), 287-294 (2001).
- Shahrezaei, V., Cao, A., Delaney, K. R. Ca2+ from one or two channels controls fusion of a single vesicle at the frog neuromuscular junction. J Neurosci. 26 (51), 13240-132499 (2006).
- Troncone, L. R., et al. Promiscuous and reversible blocker of presynaptic calcium channels in frog and crayfish neuromuscular junctions from Phoneutria nigriventer spider venom. J Neurophysiol. 90 (5), 3529-3537 (2003).
- Samigullin, D. V., Khaziev, E. F., Zhilyakov, N. V., Sudakov, I. A., Bukharaeva, E. A., Nikolsky, E. E. Calcium transient registration in response to single stimulation and during train of pulses in mouse neuromuscular junction. BioNanoSci. 7 (1), 162-166 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。