Method Article
重组腺相关病毒9型 MicroRNA 系统分娩治疗啮齿动物神经肌肉疾病
摘要
在这里, 我们描述了 microRNA 使用重组腺相关病毒9型在小鼠神经肌肉疾病模型中的交付。小鼠的单个外围管理导致肌肉和运动神经元的持续 miRNA 过度表达, 为研究 miRNA 功能和体内的治疗潜力提供了机会。
摘要
RNA 干扰通过内源 miRNA 通路调控基因表达通过控制蛋白质合成通过转录后基因沉默。近年来, miRNA 介导的基因调控已经显示了治疗神经疾病的潜能, 这是由功能机制的毒性增益引起的。然而, 有效地向目标组织传递却限制了它的应用。在这里, 我们使用了转基因小鼠模型脊髓和球肌萎缩 (SBMA), 一种神经肌肉疾病由 polyglutamine 扩张的雄激素受体 (AR), 以测试基因沉默的新确定的 AR 靶向 miRNA, miR-298。我们抗原 miR-298 使用重组腺相关病毒 (rAAV) 型9向量, 以促进非分裂细胞的转导。单尾静脉注射 SBMA 小鼠导致骨骼肌和运动神经元中 miR-298 的持续和广泛表达, 从而改善了小鼠神经肌肉表型。
引言
MiRNAs 是非编码 rna, 21-23 核苷酸长度, 在调控基因表达和控制不同的细胞和代谢通路方面起着重要作用。1基因表达主要通过诱导转录后基因沉默或 mRNA 降解来调节。2 MiRNAs 通常是互补的 3 ' 未翻译的区域 (UTR) 编码基因, 虽然绑定到 5 ' UTR 和编码区域的目标 mRNA 也被描述。3
由于目前对 miRNA 在人类疾病发病机制中的作用的理解不断扩大, 个体 miRNAs 或 miRNA 家庭的药理调控越来越成为一种可行的治疗方案。与其他 RNA 抑制策略相比, miRNAs 有许多优点: miRNAs 毒性较小, 免疫少, 而且由于体积小, 容易被送进细胞。4,5,6 MiRNAs 通常在蜂窝网络中有许多目标, 因此需要考虑潜在的非目标效应和安全问题, 同时有效地向目标组织提供。
神经肌肉疾病是获得或继承的条件, 影响肌肉和运动神经元。将药物定向到骨骼肌是一个新兴的研究领域, 主要的挑战是在治疗窗口内实现广泛的分布。7运动神经元的靶点比较困难, 主要是因为血液中的脑屏障排除了药物的进入。
本研究采用细胞培养和小鼠脊髓和球肌萎缩 (SBMA) 模型。SBMA 是一种神经肌肉疾病, 由功能机制的毒性增益引起, 其中肌肉和运动神经元都受到影响。8,9 SBMA (肯尼迪病;OMIM #313200) 是一种 X 关联的疾病, 其特点是肌肉虚弱和萎缩, 由 CAG 基因重复扩张引起的, 这对ar蛋白中的扩展 polyglutamine 道进行编码。10目前尚无治疗此病的疾病改良疗法。本研究使用的转基因小鼠模型概括了该病的特点, 包括性别特异性、运动神经元病理学和渐进性肌肉萎缩。11
在这项研究中, 我们的努力集中在确定一个 miRNA 直接 downregulates 的基因突变 AR 基因的表达和设计一个安全和有效的方式交付 miRNA 脊髓和骨骼肌肉的疾病小鼠模型。
在这里, 我们确定了一个相对 uncharacterized miRNA, miRNA-298 (加入编号 MIMAT0004901),12直接减少突变 AR 表达在 SBMA 模型。为了实现对靶组织的 miR-298, 我们采用了病毒策略, 重组腺相关病毒9型 (rAAV9)。rAAV9 能够跨越血脑屏障, 在非分裂细胞 (包括神经元) 中进行长期基因表达。13 AAV9-miR-298 的单一系统管理导致了 miRNA 的持续表达, 肌肉和运动神经元的有效传导, AR 表达的下降调节, 以及改善 SBMA 小鼠的疾病表型。14本方法可用于在体内提供 miRNA 或 antagomirs 过度表达。
研究方案
所有程序都是按照国家卫生研究院的护理和使用实验动物指南 (第八, 国家科学院出版社, 修订 2011) 进行的, 并已得到 NINDS 动物护理委员会的批准。
1. AAV9-miRNA 设计策略和 miRNA 选择
- 使用 miRWalk 预测数据库选择与目标基因的 mRNA 3 ' UTR 区域交互的候选 miRNAs。15
注: 将 miRNA 序列的最小种子长度限制在至少7核苷酸上。选择其他已建立的 miRNA 预测计划 (米兰达, miRDB, Targetscan) 进行比较分析。根据这些选择标准, 本文选择了 miR-185、miR-298、miR-873 和 miR-877 进行进一步的评价。 - 从 miRBase (http://www.mirbase.org/) 中检索选定 miRNA 的序列。
- 将和平号 (60-70) 和其250-300 个侧翼的基因组序列复制到相应的 AAV cis 向量中, 或模拟序列。
注意: 侧翼序列是正确的和平号表达和成熟的 microRNA 处理所必需的。选择一个双启动子 rAAV cis 向量, 其表达式盒包括人体伸长 factor-1 alpha (EIF1α) 启动子, 后跟选定的 miRNA 或模拟序列, 以及人巨细胞病毒 (CMV) 启动子和 cDNA 编码GFP 荧光标记。选择 EIFα启动子是因为它保证了稳定和均匀的表达, 沉默的风险最小。根据特定的应用, 可以使用组织特定的或有条件的启动子。 - 根据已发布的协议, 准备、纯化和滴定 AAV。16
注: 在这里, 克隆的和平号到 AAV 的载体和病毒的生产是由外部制造商执行。
2. AAV-miRNA 质粒的尾静脉注射
注意: 这一步需要根据目标基因和小鼠的年龄和体重进行调整。使用机构和动物护理和使用委员会 (IACUC) 指南, 以确定的剂量范围, 数量和最佳的管理途径, 根据年龄和体重的小鼠。GFP 荧光信号和 miRNA 在靶组织中的表达水平预计在注射后2周开始峰值。以下议定书是指成年早期雄性小鼠。在生物安全等级1准则下, AAV 应作为生化危害处理。
- 用无菌磷酸盐缓冲盐水 (PBS) 将 AAV-miRNA 质粒库存在100-200 µL 整除数中, 含有 1010-1011病毒基因组的病毒载量 (vg/毫升)。实验室生物危害个人防护设备应用于处理 AAV 解决方案。
注: 一旦整除解冻, 它可以保存在4摄氏度, 长达两周。病毒的股票可以储存在-80 °c 冰箱。 - 在商用抑制剂中抑制鼠标, 如塑料或锥形塑料膜管的适当尺寸。
- 用70% 酒精湿巾清洁尾部表面。
- 在尾部下保持一个温暖的垫 (28-30 °c), 以增加三十年代的血管舒张. 或者, 用一盏红色的灯 (在2-3 英尺的距离) 或将尾部浸入温水中来加热动物。
-
从尾部的远端部分开始, 插入针 (27-30 克) 载有病毒的整除, 斜面向上, 从尾部, 从尾, 到静脉。注射前, 确保针正确插入。
- 如果在注射过程中感觉到阻力, 或者皮肤肿胀出现, 停止手术。取出针头, 再将针插入上一个注射点上方。
注: 另外, 这可以通过轻轻地吸针和观察血液来实现。坚硬的吸入可以折叠尾脉。如果静脉在注射过程中 blanches, 针插入正确。
- 如果在注射过程中感觉到阻力, 或者皮肤肿胀出现, 停止手术。取出针头, 再将针插入上一个注射点上方。
- 注射完成后, 在抬针前等几秒钟。
- 观察注射部位出血。使用两个手指的适度压力到现场, 直到出血停止。
- 把动物送到笼子里去。
3. 行为化验
注: 所有实验都是由第三方盲目进行的, 用独特的编码小瓶掩盖治疗方法。治疗顺序是随机的。在执行下面描述的测试时, 应控制实验条件 (房间和时间的类型), 以减少变化。本试验应在四周以上的小鼠身上进行, 以达到可靠的效果。小鼠在5周的病毒注射前进行过一次行为评估, 以获得正常表现的基线。病毒注射后, 每周一次对小鼠进行一次48小时的注射, 达到40周的年龄。
- 将鼠标注入 AAV 到一个安静的, 黑暗的房间, 没有噪音或其他干扰至少30分钟, 然后开始测试。在这种驯化期间不要打扰动物。
- 将鼠标适应新房间30分钟, 然后开始以下行为检测 (步骤3.3 和 3.4)。在每种行为分析之间保持10分钟的差距。
-
挂线试验
注意: 这个测试监测肌肉力量和运动障碍。- 使用填充纸作为缓冲。拿起鼠标的尾巴, 并把它放在电线网架的中心。将机架抬高15-20 英寸以上的表面, 并慢慢反转屏幕, 让动物调整其在屏幕上的抓地力。
- 一旦机架完全颠倒, 启动定时器, 并记录时间下降。
注意: 老鼠会在网格上挂上四只四肢。如果电线设置得太低, 老鼠可能不会挂上。如果老鼠在六十年代之前从网格上掉下来, 把它们放回到网格上, 重新设置定时器, 再重复这个过程最多再试两次。注册最佳性能。 - 当达到六十年代的期限时, 把动物送回笼子。
-
足印检测
注: 吸水片应为一条狭窄的跑道, 长约70厘米, 宽5厘米, 5 厘米高的墙壁。- 用一只手轻轻握住鼠标, 用刷子将红色墨水涂在前爪和蓝色墨水上。
- 把吸水纸放在狭窄跑道的地板上。
- 允许鼠标在跑道上的一条直线上行走或奔跑, 从一端到其他。
- 用新的吸水纸重复这一过程两次与鼠标。
- 测量前进运动中连续两个步骤之间的距离。不要包括第一和最后几个脚印, 动物只是启动和完成它的运行。
4. 安乐死和组织收获
- 使用安乐死室或钟罐。如果使用钟罐, 在通风罩下执行程序。
- 用异氟醚浸泡棉花, 放在钟罐子里。使用物理分离器保持动物与麻醉材料的物理接触。在这一步之后立即将动物放在罐子里。
注: 钟罐不应预先充电与异氟醚, 以避免可能的低氧血症的动物。 - 继续接触异氟醚, 直到三十年代呼吸停止。
- 将鼠标从罐子中取出后立即弄死颈椎脱位。
注意: 这一步应尽可能快地进行, 以避免组织退化。 -
首先收获脊髓, 然后是四头肌骨骼肌。
- 要收割脊髓, 露出老鼠的背面, 把四只四肢固定在解剖板上。
- 用70% 乙醇清洗解剖部位。
- 用锋利的剪刀做颈椎脱位。
- 在正中线的皮肤上做一个切口。通过切割或仔细撕裂在横向平面上的皮肤, 然后拉的皮毛向上和头部的皮毛删除。用剪刀剪下肩胛骨, 在柱子的 C1-2 区域 (发现在头骨的基底附近) 切下头部。
- 切开腹壁肌组织在腹侧和继续侧向, 一次方向, 直到脊柱被到达。
- 用锋利的剪刀从颈椎脊髓开始切除椎骨。通过跨椎弓两侧切除椎骨的侧部。
- 切除整个椎骨后释放脊髓。
-
用以下方法对预冷2丁烷中的收获组织进行冻结;
- 半填充一个不锈钢碗与2丁烷和淹没底部季度的碗在一个充满液氮的容器。
- 在液氮中预冷 2-丁烷1-2 分钟。
- 将骨骼肌与钳在2丁烷, 直到它变成白色。立即将组织转移到干冰, 然后将其储存在-80 摄氏度。
- 对于脊髓染色, 在凝固冰冻之前, 在室温下将组织嵌入石蜡块中。17
- 为了进行生化分析和 miRNA 定量,1将收获的组织 cryovial 在液氮中冷冻。把样品存放在摄氏-80 摄氏度。
结果
1011 vg 的 AAV9-miR-298 的病毒负载通过一个单一的尾静脉注射注入5周老 SBMA 小鼠。这些小鼠在 ar (AR97Q) 中携带的人 ar 转基因与异常扩张的 polyglutamine, 并形成神经肌肉疾病的迹象10周的年龄 (体重减轻, 驼背背部和肌肉萎缩)。在 miRNA 定量化、生化测定和免疫组化 (图 12) 的管理后, 2、4、8和1周内收获11腰椎脊髓和四头肌。治疗的管理和随后的分析是由盲人调查员进行的。
qRT PCR 分析显示, 在治疗后两周和四周的骨骼肌和脊髓 miR-298 表达, 在骨骼肌8周的峰值表达水平和注射后脊髓12周 (图2).使用显微镜 (Axiovert 100 M), 在肌肉组织和脊髓运动神经元中检测到绿色荧光信号, 通过 GFP 的共定位和运动神经元标记胆碱乙酰转移酶 (聊天) 治疗后10周, 当小鼠开始显示疾病表现 (图 2)。
使用相同剂量方案, SBMA 小鼠随机接受 miR-298 或模拟7周的年龄通过尾静脉注射进行生化分析和功能表征。注射后, 每周体重和行为评估长达40周的年龄。qRT PCR 分析表明, miR-298 治疗降低了受影响的组织中突变 AR 的水平 (图 3), 增加了体重和改善的运动性能 (图 4) 从注射后10周开始。
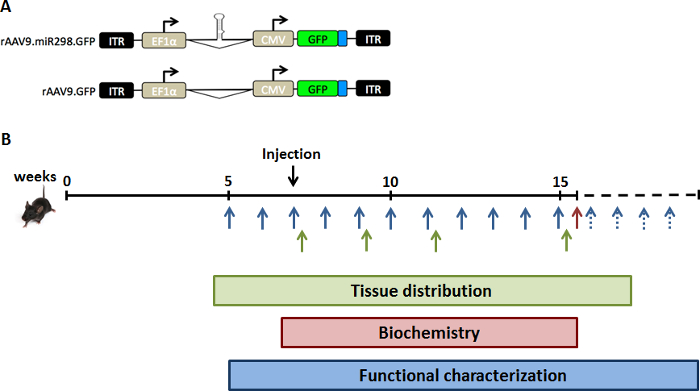
图 1: 研究设计示意图.为提高 miR-298在体内的表达水平, 我们注射 SBMA 小鼠 (A) 双启动子 AAV 载体, 表达 GFP, 或者 miR-298 或模拟。(B) 小鼠在7周的年龄 (症状前阶段) 通过一次无尾注射注入。SBMA 小鼠在不同时间点的组织分布分析 (绿色) 收集脊髓和四头肌肌肉。对 SBMA 小鼠进行了16周的生化分析 (红色) 治疗和牺牲。体重和行为分析每周进行40周的功能表征 (蓝色)。请单击此处查看此图的较大版本.

图 2: 小鼠 AAV9-miR-298 交付.使用这里描述的方法, 老鼠接受了 AAV9-miR-298-GFP 或 AAV9-mock-GFP 通过静脉注射。注射后24、8、12周从腰椎脊髓和股四头肌中收集 miRNA。qRT PCR 对 miR-298 (A) 股四头肌 (n = 5) (B) 腰椎脊髓 (n = 5, P < 0.01) 的表达水平进行了估计。所有的数据都是按标准误差表示的。在治疗后10周内, AAV 载体的广泛转导通过荧光蛋白 (C) 四头肌 (原放大倍数, 10X) 的染色定位证实。鳞片棒 = 100 µm) 和 (D) 腰脊髓运动神经元 (原放大倍数, 40X。缩放条 = 10 µm (绿色), 聊天 (红色) 和 DAPI (蓝色)。图已从 10.1038/mt 2016.13 修改。14请单击此处查看此图的较大版本.

图 3: 小鼠脊髓和股四头肌中 MiRNA-298 过表达 downregulates 突变 AR.qRT PCR 对 (A) 腰椎脊髓和 (B) AAV9-miR-298-GFP 或 AAV9-mock-GFP 治疗的股四头肌的 AR mRNA 表达水平进行了估计。转录水平被规范化到 snoRNA202 (每治疗 5)。* p < 0.05, ** p < 0.01。所有数据都以 "标准错误" 的方式报告。图已从 10.1038/mt 2016.13 修改。14

图 4: MiR-298 过度表达改善了运动功能, 减少了体重损失.行为评估每周进行一次 (w), 在5周到40之间。小鼠体重 (左) 和挂线 (右) 性能 (每组 15)。所有数据都以 "标准错误" 的方式报告。图已从 10.1038/mt 2016.13 修改。14
讨论
在这里, 我们展示了一个高效和可访问的方法来选择和提供通过尾部注射 miRNA 使用 rAAV9 作为一个病毒载体的目标骨骼肌和运动神经元的小鼠。14与其他 rna 干扰策略相比, miRNAs 毒性较小, 免疫少。18此外, 它们的小尺寸使它们很适合病毒载体的有限包装能力。2计算算法和预测工具允许识别假定的 miRNA mRNA 目标。一旦确定, miRNA 对靶基因表达的影响必须得到验证。一种常见的方法是在体外过度表达 tshr 一个给定的 miRNA, 并利用西方的分析来检测目标蛋白的表达水平。14,19
各种研究已经使用病毒和非病毒的策略来提供 miRNAs。13在这里, 我们用腺相关病毒 (AAV) 作为基因传递工具。与其他病毒载体相比, AAV 诱导低免疫原性, 允许长期基因转移, 在分裂和非分裂细胞中具有广泛的取向。18这种传递方法还可以规避对化学修饰的需要, 这可能会影响 RNA 分子的功能和特异性。AAV 有几种血清型, 主要由衣壳蛋白组成。这些血清型不同于它们的取向和传感器不同的细胞类型。在考虑靶组织时, 有必要选择正确的血清型。我们选择 rAAV9, 由于其在中枢神经系统和骨骼肌的高转导效率19,20。这种方法显示, 与成年动物相比, 新生动物的转导效果更大, 可能是由于细胞外基质成分的差异、神经元与神经胶质的比值以及血脑屏障的成熟。21,22
该协议的一个重要步骤是表达式向量的设计。与 bicistronic 载体相比, 由于第二基因的表达低于启动子旁边的第一个基因而受到阻碍, 因此双启动子向量允许在 miRNA 和 EGFP 之间产生高表达的背对回配置, 从而允许免疫荧光 miRNA 在小鼠组织中的定位。
静脉注射 AAV9 导致靶组织、骨骼肌和运动神经元的高效和均匀传导。这一注射途径允许被管理的剂量达到系统循环和跨脑血屏障, 这对于针对中枢神经系统的治疗非常重要。此外, 它是一种非侵入性的方法交付中枢神经系统。MiR-298 表达在脊髓和肌肉中增加2-4 周后, 单个外周注射在5周的年龄。在使用单链基因组 AAV 载体时, 第二 DNA 链的从头合成可以解释延迟转导。23
在治疗小鼠20周后, 一个单一的管理, 人类 miR-298 的水平是无法检测的, 这表明对于慢性病, 可能需要多次注射才能达到治疗效果。然而, 随着时间的推移, miRNA 的退化可能会限制在需要终生重复管理的情况下。此外, 对 AAV 载体的自适应免疫可以成为成功基因传递的另一个障碍。24因而免疫惰性的世代 AAV 媒介是关键的对重复的管理和达到长期作用以这个有希望的运载系统。25
对使用 miRNA 作为治疗策略的限制是非靶向效应的风险。MiRNAs 可以通过 incomplementary 基础配对与其他基因转录, 这构成了安全风险的方法。改进的干扰序列的设计, 包括使用非规范的 miRNAs, 如 mirtrons, 绕过微处理器复杂和广泛的长期安全和耐受性研究是至关重要的, 然后将此策略转换为安全和有效的治疗方法。26,27,28
本文所描述的方法最初是为 miRNA 过度表达而开发的, 但也可用于 miRNA 抑制治疗, 使用 antagomirs。
披露声明
作者没有什么可透露的。
致谢
作者声明没有利益冲突。我们感谢 SignaGen 实验室 (Rockvile, 美国 MD) 为 AAV9 病毒生产。这项研究得到了 NINDS 的校内研究计划的支持。菲利普 r. 李得到了发育研究院校内研究司的资金支持。卡洛雷那蒂得到了来自协会法国反肌病 (AFM) 的奖学金的支持。
材料
| Name | Company | Catalog Number | Comments |
| QIAzol Lysis Reagent | Qiagen | 79306 | Lysis of fatty and standard tissues before RNA isolation |
| miRNeasy Mini Kit | Qiagen | 217004 | Purification of miRNA and total RNA |
| TaqMan MicroRNA Reverse Transcription kit | ThermoFisher Scientific | 4366596 | A highly specific kit that quantitates only mature miRNAs |
| snoRNA202 Primer | ThermoFisher Scientific | 1232 | Taqman miRNA control assay in mouse |
| miR-298 Primer | ThermoFisher Scientific | 2190 | Taqman miRNA-298 assay in mouse |
| Anti-GFP antibody | abcam | ab290 | Rabbit polyclonal to GFP - ChIP Grade |
| Red ink pad | Dovecraft Essentials | ||
| Blue ink pad | Dovecraft Essentials | ||
| AAV9-GFP vector | SignaGen Laboratories | SL100840 | Large scale AAV plasmid construction, packaging and purification |
| mmu-miR-298-5p | ThermoFisher Scientific | MC12525 | mirVana miRNA mimic |
| AAV9-EF1a-has-mir-298-GFP | Vector Biosystems Inc |
参考文献
- Broderick, J. A., Zamore, P. D. miRNA therapeutics. Gene Therapy. 18, 1104-1110 (2011).
- Esteller, M. Non-coding RNAs in human disease. Nat Rev Genet. 12, 861-874 (2011).
- Pickering, B. M., Willis, A. E. The implications of structured 5' untranslated regions on translation and disease. Semin Cell Dev Biol. 16, 39-47 (2005).
- Bilen, J., Liu, N., Burnett, B. G., Pittman, R. N., Bonini, N. M. MicroRNA pathways modulate polyglutamine-induced neurodegeneration. Mol Cell. 24, 157-163 (2006).
- Lee, Y., Samaco, R. C., Gatchel, J. R., Thaller, C., Orr, H. T., Zoghbi, H. Y. miR-19, miR-101 and miR-130 co-regulate ATXN1 levels to potentially modulate SCA1 pathogenesis. Nat Neurosci. 11, 1137-1139 (2008).
- Liu, N., et al. The microRNA miR-34 modulates ageing and neurodegeneration in Drosophila. Nature. 482, 519-523 (2012).
- Ebner, D. C., et al. Strategies for skeletal muscle targeting in drug discovery. Curr Pharm Des. 10, 1327-1336 (2015).
- Giorgetti, E., Lieberman, A. P. Polyglutamine androgen receptor-mediated neuromuscular disease. Cell Mol Life Sci. 73, 3991-3999 (2016).
- Grunseich, C., Rinaldi, C., Fischbeck, K. H. Spinal and bulbar muscular atrophy: pathogenesis and clinical management. Oral Dis. 20, 6-9 (2014).
- La Spada, A. R., Wilson, E. M., Lubahn, D. B., Harding, A. E., Fischbeck, K. H. Androgen receptor gene mutations in X-linked spinal and bulbar muscular atrophy. Nature. 352, 77-79 (1991).
- Katsuno, M., Adachi, H., Kume, A., Li, M., Nakagomi, Y., Niwa, H., Sang, C., Kobayashi, Y., Doyu, M., Sobue, G. Testosterone reduction prevents phenotypic expression in a transgenic mouse model of spinal and bulbar muscular atrophy. Neuron. 35, 843-854 (2002).
- Boissonneault, V., Plante, I., Rivest, S., Provost, P. MicroRNA-298 and microRNA-328 regulate expression of mouse beta-amyloid precursor protein-converting enzyme 1. J Biol Chem. 284, 1971-1981 (2009).
- Choudhury, S. R., et al. Widespread central nervous system gene transfer and silencing after systemic delivery of novel AAV-AS vector. Mol Ther. 24, 726-735 (2016).
- Pourshafie, N., et al. MiR-298 counteracts mutant androgen receptor toxicity in spinal and bulbar muscular atrophy. Mol Ther. 24, 937-945 (2016).
- Dweep, H., Sticht, C., Pandey, P., Gretz, N. miRWalk--database: prediction of possible miRNA binding sites by "walking" the genes of three genomes. J Biomed Inform. 44, 839-847 (2011).
- McClure, C., Cole, K. L., Wulff, P., Klugmann, M., Murray, A. J. Production and titering of recombinant adeno-associated viral vectors. J Vis Exp. (57), e3348(2011).
- Stuard, D. A., Oorschot, D. E. Embedding, sectioning, immunocytochemical and stereological methods that optimise research on the lesioned adult rat spinal cord. J Neurosci Methods. 61, 5-14 (1995).
- Huang, F., et al. miR-25 alleviates polyQ-mediated cytotoxicity by silencing ATXN3. FEBS Lett. 588, 4791-4798 (2014).
- Kuhn, D. E., Martin, M. M., Feldman, D. S., Terry, A. V., Nuovo, G. J., Elton, T. S. Experimental validation of miRNA targets. Methods. 44, 47-54 (2008).
- Yang, N. An overview of viral and nonviral delivery systems for microRNA. Int J Pharm Investig. 5, 179-181 (2015).
- Bourdenx, M., Dutheil, N., Bezard, E., Dehay, B. Systemic gene delivery to the central nervous system using Adeno-associated virus. Front Mol Neurosci. 7, 50(2014).
- Foust, K. D., Nurre, E., Montgomery, C. L., Hernandez, A., Chan, C. M., Kaspar, B. K. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat Biotechnol. 27, 59-65 (2009).
- Wang, Z., Ma, H. -I., Li, J., Sun, L., Zhang, J., Xiao, X. Rapid and highly efficient transduction by double-stranded adeno-associated virus vectors in vitro and in vivo. Gene Therapy. 10, 2105-2111 (2003).
- Saunders, N. R., Joakim Ek, C., Dziegielewska, K. M. The neonatal blood-brain barrier is functionally effective, and immaturity does not explain differential targeting of AAV9. Nat Biotechnol. 27, 804-805 (2009).
- Boudreau, R. L., Spengler, R. M., Davidson, B. L. Rational design of therapeutic siRNAs: minimizing off-targeting potential to improve the safety of RNAi therapy for Huntington’s disease. Mol Ther. 19, 2169-2177 (2011).
- Duque, S., Joussemet, B., Riviere, C., Marais, T., Dubreil, L., Douar, A. M., et al. Intravenous administration of self-complementary AAV9 enables transgene delivery to adult motor neurons. Mol Ther. 17, 1187-1196 (2009).
- Lowenstein, P. R. Crossing the rubicon. Nat Biotechnol. 27, 42-44 (2009).
- Sibley, C. R., Seow, Y., Curtis, H., Weinberg, M. S., Wood, M. J. Silencing of Parkinson's disease-associated genes with artificial mirtron mimics of miR-1224. Nucleic Acids Res. 40, 9863-9875 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。